IFN-γ刺激培养未成熟树突状细胞免疫耐受效应机制研究*
2010-10-10吴银平袁发焕侯卫平
吴银平,袁发焕,侯卫平
(第三军医大学新桥医院肾病科,重庆400037)
树突状细胞(dendritic cells,DC)是体内最有效的抗原提呈细胞(antigen-presenting cell,APC),它不仅参与抗原的摄取及提呈,而且可诱导免疫耐受。目前研究发现DC的免疫应答还是诱导免疫耐受效应均取决于DC的成熟状态:成熟DC表面高表达MHCⅡ类分子和共刺激分子CD80、CD86,因而可诱导CD4+Th0分化为 Th1介导细胞免疫应答;而未成熟DC(immature DC,imDC)表面低表达MHCⅡ类分子和共刺激分子CD80、CD86,可诱导CD4+Th0分化为 Th2细胞而具有诱导建立外周免疫耐受的特性[1]。Th2细胞分泌高水平的IL-4可间接促进DC的成熟,γ-干扰素(IFN-γ)则能抵抗 IL-4的效应。在外周器官组织中,DC是以一种不成熟的状态存在,可诱导调节性T细胞(regulate T cell,Treg)产生分泌具有负调节作用的IL-10,参与外周免疫耐受的建立。Kitchen等[2]研究发现在IFN-γ基因敲除鼠可诱导更为严重的抗-GBM 肾炎,表现为抗原特异性T细胞的高度激活和增殖,提示由调节性T细胞分泌IFN-γ直接调控诱导免疫耐受的效应。新近研究还发现IFN-γ具有相矛盾的作用[3],既有可能引发Th1驱使的免疫应答反应,又可诱导产生调节性T细胞控制免疫反应[3],这种早期产生的IFN-γ能直接抑制具有IFNgR1和IFNgR2的T细胞,而且还可间接地预防T细胞的进一步激活。
本实验联合IFN-γ和imDC诱导免疫耐受特性,在体外通过IFN-γ刺激培养imDC与脾脏分离的淋巴细胞共培养,观察淋巴细胞增殖及凋亡情况及CD4+T细胞Th1/Th2型细胞因子的表达情况。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠(体质量 200~250 g)购自第三军医大学大坪医院动物中心。大鼠重组IFN-γ、GM-CSF、IL-4(美国 R&D公司),荧光抗体 FITC-anti-rat MHCⅡ、FITC-anti-rat CD86、PE-anti-rat OX62、PE-anti-rat CD80 及同型对照抗体(eBioscience公司),噻唑蓝(MTT,Amersha公司),RPMI-1640培养基(Hyclone公司),胎牛血清((FCS,杭州四季青公司)二甲基亚砜(DMSO,Sigma公司),IL-4、IL-13、IFN-γELISA试剂盒(美国 R&D公司),T细胞表位 pCol(28-40)多肽(上海英骏生物公司)等。
1.2 大鼠骨髓来源imDC制备 参照Son等[4]的方法,颈椎脱臼处死大鼠,70%乙醇浸泡消毒15 min。无菌取出股骨和胫骨,用镊子固定长骨后剪刀剪去骨两端,用RPMI-1640培养液反复冲洗出骨髓至培养皿中,直至骨变白。用200目尼龙网过滤去除小碎骨片和肌肉组织。滤液以4℃、1 000 r/min离心5 min,弃上清液。Tris-NH4Cl裂解红细胞,室温孵育 2~3 min,4℃、1 000 r/min离心 5 min,弃上清液。洗涤 2遍后,用 24 mL DC培养液(RPMI-1640加rGM-CSF 10 ng/mL+rIL-4 5 ng/m L)重悬细胞沉淀后,接种于6孔细胞培养板中,置37℃、5%CO2细胞培养箱内孵育3 h。轻轻吸出悬浮和半贴壁细胞,4℃、1 000 r/min离心5 min弃上清液。DC培养液重悬细胞沉淀,计数并调整密度为1×106/mL,加入24孔板中培养(1 mL/孔)。置37℃、5%CO2细胞培养箱培养。每48小时新配制DC培养液半量换液,继续培养。培养至第5天收集、计数、用灭菌PBS调整DC浓度至1×106/m L,即为imDC。
1.3 IFN-γ刺激培养的大鼠骨髓来源未成熟树突状细胞(im-DCIFN-γ)制备 DC取材方法同上,DC孵育3 h,转入24孔培养板培养18 h后加IFN-γ(100 U/mL)刺激培养细胞[5],37℃,5%CO2细胞培养箱培养。每48小时新配制的DC培养液半量换液,并补充IFN-γ(50 U/mL),置37℃、5%CO2细胞培养箱培养。培养至第3天用灭菌0.01MPBS洗2次,洗去IFN-γ,调整DC浓度至1×106/m L,补充外源性抗原 T细胞表位pCol(28-40)多肽,继续培养48 h,收集、计数、用灭菌PBS调整DC浓度至1×106/mL,即为imDCIFN-γ。
1.4 流式细胞检测 imDC和imDCIFN-γ表型 分别收集imDC和imDCIFN-γ入刻度离心管,4℃、1 000 r/min离心5 min,弃上清液,加入1 mL PBS重悬,计数,分装入每管约1×106个细胞于EP管中。4℃、1 000 r/min离心 5 min。弃上清液,再用PBS洗3次,最后用200μL PBS重悬。然后按试剂说明书加入荧光标记抗体:PE-anti-rat CD80(1μL)、FITC-anti-ratCD86(1μL)、FITC-anti-rat MHC Ⅱ(1μL)和PE-anti-rat OX62(10 μL),4℃避光孵育30 min。Staining buffer洗涤3次,流式细胞仪检测。
1.5 分离脾脏淋巴细胞 无菌条件下取脾组织,于200目钢丝滤网上研磨成匀浆状,用含2%胎牛血清的无菌生理盐水冲入无菌平皿制成悬液,1 500 r/min离心5 min,弃上清液,加5 mL Tris-NH4Cl,静置 2~3 min去除红细胞,加无菌生理盐水5~6 mL中和,1 200 r/min离心5 min,洗涤 3遍,加入大鼠淋巴细胞分离液,严格按说明书提取白膜层细胞。光镜下计数后,用含10%新生牛血清的RPMI-1640调整脾细胞浓度为2×106/mL,备用。
1.6 imDC和imDCIFN-γ与脾细胞铺板培养 实验分组:(1)对照组,加入含血清RPMI-1640;(2)imDC组,加入培养的im-DC;(3)imDCIFN-γ组,加入imDCIFN-γ。取上述脾细胞中一部分,铺24孔板培养,每孔0.5 mL,各孔加入制备好的imDC和im-DCIFN-γ各 0.5 mL,对照组加等量的含血清RPMI-1640,轻轻吹打混匀,置37℃,5%CO2细胞培养箱培养。每个样本铺6个复孔,分别于铺板后 48、72 h收集上清液,待作相关细胞因子测试。
1.7 MTT法检测各组与淋巴细胞的增殖情况 (1)96孔细胞培养板,每孔加入大鼠分离的脾脏淋巴细胞各100μL。(2)含血清RPMI-1640,5%CO2、37℃培养 4 h。(3)于培养细胞中加入:含血清RPMI-1640 200μL(对照组);培养的 imDC 200μL(imDC 组);imDCIFN-γ200μL(imDCIFN-γ组);均设 6 个复孔,同时设空白对照。(4)继续培养48 h。(5)在实验前4 h每孔加入MTT(5 mg/mL)20μL。(6)轻轻吸去上清液,每孔加入DMSO 150μL,轻轻振荡10 min。(7)在酶标光度计上测光吸收值,测定波长为 490 nm,参考波长为630 nm,所得光吸收值代表相应孔细胞的相对数量。
1.8 流式细胞仪检测各组淋巴细胞凋亡的情况 (1)24孔细胞培养板,每孔加入分离的大鼠脾脏淋巴细胞500μL。(2)将含血清RPMI-1640和培养细胞imDC和imDCIFN-γ加入相应的培养孔500μL,每组设6个复孔,同时设空白对照。(3)含血清RPMI-1640,37℃、5%CO2培养48 h。(4)每天各组随机抽取2孔。分别收集各组细胞入刻度离心管,4℃、1 000 r/min离心5 min,弃上清液。分装入每管约1×106个/m L细胞于EP管中。4℃、1 000 r/min离心 5 min,弃上清液,再用 PBS洗3次。最后用200μLPBS重悬。按试剂说明书加入荧光标记抗体,PE-anti-rat CD4 mAb(10μL),4℃、30 min后洗涤3次,加PBS至500μL。按Anneix-V-Flous试剂盒说明书,用流式细胞仪检测细胞凋亡情况。(5)连续检测2 d。
1.9 Th1/Th2型细胞因子浓度测定 按照 R&D公司ELISA试剂盒说明书操作,测定脾细胞上清液中Th1型细胞因子IFN-γ(用铺板培养后72 h收集之上清液)以及Th2型细胞因子IL-4、IL-13(用铺板培养后48 h收集之上清液)的含量,在BIO-RAD 680酶标仪上读取结果。
2 结 果
2.1 流式细胞仪检测DC表型 流式细胞仪检测(收集制备的imDC以及 imDCIFN-γ)表面 M HC Ⅱ类分子和共刺激分子CD80、CD86以及DC表面相对特异性标记OX62情况,结果发现,imDC表达的上述分子分别为20.07%、13.01%、21.38%、14.03%,均明显低于mDC水平(mDC上述分子表达水平均在70%以上,数据未显示)。imDCIFN-γ表达上述分子分别为14.01%、19.79%、15.31%、4.78%,均低 表达表面 MHC Ⅱ 类分子和共刺激分子 CD80、CD86;与 imDC组相比,除 CD80略高一些,其余均低于imDC组(P<0.05,n=4),见图1。
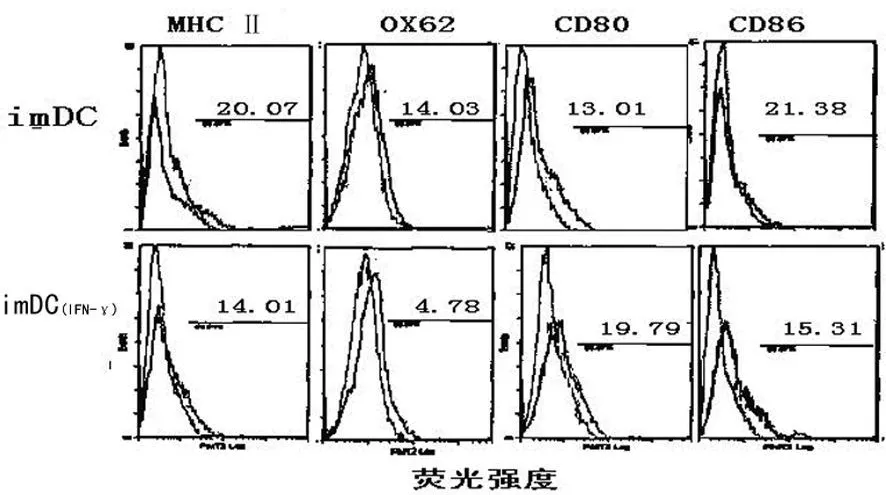
图1 耐受性DC表面共刺激分子和MHCⅡ类分子的表达情况
2.2 M TT法检测各组淋巴细胞增殖情况 对照组OD值为(0.195 0±0.016 0);imDC组为(0.197 4±0.017);imDCIFN-γ组为(0.083 6±0.012),imDC组、imDCIFN-γ组与对照组比较差异有统计学意义(P<0.05,n=5)。
2.3 在体外脾淋巴细胞与共培养细胞凋亡变化 采用流式细胞仪检测各组淋巴细胞凋亡率,imDC组(1.06±0.01)与对照组(0.03±0.01)比较差异有统计学意义(P<0.05,n=5);im-DCIFN-γ组凋亡率为(12.98±0.02),与对照组和imDC组比较均明显增高(P<0.05,n=5),见图2。
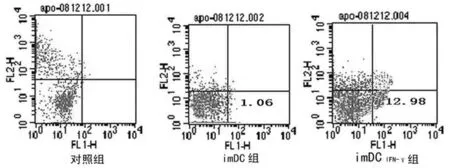
图2 流式细胞仪检测体外同等条件下大鼠脾淋巴细胞凋亡变化
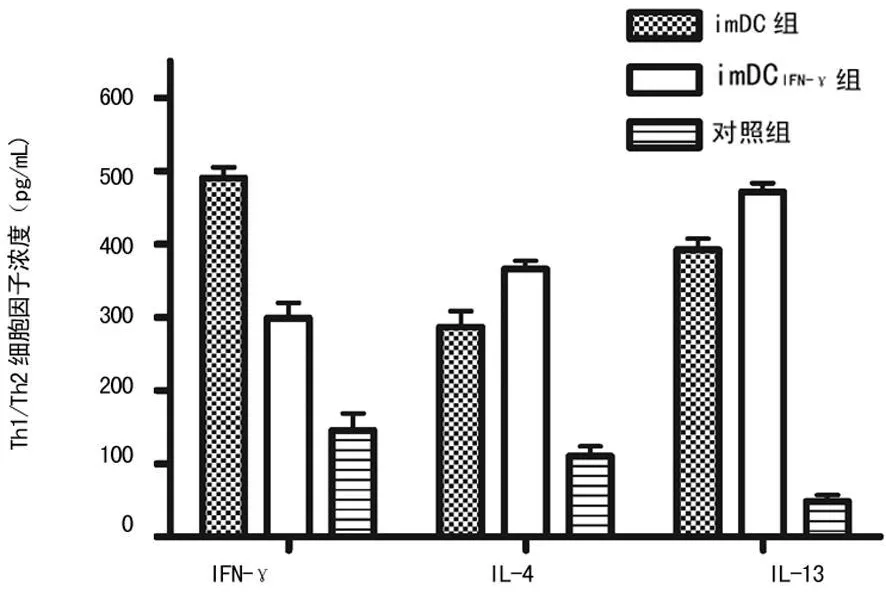
图3 脾细胞上清液中IL-4、IL-13、IFN-γ浓度
2.4 ELISA法检测体外培养脾细胞上清液Th1/Th2型细胞因子 imDC组和imDCIFN-γ组表达 IFN-γ浓度差异无统计学意义(P>0.05,n=5),imDC组表达IFN-γ浓度与对照组和imDCIFN-γ组比较差异有统计学意义(P<0.05,n=5);imDCIFN-γ组表达IL-4和IL-13高于imDC组,也明显高于对照组(P<0.05,n=5),见图 3。
3 讨 论
DC是目前已知的机体内功能最强的“专职抗原递呈细胞”(professional APC)[6]。DC广泛分布于除脑以外的全身各脏器。在外周DC获取抗原、递呈抗原、初始化免疫反应或死亡[7-9]。DC经历几个不同的表型期;各个表型期DC具有不同的功能活性,不同的免疫功能。未成熟DC特点是能够吞噬外源性抗原(通过胞吞、胞饮或各种受体介导的吞噬作用),处理并将相应的肽段结合到内源性MHC分子。由于表面表达MHC和接触分子(CD80、CD86)的量较少,从而在抗原识别时提呈抗原而缺乏共刺激分子及细胞因子的参与介导免疫耐受。本实验采用经典的GM-CSF+IL-4诱导方案,经IFN-γ刺激培养的imDC通过外源性抗原T细胞表位pCol(28-40)多肽培养,均低表达表面分子MHCⅡ类分子及共刺激分子CD80、CD86,同样低表达DC表面相对特异性标记 OX62,表明经IFN-γ刺激培养的imDC对抗原的摄取和提呈能力低,未能激活T细胞免疫应答,而具有诱导免疫耐受的特性。
Wood和Bawitzki[3]研究及新近研究发现 IFN-γ诱导产生Treg控制免疫反应。Treg分泌IFN-γ对T细胞的直接调控发挥着诱导免疫耐受的效应[10]。有研究认为,Th1/Th2的动态平衡是免疫耐受的关键因素,IFN-γ由Th1分泌,IL-4和IL-13由Th2分泌,Th1向 Th2漂移可能是免疫耐受的形成机制[11-18]。ELISA检测脾细胞上清液中imDC组和imDCIFN-γ组表达IFN-γ无明显差异,但均高于对照组,同样脾细胞上清液中imDCIFN-γ组表达IL-4和IL-13高于imDC组,且明显高于对照组,表明IFN-γ诱导产生 Treg诱导免疫耐受的效应,并且Th1向Th2漂移,可能诱导形成免疫耐受。
imDC在经IFN-γ刺激培养后对外源性抗原的摄取和提呈能力差,能够体外抑制T细胞增殖,促进其凋亡;同时实验表明Th1向Th2漂移,可诱导形成免疫耐受。该实验的结果有待于体内实验进一步验证,这将为临床进一步研究免疫耐受提供新的思路。
[1] 辛海明,彭毅.CCR7基因修饰未成熟树突状细胞诱导小鼠皮肤移植免疫耐受的研究[J].重庆医学,2009,38(19):2457.
[2] Kitchen R,Khchen A R,Tumer AL,et al.Experimental autoimmune anti-Glomerular basement mem-brane glomerulonephritis a protective Role for IFN[J].Am Soc Nephrol,2004,15:1764.
[3] Wood KJ,Bawitzki B.Interferon-γ:a crucial role in the function of induced regulatory T cells in vivo[J].Trends Immunol,2006,27(4):183.
[4] Son Y,Egawa S,Tatsumi T,et al.A novel bulk-culture method for generating mature dendritic cells from mouse bone marrow cells[J].Immunol Methods,2002,262(1-2):145.
[5] Xiao BG,Wu XC,Yang JS,et al.Ther-apeutic potential of IFN-γmodied dendritic cells in acute and chronic experimental allergic encephalomyelitis.[J].Int Immunol,2004,16(1):13.
[6] 石庆凤,陈敏,曾维群,等.HBV无症状携带者树突状细胞的分化及功能研究[J].重庆医学,2009,38(7):821.
[7] 史蓉华,范娅涵,赵树铭,等.人外周血富集白细胞层来源的树突状细胞的培养与鉴定[J].重庆医学,2009,38(10):1195.
[8] 王海权,徐皓.联合应用未成熟树突状细胞和CD40L单克隆抗体延长大鼠移植肠存活时间[J].南京医科大学学报:自然科学版,2006,26(7):516.
[9] Steinman RM.The dendritic cell system and its role in immunogenicity[J].Annu Rev Immunol,1991,9:271.
[10]Jurgens B,Hainz U.Interferon-gamma-triggered indoleamine 2,3-dioxygenase competence in human monocyte-derived dendritic cells induces regulatory activity in allogeneic T cells[J].Blood,2009,114(15):3235.
[11]Steinman RM,Hawiger D,Nussenzweig MC.Tolerogenic dendritic cells[J].Annu Rev Immunol,2003,21:685.
[12]Chen Y,Chen J,Liu Z.Relationship between Th1/Th2 cytokines and immune tolerancein liver transplantation in rats[J].Transplant Proc,2008,40(8):2691.
[13]Williams CA,Harry RA,Mcleod JD,et al.Apoptotic cells induce dendritic cell-mediated suppression via interferongamma-induced IDO[J].Immunolog,2008,124(1):89.
[14]Mascarell L,Lombardi V,Louise A,et al.Oral dendritic cells mediate ntigen-specific tolerance by stimulating TH 1 and regulatory CD4+T cells[J].Allergy Clin Immunol,2008,122(3):603.
[15]Sagoo P,Lombardi G.Regulatory T cells as therapeutic cells[J].Curr Opin Organ Transplant,2008,13(6):645.
[16]刘加洪,姚艳红,王英年,等.Th1/Th2平衡失调与人类疾病关系及其相关治疗研究现状[J].青岛大学医学院学报,2002,38(4):366.
[17]Yamazaki S,Steinman RM.Dendritic cells as controllers of antigen-specific Foxp3(+)regulatory T cells[J].J Dermatolo Sci,2009,54(h2):69.
[18]Van Duivenvoorde LM,Van Mierlo GJ,Boonman ZF,et al.Dendritic cells:vehicles for tolerance induction and prevention of autoimmune diseases.[J].Immunobiology,2006,211(6-8):627.
