糖尿病肾病患者血清VEGF和TNF-α水平表达的临床意义
2010-10-10耿晓仲
耿晓仲
(河南省洛阳市洛轴总医院 471039)
糖尿病肾病(diabetes nephropathy,DN)是糖尿病三大并发症之一,与心脏病、脑血管病同为糖尿病的重要死因。其病变累及肾小球、肾血管和肾间质,最终可致终末期肾衰,严重影响患者的生存和生活质量。最近发现血管内皮生长因子(vascular endothelia growth factor,VEGF)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)与糖尿病微血管病变的发生、发展有密切关系,但DN患者血清VEGF和TNF-α的水平及其两者之间的关系研究较少。本试验旨在探讨 VEGF和TNF-α水平与糖尿病肾病患者间的关系,为其发病机制提供理论依据。
1 对象与方法
1.1 研究对象
1.1.1 病例组 选择2005年9月至2006年6月在本院内分泌科住院及门诊DN患者81例,男42例,女39例,年龄为 48~77岁,平均(54.5±11.1)岁。81例患者在1个月内未发生糖尿病酮症酸中毒及其他急性并发症;排除其他如发热、剧烈运动等影响蛋白尿的因素;近期未使用对肾脏有害药物;排除心、肺、肝疾病、泌尿系感染及其他肾脏疾病;排除其他内分泌疾病、结缔组织病和肿瘤。根据尿清蛋白排泄率(UAER)分为3组:(1)单纯 DN组UAER<20μg/min 34例,其中男 20例,女14例;(2)微量蛋白尿组(microalbuminurias groups,MA)组UAER 20~200μg/min 27例,男14例,女13例;(3)临床蛋白尿组(clinical albuminurias groups,ODN)组 UAER>200μg/min 20 例,男 10 例,女 10 例 。
1.1.2 健康对照组20例,男 11例,女 9例,平均(52.13±9.51)岁,均除外高血压、糖尿病、高血脂和心、肺、肝、肾疾病及外伤等情况。各组在年龄、性别、体质量、经济状况、居住条件等各方面均匹配。
1.2 研究方法
1.2.1 标本留取 受试者均于空腹抽静脉血6 m L加入试管,室温静置30 min,3 000 r/min离心15min,分离血清,留待测定VEGF和TNF-α,-20℃保存;检测低密度脂蛋白(LDLC)和糖化血红蛋白(HbA1c)。同时留取24 h尿,二甲苯防腐,以备检测UAER。
1.2.2 VEGF和TNF-α测定采用双抗体夹心ELISA法,严格按照试剂盒说明书进行操作,试剂盒购于深圳晶美生物工程公司。应用放射免疫法检测24 h UAER;HbA1c采用德国Bayer公司DCA2000仪器及试剂盒测定;LDL-C由本院生化室检测。
1.3 统计学方法 所有数据用SPSS统计软件处理,数据以±s表示,两组间比较采用t检验,两组以上比较采用方差分析,相关分析采用二元变量相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 糖尿病各组与对照组间外周血VEGF和TNF-α水平比较见表1。与对照组相比,血清VEGF在 DM、MA、ODN 3组中明显增高,差异有统计学意义(P<0.01);MA、ODN组高于DM组(P<0.01);ODN组高于 MA组(P<0.01)。血清TNF-α水平在DM、MA、ODN 3组明显高于对照组,差异有统计学意义(P<0.01);MA组患者高于DM组患者,但差异无统计学意义(P>0.05);ODN组较DM、MA均增高,但差异无统计学意义(均为P>0.05)。
表1 各组血清细胞因子水平比较±s)
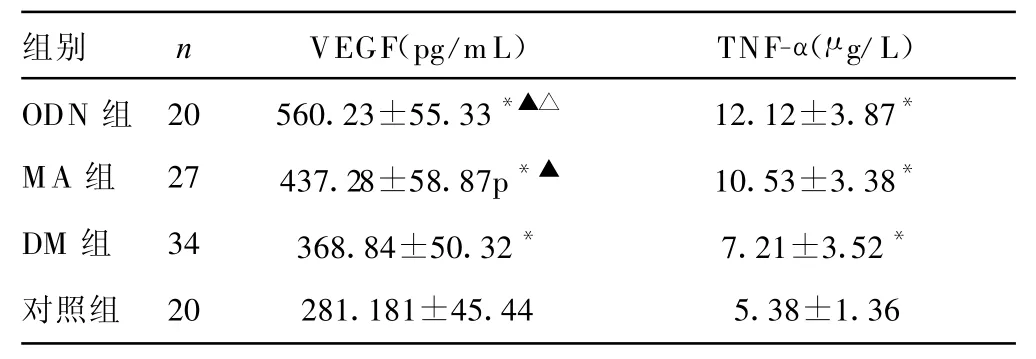
表1 各组血清细胞因子水平比较±s)
*:与对照组比较,P<0.01;▲:与 DM 组比较,P<0.01;△:与MA组比较,P<0.01。
组别 n VEGF(pg/m L) TNF-α(μg/L)ODN 组 20 560.23±55.33*▲△ 12.12±3.87*MA组 27 437.28±58.87p*▲ 10.53±3.38*DM 组 34 368.84±50.32* 7.21±3.52*对照组 20 281.181±45.44 5.38±1.36
2.2 糖尿病组患者血清中VEGF与TNF-α浓度呈正相关(r=0.712,P<0.01);血清VEGF浓度、TNF-α浓度均与UAER的升高呈正相关(r1=0.801,P<0.01;r2=0.732,P<0.01)。
2.3 血清VEGF和TNF-α水平与LDL及HbA1c值呈正相关,相关系数分别为(r3=0.345,P<0.05;r4=0.455,P<0.05)。
3 讨 论
DN是糖尿病的三大并发症之一,严重威胁人们身体健康。其主要病理改变为肾小球毛细血管基底膜增厚,肾小球系膜区微血管病变及肾小球毛细血管通透性增高。近年研究表明,血管内皮细胞生长因子在糖尿病肾病的发生和发展过程中起到非常重要的作用。
VEGF是一种特异性极强的内皮细胞生长因子,也称为血管通透因子(VPF),可强烈地刺激内皮细胞分裂与增殖,增加内皮细胞通透性,促进细胞外基质堆积、内皮细胞增殖、迁移,参与糖尿病肾病的病理生理过程[1]。VEGF与其受体结合后,可发挥不同的生物学效应。VEGF受体主要表达于肾小球内皮细胞、管旁毛细血管和皮质间质细胞中。在大鼠系膜细胞培养中,高糖可以在3 h内增加VEGF mRNA的表达及蛋白质产量[2]。人体研究结果表明,在轻、中度DN患者的肾脏中肾小球足突细胞和远曲小管细胞均存在VEGF mRNA表达的显著增加,在肾小管(特别是近曲小管)处,晚期 DN的VEGF表达明显多于早期DN[3]。糖尿病发病的相关因素如高血糖、血管紧张素Ⅱ、转化因子β、血小板源性生长因子、机械牵拉等均可上调VEGF[4]。缺氧也可导致VEGF强烈表达,可能与低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的形成从而促进VEGF转录增加有关[5]。本实验研究结果表明,在DN的早期患者血中的VEGF水平就已明显增高,并且随着DN病程的进展,患者血中VEGF的含量逐渐增加,与上述研究观点一致。VEGF水平和糖化血红蛋白浓度呈正相关,支持了糖尿病患者持续的高血糖状态对VEGF具有上调作用的观点。
本文结果同样明,DN患者VEGF与UAER呈显著的正相关,VEGF升高与UAER变化一致,推测糖尿病患者尿蛋白增加可能与VEGF改变肾小球通透性有关。有研究表明,循环血中高于生理浓度的VEGF可促进肾小球毛细血管内皮细胞增殖、分裂,同时促进内皮细胞释放纤溶酶原、前列环素、胶原酶等血管活性物质,溶解微血管基膜,改变内皮细胞窗孔及诱导肾脏血流动力学,引起血管床重建,增高微血管的通透性[6]。VEGF在肾小球脏层上皮细胞的持续表达,可以通过旁分泌形式穿过肾小球基底膜作用于内皮细胞,调节滤过膜的通透性,也可能是通过旁分泌形式作用,增加管周毛细血管的通透性[7]。
高脂血症是糖尿病代谢紊乱的一个突出表现,高脂血症不仅直接参与糖尿病大血管病变,而且LDL还可以通过作用于肾小球系膜上的LDL受体,导致系膜细胞和足细胞损伤,加重蛋白尿和肾小球及肾小管间质纤维化的进展[8]。本研究亦发现DN组中UAER、LDL与VEGF有正相关性,说明LDL及VEGF共同参与了DN的发生发展。
本研究显示,糖尿病患者血清 TNF-α水平与VEGF水平、LDL及 UAER的升高呈正相关,说明 TNF-α也参与糖尿病肾病的发生。TNF-α是一种潜在的致纤维化因子,作为炎性介质在炎症急性期和硬化过程中起重要作用。TNF-α介导了白细胞与内皮细胞黏附,导致内皮细胞损伤,同时促使白细胞(主要由单核/巨噬细胞组成)在肾小球和肾间质浸润,加速肾小球硬化[9]。有研究证实 TNF-α也可上调 VEGF水平[4,10-11]。
血清中VEGF和TNF-α水平在不同时期DN患者中有不同程度的增高,且具有相关性,提示VEGF和TNF-α共同作用参与了DN的发生发展,并有可能成为监测DN病情变化的有效指标之一;但因DN机制复杂,VEGF和TNF-α与其关系尚需更多临床研究证实。
[1] Belgore FM,Blann AD,LI-Saw-Hee FL,et al.Plasma levels of vascular endothelial growth factor and its soluble receptor(sFlt-1)in essential hypertension[J].Am J Cardiol,2001,87(6):805.
[2] Thomas S,Vanuystelj J,Gruden G,et al.Vascular endothelial growth factor receptors in human me-sangium in vitro and in glomerular disease[J].J Am Soc Nephrol,2002,11:1236.
[3] Matsumoto K,Kanmatsuse K.Elevated vascular endothelial growth factor levels in the urine of patients with minimal-change nephritic syndrome[J].Clin Nephrol,2001,55:269.
[4] Chen S,Kasama Y,Lee JS,et al.Podocyte-derived vascular endothelial growth factor mediates the stimula-tion of alpha 3(IV)collagen production by transforming growth factor-beta 1 in mouse podocytes[J].Diabetes,2004,53(11):2939.
[5] Tsuzuki Y,Fukumura D,Oosthuyse B,et al.Vascular endothelial growth factor(VEGF)modulation by targeting hypoxia-inducible factor-1 a hypoxia response element VEGF cascade differently regulates vascular responseand growth rate in tumors[J].Cancer Res,2000,60(22):6 248.
[6] Senthil D,Choudhury GG,Mclaurin C,et al.Vascular endothelial growth factor induces protein synthesis in renal epithelial cells:a potential role in diabetic ne-phropathy[J].Kidney Int,2003,64(2):468.
[7] Santilli F,Spagnoli A,Mohn A,et al.In-creased vascular endothelial growth factor serum concentrations may help to identify patients with onset of type 1 diabetes during childhood at risk for developing persis-tent microalbuminuria[J].JClin Endocrinol Metab,2001,86(8):3871.
[8] 殷培,袁伟杰,叶表斌,等.低密度脂蛋白对大鼠系膜细胞产生血管内皮生长因子的影响[J].中华肾脏病杂志,2003,19(5):324.
[9] 周燕.血清肿瘤坏死因子α与糖尿病肾病的相关性[J].医学理论与实践,2005,11(1):1263.
[10]戎健,邱鸿鑫,汪恕萍.糖尿病大鼠肾小球晚期糖基化终末产物对肾脏改变的影响[J].重庆医学,2001,30(6):492.
[11]魏倩萍,邓华聪,赵劼.亚硒酸钠对大鼠肾小球系膜细胞表达 VEGF的调控[J].重庆医学,2006,35(10):871.
