康莱特对小鼠肝癌细胞Hepa1-6增殖和凋亡的影响
2010-09-13武晋荣赵和平
武晋荣,赵和平
(1.山西医科大学,山西太原 030001;2.山西医科大学第一医院,山西太原 030001)
康莱特(KLT)注射液是从传统中药薏苡仁中提取的新型双相广谱中药抗肿瘤药物,临床上多用其静脉乳剂,研究表明[1-2],KLT 具有阻滞肿瘤细胞有丝分裂,抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,影响癌基因表达,抑制肿瘤新生血管生成,调节细胞因子水平以及逆转多药耐药等作用,而且能明显改善患者的生存质量[3-4]。目前KLT 对小鼠肝癌细胞Hepa1-6 抗肿瘤作用的机制还缺少全面的研究。本实验旨在分析康莱特是否是通过抑制Hepa1-6 细胞增殖、诱导Hepa1-6细胞凋亡来发挥抑瘤作用,为其在临床应用中提供进一步的理论依据。
1 材料与方法
1.1 实验材料
1.1.1 药物与试剂 康莱特注射液(100 ml/瓶,浙江康莱特药业有限公司,国药准字:Z10970091);DMEM 培养液为Invitrogen 公司产品,小牛血清、胰蛋白酶及噻唑兰(MTT)均购自武汉博士德生物工程有限公司;青霉素、链霉素为HyClone公司产品。二甲基亚砜(DMSO):天津市化学试剂公司。
1.1.2 主要仪器 ZS-2 板式酶标仪(中国航天工业总公司),SWCJ-FD 型超净工作台(苏州安泰空气技术有限公司),流式细胞仪,CO2细胞培养箱,普通台式离心机。
1.2 细胞培养
小鼠Hepa1-6 肝癌细胞株购于中国农科院细胞库,以含体积分数为10%胎牛血清的DMEM 培养基,在37℃、5%CO2、饱和湿度条件下常规培养。隔天换液一次,3~4d 传代一次。取对数生长期细胞制备单细胞悬液进行不同的实验。
1.3 MTT法检测细胞抑制情况
取对数生长期细胞稀释为1×105/ml 密度每孔200 μl 移入 96 孔培养板中。 加入 KLT 组 B(10 ml/L)、C(20 ml/L)、D(30 ml/L)、E(40 ml/L)、F(50 ml/L)的 10%胎牛血清dMEM培养液。另设A 组(空白对照组,10%胎牛血清DMEM 培养液)。分别培养24、48、72 h, 实验终止4h 前加入MTT 液(5 mg/ml)20 μl。 弃上清,加入dMSO 150 μl,振荡 10 min 使结晶溶解,用酶标仪(波长490 nm)测定吸光度(OD)值,重复3次取平均值。药物对细胞生长的抑制率:抑制率(IC)=(空白对照组OD 均值-用药组OD 均值)/空白对照组OD 均值×100%。
1.4 光镜观察细胞形态学改变传代试验
取对数生长期细胞稀释为1×105/ml 密度每孔1 ml 接种于放有盖玻片的6 孔板中,细胞贴壁后,随机分为四组,分别加入 KLT(B、D、F),并设 A 组作为对照(每孔总液量均为2 ml),培养48h 后取出覆盖有细胞的盖玻片,PBS 洗3次,浸入40g/L 多聚甲醛中固定15 min,PBS 洗2次, 常规苏木精-伊红染色,光镜下观察细胞结构变化。
1.5 流式细胞术测定细胞凋亡率
取对数生长期细胞消化成单细胞悬液置6 孔培养板,培养 24h 后弃上清,加入 KLT(B、D、F),每种浓度设平行4孔(即每种浓度重复4次),并设A 组作为对照,继续培养48 h后,加入0.25%的胰酶1 ml 将细胞消化,置入离心管中,离心(1 000 r/min,5 min),弃上清;PBS洗2次,离心、弃上清,加70%无水乙醇2 ml 固定,振荡混匀,离心,弃上清,过300 目筛子,PBS 洗3次,加入1 ml PI工作液,4℃避光染色30 min,流式细胞仪分析。
1.6 统计学方法
采用SPSS 16.0 软件进行分析,计量资料数据以均数±标准差(x ±s)表示,采用单因素方差分析及 LSD-t 检验,P<0.05表示差异有统计学意义。
2 结果
2.1 KLT对Hepa1-6细胞生长的抑制效应
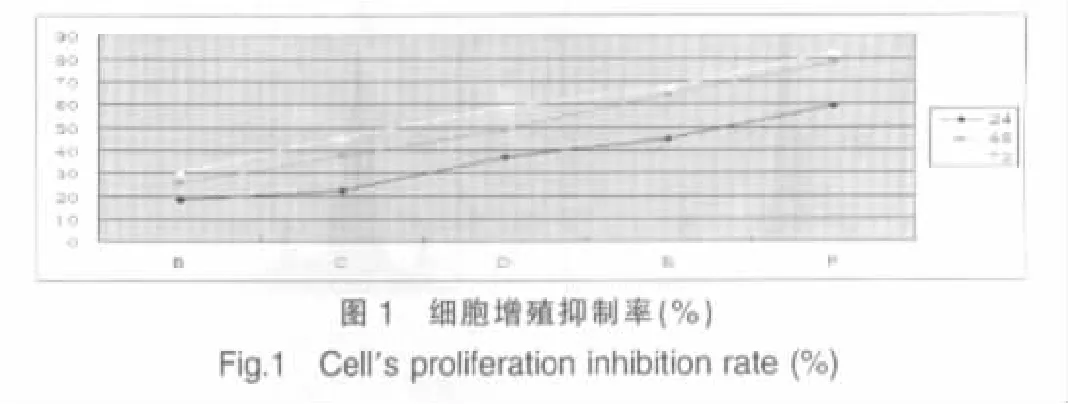
Hepa1-6 细胞在KLT 不同剂量、时间作用后,MTT 法观察细胞生长情况结果示:随着KLT剂量的逐渐增加、作用时间逐渐延长,其细胞生长抑制率逐渐增加。各给药组与A 组比较,差异均有统计学意义(均P<0.01);各给药组组间比较示:与 B 组比较,C 组与 B 组(P>0.05),D 组与 B 组(P<0.01);与d 组比较,E 组与d 组(P>0.05),F 组与d 组(P<0.01)。 提示,KLT 对Hepa1-6 细胞的抑制作用呈剂量、时间依赖关系;并且KLT 以10、30、50 ml/L 作用时,细胞抑制率显著,因此,后续实验用此三种浓度进行。见图1。
2.2 KLT对Hepa1-6细胞形态及传代试验的影响
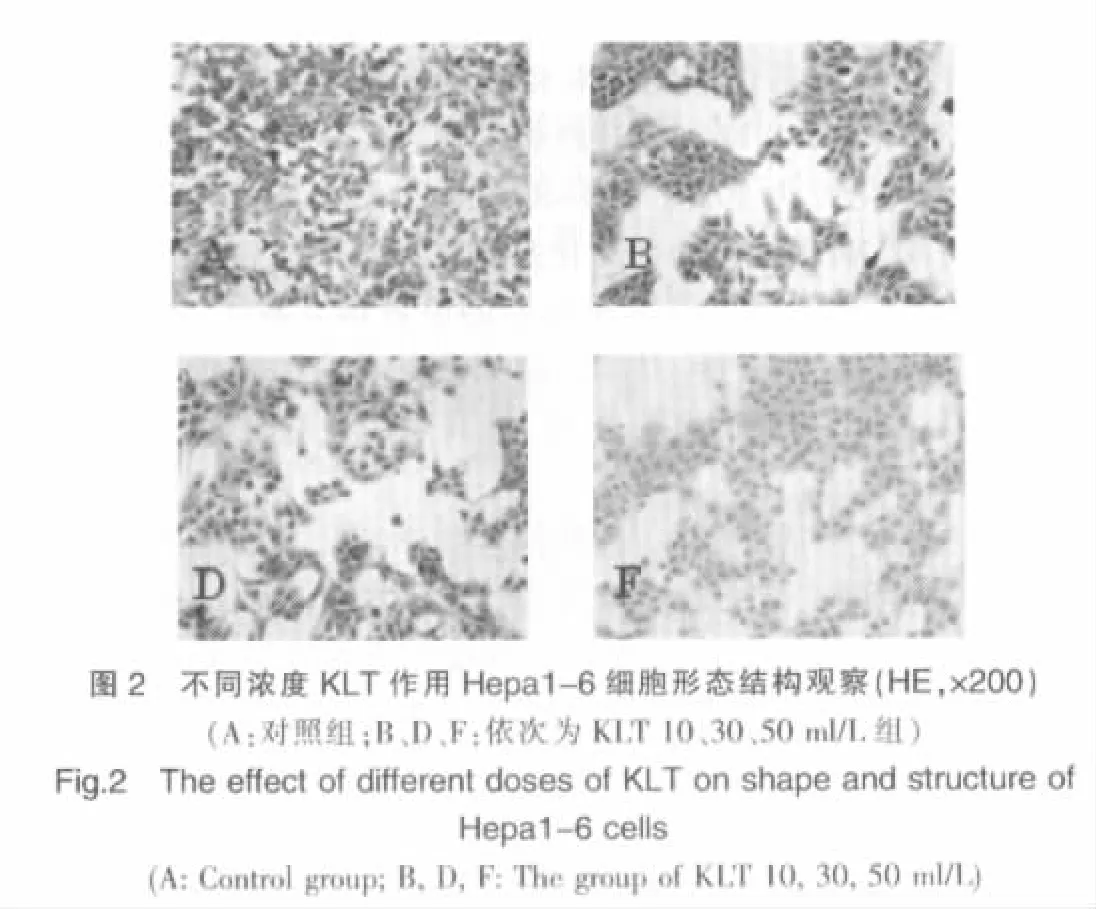
光镜示,Hepa1-6 胞质呈粉红色,胞核呈深蓝色。A 组细胞形态呈多边形或三角形,伪足多、长,满视野瘤巨细胞及核分裂相。随着给药浓度增加,细胞伪足渐回缩,细胞形态变小、圆,细胞轮廓清晰度增强,排列松散或聚集成团,细胞分裂相渐减少,瘤巨细胞渐减少。传代试验表明,A 组细胞生长快,分裂增殖旺盛,3~4d 传代一次,随着给药浓度增加,传代能力逐渐下降且失去传代能力,出现悬浮现象。上述现象表明,细胞形态及传代试验与药物浓度呈依赖性,见图2。
2.3 KLT对Hepa1-6细胞凋亡的影响
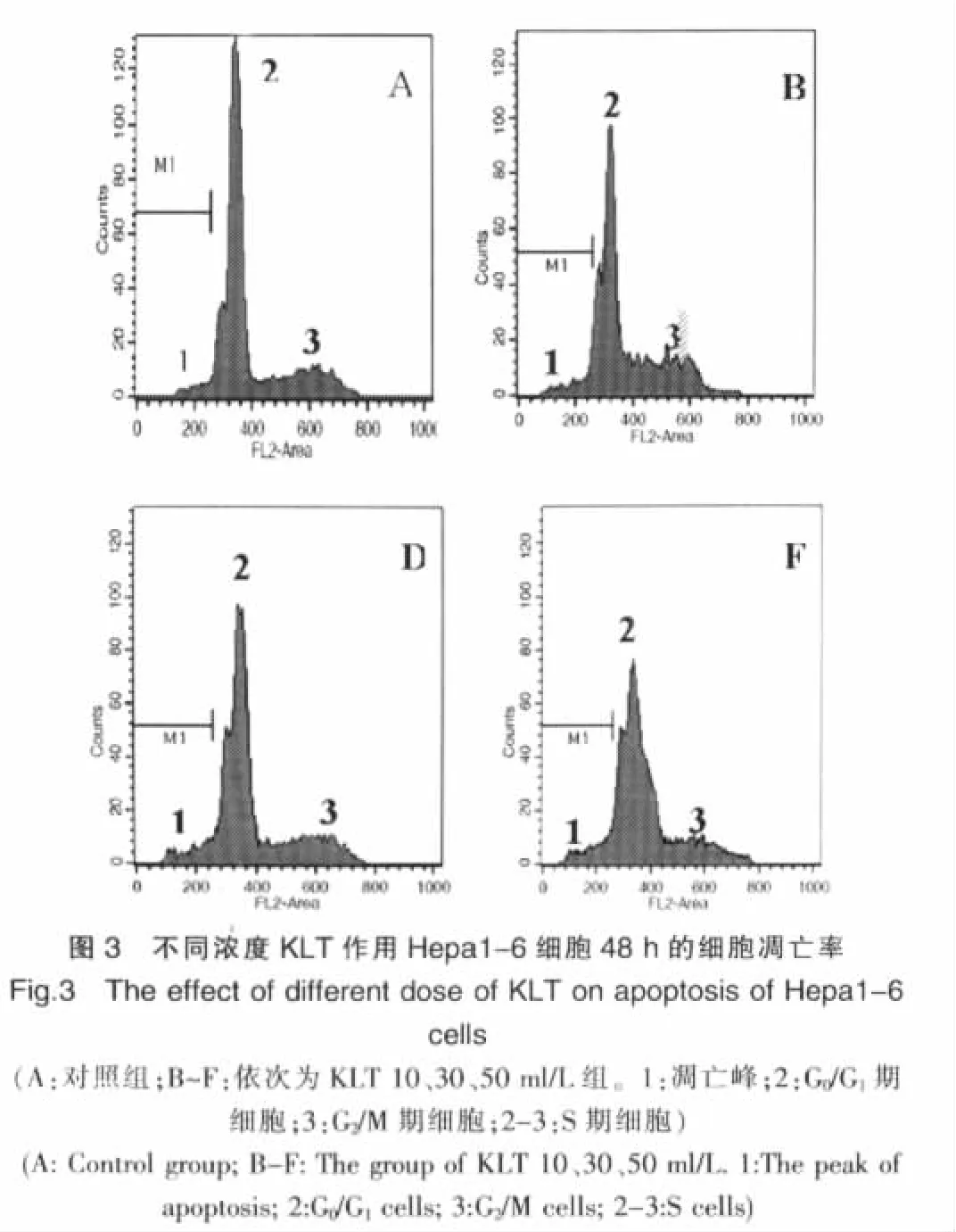
不同剂量KLT 作用Hepa1-6 肝癌细胞48h 后, 均在G0/G1期前出现一个亚二倍体峰,且该峰随着KLT 作用浓度的增高而升高(图 3)。 经 KLT(B、D、F)作用 48h 后,细胞凋亡率分别为(7.86±0.40)%、(12.34±1.09)%和(28.67±0.85)%,而对照组仅为(2.88±0.30)%,各药物组与对照组比较、各药物组间比较,差异均有统计学意义(均P<0.01)。
3 讨论
原发性肝癌系全球发病率和死亡率均较高的恶性肿瘤之一,且近年来发病率有上升趋势[5]。目前临床治疗肝癌仍以手术、放疗、化疗为主,但70%~80%的患者就诊时已失去手术最佳时期。临床常用的西药化疗物虽有很强的癌细胞杀伤性,但药物的毒副作用使体质较差的患者难以耐受,极大地降低了患者的生存质量。因此,临床上寻求一种既能抑制肝癌的生长,又无明显的毒副作用、提高患者生存质量的药物迫在眉睫。
恶性肿瘤包括肝癌在内,共同生物学特征是细胞的失控增长,即细胞凋亡与细胞增殖失衡。因此,抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡已成为目前肿瘤综合治疗的重要途径之一[6]。KLT注射液是从传统中药薏苡仁中提取的新型双相广谱中药制剂,具有多靶点治疗、提高晚期癌症患者的生存质量和毒副作用小等优点,目前临床已应用于非小细胞肺癌[7]、胃癌[8]、大肠癌[9]等恶性肿瘤的综合治疗中。本研究通过MTT法观察,结果表明,KLT能够有效抑制肝癌Hepa1-6细胞增殖,抑制率呈明显的时间、浓度依赖性,且10、30、50 ml/L抑制作用明显。
苏伟贤等[8]将不同浓度的KLT作用于人SGC-7901胃癌细胞,研究发现随着药物浓度增加,胃癌细胞核浆比例显著缩小,细胞恶性程度降低,细胞分化趋向良性;本研究细胞爬片HE染色示,发现给药后Hepa1-6肝癌细胞伪足回缩,细胞变小、变圆,核分裂相减少,出现悬浮现象,传代能力减弱,且呈浓度依赖性。进一步提示KLT可能在一定程度上能够诱导肿瘤细胞向正常细胞分化。
细胞凋亡是指为维持内环境稳定而出现的一种由多种凋亡相关基因控制的细胞自主的有序死亡,受细胞内源性基因、酶类和信号转导途径的调控。研究认为,细胞凋亡功能的抑制将导致肿瘤的发生[10]。因此,以选择性诱导肿瘤细胞凋亡已成为肿瘤治疗的重要策略之一[11-12]。本研究采用流式细胞术发现KLT可以诱导Hepa1-6肝癌细胞株发生凋亡,且凋亡峰随着KLT作用浓度的增高而升高,细胞增殖受到抑制,提示KLT抗肿瘤作用可能通过其促凋亡机制来实现。
[1]杨红亚,王兴红,彭谦.薏苡仁抗肿瘤活性研究进展[J].中草药,2007,38(8):7-9.
[2]杨晓蓉.薏苡仁化学成分及抗肿瘤活性研究进展[J].辽宁中医药大学学报,2008,10(3):135-138.
[3]唐东平,韦长元,唐凯,等.康莱特注射液对肝癌化疗增敏作用的实验研究[J].肿瘤防治杂志,2001,8(4):396-397.
[4]伊如如.介入治疗联合康莱特注射液治疗中晚期肝癌疗效观察[J].中外医疗,2009,(17):78.
[5]Schafer M,Sorrell MF.Hepatocellular carcinoma [J].Lancet,1999,353:1253-1257.
[6]Rodriguez-Nieto S,Zhivotovsky B.Role of alterations in the apoptotic machinery in sensitivity of cancer cells to treatment [J].Curr Pharmdes,2006,12(34):4411-4425.
[7]阙劲松,闫建强.康莱特联合化疗中晚期非小细胞肺癌[J].现代肿瘤医学,2009,17(4):671-673.
[8]苏伟贤,朱光辉,肖焕擎,等.康莱特对胃癌细胞增殖及凋亡能力的影响[J].临床和实验医学杂志,2008,7(4):89-90.
[9]吕金芳.薏苡仁提取物合并化疗治疗晚期大肠癌临床观察[J].肿瘤防治杂志,2000,7(6):671.
[10]Gobeg,Rubin M,Williamsg,et al.Apoptosis and expression of Bcl-2,Bcl-XL and Bax in renal cell carcinomas[J].Cancer Investigation,2002,20(3):324-332.
[11]Chase A,Grand FH,Cross NC.Activity of TKI258 against primary cells and cell lines with FGFR1 fusiongenes associated with the 8p11 myeloproliferative syndrome[J].Blood,2007,110(10):3729-3734.
[12]Ghosh AK,Varga J.The transcriptional coactivator and acetyltransferase p300 in fibroblast biology and fibrosis[J].J Cell Physiol,2007,213(3):663-671.
