康莱特注射液对Lewis 肺癌小鼠TAM及HIF-1α的影响
2016-07-04彭丽丽张洪珍
闫 哲,彭丽丽,申 婷,张洪珍,2
(1. 河北医科大学研究生学院,河北 石家庄 050017;2. 河北省人民医院,河北 石家庄 050051)
康莱特注射液对Lewis 肺癌小鼠TAM及HIF-1α的影响
闫哲1,彭丽丽1,申婷1,张洪珍1,2
(1. 河北医科大学研究生学院,河北 石家庄 050017;2. 河北省人民医院,河北 石家庄 050051)

[摘要]目的研究康莱特注射液对Lewis 肺癌小鼠肿瘤相关巨噬细胞(TAM)及缺氧诱导因子-1α(HIF-1α)表达的影响。方法将造模成功Lewis 肺癌荷瘤小鼠随机分为模型组、康莱特组、顺铂组及康莱特+顺铂组,模型组给予生理盐水腹腔注射,其余组均分别给予相应药物腹腔注射。干预14 d后处死各组小鼠取瘤组织,流式细胞仪检测TAM的比例,实时定量PCR检测HIF-1αmRNA的表达情况。结果康莱特组、顺铂组及康莱特+顺铂组小鼠瘤质量均明显低于模型组(P均<0.05);康莱特+顺铂组与顺铂组抑瘤率均明显高于康莱特组(P均<0.05),但康莱特+顺铂组与顺铂组比较差异无统计学意义(P>0.05)。顺铂组小鼠脾指数明显低于其他3组(P均<0.05),康莱特组小鼠脾指数明显高于其他3组(P均<0.05),而康莱特+顺铂组与模型组比较差异无统计学意义(P>0.05)。康莱特组和康莱特+顺铂组TAM比例均明显低于模型组(P均<0.05),康莱特组和康莱特+顺铂组比较差异无统计学意义(P>0.05),康莱特+顺铂组明显低于顺铂组(P<0.05)。康莱特组、顺铂组、康莱特+顺铂组HIF-1α表达量均明显低于模型组(P均<0.05),康莱特+顺铂组HIF-1α表达量均明显低于康莱特组、顺铂组(P均<0.05),而康莱特组与顺铂组比较差异无统计学意义(P>0.05)。结论康莱特注射液具有抗肿瘤作用,与顺铂联用可增强化疗疗效、提高小鼠免疫功能,可能是通过降低TAM水平、改善缺氧实现的。
[关键词]康莱特注射液;Lewis 肺癌;肿瘤相关巨噬细胞;缺氧诱导因子-1α
肺癌在世界范围内死亡率居恶性肿瘤的首位。铂类为主的化疗药物在肺癌综合治疗中占有重要地位,但毒副作用限制了其应用。多项研究表明康莱特注射液对化疗具有增效减毒作用[1],但具体机制尚不十分明确。本研究从肿瘤免疫微环境中肿瘤相关巨噬细胞(TAM)和缺氧微环境标志之一缺氧诱导因子-1α(HIF-1α)出发,研究了康莱特注射液联合顺铂对Lewis肺癌荷瘤小鼠的影响及其相关机制,现将结果报道如下。
1实验资料
1.1动物健康雄性昆明种小鼠,4~6周龄,体质量18~24 g,购自河北省实验动物中心(动物合格证编号:1409008),给予常规饲料喂养,不控制饮水,由河北省人民医院临研中心提供SPF级动物饲养室。
1.2细胞株小鼠Lewis肺癌细胞株,购自河北医科大学免疫教研室,用含10%胎牛血清的DMEM高糖培养基,在37 ℃、5%二氧化碳的细胞培养箱中培养。
1.3主要药品及试剂康莱特注射液购于浙江康莱特药业有限公司,国药准字Z10970091;注射用顺铂购于齐鲁制药有限公司,规格:10 mg,国药准字H20023461。四季青胎牛血清为浙江天杭生物科技有限公司产品;DMEM高糖培养液为美国Gibco公司产品。逆转录试剂盒购自R&D Systems,Inc.USA。PE-CD11b、FITC-F4/80 mAb购自美国eBioscience公司。
1.4实验方法
1.4.1模型的建立及分组干预Lewis肺癌细胞株复苏后传代,取传至3~4代生长良好的Lewis肺癌细胞,台盼蓝计数活性>95%,配制细胞浓度为5×107个/mL的细胞悬液,0.2 mL/只注射于小鼠左前腋窝皮下。接种6~7 d后,小鼠左前腋皮下可触及2~3 mm直径硬结,证实移植瘤模型建立成功。隔日定时用游标卡尺测量肿瘤最长径(a)及最短径(b),待最长径为0.8~1 cm时,舍弃肿瘤过大(ab>2.5 cm2) 或过小(ab<0.20 cm2) 的小鼠,挑选肿瘤大小较均一的荷瘤小鼠24只,随机分为模型组、康莱特组、顺铂组及康莱特+顺铂组,每组6只。模型组给予生理盐水腹腔注射,其余组均分别给予相应药物腹腔注射。其中生理盐水、康莱特注射液按12.5 mL/kg,顺铂按1 mg/kg(将10 mg顺铂溶于125 mL氯化钠注射液中)每天腹腔注射,两次注射之间间隔12 h,连续注射14 d。
1.4.2肿瘤抑制率及脾脏指数计算干预第15天脱颈处死小鼠,完整剥离肿瘤及脾脏,分别称质量,计算抑瘤率及脾脏指数。抑瘤率= (模型组平均瘤质量-干预组平均瘤质量)/模型组平均瘤质量×100%。脾脏指数=脾质量(mg)/小鼠体质量(g)。
1.4.3肿瘤组织TAM比例检测将肿瘤组织机械法制备成细胞悬液,加入PE-F4/80+和FITC-CD11b+抗体各2 μL,用流式细胞仪检测CD11b+ F4/80+细胞含量。
1.4.4肿瘤组织HIF-1αmRNA表达量检测提取细胞总RNA,电泳鉴定完整性和纯度,逆转录成cDNA后进行实时荧光定量PCR反应,反应条件:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 30 s,共30个循环,后延伸72 ℃ 10 min。按照RQ=2-△△Ct计算HIF-1α mRNA表达水平的RQ值,用于统计分析。GAPDH作内参照,上游引物序列为5’-TGAACGGGAAGCTCACTG-3’,下游为5’-GCTTCACCACCTTCTTGATG-3’,片段长度为121 bp;HIF-1α上游引物序列为5’-TCAAAGTCGGACAGCCTCA-3’,下游为5’-CCCTGCAGTAGGTTTCTGCT-3’,片段长度为90 bp。
2结果
2.1各组小鼠一般情况接种癌细胞后,早期无明显变化,接种6~7 d后,小鼠左前腋皮下可触及2~3 mm直径硬结,皮下移植瘤生长,进食、活动较前减少,毛发欠光泽,有脱落。第10天绝大部分小鼠肿瘤最长径0.8~1.0 cm。后期模型组部分荷瘤小鼠反应迟钝,肿瘤局部皮肤可见点片状溃烂、渗血、渗液,少数因瘤体积过大而出现左前肢运动障碍。而各给药组小鼠较模型组小鼠进食多、活动敏捷。
2.2各组肿瘤抑制率比较康莱特组、顺铂组及康莱特+顺铂组小鼠瘤质量均明显低于模型组(P均<0.05);康莱特+顺铂组与顺铂组抑瘤率均明显高于康莱特组(P均<0.05),但康莱特+顺铂组与顺铂组比较差异无统计学意义(P>0.05)。见表1。
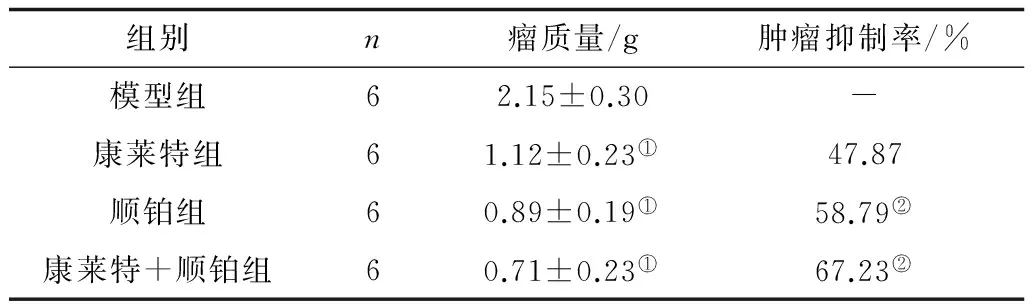
表1 各组小鼠瘤质量及肿瘤抑制率比较
注:①与模型组比较,P<0.05;②与康莱特组比较,P<0.05。
2.3各组小鼠脾脏指数比较模型组、康莱特组、顺铂组、康莱特+顺铂组脾脏指数分别为(7.31±1.50)mg/g、(9.70±1.53)mg/g、(4.58±1.29)mg/g、(6.54±1.68)mg/g 。顺铂组小鼠脾指数明显低于其他3组(P均<0.05),康莱特组小鼠脾指数明显高于其他3组(P均<0.05),而康莱特+顺铂组与模型组比较差异无统计学意义(P>0.05)。
2.4各组肿瘤组织TAM比例模型组、康莱特组、顺铂组、康莱特+顺铂组TAM比例分别为(6.41±1.73)%、(4.27±1.44)%、(6.52±1.77)%、(4.08±0.67)%。康莱特组和康莱特+顺铂组TAM比例均明显低于模型组(P均<0.05),康莱特组和康莱特+顺铂组比较差异无统计学意义(P>0.05),康莱特+顺铂组明显低于顺铂组(P<0.05)。双染色流式细胞仪检测结果见图1~4。

图1 模型组肿瘤组织TAM比例
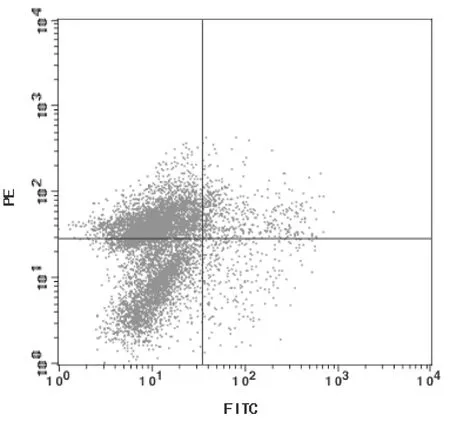
图2 康莱特组肿瘤组织TAM比例

图3 顺铂组肿瘤组织TAM比例

图4 康莱特+顺铂组肿瘤组织TAM比例
2.5各组肿瘤组织中HIF-1αmRNA表达情况模型组、康莱特组、顺铂组、康莱特+顺铂组HIF-1αmRNA表达量分别为2.47±0.57,1.59±0.39,1.76±0.49,1.03±0.21。康莱特组、顺铂组、康莱特+顺铂组HIF-1α表达量均明显低于模型组(P均<0.05),康莱特+顺铂组的HIF-1α表达量均明显低于康莱特组、顺铂组(P均<0.05),而康莱特组与顺铂组比较差异无统计学意义(P>0.05)。
3讨论
随着医学科学的发展和医疗水平的提高,肺癌的治疗已从单一方法治疗逐步发展成手术、放化疗、靶向治疗、免疫治疗等综合治疗[2]。2006年世界卫生组织将包括肺癌在内的恶性肿瘤的定位从“不治之症”转变为“可以控制的慢性疾病”[3],但肺癌患者确诊时30%~40%已是局部晚期,40%有远处转移,整体5年生存率并未随治疗手段的多样化而显著改善,其原因也与治疗主要着眼于肿瘤细胞本身,而极少考虑其所处微环境有关。肿瘤微环境包括肿瘤细胞及其周围的成纤维细胞、固有及特异性免疫细胞(中性粒细胞、巨噬细胞、肥大细胞、淋巴细胞等)、血管和淋巴管结构的组成细胞(上皮细胞、内皮细胞、毛细血管外膜细胞等) 及细胞外基质蛋白、生长因子和细胞因子等[4],肿瘤的发生发展与其关系密切,按照其特点可分为肿瘤缺氧微环境、肿瘤酸性微环境及肿瘤免疫微环境。
TAM是肿瘤免疫微环境中数量最多的免疫细胞群,主要由外周循环中的单核细胞在多种趋化因子作用下招募至肿瘤组织,并分化增殖而来,在肿瘤微环境中,TAM具有抑制免疫、促进血管生成和组织重塑的作用[5]。研究认为TAM通过诱导多种生长因子如血管内皮生长因子(VEGF)、转化生长因子-β(TGF-β)、促进细胞外基质降解、介导免疫逃逸、促进血管和淋巴管生成等方式,促进肿瘤的发生、发展、侵袭和转移,导致不良预后[6];其还可通过削弱Caspase凋亡信号通路[7]、高表达半胱氨酸组织蛋白酶[8]等途径参与化疗耐药。HIF-1是在缺氧条件下广泛存在于哺乳动物细胞核中的一种具有转录活性的核蛋白,由功能型α亚基和构成型β亚基组成,其生物效应由α亚基完成。HIF-1α通过激活下游靶基因如促红细胞生成素(EPO)、葡萄糖载体蛋白1,3(GLUT1,3)、p53等,影响肿瘤及周围组织的血管发生、红细胞生成、糖代谢、细胞凋亡、上皮间质化等[9-10],或调节酶活性降低活性氧簇(ROS)水平[11]促进肿瘤的发生发展、侵袭转移。
近年来,“补充替代医学”在恶性肿瘤的治疗中应用越来越广泛,中药作为补充替代医学的一大主要形式正逐步被广泛应用。康莱特注射液是目前临床用于肺癌的中药制剂之一,提取自传统利水渗湿类中药薏苡仁,大量的基础和临床研究证实康莱特注射液具有抗肿瘤、化疗增效减毒[11]、增强免疫、提高生活质量[12]等作用,有关机制涉及降低耐药相关因子MDR1/P-gp、NF-κB/IκB等的水平,阻断有丝分裂,促肿瘤细胞凋亡,抑制血管和淋巴管生成,抑制COX-2表达等。本实验结果显示,康莱特+顺铂组与顺铂组抑瘤率均明显高于康莱特组,但康莱特+顺铂组与顺铂组比较差异无统计学意义;顺铂组小鼠脾指数明显低于其他3组,康莱特组小鼠脾指数明显高于其他3组,而康莱特+顺铂组与模型组比较差异无统计学意义;康莱特组和康莱特+顺铂组TAM比例均明显低于模型组,康莱特组和康莱特+顺铂组比较差异无统计学意义,康莱特+顺铂组明显低于顺铂组;康莱特组、顺铂组、康莱特+顺铂组HIF-1α表达量均明显低于模型组,康莱特+顺铂组HIF-1α表达量均明显低于康莱特组、顺铂组,而康莱特组与顺铂组比较差异无统计学意义。
提示康莱特注射液单用及与顺铂联用均可抑制肿瘤生长,能降低Lewis肺癌组织中TAM比例及HIF-1αmRNA表达量,两者联合应用效果更明显,且康莱特注射液与顺铂联用可显著升高脾脏指数,说明康莱特除本身具有抗肿瘤作用外,还可改善化疗药物所致的免疫抑制。
综上所述,康莱特注射液的抗肿瘤机制可能是通过提高机体免疫功能、降低肿瘤微环境中的TAM水平、改善缺氧实现的。
[参考文献]
[1]Liu X,Yang Q,Xi Y,et al. Kanglaite injection combined with c-hemotherapy versus chemotherapy alone in the treatment of advanced non-small cell lung carcinoma[J]. J Cancer Res Ther,2014,10(Suppl 1):46-51
[2]Siegel R,Ma J,Zou Z,et al. Cancer Statistics, 2014[J]. CA Cancer J Clin,2014,64(1):9-29
[3]孙燕. 进一步提高中西医结合防治肿瘤的临床研究水平[J]. 中国新药杂志,2011,20(17):1588-1591;1611
[4]Yang JD,Nakamura I,Roberts LR. The tumor microenvironment in hepatocellular carcinoma: current status and therapeutic targets[J]. Semin Cancer Biol,2011,21(1):35-43
[5]Mantovani A,Germano G,Marchesi F,et al. Cancer-promoting tumor-associated macrophages:new vistas and open questions[J]. Eur J Immunol,2011,41(9):2522-2525
[6]Qian BZ,Pollard JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell,2010,141(1):39-51
[7]Zheng Y,Cai Z,Wang S,et al. Macrophages are an abundant component of myeloma microenvironment and protect myeloma cells from chemotheropy drug-induced apoptosis[J]. Blood,2009,114(17):3625-3628
[8]Shree T,Olson OC,Elie BT,et al. Macrophages and cathepsin proteases blunt chemotherapeutic response in breast cancer[J]. Genes Dev,2011,25(29):2465-2479
[9]Lei Wang,Young-Ok Son,Songze Ding,et al. Ethanol Enhances Tumor Angiogenesis In Vitro Induced by Low-Dose Arsenic in Colon Cancer Cells Through Hypoxia-Inducible Factor 1 Alpha Pathway[J]. Toxicol Sci,2012,130(2):269-280
[10] Xu Z,Liu E,Peng C,et al. Role of hypoxia-inducible-1α in hepatocellular carcinoma cells using a Tet-on inducible system to regulate its expression in vitro[J]. Oncol Rep,2012,27(2):573-578
[11] Guan D,Su Y,Li Y,et al. Tetramethylpyrazine inhibits CoCl2 -induced neurotoxicity through enhancement of Nrf2/GCLc/GSH and suppression of HIF1α/NOX2/ROS pathways[J]. J Neurochem,2015,134(3):551-565
[12] 杨晓玲. 康莱特注射液对晚期恶性肿瘤患者生活质量及免疫功能影响的临床观察[J]. 山西中医,2013,29(11):20-21
Effects of Kanglaite injection on TAM and expression of HIF-1α in vivo in Lewis lung carcinoma mice
YAN Zhe1, PENG Lili1, SHEN Ting1, ZHANG Hongzhen1,2
(1. Graduate School of Hebei Medical University, Shijiazhuang 050017, Hebei, China;2. Hebei General Hospital, Shijiazhuang 050051, Hebei, China)
Abstract:Objective It is to investigate the effects of Kanglaite injection (KLT) on tumor associated macrophage (TAM)and expression of hypoxia inducible factor-1 alpha(HIF-1α) in Kunming mice with Lewis lung carcinoma. Methods The models sucessfully established of Kunming mice with Lewis lung carcinoma were randomly divided into four groups: the control (NS)group, KLT group, cisplatin(DDP) group and DDP+KLT group. Tumors were harvested 14 days after corresponding interventions. The percentage of TAM was determined by flow cytometry and HIF-1αmRNA was detected by realtime-PCR. Results Tumor weight of mice in KLT group, DDP group and DDP+KLT group was significantly lower than that of NS group(P<0.05); Tumor growth inhibition rate in DDP+KLT group was higher than DDP group,without statistical significance(P>0.05). The spleen index was lower in DDP group than in NS group(P<0.05),but was significantly increased when combined with KLT (P<0.05). The percentage of TAM was higher in DDP group than in NS group, but was not statistically significant(P>0.05), and the combination with KLT significantly decreased the percentage(P<0.05). Expression of HIF-1αwas lower in KLT group,DDP group and DDP+KLT group than in NS group,and it decreased more in DDP+KLT group(P<0.05). Conclusion KLT has pronounced antitumor activity in mice with Lewis lung carcinoma.It enhances the chemotherapy effect and improve immunity function when combined with cisplatin,which can be accomplished by decreasing the TAM level and improving hypoxia status.
Key words:Kanglaite; Lewis lung carcinoma;tumor associated macrophage; hypoxia inducible factor-1α
[作者简介]闫哲,女,硕士,研究方向为放疗为主的恶性肿瘤综合治疗。 [通信作者]张洪珍,E-mail: 1256596529@qq.com
doi:10.3969/j.issn.1008-8849.2016.10.007
[中图分类号]R-332
[文献标识码]A
[文章编号]1008-8849(2016)10-1047-04
[收稿日期]2015-10-30
