解脂耶氏酵母URA3基因的敲除
2010-08-27冯春利任清张蕾蕾李秀婷宋焕禄
冯春利, 任清, 张蕾蕾, 李秀婷, 宋焕禄
(北京工商大学化学与环境工程学院,北京 100048)
解脂耶氏酵母URA3基因的敲除
冯春利, 任清, 张蕾蕾, 李秀婷, 宋焕禄*
(北京工商大学化学与环境工程学院,北京 100048)
构建了营养缺陷型解脂耶氏酵母菌株,使之用于遗传标记和高产香味物质γ-癸内酯。作者利用基因同源重组的方法敲除掉尿嘧啶合成酶关键基因URA3基因,用尿嘧啶营养缺陷型培养基(SD-URA)添加一定浓度的5-氟乳清酸(5-FOA)和尿嘧啶筛选获得转化子。实验表明:尿嘧啶营养缺陷型菌株在含有5-FOA和尿嘧啶的培养基上生长而野生型菌株不生长,从而建立了一种快速获得营养缺陷型解脂耶氏菌株的方法。
解脂耶氏酵母菌;URA3;基因敲除
解脂耶氏酵母于1942年首次被分离得到,先后被命名为Candida lipolytica、Endomycopsis lipolytica、S accharomycopsis lipolytica,最终定名为Yarrowia lipolytica(解脂耶氏酵母)[1]。解脂耶氏酵母是非常规酵母中的一种[2],非常适应疏水环境,可以代谢不饱和羟基酸,用于香味物质γ-癸内酯的制备。在众多的可以生产γ-癸内酯的菌株中,酵母Yarrowia lipolytica的发酵能力是较强的[3]。
在Yarrowia lipolytica中,URA3[4-5]基因能够编码乳清苷酸脱羧酶基因,该酶是尿嘧啶合成的关键酶。该酶又可催化5-氟乳清酸(5-FOA)[6]转化为有毒物质。作者通过对URA3基因敲除,使5-氟乳清酸(5-FOA)无法形成有毒物质5-氟尿嘧啶核苷酸,从而对5-FOA具有抗性,其嘧啶核苷酸营养则可以向培养基加入尿嘧啶通过补救途径给与补充;而5-FOA可以抑制野生型解酯酵母菌生长。因此5-FOA可用于尿嘧啶营养缺陷型突变体的筛选[7-8]。
作者构建的营养缺陷型解脂酵母菌株,一方面可以作为遗传标记,应用于遗传工程和菌种改良。另一方面由于解酯酵母菌一般用于香味物质γ-癸内酯的制备。苏畅等[9]曾对7株菌产生γ-癸内酯的能力进行了研究,结果发现Yarrowia lipolyticaAS2.1405产生γ-癸内酯的能力最强,产率为1%。作者所在实验室所用的菌株为Yarrowia lipolyticaAS2.1405。在不含有尿嘧啶的培养基中,尿嘧啶缺陷型的Yarrowia lipolytica菌株进行生物转化蓖麻油酸甲酯,使蓖麻油酸的一个旁路代谢途径和细胞生长受到抑制,从而转回内酯的合成途径[10],由此可以提高香味物质γ-癸内酯产量,具有非常重要的理论价值和应用前景。
1 材料与方法
1.1 菌种及质粒
解脂耶氏酵母Y.lipolyticaAs 2.1405:购自中国模式菌种保藏中心,是一株模式菌株,为非常规酵母,用于香味物质γ-癸内酯的制备;大肠杆菌DH5α:作者所在实验室保藏;质粒pBluscriptks +:作者所在试验室保藏,用于在大肠杆菌中载体制备,具有氨苄青霉素抗性,可用于大肠杆菌的蓝白筛选。
1.2 培养基
YEPD液体培养基(组分g/L):葡萄糖1,蛋白胨1,酵母浸膏0.5;p H值自然。112℃灭菌20 min。
LB液体培养基(组分g/L):蛋白胨1,酵母浸膏0.5,NaCl 1。121℃灭菌20 min。
LB固体培养基:LB液体培养基中加1.5 g/dL的琼脂。
GENMED酵母菌尿嘧啶合成缺陷型(SDURA)培养基:含有除尿嘧啶外所有其它氨基酸和核苷酸基本营养元素,用于尿嘧啶营养缺陷型的筛选,购自上海百事生物科技有限公司。
1.3 酶及主要试剂
蜗牛酶、Taq DNA Polymerase聚合酶、T4 DNA Ligase连接酶等:均购于北京天根生化科技有限公司。Trans DNA MarkerⅢ:购于北京全式金生物技术有限公司;限制性内切酶:SalⅠ、EcoRⅠ、PstⅠ、HindⅢ等酶:购于宝生物工程(大连)有限公司;小牛胸腺DNA,5-FOA,PCR扩增所用引物等:均购自上海生工有限公司;其他化学试剂:购自北京拜尔迪生物技术有限公司。
1.4 引物设计
利用NCBI的Entrez检索系统,查知该酵母菌已经注册过的URA3的基因,获得启动子和终止子序列;根据已知序列,用Primer premier5.0软件设计上游引物和下游引物。
URA3上游引物:5’-CAA GGTACCGCTATCACATCACGCTCTCA-3’,下划线部分为KpnⅠ酶切位点。
URA3下游引物:5’-ATCGAATTCTCATGA TTTCAAACACG-3’,下划线部分为EcoRⅠ酶切位点。
1.5 主要仪器及设备
Alpha自动凝胶成像仪:Alpha Inotech公司制造;DYY-6C电泳仪:北京六一仪器厂制造;XP梯度PCR仪:杭州博日科技有限公司制造。
1.6 方法
1.6.1 酵母基因组的提取 将保存在斜面培养基上的解脂酵母菌接种于2 mL液体YEPD培养基中,28℃振荡过夜(200 r/min),提取酵母基因组[11],0.8 g/dL琼脂糖凝胶电泳检测。
1.6.2 目的基因的PCR扩增 利用PCR方法扩增Yarrowia lipolytica尿嘧啶合成酶关键基因URA3。
PCR反应条件为:95℃预变性5 min;94℃变性4 s,55℃退火45 s,72℃延伸2 min 45 s,循环30次;72℃最后延伸10 min,4℃保存。
1.6.3 基因敲除组件的构建
1)质粒pBluscript ks+和PCR扩增产物URA3基因的酶切:PCR产物酶切体系20μL为10 ×M Buffer 2μL、PCR产物10μL、去离子水6.6 μL、EcoRⅠ0.7μL、KpnⅠ0.7μL;质粒pBluscript ks+酶切体系20μL为10×M Buffer 2μL、质粒DNA 2μL、去离子水14.4μL、EcoRⅠ0.8 μL、KpnⅠ0.8μL;37℃保温5 h,然后电泳。将质粒和PCR产物酶切体系用天根琼脂糖凝胶回收试剂盒回收,然后放入-20℃保存备用。
2)重组质粒m13-URA3的酶连:在1.5 mL离心管中加入以下20μL体系。目的DNA片段12 μL、载体DNA 3μL、10×Ligase Buffer 2μL、T4 DNA Ligase 2μL、去离子水1μL。调节保温杯为16℃,连接过夜。
3)重组质粒的转化:将酶连产物转化大肠杆菌E.coli DH5α感受态细胞,方法见文献[11,12]。
4)重组质粒快速提取:用无菌牙签挑菌法挑取含有氨苄青霉素LB平板上的白色菌落,接种于含Amp 50μg/mL的2 mL LB培养基中,37℃振荡过夜。取出大肠杆菌至1.5 mL离心管中,离心加25μL TE缓冲液再加入25μL Tris饱和酚-氯仿(体积比1∶1),激烈振荡混匀后12 000 r/min离心5 min,用1 g/dL琼脂糖凝胶电泳验证。
5)重组质粒的大量提取与鉴定:提取小量快速提取后比原始质粒大的重组质粒,并进行单酶切和双酶切验证。
6)URA3基因敲除组件的构建:将已经构建的重组质粒m13-URA3进行SalⅠ单酶切,由于在URA3基因的CDS区两侧有相同的SalⅠ酶切位点,可以将URA3基因的CDS区切除,从而进一步16℃连接过夜。转化大肠杆菌后大量提取已经去掉URA3的CDS区的基因敲除质粒。
1.6.4 将URA3基因敲除组件转化酵母 制备酵母菌感受态细胞,利用醋酸锂方法[13-14]介导URA3基因敲除组件转化酵母感受态细胞,转化后的酵母菌涂布于含有5-FOA的GENMED酵母菌尿嘧啶合成缺陷型(SD-URA)培养基上,28℃培养3~4 d使转化子形成单菌落。同时做一组未进行转化质粒的酵母菌对照。
1.6.5 尿嘧啶营养缺陷型菌株的筛选和分子生物学鉴定 从合成缺陷型(SD-URA)培养基上挑取单菌落进行饥饿培养至菌体浓度不再增长,将其均匀涂布于加有尿嘧啶的完全培养基和不添加尿嘧啶的基本培养基上做对比。经多次复筛和分离纯化获得遗传性状稳定的尿嘧啶营养缺陷型菌株进行保存。并将这些菌株进行提取基因组后,利用原URA3基因上下游引物进行PCR扩增,进行分子生物学鉴定。
2 结果与讨论
2
.1 目的基因的PCR扩增
利用设计好的引物1和引物2,对已经提取的酵母基因组进行URA3基因的PCR扩增,并获得与NCBI上已经公布的该基因大小相符,经天根生物技术公司基因测序,为所需要的目的基因,长度为2.56 kb,见图1。

图1 URA3基因的PCR扩增Fig.1 PCRamplification ofURA3 gene
2.2 构建URA3基因敲除组件
首先将大小为2.56 kb左右的URA3基因连到pBluscript ks+载体上,见图2。由于在URA3基因上有两个SalI酶切位点,将5.5 kb的m13-URA3重组质粒进行Sal I酶切,可以将URA3的CDS区切除,凝胶回收3.8 kbp左右片段,然后酶连获得去除CDS区的重组敲除载体。其片段大小为3.8 kb左右。构建的质粒酶切验证见图3。左侧为pBluscript ks+载体和URA3基因连接后的酶切图。1道为m13-URA3重组质粒载体,2道为用SalⅠ酶切后将URA3基因的CDS区切除,大小分别为3.8 kb和1.7 kb。将3.8 kb片段凝胶回收,然后用T4连接酶于16℃连接构成敲除组件。

图2 URA3基因敲除组件的构建过程Fig.2 Construction ofURA3 gene disrupt cassette
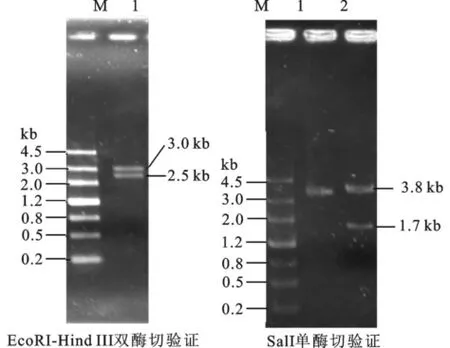
图3 重组质粒m13-URA3质粒的单双酶切验证Fig.3 Recombinantm13-URA3 plasmid digestion validation
2.3 利用基因敲除组件转化酵母
将获得的基因敲除组件用PstⅠ进行单酶切,将URA3基因敲除组件切成线型,转化酵母。此敲除组件与酵母体内URA3基因左侧有454 bp,右侧有395 bp的同源片段,因此可以发生同源重组。从而替换掉酵母内部的URA3基因,用含有一定浓度5-FOA和尿嘧啶的筛选培养基筛选敲除掉URA3基因的营养缺陷型转化子。表1、2为进行初步筛选。

表1 敲除组生长情况Tab.1 G rowth of the disrupted strain

表2 野生型(未敲除组)生长情况Tab.2 G rowth of the wild type strain
将初筛获得的转化子挑取菌株接入不含尿嘧啶的液体培养基和固体培养基上,均未生长,同时做了对照组含有尿嘧啶和5-FOA为1 mg/mL的培养基,结果转化子生长,说明初筛获得的营养缺陷型转化子是正确的。
2.4 尿嘧啶营养缺陷型菌株的进一步验证和分子生物学鉴定
提取营养缺陷型酵母基因组和野生型酵母基因组,用URA3基因上下游引物对其分别进行PCR扩增,并且在含有尿嘧啶20μg/mL和5-FOA为1 mg/mL的(SD-URA)固体培养基上划线培养。
由图4可知,营养缺陷型菌株进行URA3基因PCR扩增得到849 bp片段,而野生型菌株PCR扩增片段仍为2 560 bp。图5左侧为野生型菌株,未生长,而右侧为获得的营养缺陷型菌株。由此双重验证了基因敲除成功,构建出了尿嘧啶营养缺陷型菌株。

图4 基因缺陷型的分子生物学验证Fig.4 G enetic defects in molecular biology-based authentication

图5 尿嘧啶营养缺陷型菌株的鉴定Fig.5 Identification of uracil auxotrophic strain
3 结 语
构建了2个重组质粒并且均经过了单双酶切的验证,然后通过同源重组的方法转化酵母获得营养缺陷型转化子。在敲除掉URA3基因后,可用其作为筛选标记,进行其他功能基因的敲除研究。通过基因敲除技术得到的尿嘧啶营养缺陷型菌株,在不含有尿嘧啶的发酵培养基中,能够抑制蓖麻油酸的一个旁路代谢途径和细胞生长,使其转回内酯的合成途径,从而提高香味物质γ-癸内酯产量,因此在下一步生产实践中,还可以进行培养基优化,进而使γ-癸内酯产量更加提高,进行香味物质制备。
[1]Barth G,Gaillardin C.Non-conventional Yeasts in Biotechnology[M].Berlin:Springer-Verlag,1996:313-388.
[2]Madzak Catherine,Gaillardin Claude,Beckerich Jean-Marie.Heterologous protein expression and secretion in the non-conventional yeastYarrowia lipolytica:a review[J].Journal of Biotechnology,2004,109:63-81.
[3]Wache Y,Aguedo M,Nicaud J M.Catabolism of hydroxyacids and biotechnological production of lactones byYarrowia lipolytica[J].Applied Microbiology and Biotechnology,2003,61:393-404.
[4]LI Wen-li,LIU Gang,TAN Hua-rong.Disruption of sabR affects nikkomycin biosynthesis and morphogenesis inStreptomyces ansochromogenes[J].Biotechnology Letters,2003,25:1491-1497.
[5]Kim J G,Choi YD,Chang YJ,et al.Genetic transformation ofMonascus purpureusDSM1379[J].Biotechnology Letters,2003,25:1509-1514.
[6]白玉杰.酵母双杂交系统研究及其应用[Z].西安:第四军医大学生物化学及分子生物学教研室,2002.
[7]Boeke J D,LaCroute F,Fink G R.A positive selection for mutants lacking orotidine-5’-phosphate decarboxylase activity in yeast:5-fluoro-orotic acid resistance[J].Mol G en G enet,1984,197:345-346.
[8]Peck R F,Krebs M P.Homologous gene knockout in the archaeonHalobacterium salinarumwithURA3 as a counterselectable marker[J].Molecular Microbiology,2000,35(3):667-676.
[9]苏畅,杜毅,陈洪.微生物发酵法生产γ-癸内酯[J].食品工业科技,2004,10:118-189.
SU Chang,DU Yi,CHEN Hong.The production of gamma-decalactone by microbial fermentation[J].Science and Technology of Food Industry,2004,10:118-189.(in Chinese)
[10]Pagot Y,Endrizzi A,Nicard J M.Utilization of an auxotrophic strain of the yeastYarrowia lipolyticato improveγ-decalactone production yields[J].Letters in Applied Microbiology,1997,25:113-116.
[11]J.萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南[M].北京:科学出版社,2002:385-455.
[12]李欣,杨坤宁,刘志勇,等.电转化法制备高转化效率的E.coli感受态细胞研究[J].食品与生物技术学报,2007,11(6): 48-51.
LI Xing,YANG Kun-ning,LIU Zhi-yong,et al.Study on preparation of high transformation efficiency electrocompetentEscherichia coli[J].Journal of Food Science and Biotechnology,2007,11(6):48-51.(in Chinese)
[13]Gietz R D,Woods R A.Transformation of yeast by the lithium acetate/single-stranded carrier DNA/polyethylene glycol method[J].Methods Enzymol,2002,350:87-96.
[14]Maitreya T,Takegawa K.A simple and efficient procedure of transformation ofSchizosaccharomyces pombe[J].Yeast, 2004,21(8):613-617.
(责任编辑:李春丽)
The Disruption ofURA3 Gene ofYarrowia lipolytica
FEN G Chun-li, REN Qing, ZHANG Lei-lei, LI Xiu-ting, SONG Huan-lu*
(College of Chemical&Environmental Engineering,Beijing Technology&Business University,Beijing 100048,China)
In order to get high-yieldγ-decalactone and genetic markers,an auxotrophicYarrowia lipolyticastrain was isolated by genetic modification.In this study,URA3,a key gene for uracil synthetase ofYarrowialipolytica,was disrupted using the method ofgene homologous recombination,then transformants were screened by uracil auxotrophic medium(SD-URA)with the combination of 5-FOA and uracil.The results showed that the uracil auxotrophic strain was able to grow at the SD-URA medium containing 5-FOA and uracil while the wild-type strains do notgrown.Therefore,an easy and efficientmethod for obtaining auxotrophicYarrowia lipolyticastrain was established in this study.
Yarrowia lipolytica,URA3,gene disruption
Q 819
:A
1673-1689(2010)04-0624-05
2009-09-01
北京市教委科技计划重点项目(KZ200910011001)。
*通信作者:宋焕禄(1961-),男,山东烟台人,工学博士,教授,硕士生导师,主要从事食品风味化学及农产品深加工方面的研究。Email:songhl@th.btbu.edu.cn
