鳕鱼多肽的抗氧化活性及其分离纯化
2010-08-27牛瑞于建生
牛瑞, 于建生
(青岛科技大学化工学院,青岛 266042)
鳕鱼多肽的抗氧化活性及其分离纯化
牛瑞, 于建生*
(青岛科技大学化工学院,青岛 266042)
研究了鳕鱼多肽的抗氧化活性及分离纯化。为获得高纯度的抗氧化肽,将鳕鱼多肽依次通过超滤、凝胶过滤层析、阴离子交换层析(Q-FF)和反相高效液相色谱层析(RP-HPLC)进行分离纯化。结果表明:鳕鱼多肽具有很强的清除羟自由基的能力、清除DPPH的能力和还原能力;经Q-FF柱层析分离得到了B1、B2和B33个组分,B2经RP-HPLC检测显示为单一峰,获得了纯度较高的鳕鱼多肽,这为鳕鱼多肽的开发利用提供了科学理论依据。
鳕鱼多肽;抗氧化活性;分离纯化
国内外的研究发现,蛋白质经酶解处理后会产生具有特殊功能的活性肽[1],其中,对多肽的抗氧化活性的研究越来越引起人们的注意。科学家们将目光投向了有无穷潜力的海洋资源,鳕鱼(Gadous macrocephaius)就是其中一种重要的海洋资源。它属于冷水性底层鱼类,为北方沿海出产的海洋经济鱼类之一,含有丰富的蛋白质、维生素类、钙等营养元素,且价格相对较低,因此选择鳕鱼作为多肽抗氧化性研究的原料。由于酶解液中含有未水解的蛋白质、酶及一些其他大分子物质,将其进行进一步的分离纯化将有利于提高鳕鱼多肽的抗氧化活性[2]。抗氧化肽以其相对分子质量小、易吸收、活性强等特点受到重视,在医药、化妆品、保健品和食品与饲料添加剂等方面有广阔前景[3]。
本文采取目前常用的体外检测物质抗氧化活性的方法,对鳕鱼多肽的抗氧化性质进行了研究,并且采用现代分离纯化技术手段对多肽进行了分离,得到了具有较高抗氧化活性的多肽,为进一步的工业化生产提供理论基础。
1 实验材料与方法
1.1 实验原材料与试剂
鳕鱼由中国水产科学研究院黄海水产研究所提供,邻苯三酚、番红花红、DPPH、VC、茶多酚、二丁基羟基甲苯(BHT)均为进口分装,乙腈(色谱纯)购于上海星狮生物工程有限公司,其他试剂均为国产商品试剂(分析纯)。
1.2 仪器
20PR-52D高速冷冻离心机:日本日立公司生产;L KB 2021数控层析冷柜、瑞典L KB公司生产; Waters 2690高效液相色谱系统美国waters公司生产;752型紫外分光光度计:上海第三分析仪器厂生产;A KTA FPLC快速液相色谱仪(FPLC):安玛西亚公司生产;J TM1812/30-1多功能膜小型实验机:大连屹东膜工程设备有限公司生产;H1650-W高速离心机:长沙湘仪离心机仪器有限公司生产;凝胶过滤层析柱TSK-GELG2000SW:TOSOH CORPORATION生产;Kromasil C-18色谱柱:上海安谱科学仪器有限公司生产。
1.3 实验方法
1.3.1 鳕鱼多肽的制备 将50 g鳕鱼肉溶于150 mL蒸馏水中,搅碎,用1 mol/L的NaOH调p H至9.0,加入0.6 g海洋低温碱性蛋白酶,40℃恒温水浴中酶解1 h,此过程中,一直用1 mol/L的NaOH调p H,维持p H值在9.0,酶解液经沸水浴灭酶活8 min,冷却后10 000 r/min,离心30 min,取上清,即为鳕鱼多肽。
1.3.2 样品的抗氧化能力
1)样品的还原能力[4]取一定浓度的样品,加入2.5 mL p H 6.6的磷酸盐缓冲液(0.2 mol/L)和2.5 mL体积分数1%的铁氰化钾溶液,混匀,在50℃保温20 min后加入2.5 mL10%的三氯乙酸,混合后以3 000 r/min离心10 min。取上清液2.5 mL,加蒸馏水2.5 mL和0.5 mL,质量分数为0.1%的FeCl3,然后在700 nm波长处比色。
2)样品的清除超氧阴离子自由基的能力 采用邻苯三酚自氧化法[5],邻苯三酚在碱性条件下会发生自氧化,生成有色中间产物和超氧阴离子自由基,超氧阴离子自由基对自氧化有催化作用。具体操作:取0.05 mol/L Tris-HCl p H 8.2缓冲液4.5 mL,置25℃水浴预热20 min,加0.1 mL不同浓度的样品,2.5 mmol/L邻苯三酚0.4 mL,混匀后在25℃水浴中反应4 min,立即用VC溶液终止反应,测A299nm值。以蒸馏水代替样品做空白组,按下式计算清除率并求得IC50。

式中:A样品、A空白分别为样品和空白的吸光值。
3)样品清除DPPH自由基的能力 采用DPPH·酶标仪法[6],加不同浓度的样品溶液100μL和1 mmo1/L的DPPH自由基甲醇溶液100μL于96孔酶标板中,振荡30 s,37℃保温20 min后在517 nm波长下测定。每个样品平行测定3次。然后按下述公式计算
自由基清除率=[1-(Ap-Ac)/Amax]× 100%.
式中:Ap为样品和1 mmol/mL DPPH自由基反应后的吸光值;Ac为不加DPPH自由基时样品的吸光值;Amax为加DPPH自由基但不加样品(以80%甲醇代替样品)的吸光值。
4)样品的清除羟自由基能力的测定[7]取0.025 mol/L,p H 7.4的磷酸缓冲液1mL,40μg/ mL的番红花红1mL,供试药品0.5 mL,3%过氧化氢1mL(新鲜配制),0.945 mmol/L EDTA-Fe(Ⅱ) 1 mL(新鲜配制),混合后在37℃水浴中反应30 min后在520 nm处测定吸收度。空白组以0.5 mL蒸馏水代替供试样品,对照组以1.5 mL蒸馏水代替EDTA-Fe(Ⅱ)和供试样品。并按下式计算清除率

式中:A样品、A空白、A对照分别为样品、空白和对照的吸光值。
5)样品的蛋白质浓度的测定 采用Folin-酚测定法[8]。
1.3.3 鳕鱼多肽的分离
1)超滤分离 将鳕鱼酶解液,分别选用相对分子质量截留量为30 000、10 000、6 000的超滤膜对来自原液、30 000上、30 000~10 000、10 000~6 000和6 000下的组分测定其羟自由基清除率、蛋白浓度,计算各组分的IC50,收集活性最高的组分,冻干保存。
2)凝胶过滤层析 将超滤分离中,活性最高的组分上Superdex-peptide Gel柱,用双蒸水平衡和洗脱,自动分步收集器收集,用280 nm紫外光检测,收集活性峰并冷冻干燥保存。
3)Q-FF阴离子交换层析 将上一步得到的活性部分上Q-FF阴离子交换层析柱,上样缓冲液为5 mmol/L p H9.0,Tris-HCl缓冲液,上样量为2 mL,洗脱时30 min达到100%B,洗脱液B=A+ 1mol NaCl,体积流量为1.0 mL/min,检测波长为280 nm。收集活性峰并冷冻干燥保存。
4)反相高效液相色谱 进一步经高效液相色谱(RP-HPLC)分析,使用Kromasil C-18分析型色谱柱(5μm,4.6 mm×150mm),Waters 2690高效液相色谱系统,A液为过膜的水溶液,B液为体积分数100%的乙腈溶液,检测波长为280 nm,流速为1 mL/min,对洗脱得到的各峰收集浓缩,进行抗氧化活性测定,得到单一组分。
2 结果与讨论
2.1 样品的抗氧化能力
2.1.1 样品的还原能力 在700 nm的波长下检测样品的吸光度,吸光度越大,样品的还原能力越强。一般情况下,样品的还原能力与抗氧化活性之间存在显著的相关性,见图1。

图1 样品的还原能力Fig.1 Reducing ability
由图1可知不同抗氧化剂的还原能力的比较。鳕鱼多肽的还原能力随浓度的增加而增大,说明具有较强的还原能力,因此具有更强的抗氧化能力。相同浓度的抗氧化剂中,VC的还原能力最高,鳕鱼的还原能力介于VC和BHT之间。
2.1.2 样品的清除超氧阴离子自由基的能力 超氧阴离子是有机体新陈代谢过程中产生的一种重要的自由基,具有很强的氧化能力。因此,可以通过抗氧化剂对超氧阴离子清除能力来反应样品的抗氧化活性。取不同浓度的抗氧化剂,测定超氧阴离子清除率,其浓度关系与自由基的清除率变化的比较如图2。分析可知,超氧阴离子清除率均随抗氧化剂浓度的增加而增大,多肽的清除率最低,当浓度为10 mg/mL时,多肽的清除率仅为38%。可能是由于该肽的清除自由基作用主要不是通过清除超氧阴离子来实现的。
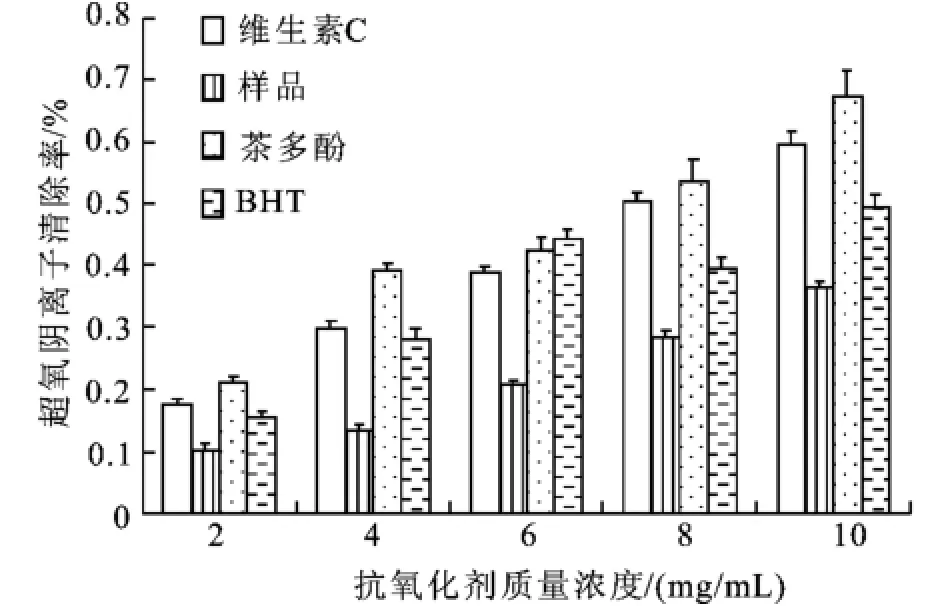
图2 样品清除超氧阴离子的能力Fig.2 Scavenging ability on super oxide anions
2.1.3 样品清除DPPH自由基的能力[9-10]DPPH·法是一种简单快速的自由基分析方法,其原理是依据稳定自由基DPPH·在乙醇溶液中呈深紫色,在517 nm波长处有一强吸收,自由基清除剂通过与其单电子配对使其颜色逐渐消失,如果有其它物质提供一个电子使此单电子配对,其吸收将会消失,褪色程度与其接受的电子呈定量关系。因此,通过吸光度的变化可以衡量试样清除自由基的能力,从而评价抗氧化能力。不同浓度的抗氧化剂清除DPPH自由基的结果如图3。

图3 样品清除DPPH的能力Fig.3 Scavenging ability on DPPH
分析可知,抗氧化剂清除DPPH自由基的能力均随浓度的增加而增大,相同浓度下,清除能力的大小依次为茶多酚>VC>多肽>BHT。因此,可以推断此多肽具有较强的清除DPPH的能力。
2.1.4 样品的清除羟自由基能力 羟基自由基(·OH)化学性质非常活泼,反应速度极快,能够对机体产生很大危害。抗氧化剂能够清除在金属离子的催化下发生Fenton反应生成的高活性的羟自由基,因此可以用来反应抗氧化性的强弱。不同抗氧化剂清除羟自由基能力如图4所示。每种抗氧化剂均有清除羟自由基的能力,且均随浓度的增加而增大,当多肽的浓度为10 mg/mL时,清除率可达到83%,明显高于VC和BHT。相同浓度下,清除能力的大小依次为茶多酚>多肽>BHT>VC。由此可知,鳕鱼多肽具有很强的清除羟自由基的能力。
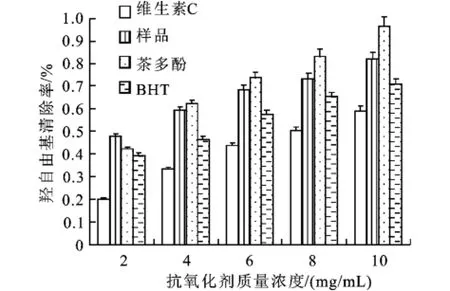
图4 样品的清除羟自由基的能力Fig.4 Scavenging ability on hydroxyl free radical
维生素C是公认的羟基自由基清除剂,本实验经测定,鳕鱼多肽的羟基自由基清除率高于相同浓度下的维生素C的清除率。同时,结合清除DPPH能力,还原能力,超氧阴离子能力,得出鳕鱼多肽具有较高的还原能力、DPPH清除能力,说明其具有很强的抗氧化能力。
2.1 超滤结果与分析
鳕鱼酶解液经过30 000、10 000、6 000超滤膜,各组分活性结果如表1。
由表1对各分离组分的活性进行比较可知,经不同分子量的超滤截留后,各组分均有羟自由基清除活性,且活性与分子量的大小相关。各分子段截留组分的活性相差不明显,都不超过一个数量级,即活性区域集中分布不强;各分子段截留组分的活性随着分子量减小而增大。6 000下的活性最高,其IC50达到15.02 mg/mL。因此选择6 000下的组分收集并冻干保存,进行进一步的分离。
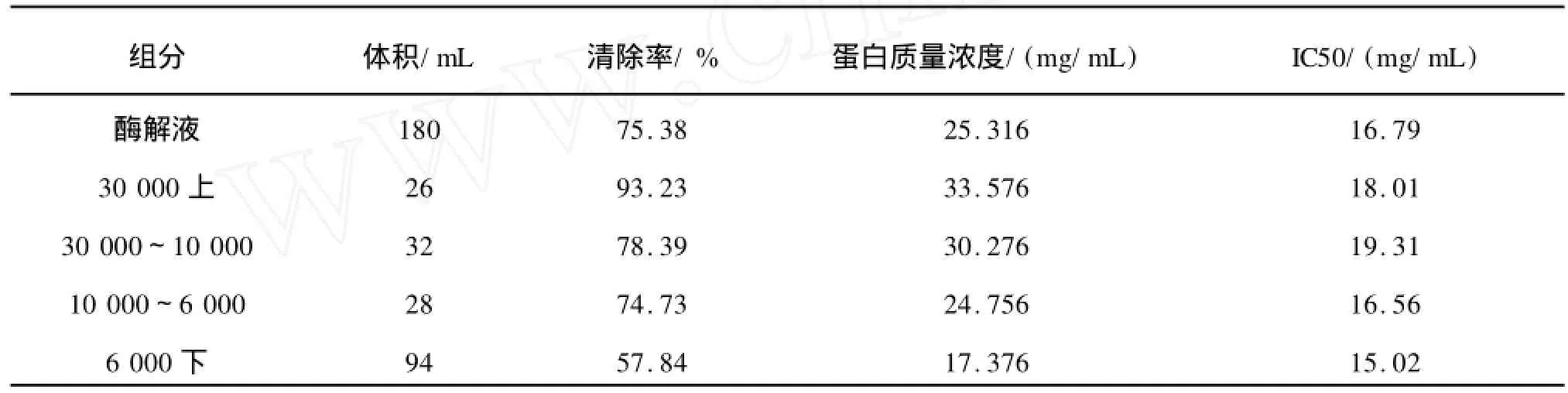
表1 超滤分离及活性测定结果Tab.1 Results of ultrafilteration and active measuring
2.2 凝胶过滤层析
经超滤分离后,选择活性大的6 000下的超滤冻干样品进行凝胶过滤层析。结果如图5。

图5 鳕鱼多肽的凝胶过滤层析图Fig.5 Column chromatogram of ling peptide on Superdex peptide
由图5可知,样品经凝胶过滤层析洗脱后得到3个峰(A1、A2和A3),分别收集各峰并检测其活性,发现3个峰均有抗氧化活性,其中A2活性最大,收集A2的样品冻干,用于下一步分析。
2.3 Q-FF阴离子交换层析
经凝胶过滤层析分离后,对A2的冻干样品进行Q-FF阴离子交换层析分离。结果如图6。

图6 鳕鱼多肽的Q-FF阴离子交换层析图Fig.6 Column chromatogram of ling peptide on Q-FF
由图6可知,B1为穿透峰,B2和B3分别为梯度洗脱峰,分别收集各峰并检测其活性,得到B2的活性最高,收集并浓缩,用于下一步分析。
2.4 反相C-18高效液相色谱
经Q-FF阴离子交换层析后,B2浓缩的样品进行反相C-18的高效液相色谱分离,结果如图7。
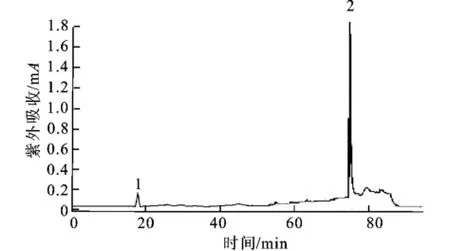
图7 鳕鱼多肽的RP-HPLC分析曲线Fig.7 Column chromatogram of ling peptide on RPHPLC
由图7可知,洗脱得到两个峰,峰1为单一组分,分别收集各峰,浓缩后检测其活性,得到峰2无抗氧化活性,峰1有抗氧化活性。收集峰1的样品并冻干保存,命名为LPN。
3 结 语
通过还原能力的测定、清除羟自由基能力、清除超氧阴离子能力、清除DPPH能力来反应其抗氧化活性,对酶解鳕鱼得到的多肽进行了抗氧化能力的研究。同时,采用超滤、阴离子交换层析、凝胶过滤层析、RP-HPLC对酶解液进行了初步的分离纯化。结果表明:鳕鱼多肽具有较强的还原能力,清除羟自由基的能力和清除DPPH的能力,但清除超氧阴离子的能力较弱,从而得出鳕鱼多肽具有较强的抗氧化活性。同时分离纯化得到了活性较强、纯度相对较高的单一组分,命名为LPN。鳕鱼多肽的抗氧化机制和分离纯化还有待于进一步研究。
[1]蒋菁莉,任发政,蔡华伟.牛乳酪蛋白降血压肽的超滤分离[J].食品科学,2006,27(7):124-128.
J IANGJing-li,REN Fa-zheng,CAI Hua-wei.Separation of antihypertensive peptides derived from yakMilk casein with ultra-filtration technology[J].Food Science,2006,27(7):124-128.(in Chinese).
[2]刘成梅,梁汉萦,刘伟,等.罗非鱼鱼皮多肽的超滤分离及其抗氧化活性研究[J].食品科学,2008,29(5):227-230.
LIU Cheng-mei,LIANG Han-ying,LIU Wei.Study on separation of peptides derived from oreochromis niloticus skin with ultra-filtration technology and its antioxidative activity[J].Food Science,2008,29(5):227-230.(in Chinese)
[3]李珂,卜尔红,杨秀华,等.骨蛋白酶解物的抗氧化作用[J].食品与生物技术学报,2009,28(6):773-776.
LI Ke,BO Er-hong,YANG Xiou-hua.Study on anti-oxidant enzymatic hydrolysis of bone protein[J].Journal of Food Science and Biotechnology,2009,28(6):773-776.(in Chinese)
[4]荣建华,李小定,谢笔钧.大豆肽体外抗氧化效果的研究[J].食品科学,2002,23(11):118-120.
RONGJian-hua,LI Xiao-ding,XIE Bi-jun.Anti-oxidant effect of soybean peptide in vitro study[J].Food Science,2003,23 (11):118-120.(in Chinese)
[5]Marklund S,Marlund G,Involvement of the superoxide anion radical in the autooxidation of pyrogallol and a convenient assay for superoxide dismutase[J].Eur J Biochem,1974,47(3):469-473.
[6]许申鸿,杭瑚.DPPH分析法研究野生植物的抗氧化活性[J].青岛大学学报,1999,12(3):75-78.
XU Shen-hong,HANG Hu.Study of antioxidative activities of wild plants by DPPH·assay[J].Journal of Qing Dao University,1999,12(3):75-78.(in Chinese)
[7]陈学勤主编.抗氧化研究实验方法[M].北京:中国医药科技出版社,1996.499-500.
[8]杨安钢,等.生物化学与分子生物学实验技术[M].北京:高等教育出版社,2001.245-247.
[9]彭长连,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661.
PENG Chang-lian.Detection of antioxidative capacity in plants by scavenging organic free radical DPPH[J].Prog Biochem Biophys,2000,27(6):658-661.(in Chinese)
[10]C Negro.Phenolic compounds and antioxidant activity from red grape marc extracts[J].Bioresource Technology,2003,87: 41-44.
(责任编辑:杨萌)
Antioxidant Activity and Purification of Pollock Peptides
NIU Rui, YU Jian-sheng*
(College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
The antioxidant activities of Pollock peptides were studied at first in this manuscript and demonstrated he Pollock peptides had strong scavenging hydroxyl free radical activity,and scavenging 1,diphenyl-2-picrylhydrazyl(DPPH)activity,and reducing activity.In order to obtain high homogenous antipeptide,the Pollock peptides were purified by ultraffltrations,gel filtration,anion-exchange chromatography(Q-FF),and reversed phase high performance liquid chromatography(RP-HPLC)in turn.These results showed that Pollock peptides separated on Q-FF column and three components(B1,B2,B3)were obtained.B2was identified by RP-HPLC to be homogenous.
pollock peptides,antioxidant activity,separation and purification
Q 517
:A
1673-1689(2010)04-0562-05
:2009-06-05
*通信作者:于建生(1956-),男,山东青岛人,副教授,主要从事生物化工方面的研究。Email:jiansheng_yu1956@163.com
