重组融合人血清白蛋白-人白介素-2 C125A突变体在毕赤酵母中的表达
2010-08-27金光泽段作营张莲芬金坚李华钟
金光泽, 段作营, 张莲芬, 金坚, 李华钟*
(1.江南大学工业生物技术教育部重点实验室;2.江南大学医药学院,江苏无锡 214122)
重组融合人血清白蛋白-人白介素-2 C125A突变体在毕赤酵母中的表达
金光泽1, 段作营1, 张莲芬2, 金坚2, 李华钟*1
(1.江南大学工业生物技术教育部重点实验室;2.江南大学医药学院,江苏无锡 214122)
构建编码人血清白蛋白-人白介素-2 C125A的重组表达质粒,在Pichia pastorisGS115中表达,获得具有较高IL-2活性的融合蛋白。设计并合成符合P.pastoris密码子偏好,且含有C125A突变的IL-2编码基因IL-2m,通过酶切连接方法将其与人血清白蛋白(HSA)的编码基因连接为融合蛋白HSA-IL2m的编码基因。克隆到表达质粒pPIC9K中,电击转化P.pastorisGS115感受态细胞,获得重组P.pastorisGS115/pPHIm基因工程菌。摇瓶发酵获得分泌表达产物。结果:Western blot鉴定结果显示该融合蛋白与IL-2、HSA的抗体都能发生免疫反应。经脱盐、冻干制备的粗蛋白的IL-2生物学活性为1.51×106IU/mg。结论:在P.pastorisGS115中成功表达了具有人白介素-2生物学活性的HSA-IL2m融合蛋白。
突变型人白介素-2;人血清白蛋白;毕赤酵母;融合蛋白
白细胞介素-2(Interleukin-2,IL-2),又称T细胞生长因子,1976年由Morgan等首先在外周血淋巴细胞中发现[1],是辅助T细胞分泌的淋巴因子,在免疫系统中发挥着重要的作用。它是中国第一个基因工程生产的蛋白质药物[2],临床上可用于恶性肿瘤治疗、感染性疾病的治疗、镇痛等[3]。由于IL-2在人体内的半衰期很短,临床多采用高剂量频繁给药,这不仅增加患者的经济负担更有可能产生不良副作用[4]。为了克服上述缺点,作者利用人血清白蛋白融合技术(albumin fusion technology)构建了编码人血清白蛋白(Human Serum Albumin, HSA)和IL-2的融合基因,通过分泌型表达载体pPIC9K,将该融合基因整合到巴斯德毕赤酵母染色体中,在分泌信号肽的作用下分泌表达融合蛋白HSA-IL2,以增加其半衰期。同时,为了能够大量生产具有较高的IL-2活性的融合蛋白,对IL-2分子的编码序列进行了改造。IL-2的成熟分子由133个氨基酸残基组成,它剪切掉了IL-2 N-端20个氨基酸残基的信号肽,翻译后加工的过程还包括在58位和105位半胱氨酸(Cys)之间形成二硫键,正确的二硫键对于IL-2活性的保持是必需的[5],而肽链中第三个Cys位点的存在极有可能造成二硫键的错配产生无活性异构体和多聚体。根据毕赤酵母密码子使用频率,替换天然IL-2编码序列中的低频密码子,并设计合成了第125位游离Cys点突变为Ala的突变型人白介素-2(mutant Interleukin-2, IL2m)的编码基因。再通过表达条件优化,得到较高的融合蛋白产量及生物学活性。
1 材 料
1.1 质粒、菌株和细胞株
大肠杆菌Escherichia coliXL1-Blue和含有HSA编码基因的质粒pBlue/HSA为作者所在实验室保存,毕赤酵母Pichia pastorisGS115和酵母分泌型表达质粒pPIC9K购自Invitrogen公司, IL2m的编码基因委托上海生工生物工程有限公司合成。
1.2 酶和其他试剂
Plasmid Mini Kit、Gel Extraction Kit(OMEGA BIO-TEK),限制性内切酶、T4 DNA Ligase、 Taq DNA Polymerase、PCR试剂:Takara宝生物公司产品;Interleukin-2 Antibody(sc-34799):Santa公司产品;Donkey anti-Goat/HRP(KC-GT-035):上海康成生物有限公司产品;HSA兔抗人多克隆抗体:作者所在实验室制备;Goat anti-Rabbit IgG/ HRP(bse-0295G):北京博奥森公司产品;脲微量白蛋白测定试剂盒:上海名典生物公司产品;其余试剂均为分析纯试剂。
1.3 培养基
大肠杆菌LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,p H 7.2;固体LB培养基添加质量分数1.5%的琼脂;
酵母培养基YPD、MD、BMGY、BMMY、YPD按照文献[6]方法配制。
2 方法
2.1 融合蛋白基因的克隆
2.1.1 IL2m基因的设计与合成 参照GenBank中天然IL-2编码基因序列,根据http://www.kazusa.or.jp/codon/数据库提供的Pichia pastoris密码子信息,保留天然IL-2编码基因中的高频及次高频密码子,用高频密码子替换剩余的所有低频密码子,并突变天然IL-2第125位Cys为Ala。设计如下序列:

其中S1为设计合成序列,S2是天然IL-2的编码序列。S1的5’端序列GCCTTA GGCTTA为人血清白蛋白的编码基因3’末端的序列,下划线部分为限制性内切酶位点,TAA是终止密码,两者之间的396个碱基为IL2m的编码序列。全部序列长423 bp,交由上海生工生物工程公司合成并克隆到载体pUC57中。
2.1.2 HSA-IL2m融合蛋白的表达基因的构建质粒pBlue/HSA经Eco81I、NotI双酶切,回收含有HSA序列的载体片段。质粒pUC57-IL2m经Eco81I、N otI双酶切,回收IL2m片断,连接两片段后,转化E.coliXL1-Blue,根据Amp抗性挑选转化子。提取质粒,酶切验证,得到含有人血清白蛋白-人白介素2C125A(HSA-IL2m)的序列的重组质粒pBHIm。
2.1.3 表达载体的构建 质粒pPIC9k和pBHIm经EcoRI、N otI双酶切,回收两片断,连接后,转化E.coliXL1-Blue,根据Amp抗性挑选转化子
pPHIm。提取质粒,酶切验证,并送上海生工生物技术有限公司测序。
2.2 融合蛋白表达与鉴定
2.2.1 酵母细胞转化 质粒pPHIm经S alI酶切,回收线性化片断,电击转化P.pastorisGS115。感受态细胞的制备方法及酵母转化方法同参考文献[7]。
2.2.2 重组克隆筛选及产物表达 将电击转化的酵母细胞以合适的稀释度涂布含有1 mol/L山梨醇的MD平板,30℃培养至菌落出现。初筛:挑取长出的转化子200个,接种到含5 mL BMGY培养基的试管中,30℃,200 r/min培养36 h。置于4℃冰箱中待菌体自然沉降,无菌条件下弃上清,加入1 mL BMMY培养基,30℃,200 r/min诱导培养72 h,其间每隔24 h补加体积分数1%甲醇。5 000 r/ min,5 min离心收集上清,用脲微量白蛋白测定试剂盒测定上清液中目标蛋白的量,选取高表达量菌株,于YPD斜面4℃保藏。复筛:挑取上述初筛的菌至5 mL BMGY培养基的50 mL三角瓶中,30℃,200 r/min培养24 h,以体积分数1%接种量转接到装有100 mL BMGY培养基的500 mL三角瓶中,30℃,200 r/min培养30 h左右,离心收集菌体于装有25 mL BMMY培养基的250 mL三角瓶中培养,30℃,200 r/min诱导72 h,其间每隔24 h补加体积分数1%甲醇。5 000 r/min,5 min离心收集发酵上清液。结合脲微量白蛋白测定试剂盒和SDS-PAGE电泳,挑选表达量最高菌株,于YPD斜面4℃保藏。
2.2.3 重组子诱导表达产物的分析与Western blot验证 取保存的发酵上清液,经SDS-PA GE后,电转移蛋白至硝酸纤维素膜上,用含50 g/L脱脂奶粉的1×TBS缓冲液(10 mmol/L Tris-HCl,15 mmol/L NaCl,p H7.5)4℃封闭过夜,用TBS清洗后分别用兔抗人HSA或山羊抗人IL-2的抗体(1: 100)室温孵育2 h,用TBS清洗后分别加入辣根过氧化物酶标记的山羊抗兔二抗(1:500)或驴抗山羊二抗(1:500)室温孵育1 h,用TBS清洗后用DAB试剂显色。
2.2.4 活性测定 根据中国药2005年第三部中关于IL-2的生物活性的检测方法,即CTLL-2/ MTT法[8],对融合蛋白的生物学活性进行检测。文中没有说明的其他分子生物学的实验方法,均参照文献[9]进行。
2.2.5 融合蛋白的摇瓶发酵诱导条件初步优化菌体培养及诱导的方法同2.2.2中复筛时所用的两步法。采用单因素实验,根据优化需要进行相关调整,研究初始p H、甲醇加量、转速、诱导相与生长相培养基体积比等4个主要条件对HSA-IL2m表达量的影响。
3 结果与讨论
3.1 融合蛋白基因的构建
质粒pBlue/HSA经Eco81I、N otI双酶切,回收约4.7 kb的片断;质粒pUC57-IL2m经Eco81I、N otI双酶切,回收0.4 kb的片断。利用这两个片断双酶切所形成的粘性末端,连接后转化E.coliXL1-Blue感受态细胞,通过Amp抗性挑选阳性转化子,提取质粒后进行酶切验证,结果如图1所示,重组质粒pBHIm经EcoRI单酶切得到5.1 kb的片断,比质粒pBlue/HSA双酶切的回收产物多出了约0.4 kb;经EcoRI和N otI双酶切得到长度约2.2 kb的片断和2.9 kb的载体片断,而HSA的编码序列为1.8 kb,证明成功构建了HSA-IL2m的编码基因。
3.2 表达载体pPHIm的构建
重组质粒pPHIm物理图谱如图2(a)所示。融合基因插入表达载体pPIC9K的EcoRI和NotI位点之间,在序列上位于AOX1启动子和α交配因子的下游且与α交配因子的开放阅读框相同。构建的重组质粒pPHIm的酶切鉴定见图2(b),重组质粒pPIHm经EcoRI单酶切得到一条长约11.4 kb的产物,经EcoRI和NotI双酶切得到长约2.2 kb的插入片断和长约9.3 kb的载体片断,表明融合基因已经成功插入到载体pPIC9k中。质粒测序结果显示,全部序列没有发生突变,与预期一致。
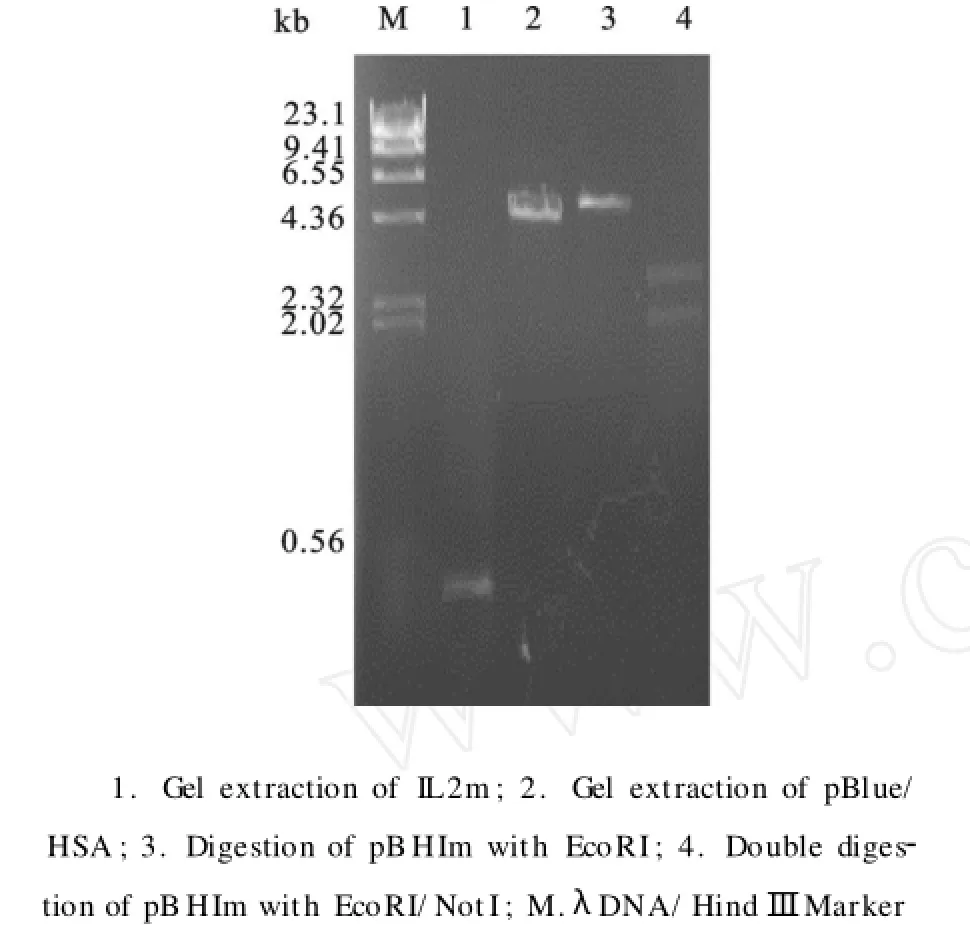
图1 重组质粒pBHIm的酶切分析Fig.1 Restriction analysis of the recombinant plasmid pBHIm
3.3 阳性转化子的筛选及诱导产物的Western blot鉴定
质粒pPHIm经S alI酶切,回收线性化片断,电击转化P.pastorisGS115感受态细胞。涂布MD平板,30℃培养4 d后共长出了约400个转化子,挑选其中200个菌落进行初筛,选其中表达量较高的10株重组菌进行复筛验证,得到一株产量最高的重组菌P.pastorisGS115/pPHIm,诱导3 d后上清液的SDS-PAGE分析和Western blot结果如图3所示。


图2 重组质粒pPHIm的物理图谱(A)和酶切分析(B)Fig.2 Physical map(A)and restriction analysis(B)of the recombinant plasmid pPHIm
研究发现,表达的蛋白质的相对分子质量约为82 000,与理论计算HSA-IL2m的相对分子质量相符,且这一位置的蛋白与IL-2、HSA的抗体都能发生免疫反应,进一步证实酵母经诱导表达HSAIL2m。但70 000和45 000这两处的降解条带又都可以与HSA的抗体发生免疫反应,认为是融合蛋白降解所产生的条带。经白蛋白测定试剂盒测得其中白蛋白融合蛋白的量约为60.2 mg/L(以HSA-IL2m计)。
3.4 诱导产物的活性测定
发酵液经脱盐处理后,冻干保存。取0.1 mg冻干粉用2 mL PBS复溶后,离心取上清,测得其中融合蛋白的量约为300μg/mL。采用IL-2依赖细胞株CTLL-2以标准品IL-2为对照,对上清液中的融合蛋白的生物学活性进行了测定。标准品的活性为2×105IU/mL,用RPMI1640稀释到浓度为200 IU/mL。测定结果表明,上清液中的融合蛋白可以有效的刺激CTLL-2细胞增殖。以标准品的最高浓度OD570值为100%,计算标准品、样品梯度百分率。将百分率换算为概率单位,以概率单位为纵坐标,以稀释度X的对数为横坐标,绘制直线回归图(图4),通过计算得出融合蛋白粗蛋白的比活性为1.51×106IU/mg。

图3 融合蛋白HSA-IL2m的SDS-PAGE分析(A)和Western Blot分析(B)Fig.3 SDS-PAGE(A)and Western Blot(B)of the fusion protein HSA-IL2m
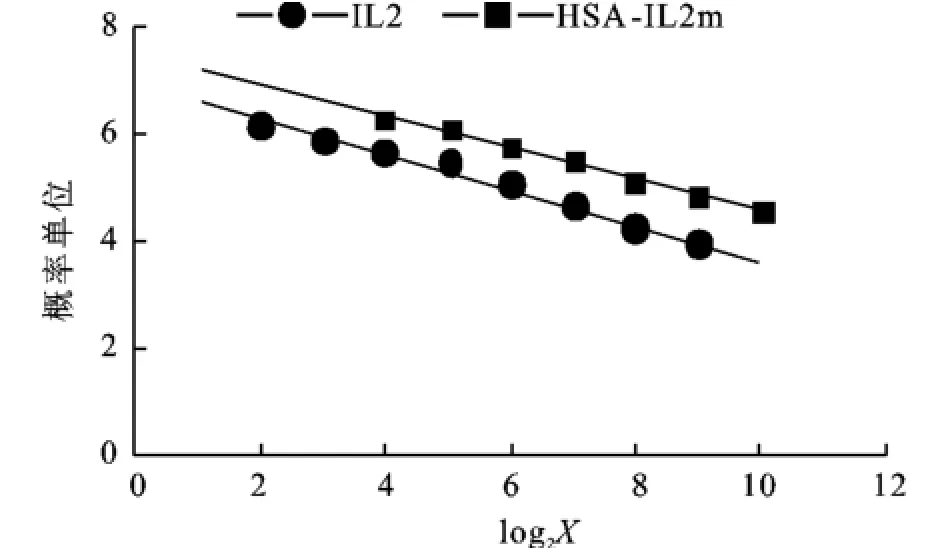
图4 数据转换与线性回归的概率单位分析Fig.4 Probit unit analysis of transformation and linear regression of data
3.5 融合蛋白的摇瓶诱导条件初步优化
3.5.1 初始p H对表达量的影响 配制BMMY培养基时,将初始p H值分别调至5.0、5.5、6.0、
6.5,种子液培养36 h后,经离心,用相同体积的BMMY液体培养基重悬菌体,200 r/min,30℃培养,每隔24 h补加体积分数1%甲醇,72 h后将发酵液离心并取上清,测定其中融合蛋白的含量。结果如图5(a)所示,该菌表达HSA-IL2m的最适初始p H都在6左右,由于诱导培养基中含有0.1 mol/L的磷酸钾缓冲液,测得的发酵液p H也基本在初始p H附近,因此可基本确定该菌的最适p H在6.0附近,这与Invitrogen公司的介绍相符。
3.5.2 甲醇体积分数对表达量的影响 配制BMMY培养基时,将初始p H调至6,二级种子培养36 h后,用相同体积的BMMY液体培养基重悬菌体, 200 r/min,30℃培养,每隔24 h按体积分数补加1%,2%,3%,4%甲醇,72 h后将发酵液离心并取上清,测定其中融合蛋白的含量。结果如图5(b)所示,甲醇添加量为3%时HSA-IL2m的表达量最高。
3.5.3 转速对表达量的影响 配制BMMY培养基时,将初始p H调至6,二级种子培养36 h后,用相同体积的BMMY液体培养基重悬菌体,分别采用旋转式摇床150、200、250 r/min,往复式摇床100、200 r/min,30℃培养,每隔24 h按体积补加甲醇3%,72 h后将发酵液离心并取上清,测定其中HSA-IL2m的含量。结果如图5(c)所示,100(W)、200(W)为往复式摇床转速),在装液量体积10%条件下,随转速上升,表达量呈上升趋势。相同转速下往复式摇床的溶氧要高于旋转式摇床,说明毕赤酵母在诱导期间对溶氧的需求量非常大,由于摇床转速的限制,确定最适的摇床转速为往复式200 r/ min。
3.5.4 诱导相与生长相培养基体积比对表达量的影响 配制BMMY培养基时,将初始p H调至6,二级种子培养36 h后,用1∶1、1∶0.5、1∶0.3倍体积的BMMY液体培养基重悬菌体,分别采用往复式摇床200 r/min,30℃培养,每隔24 h按体积补加甲醇3%,72 h后将发酵液离心并取上清,测定其中HSA-IL2m的含量。结果如图5(d)所示,该菌在1:0.5这个浓缩倍数下,表达量较高,在有充分的溶氧和合理的培养基的组分的情况下,随着细胞密度的增加,目的蛋白的表达量会逐渐增加。由于本文研究的是在摇床条件下表达目的蛋白,当细胞密度达到一定值的时候,溶氧就成了限制菌体代谢和目的蛋白表达的重要因素,所以研究细胞密度对融合蛋白表达量的影响是有必要的。

图5 诱导条件对HSA-IL2m产量的影响Fig.5 Effect of inducing conditions on HSA-IL2m yield
3.5.5 初步优化的诱导条件下目的蛋白的表达配制BMMY培养基时,将初始p H调至6,二级种子培养36 h后,用1:0.5倍体积的BMMY液体培养基重悬菌体,采用往复式摇床200 r/min,30℃培养,每隔24 h补加3%甲醇,诱导5 d,其间每隔24 h取样保存。结果如图8所示,从发酵液SDSPAGE电泳来看,82 000处的条带随时间逐渐变深,诱导3 d以后该条带基本不再变化,因此确定摇瓶诱导持续时间为3 d。取3 d的样品,测其中HSA-IL2m的质量浓度为144 mg/L。
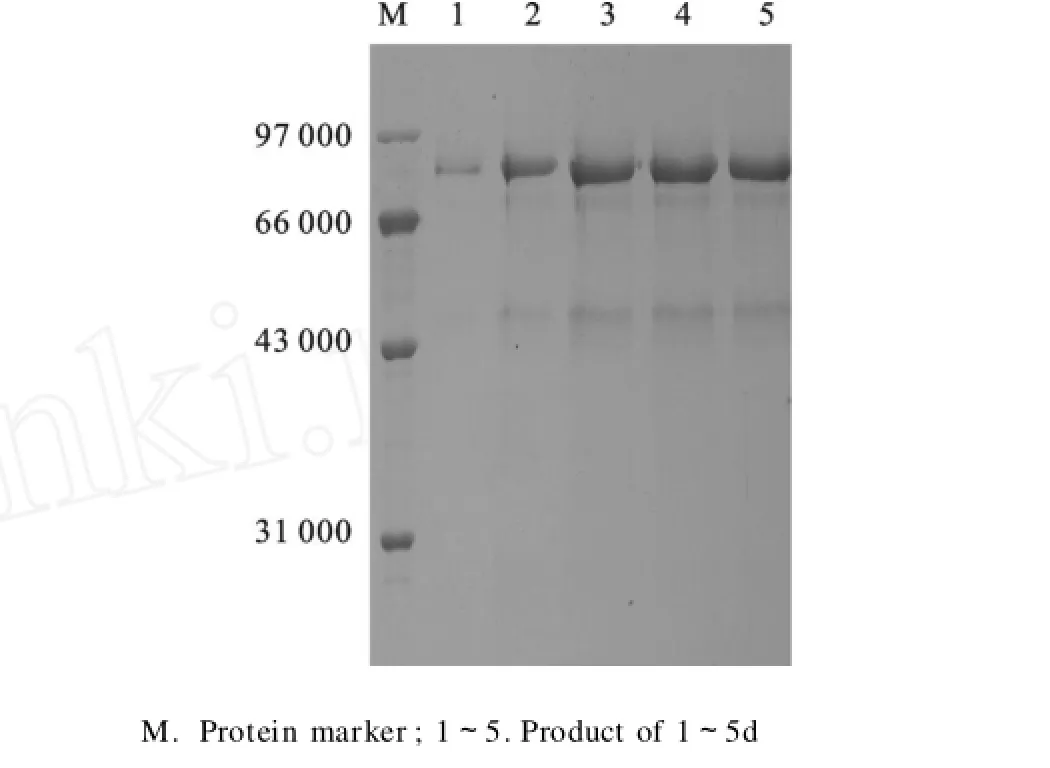
图6 优化诱导条件下P.pastorisGS115/pPHIm表达产物的SDS-PAGE分析Fig.6 SDS-PAGE of expressed product ofP.pastoris GS115/pPHIm under the optimized inducing condition
实验得到的表达产物相对分子质量与HSAIL2m的理论预测值相符,Western blot发现表达产物拥有HSA和IL2m,CTLL-2/MTT法提示表达产物具有IL-2生物学活性,说明本研究的表达产物是HSA-IL2m。
根据密码子的偏爱性,宿主细胞能够以不同的速度合成所需要的蛋白质,需要量少的蛋白质基因由于其中有些密码子对应的tRNA含量少,因而合成较少,反之亦然,宿主以此来控制该蛋白质的合成速度,这符合基因表达调控的规律。因此按照密码子偏好,对外源基因编码基因进行定向改造可以有效提高外源蛋白的表达量[10]。
HSA是含有585个氨基酸残基的单链无糖基化的球形蛋白质,相对分子质量65 000,它是人血浆中含量最高的蛋白质。HSA本身就是许多内源因子和外源药物的载体,药物蛋白和HSA结合后,可以减少其药物利用度同时增加在体内的半衰期[11]。大多数治疗用的蛋白和多肽半衰期一般较短,而HSA有将近长达19 d的血清半衰期,并且HSA的基因在毕赤酵母中可以高效分泌表达[12],摇瓶发酵表达量可达390 mg/L,上罐发酵表达量可以达到4 g/L,摇瓶发酵上清液杂质含量较少,纯化方便,将药物基因与HSA的基因融合,在毕赤酵母中表达,获得融合蛋白,延长蛋白质药物的半衰期。
4 结 语
将IL2m的编码基因直接融合于HSA的编码序列的C端,中间没有加入任何连接肽。突变型融合蛋白在毕赤酵母中得到了分泌表达,有轻微降解。所表达的HSA-IL2m可以有效刺激CTLL-2细胞的增殖,表现较高的生物学活性。
[1]Kim HP,Imbert J,Leonard W.Both integrated and differential regulation of components of the IL-2/IL-2 receptor system [J].Cytokine G rowth Factor Rev,2006,17(5):349-366.
[2]常志远,徐荻.白细胞介素2的研究进展[J].中国处方药,2004,29:36-38.
CHANG Zhi-yuan,XU Di.Advances in Interleukin-2[J].China Prescription Drug,2004,29:36-38.(in Chinese)
[3]蒋春雷,徐荻,郑仲承,等.白细胞介素-2的中枢镇痛作用[J].中国应用生理学杂志,1994,10(4):322-324.
J IANG Chun-lei,XU Di,ZHENG Zhong-cheng,et al.The central analgesic effect of IL-2[J].Chinese Journal of Applied Physiology,1994,10(4):322-324.(in Chinese)
[4]Alice KP,Jorge AT.Therapeutic use of interleukin-2 in HIV-infected patients[J].Current Opinion In Pharmacology, 2002,2:433-439.
[5]Grace Ju,Lisa C,Kimberlee L,et al.Structure-Function analysis of human interleukin-2[J].The journal of Biological Chemistry,1994,262(12):5723-5731.
[6]李洁,张莲芬,孙均铭,等.人C-型利钠肽-血清白蛋白融合蛋白质的构建及在毕赤酵母中的分泌表达[J].中国生化药物杂志,2007,28(5):289-293.
LI Jie,ZHANGLian-fen,SUN Jun-ming,et al.Secretive expression of the fusion protein HSA-CNP inPichia pastoris[J].Chinese Journal of Biochemical Pharmaceutics,2007,28(5):289-293.(in Chinese)
[7]Version E,Carlsbad CA.Multi-copy Pichia Expression Kit.Invitrogen,1999.
[8]周道洪,沈元珊,赵曼瑞.测定淋巴细胞转化和鼠白细胞介素2活性的新方法——MTT比色分析法[J].中国免疫学杂志,1986,2(1):39-44.
ZHOU Dao-hong,SHEN Yuan-shan,ZHAO Man-rut.The application of MTT colorimetric assay to measured the proliferation of lymphocytes and the activity of rat/mouse IL2[J].Chinese Journal of Immunology,1986,2(1):39-44.(in Chinese)
[9]Samrook J,Pritsch EF,Maniatis T.Molecular cloning:a laboratory manual[J].Analytical Biochemistry,1990,186:182 -183.
[10]Scorer CA,Buckholz RG,Clare JJ,et al.The intracellular production and secretion of HIV-envelope protein in the methylotropic yeastPichia pastoris[J].G ene,1993,136:111-119.
[11]Roberts M J,Bentley MD,Harris JM,et al.Chemistry for peptide and protein PEGylation[J].Advanced Drug Delivery Reviews,2002,54(4):459-476.
[12]郭美锦,庄英萍,储炬,等.重组巴氏毕赤酵母高密度发酵表达rHSA[J].微生物学报,2002,42(1):65-68.
GUO Mei-jin,ZHUANG Ying-ping,CHU Ju,et al.Expression of recombinant human serum albumin in genetically engineered pichia pastoris in high-density fermentation[J].Acta Microbiologica Sinica,2002,42(1):65-68.(in Chinese)
(责任编辑:朱明)
Expression of the Fusion Protein Human Serum Album/Mutant Human Interleukin 2C125A inPichia pastoris
J IN Guang-ze1, DUAN Zu-ying1, ZHANG Lian-fen2, J IN Jian2, LI Hua-zhong*1
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Wuxi 214122,China;2.School of Medicine and Pharmaceutics,Jiangnan University,Wuxi 214122,China)
The aim of this study was to obtain the fusion protein HSA-IL2m with high IL2 bioactivity,for this,the recombinant plasmid encoding HSA-IL2C125A was constructed and expressed inPichia pastorisGS115.The DNA fragment encoding mutant IL-2 of C125A was design and synthesized based on codon usage bias ofP.pastoris.The fragment was spliced with Human Serum Album encoding gene and then the fusion gene was cloned into pPIC9K to construct the expression plasmid pPHIm by restrictive digestion and ligation.Recombinant yeast ofP.pastorisGS115/pPHIm was obtained with pPHIm linearization and electroporation.The excreting product was obtained under shake flask culture.Results:Western-blot showed the fusion protein reactive positively with the antibody of IL-2 and HSA,respectively.The crude fusion protein prepared by desalting and freeze-drying showed IL-2 bioactivity of 5.0 105IU/mg. The results demonstrated that the fusion protein ofHSA-IL2m with IL-2 bioactivity wassuccessfully expressed inP.pastorisGS115.
mutant Human interleukin-2,Human serum album,Pichia pastoris,fusion protein
Q 81
:A
1673-1689(2010)04-0595-07
2009-09-03
国家自然科学基金项目(30970029);江苏省产学研联合创新资金计划项目(BY2009110)。
*通信作者:李华钟(1958-),男,山东龙口人,教授,博士生导师,主要从事微生物制药研究。Email:hzhli@jiangnan.edu.cn
