10-羟基喜树碱的提取方法及工艺优化研究
2010-07-13赵荣国真国辉王贺双
赵荣国,真国辉,王贺双
10-羟基喜树碱的提取方法及工艺优化研究
赵荣国,真国辉,王贺双
116023 大连国人生物科技有限公司(赵荣国、真国辉);116024 大连理工大学环境与生命学院(王贺双)
10-羟基喜树碱是从我国特有植物喜树()中分离得到的 20 多个单体中抗肿瘤作用最强的生物碱,它不仅是临床效果较好的抗肿瘤药物,而且还是制备其他喜树碱类衍生物药品的重要中间体。由于喜树中 10-羟基喜树碱含量甚微,其制备方法的研究已成为当前热点,其中利用现代生物工程技术的方法尤为引人注目[1]。但至今鲜有报道从喜树细胞培养物中提取天然 10-羟基喜树碱的生产工艺[2-5],本文就经次生代谢调控和微生物转化后的喜树细胞培养物中提取天然 10-羟基喜树碱的方法及工艺进行了研究,以期为规模化生产提供依据。
1 材料与方法
1.1 主要材料
1.1.1 试剂 甲醇、乙醇,分析纯,购自天津东丽化学试剂厂;二氯甲烷,分析纯,购自天津瑞金化学试剂厂;氢氧化钠、石油醚、环己烷,分析纯,购自北京化工厂;10-羟基喜树碱标准品由中国药品生物制品检定所提供。
1.1.2 仪器 高效液相色谱仪为美国 Waters 公司产品;Techsphere ODS 色谱柱和 KQ2250DB 超声波清洗仪均为大连依利特分析仪器有限公司产品;RS-20III冰冻高速离心机为日本Tokyo 公司产品;H.H.S21.6 恒温水浴锅为上海医疗器械五厂产品。
1.2 方法
1.2.1 细胞培养物样品 将收获的细胞培养物于 60℃烘箱中烘干后粉碎,过 60 目筛备用。
1.2.2 乙醇回流提取 称取细胞培养物样品 10 g,按表 1 设计因素水平,选 L9(34)正交设计表,进行乙醇回流提取,收集提取液,浓缩后进行测定。

表 1 试验因素水平表
1.2.3 碱水回流提取 称取细胞培养物样品 10 g,按表 2 设计因素水平,选 L9(34)正交设计表,加稀 NaOH 溶液回流提取,收集提取液,适当浓缩,调 pH 至 6.0 左右,离心半径 9 cm,8 000 r/min 离心10 min,沉淀用适量甲醇溶解后进行测定。
1.2.4 乙醇超声提取 称取细胞培养物样品 10 g,在 25 ℃,工作频率为 40 kW 的条件下,分别以 15、20 倍量的 75%乙醇超声提取 30 和 60 min,见表 3。

表 2 试验因素水平表
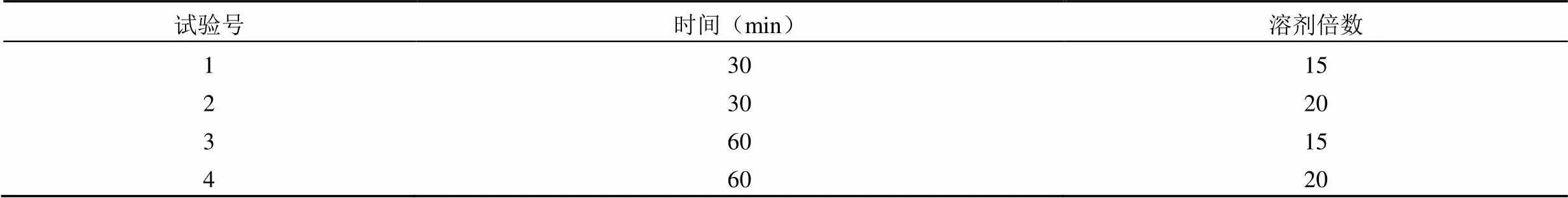
表 3 超声提取试验表
1.3 含量测定
1.3.1 高效液相色谱条件 用十八烷基硅烷键合硅胶为填充剂;以甲醇-水(60:40)为流动相;流速 1.0 ml/min;柱温 25 ℃;检测波长为 266 nm;出峰时间约 24 min。
1.3.2 样品测定 按照 10-羟基喜树碱标准品的测定条件,分别测定乙醇回流提取样品、碱水回流提取样品以及超声提取样品中 10-羟基喜树碱的含量。
2 结果
2.1 标准曲线的制备
取0.02 mg/ml 的 10-羟基喜树碱标准液,稀释成 0.8 × 10-3~ 12 × 10-3mg/ml 的系列溶液,进样 20 μl,以浓度与峰面积进行线性回归,得标准曲线方程:Y = 68.552X+32.138,= 0.9995。10-羟基喜树碱在 0.8 × 10-3~ 12 × 10-3mg/ml 时浓度与峰面积具有良好的线性关系。
2.2 乙醇回流提取工艺的正交试验
根据极差 R 的大小,其影响顺序为 A > D > B > C,即乙醇浓度 > 提取次数 > 提取时间 > 溶剂量,最佳工艺为 A1B3C3D3,即 20 倍 75% 乙醇回流提取 3 次,1.5 h/次,结果见表 4。
2.3 碱水回流提取工艺的正交试验
根据极差 R 的大小,其影响顺序为 A > D > B > C,即碱的浓度 > 提取次数 > 提取时间 > 溶剂量,最佳工艺为 A2B1C2D3,即 15 倍 0.3% NaOH 溶液回流提取 3 次,0.5 h/次,结果见表 5。
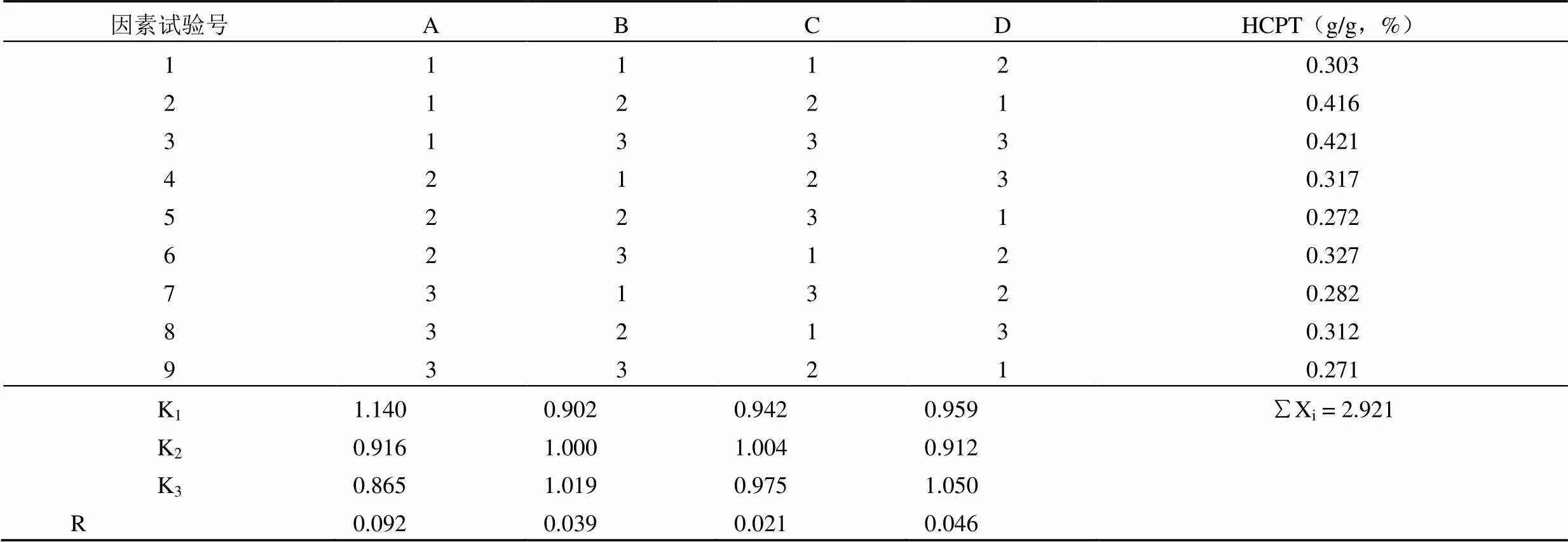
表 4 乙醇回流提取正交试验安排及结果
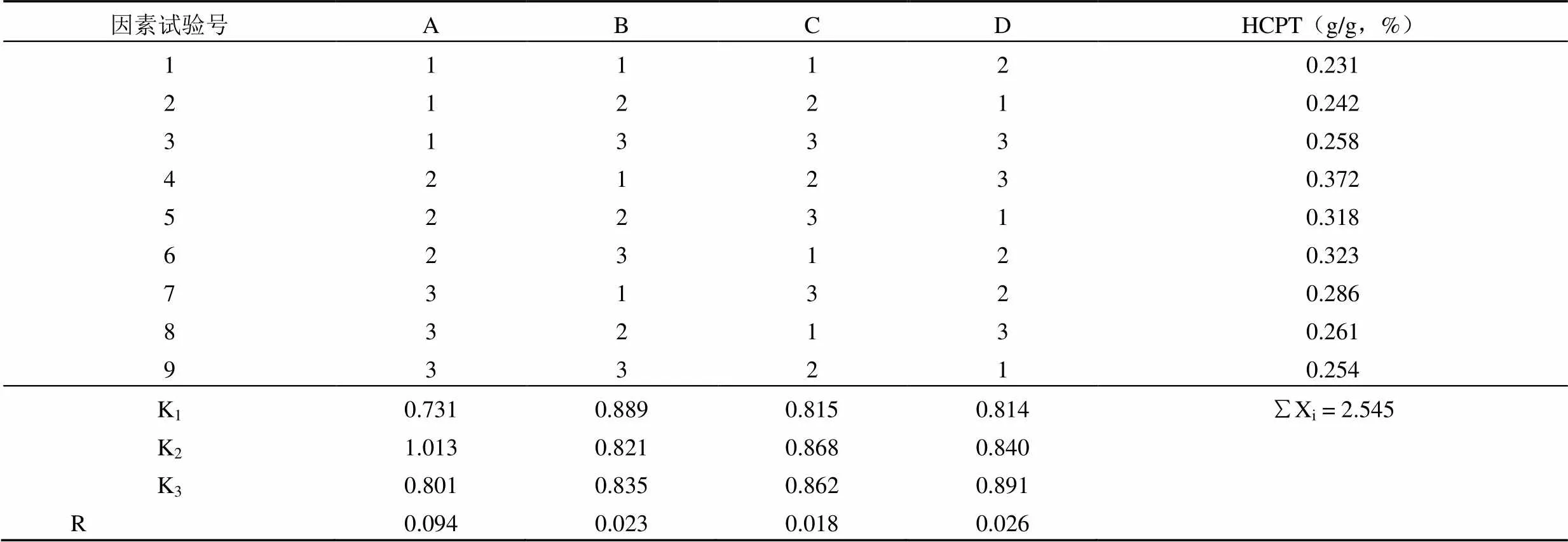
表 5 碱水回流提取正交试验安排及结果
2.4 乙醇超声提取
由表 6 可以看出,与乙醇回流提取最佳工艺相比,乙醇超声提取 10-羟基喜树碱的得率更高。
3 讨论
通过考察不同的提取方法对 10-羟基喜树碱提取的影响,结果表明:乙醇回流提取时以75% 乙醇作溶剂效果较好,可能是高浓度乙醇不易穿透脱分化组织的细胞壁;碱水回流提取的效果较差,可能是 10-羟基喜树碱 E 环的 α-羟基内酯结构遇碱开环生成钠盐后,再遇酸不能完全还原为 10-羟基喜树碱的缘故;以 75% 乙醇作溶剂进行超声提取,有利于喜树细胞培养物中 10-羟基喜树碱的提取,收率高且工艺简单。由于超声波可以使液体流动,并产生空化现象,从而有利于将 10-羟基喜树碱从喜树脱分化组织中快速地浸提出来。喜树细胞培养物中 10-羟基喜树碱提取的最佳工艺为 20 倍量的 75% 乙醇超声提取 60 min。

表 6 乙醇超声提取结果
[1] Zhang DY, Zhao XQ, Yu F, et al. Callus induction of Camptotheca acumianta and camp tothecin production. J North Normal Univ (Nat Sci Ed), 2002, 34(1):45-48. (in Chinese)
张冬艳, 赵心清, 于放, 等. 喜树愈伤组织诱导及喜树碱的产生. 东北师大学报(自然科学版), 2002, 34(1):45-48.
[2] Zhang ZX, Zhang SX, Song GB. Study on the Camptothecine extraction technology of Camptotheca leaves. Biotechnology, 2003, 13(5):24-25. (in Chinese)
张志信, 张仕秀, 宋关斌. 从喜树叶中提取喜树碱工艺研究. 生物技术, 2003, 13(5):24-25.
[3] Guo ZJ, Ma CJ. Study on natural Camptothecin and 10-hydroxycamptothecin column chromatography separation. ACTA Chin Med Pharmacol, 2005, 33(4):10-11. (in Chinese)
郭忠军, 麻长娟. 天然喜树碱和10-羟基喜树碱柱层析分离工艺研究. 中医药学报, 2005, 33(4):10-11.
[4] Zu YG, Tang ZH, Yu JH, et al. Camptothecin and 10-hydroxycamptothecin accumulate differentially under specific developmental control in Camptotheca acuminata. Acta Botanica Sinica, 2003, 45(4):494-499.
[5] Ming X, Wei ZH, Xu QH. A process for the extraction of Camptothecine from fruits of Camptotheca acuminata decne.J Shenyang Agric Univ, 2005, 36(1):101-103. (in Chinese)
明霞, 魏忠环, 徐清海. 从喜树果实中提取喜树碱工艺研究. 沈阳农业大学学报, 2005, 36(1):101-103.
大连市产业技术创新资金项目(2008039)
2009-09-25
10.3969/cmba.j.issn.1673-713X.2010.02.014
赵荣国,Email:zrgmail@sina.com
