温度和pH对重组人血管内皮抑制素脱酰胺的影响
2010-07-13解茹张贵锋高建萍王明林马润宇苏志国
解茹,张贵锋,高建萍,王明林,马润宇,苏志国
温度和pH对重组人血管内皮抑制素脱酰胺的影响
解茹,张贵锋,高建萍,王明林,马润宇,苏志国
100029 北京化工大学生命科学与技术学院(解茹、马润宇);100190 北京,中国科学院过程工程研究所生化工程国家重点实验室(张贵锋、苏志国);271018 泰安,山东农业大学食品学院(高建萍、王明林)
利用液质联用技术研究温度和 pH 对重组人血管内皮抑制素中天冬酰胺(Asn)脱酰胺过程的影响。
在不同的温度和 pH 值条件下,对重组人血管内皮抑制素样品溶液进行孵化,酶解处理后利用液质联用技术识别发生脱酰胺的多肽并测定其含量随样品放置温度和 pH 条件的变化。
质谱分析结果表明酶解产物中多肽 SVWHGSDPNGR序列中的 Asn 发生了脱酰胺化,Asn 残基生成了天冬氨酸和异天冬氨酸残基,其他位置的 Asn 均未检测出明显的脱酰胺化;实验获得了不同温度和 pH 条件下重组人血管内皮抑制素中 Asn 脱酰胺化的速率及动力学常数;Asn 脱酰胺过程随着温度和溶液pH 值的升高,Asn 脱酰胺速率上升。
重组人血管内皮抑制素中天冬酰胺的脱酰胺过程受储存温度和 pH 值影响,研究药用蛋白质在不同条件下的脱酰胺过程对于筛选合适的储存条件、减少活性损失具有重要意义。
血管抑制素类; 天冬酰胺; 肽类;色谱法,高压液相

蛋白质中 Asn 或 Gln 残基均可发生非酶催化的脱酰胺化,但 Gln 的脱酰胺速率远低于 Asn[9]。Asn 的脱酰胺包括两步反应,先形成五元环的琥珀酰亚胺,再发生环内酰胺键水解(图 1)。环内酰胺键断裂可发生在琥珀酰亚胺的任何一端并形成天冬氨酸(Asp)和异天冬氨酸(isoAsp),但最终蛋白中的脱酰胺产物多为 Asp,其可能是 Asp 作为天然氨基酸更能稳定存在于蛋白质结构中[10],Asn 的脱酰胺速率受蛋白质的氨基酸序列及三维结构、储存温度和pH值、离子种类和离子强度等因素影响[9-11]。在脱酰胺位点识别方面,离子交换色谱因分离含 Asp 与 IsoAsp 多肽存在一定难度导致其用于脱酰胺化研究存在局限性[12]。羧酸甲基转移酶法分析 Asn 脱酰胺位点具有特征性强等优点,但检测过程繁琐且需要使用难以获得的工具酶,导致该方法应用并不十分广泛[13]。反相色谱具有分辨率高和稳定性好等优点,尽管使用反相色谱可区分发生脱酰胺前后的多肽,但多肽的分离度对结果影响较大[14],而高效液相色谱质谱联用技术可通过色谱分离脱酰胺前后的多肽,利用质谱技术识别脱酰胺化位置等优点,在脱酰胺化研究中的应用日益增多[6, 8]。
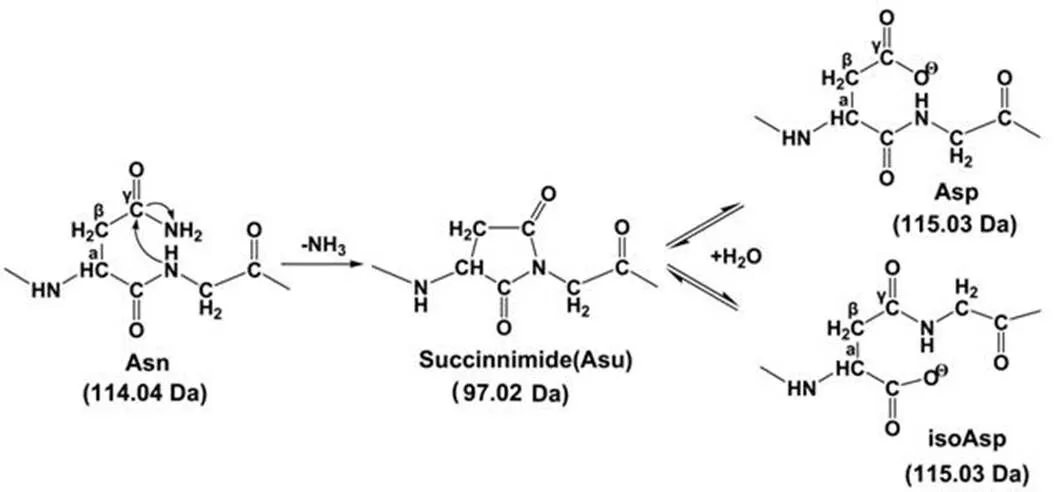
Asn、Asu、Asp、isoAsp 理论分子量按单一同位素计算
Figure 1 The mechanism of asparagine deamidation and aspartic acid isomerization via succinimide intermediate
重组人血管内皮抑制素(rhEndostatin)是一种在大肠杆菌中表达用于治疗肿瘤的蛋白质药物,与人 XVIII 胶原蛋白的羧基末端具有同源性[15]。rhEndostatin 具有特异性抑制肿瘤血管内皮细胞增殖功能,从而起到抗肿瘤作用[16]。本研究以重组人血管内皮抑制素为模型蛋白,利用高效液相色谱质谱联用技术研究了不同放置条件下天冬酰胺残基的变化,探索其脱酰胺化的规律,为蛋白质药物储存过程中的稳定性研究提供参考。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 重组人血管内皮抑制素(批号 20070303)为烟台麦得津生物工程股份有限公司产品;胰蛋白酶(序列纯)购自美国 Promega 公司;二硫苏糖醇(DTT)购自美国 Sigma 试剂公司;三氟乙酸(TFA)和乙腈为美国 Merck 公司产品;其他试剂均为市售分析纯。
1.1.2 仪器设备 液相色谱质谱联用系统由美国安捷伦公司的 Agilent 1100 HPLC 和 Thermo Fisher公司的 LCQ DecaXP电喷雾质谱组成,数据采集软件和多肽质谱数据处理软件分别为 Xcalibur 1.3 和Bioworks 3.1。
1.2 方法
1.2.1 rhEndostatin 样品处理 将重组人血管内皮抑制素样品溶于不同 pH 的 Tris-HCl 溶液(0.1 mol/L,pH 3.0、4.0、5.0),浓度控制在1 mg/ml;将各样品溶液放置在 70 ℃条件恒温处理,每 24 h 取样 200 μl;使用 pH 10.0 的 Tris-HCl缓冲液将提取的每个样品的 pH 调至 8.0,加入胰蛋白酶(1mg/ml,0.05 mol/L NH4HCO3,pH 8.0),加入比例为 50:1(蛋白质:酶),37 ℃放置 6 h 后加入 5 μl DTT(0.4 mol/L,0.05 mol/L NH4HCO3),混合均匀后于 37 ℃恒温反应 30 min 以打开全部二硫键,将该多肽混合物于–20 ℃放置。
利用上述方法将重组人血管内皮抑制素溶液分别在 37 和 50 ℃条件下放置,研究温度对脱酰胺过程的影响。不同 pH 条件下的样品按照相同的方法将实验重复两次。实验利用同一样品不同浓度条件下通过脱酰胺化和未发生脱酰胺化多肽的峰面积考察方法的稳定性。
1.2.2 高效液相色谱质谱设置参数 色谱柱:Agilent SB C18(150 mm × 2.1 mm,5 μm);流动相 A:水(含 0.3% TFA),B:乙腈(含 0.3% TFA);梯度:0 ~ 120 min,0 ~ 40% B,120 ~ 150 min,40% ~ 100% B;流速:0.2 ml/min,进样量 20 μl。离子源(ESI)喷雾电压 4.5 kV;毛细管温度300 ℃;鞘气(N2)60 个单位(约 400 kPa);一级质谱扫描范围m/z330 ~ 2000;精确质量数扫描(zoomscan)和二级质谱(MS/MS)扫描均为数据依赖型扫描(data dependent scan),动态排除次数 1;动态排除时间 0.5 min;二级质谱碰撞能量为 35%。
1.3 数据处理
将实验得到的质谱数据使用 Bioworks 3.1 软件进行处理,数据检索过程重点检测含天冬酰胺的多肽,当检测出的多肽与其理论质荷比(m/z)之差为1 时,通过二级质谱确认该多肽中 Asn 是否发生了脱酰胺。
2 结果
2.1 脱酰胺化位点识别
重组人血管内皮抑制素共含有 184 个氨基酸,有4 个 Asn,通过质谱数据库检索分析并结合各色谱峰中的多肽识别结果表明含Asn 的多肽均能实现完全分离(图 2),同时发现仅多肽SVWHGSDPNGR(m/z 1211.7)中的Asn 发生了脱酰胺化。
将重组人血管内皮抑制素在一定的 pH 和温度条件下进行脱酰胺加速实验,Asn 在非酶催化条件下发生的脱酰胺化一般经过琥珀酰亚胺中间产物再形成 isoAsp 和 Asp。图 3 为重组人血管内皮抑制素在 pH 5.0、70 ℃放置不同时间后其酶解产物中 m/z 1211.7 和 1212.7 的提取离子流图,色谱峰P2 和 P3 对应的多肽VWHGSDPN*GR 中第 8 位氨基酸应分别为 isoAsp 和 Asp,两者比例约为 2:1[3]。

相对丰度Relative abundance 时间(min) Time (min)
Figure 2 Total ion current chromatogram of the tryptic digest of rhEndostatin

相对丰度Relative abundance 时间(min) Time (min)
Figure 3 Extracted ion chromatograms for m/z 1211.7 and 1212.7 of the tryptic digest of rhEndostatin
Asn 发生脱酰胺化后形成Asp(或isoAsp),质量数增加 1 Da。以图 3C 为例,保留时间为 50.34 min 的色谱峰中检测出带单电荷的离子 m/z 1211.7 和带双电荷的离子 m/z 606.4(图 4A),其二级质谱表明离子 m/z 1211.7 和 m/z 606.4 来自多肽SVWHGSDPNGR(图 4C);保留时间为 50.95 和 52.70 min 的色谱峰中均检测出带单电荷的离子 m/z 1212.7 和带双电荷的离子 m/z 606.9(图 4B),二级质谱表明离子 m/z 1212.7 和 m/z 606.9 来自多肽 VWHGSDPDGR(图 4D),表明多肽 VWHGSDPNGR 中的天冬酰胺发生了脱酰胺化。多肽序列中 Asn 残基的脱酰胺化将导致多肽亲/疏水性发生变化,本研究为有效分离发生脱酰胺化和未发生脱酰胺化的多肽,实验中降低了色谱流动相的梯度。
2.2 pH 对脱酰胺过程的影响
通过测定重组人血管内皮抑制素在70 ℃、不同 pH 条件下放置后其酶解产物中多肽 VWHGSDPGR 和 VWHGSDPGR 的相对含量,以便计算出在相同温度,不同 pH 条件下 VWHGSDPGR 发生脱酰胺的比例。在放置初期重组人血管内皮抑制素中 Asn127的脱酰胺化的比例随时间延长逐渐增加(图 5),4 d 后脱酰胺化多肽的相对含量变化趋于稳定。在方法的稳定性实验中,利用同一样品研究了不同浓度溶液通过积分脱酰胺化和未发生脱酰胺化多肽的峰面积以考察方法的稳定性,结果表明方法的日内稳定性和日间稳定性的 RSD 均低于 2.8%。
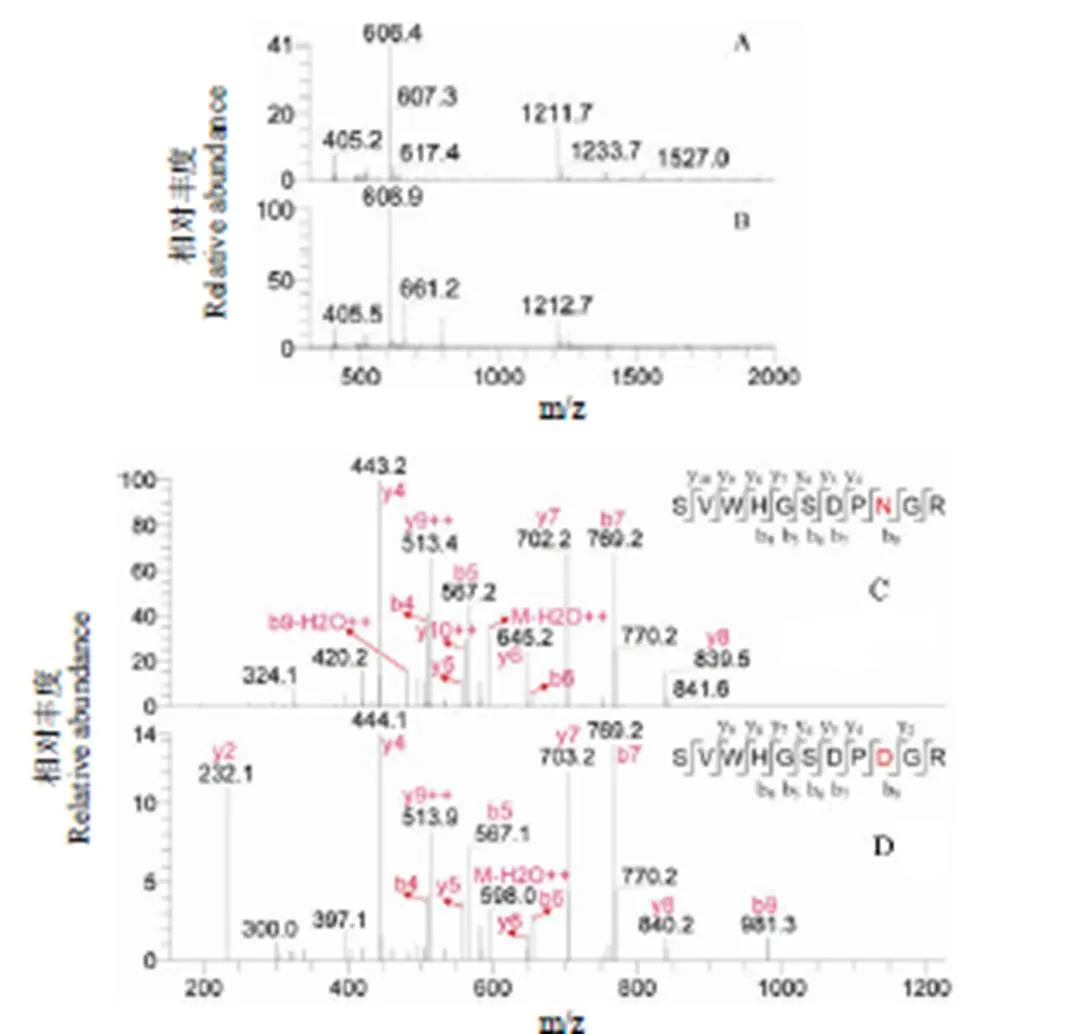
图 4 提取离子流图 3C 中保留时间为 50.34、50.95 min 多肽的谱图(A、B:质谱图;C、D:二级质谱图)
Figure 4 Spectra of peptide contained in the chromatgraphic peaks with retention time 50.34 and 50.95 min in Figure 3C (A, B: Mass spectra; C, D: MS/MS spectra)
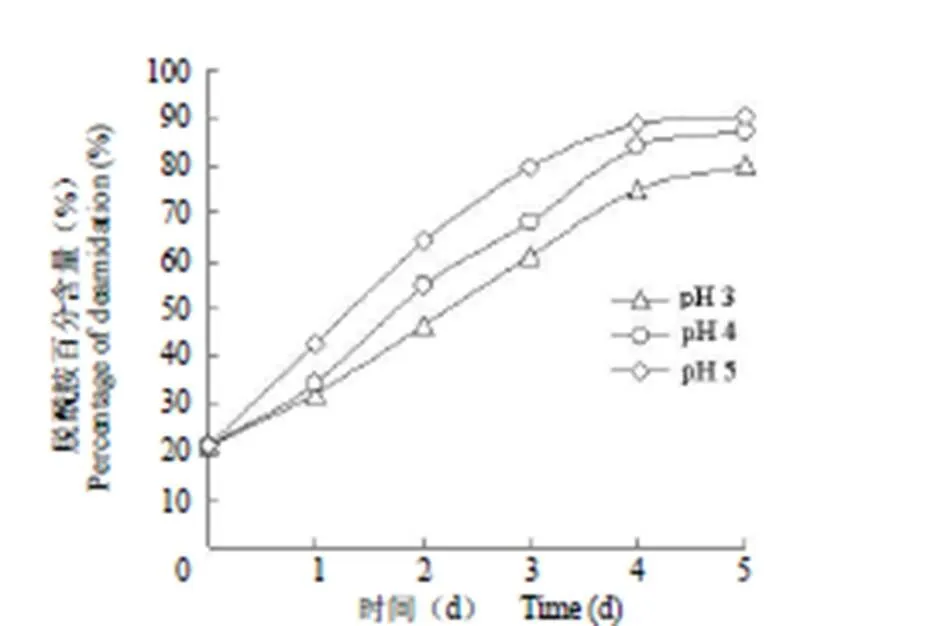
图 5 不同 pH 条件下发生脱酰胺重组人血管内皮抑制素的百分含量
Figure 5 The deamidation percentage of rhEndostatin incubated at different pH
研究表明在一定温度条件下非酶催化的脱酰胺过程为一级反应[17],在不考虑逆反应的条件下,脱酰胺过程的反应速率与未发生脱酰胺蛋白的浓度呈比例,脱酰胺化蛋白浓度可用如下方程表示:
P=P(--kt),P=Pe-kt。其中,P表示未发生脱酰胺化的蛋白浓度;P表示发生脱酰胺的蛋白浓度;P表示总蛋白浓度;表示脱酰胺反应的速率常数。
本研究测定了不同pH 条件下重组人血管内皮抑制素脱酰胺的速率,如图6 所示。计算表明在70 ℃、pH 分别为 3.0、4.0、5.0 条件下重组人血管内皮抑制素的脱酰胺速率常数分别为1= 0.29 d-1、2= 0.38 d-1、3= 0.45 d-1。
2.3 温度对脱酰胺过程的影响
本研究确定了重组人血管内皮抑制素在相同pH、不同温度条件下放置过程中脱酰胺随时间的变化趋势。图 7 是在 pH 5.0,温度分别为 37、50 和 70 ℃条件下不同放置时间重组人血管内皮抑制素中 Asn127发生脱酰胺化的变化趋势。由图 7 可见脱酰胺速率随温度升高而逐渐加快。

图 6 不同 pH 条件下重组人血管内皮抑制素脱酰胺反应速率常数
Fgiure 6 The kinetic constant of deamidation process of the rhEndostatin incubated at different pH

图 7 pH 5.0,不同温度重组人血管内皮抑制素脱酰胺含量变化
Figure 7 The deamidation percentage of rhEndostatin incubated at pH 5.0 and different temperature
本研究测定了上述条件下Asn127脱酰胺化的速率常数(图 8)。结果表明在 37、50、70 ℃三个温度下的脱酰胺速率常数分别为1= 0.0093 d-1、2= 0.068 d-1、3= 0.38 d-1。

图 8 pH 5.0,不同温度重组人血管内皮抑制素脱酰胺反应的速率常数
Figure 8 The kinetic constant of deamidation process of the rhEndostatin incubated at pH 5.0 and different temperature
3 讨论
在脱酰胺位点识别方面,本研究仅检测到多肽SVWHGSDPNGR(m/z 1211.7)中的 Asn 发生了脱酰胺,其他位置的 Asn 未检测到明显的脱酰胺化,说明 Asn 羧基端的氨基酸对其脱酰胺速率影响较大,当与 Asn 羧基相连的氨基酸为 Gly 时,Asn 非常容易发生脱酰胺化,可能原因是与 Asn 羧基相连的氨基酸侧链越长,则空间位阻越大,Asn 侧链的 N 难以被接近导致脱酰胺不易发生,溶剂能进入 Asn 的侧链区域和Asn 所在的局部结构具有灵活可变性是 Asn 发生脱酰胺化的重要条件。因此,蛋白质的高级结构对 Asn 的脱酰胺速率有一定影响[11]。同时,当 Asn 后面的氨基酸为极性且侧链较短时,如 Ser、The 和 Asp,脱酰胺难度相对有所增加;当 Asn 后面的氨基酸为疏水性且侧链较长时,Asn 发生脱酰胺化的难度更大。
在 pH 值对脱酰胺速率影响方面,Vlasak 等[18]研究了人 IgG1 抗体轻链 CDR1 中 Asn 脱酰胺随 pH 的变化,表明在 pH 4.0 ~ 7.0 范围内,Asn 脱酰胺速率也呈随 pH 升高而增加的趋势。由本实验测定脱酰胺速率常数发现,在相同温度条件下,pH 3.0 ~ 5.0 范围内脱酰胺速率随着 pH 值的上升而增加,其可能原因是脱酰胺化过程是一亲核反应,碱性条件下亲核反应更容易进行,故随着 pH 升高酸性逐渐减弱,碱性逐渐增强,导致反应速率常数在一定范围内逐渐增加。
在温度对脱酰胺速率的影响方面,通过研究发现,在相同的 pH 条件下,随着温度的升高天冬酰胺脱酰胺反应速率逐渐增大。在不考虑温度对蛋白质结构的影响条件下,反应速率常数与温度之间的关系应符合阿累尼乌斯方程,但根据实验结果计算出的速率常数与温度之间的关系并不完全符合阿累尼乌斯方程,其可能原因是温度升高对蛋白质的结构产生了一定影响,使得重组人血管内皮抑制素疏水性的结构发生聚集,而亲水性的结构域暴露在蛋白质外部,导致脱酰胺化过程加快。因此,温度变化导致的蛋白质结构变化对脱酰胺过程存在一定影响。
重组人血管内皮抑制素中天冬酰胺的脱酰胺过程受其氨基酸序列、储存温度和 pH 值影响,且在一定条件下随着温度和 pH 值的升高,脱酰胺速率逐渐加快。脱酰胺化是药物蛋白存放过程中化学降解和活性降低的重要原因之一[19],研究药用蛋白质在不同条件下的脱酰胺过程对于筛选合适的储存条件、减少活性损失具有参考价值。
[1] Robinson NE. Protein deamidation. Proc Natl Acad Sci U S A, 2002, 99(8):5283-5288.
[2] Paleari R, Paglietti E, Mosca A, et al. Posttranslational deamidation of proteins: the case of hemoglobin J Sardegna [alpha50(CD8)His--> Asn-->Asp]. Clin Chem, 1999, 45(1):21-28.
[3] Robinson NE, Robinson AB. Molecular clocks: deamidation of asparaginyl and glutaminyl residues in peptides and proteins.London, Ontario, Canada: Althous Press, 2004.
[4] Stephenson RC, Clarke S. Succinimide formation from aspartyl and asparaginyl peptides as a model for the spontaneous degradation of proteins. J Biol Chem, 1989, 264(11):6164-6170.
[5] Takata T, Oxford JT, Brandon TR, et al.Deamidation alters the structure and decreases the stability of human lens betaA3-crystallin. Biochemistry, 2007, 46(30):8861-8871.
[6] Huang L, Lu J, Wroblewski VJ, et al. In vivo deamidationcharacterization of monoclonal antibody by LC/MS/MS. Anal Chem, 2005, 77(5):1432-1439.
[7] Takata T, Woodbury LG, Lampi KJ. Deamidation alters interactions of beta-crystallins in hetero-oligomers. Mol Vis, 2009, 15:241-249.
[8] Liu YD, van Enk JZ, Flynn GC. Human antibody Fc deamidation in vivo. Biologicals, 2009, 37(5):313-322.
[9] Wright HT. Nonenzymatic deamidation of asparaginyl and glutaminyl residues in proteins. Crit Rev Biochem Mol Biol, 1991, 26(1):1-52.
[10] Tyler-Cross R, Schirch V. Effects of amino acid sequence, buffers, and ionic strength on the rate and mechanism of deamidation of asparagine residues in small peptides. J Biol Chem, 1991, 266(33):22549-22556.
[11] Robinson NE, Robinson ZW, Robinson BR, et al. Structure-dependent nonenzymatic deamidation of glutaminyl and asparaginyl pentapeptides. J Pept Res, 2004, 63(5):426-436.
[12] Teshima G, Porter J, Yim K, et al. Deamidation of soluble CD4 at asparagine-52 results in reduced binding capacity for the HIV-1 envelope glycoprotein gp120. Biochemistry, 1991, 30(16): 3916-3922.
[13] Aswad DW, Paranandi MV, Schurter BT. Isoaspartate in peptides and proteins: formation, significance, and analysis. J Pharm Biomed Anal, 2000, 21(6):1129-1136.
[14] Schirch V, Delle Fratte S, di Salvo M. Detection of isoAspartate residues as a posttranslational modification of proteins and peptides. Methods Mol Biol, 2002, 194:269-276.
[15] Liang JF, Pan MY, Xie WP. Research advance of endostatin.J Southeast China Natl Defence Medl Sci, 2005, 7(6):475-478. (in Chinese)
梁健富, 潘明阳, 谢伟平. 血管内皮抑制素研究进展. 东南国防医药, 2005, 7(6):475-478.
[16] Liu JQ, Li ZY, Chen LS, et al. An experimental study on inhibiting growth and metastasis of mouse melanoma by engineering endostatin. J Cell Mol Immunol, 2001, 17(1):63-64. (in Chinese)
刘江秋, 李忠义, 陈林生, 等. 重组人血管内皮抑制素抗肿瘤效应的应用研究. 细胞与分子免疫学杂志, 2001, 17(1):63-64.
[17] Patel K, Borchardt RT. Chemical pathways of peptide degradation. II. Kinetics of deamidation of an asparaginyl residue in a model hexapeptide. Pharm Res, 1990, 7(7):703-711.
[18] Vlasak J, Bussat MC, Wang S, et al. Identification and characterization of asparagine deamidation in the light chain CDR1 of a humanized IgG1 antibody. Anal Biochem, 2009, 392(2):145-154.
[19] Wakankar AA, Borchardt RT. Formulation considerations for proteins susceptible to asparagine deamidation and aspartate isomerization.J Pharm Sci, 2006, 95(11):2321-2336.
Effect of temperature and pH on the deamidation process of Asn in rhEndostain
XIE Ru, ZHANG Gui-feng, GAO Jian-ping, WANG Ming-lin,MA Run-yu, SU Zhi-guo
Author Affiliations: College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China (XIE Ru, MA Run-yu); State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China (ZHANG Gui-feng, SU Zhi-guo); College of Food Science and Engineering, Shandong Agricultural University, Taian 271018, China (GAO Jian-ping, WANG Ming-lin)
To investigate the effect of temperature and pH on the deamidation process of asparaginyl (Asn) in the rhEndostatin using liquid chromatography-tandem mass spectrometry.
The samples of rhEndostatin were incubated at different temperature and pH, and then digested by trypsin. The peptides in the digest mixture were analyzed to identify the deamidation site of Asn. The ratio of deamidation of sample inculated at different temperature and pH was determined.
The Asn in the peptide, SVWHGSDPNGR, was found to deamidate and transform into asparate (Asp) and isoaspartate (isoAsp). No obvious deamidation in Asn except in the SVWHGSDPNGR was observed. The effect of incubation temperature and pH on the deamidation process and kinetic constant was investigated. The kinetic constant of Asn deamidation is accelerating with the increasing of temperature and the pH of solution.
The deamidation process of Asn in rhEndostatin is affected by the pH of solution and the temperature of storage. Thus, studying of the deamidation of pharmaceutical proteins in different conditions is important for selecting proper storage environment and reducing the loss of activity.
Angiostatins; Asparagine; Peptides; Chromatography, high pressure liquid
10.3969/cmba.j.issn.1673-713X.2010.02.002
国家高技术研究发展计划(863 计划)(2007AA021604)
张贵锋,Email:gfzhang@home.ipe.ac.cn
2009-11-16
ZHANG Gui-feng, Email: gfzhang@home.ipe.ac.cn
中国医药生物技术
