PCR引物浓度对寡核苷酸液相杂交的影响
2010-07-13李义良易进华夏佳慧周文艳范丽丽
李义良,易进华,夏佳慧,周文艳,范丽丽
PCR引物浓度对寡核苷酸液相杂交的影响
李义良,易进华,夏佳慧,周文艳,范丽丽
201210 上海复旦张江生物医药股份有限公司
考察 PCR 引物浓度配比对液相微珠杂交效率的影响,寻求具有较强杂交信号和较好稳定性的 PCR 引物浓度配比。
建立 HLA-DRB1 等位基因的相关数据库,选择在 HLA-DRB1 位点的第二外显子上设计探针,并且选择其保守序列作为阳性对照探针(DPC2),DPC2 探针中间位点 T 突变成 A 作为阴性对照探针(DNC)。分别针对标本 C2-008、C2-024、C2-025 的等位基因序列设计出 6 条约 21 bp 的寡核苷酸探针,各探针 5’ 端用氨基(NH2)修饰。通过引物浓度梯度配比(1:100、1:50、1:20、1:8、1:4、1:2、1:1),对型别已知的细胞株 DNA 进行 PCR 扩增并得到目的片段(1:100 配比除外),在相同条件下将 PCR 产物与寡核苷酸探针进行液相杂交检测。
浓度配比为 1:1 的对称式扩增产物杂交结果不理想,而浓度配比分别为 1:20、1:8、1:4、1:2 的不对称扩增均得到了待检单链、双链 DNA 混合物,其中 1:4 浓度配比具有最好的扩增效率和稳定性。根据阳性信号与阳性标本是否相符表明:引物浓度配比为 1:100 的不对称 PCR 和 1:1 的对称 PCR 检测效果差,易出现假阴性;1:2、1:4、1:8、1:20 配比检测效果较好,比较稳定。
PCR 引物浓度配比影响液相微珠杂交效率,不对称 PCR 产物有利于提高杂交效率,为快速成功配制 PCR 试剂奠定了基础,有利于寡核苷酸液相芯片的应用。
聚合酶链反应; 寡核苷酸序列分析; 核酸杂交
液相芯片是 20 世纪 90 年代中期发展起来的,以美国 Luminex 公司的 xMAP(flexible multi- analyte profiling)技术为基础,既能保证信息质量,又能提供相对高通量的新一代分子检测技术平台[1-2]。xMAP 液相芯片体系由许多不同颜色的微珠为主要基质构成,每种微珠表面共价连接有不同的寡核苷酸探针分子,将这些微珠悬浮于一个液相体系中,就构成了一个液相芯片系统。杂交在悬浮的液相中进行,空间位阻小,所需反应时间短,杂交后不用清洗就可以直接读数,检测效率大大高于固相杂交。xMAP 液相基因芯片已广泛应用于单核苷酸多态性分析[3]、组织相容性抗原分型[4]、基因表达分析等[5]研究,可实现高通量检测。目前寡核苷酸间的分离和杂交过程已被进行了较深入的研究[6-7],但仍有很多问题亟待解决。影响寡核苷酸液相芯片杂交效果的因素有很多,样品制备是其中一重要影响因素。传统对称 PCR,扩增所得产物为双链 DNA,不经过碱变性或热变性,无法同寡核苷酸探针杂交。即使通过变性步骤后,杂交效率也比较低。而且,DNA 双链间的复性作用力要远远强于核酸与寡核苷酸探针间的杂交作用力,造成杂交信号较弱或不稳定。用单链进行杂交被认为是排除双链干扰、得到理想杂交结果的较好方式[8-10]。
不对称 PCR 由 Gyllensten 和 Erlich[11]在 1988 年首次提出,常被用于获得单链 DNA,目前文献一般认为其限制性引物和非限制性引物浓度最佳配比为 1:50 ~ 1:100,扩增效率较低、不稳定、难以优化并且容易产生非特异性扩增。研究表明,相对于传统对称 PCR,不对称 PCR 扩增效率只有 60% ~ 70%,而前者可达到 90%,甚至更高[12-13]。此外,还需要控制引物和模板数量,因而,往往不能保证每次不对称 PCR 扩增都获得成功。如两条引物浓度相差太大,限制性引物浓度太低,其对称扩增效率也会大大降低。
本文比较了 PCR 引物浓度配比对寡核苷酸液相杂交的影响,寻求具有一定扩增效率,能获得较强的杂交信号和稳定性的引物浓度配比,以便于建立成功率较高的 PCR 试剂配制标准操作程序,促进寡核苷酸液相芯片的 SNP 检测和临床应用。
1 材料和方法
1.1 材料
1.1.1 标准 DNA HLA 基因型别已知 DNA 标本:C2-008、C2-024、C2-025 购于美国 UCLA(University of California,Los Angeles)免疫遗传学中心,浓度 50 ng/μl,纯度 OD260/280 1.65 ~ 2.0。标本相应基因型详见表 1 中阳性标本列。
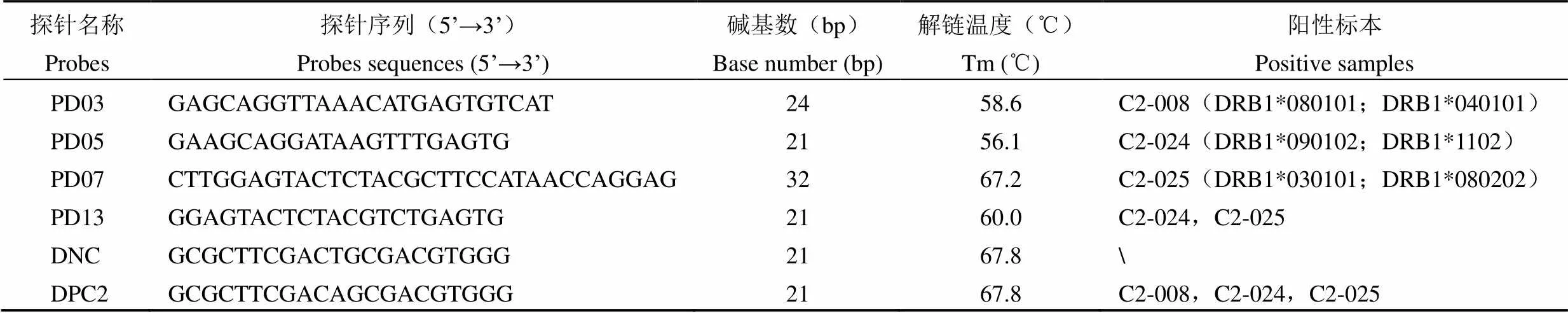
表 1 寡核苷酸探针序列及对应阳性标本
1.1.2 试剂与微珠 Taq DNA 聚合酶为上海博彩公司产品;链亲素修饰的藻红蛋白 PJ31S (StreptavidinR-phycoerythrin,SAPE),2.02 mg/ml,购于美国 Prozyme 公司;杂交液为上海复旦张江生物医药股份有限公司产品;羧基修饰的聚苯乙烯荧光微珠 L100-C103、L100-C105、L100-C107、L100-C113、L100-C130、L100-C197 为美国 Luminex 公司产品。
1.1.3 主要仪器 多功能悬浮点阵仪 Luminex- 100TM购自美国 Luminex Corp 公司;9700 PCR 仪购自美国 ABI 公司;EPS 3500 电泳仪和凝胶成像仪均购自美国 Pharmacia 公司;5810R 型平板离心机购自德国 Eppendorf 公司。
1.2 方法
1.2.1 杂交微珠制备方法
1.2.1.1 引物与探针的设计、合成与标记 参照文献[4],并检索 Genbank(http://www.ncbi.nlm.nih. gov)以及 EMBL(http://www.ebi.ac.uk)数据库中的 HLA-DRB1 基因序列进行整理,建立了 HLA- DRB1 等位基因的相关数据库。HLA-DRB1 基因的第二外显子的 PCR 引物序列为:上游引物 P1(5’ CCGGATCCTTCGTGTCCCCACACG 3’),下游引物 P2(5’ CCGCTGCACTGTGAAGCTCTC 3’)。下游引物 P2 的 5’ 端进行生物素标记。
根据 HLA 等位基因的变异特点,选择在 HLA-DRB1 位点的第二外显子上设计探针,并且选择第二外显子上的保守序列作为阳性对照探针(DPC2),DPC2 探针中间位点 T 突变成 A 作为阴性对照探针(DNC)。分别针对标本 C2-008、C2-024、C2-025 的等位基因序列设计出 6 条约 21 bp 的寡核苷酸探针,各探针 5’ 端用氨基(NH2)修饰。上述引物和探针由上海生工生物工程技术有限公司合成。表 1 为寡核苷酸探针具体序列及对应成阳性反应的标本。
1.2.1.2 探针耦联 ①耦联条件:0.1 mol/L的(N-吗啡基)乙磺酸(MES)(pH 4.5),50 μl;0.1 nmol 氨基修饰寡核苷酸探针;2.5 × 106个羧基修饰荧光微珠(不同颜色编号),加入 2.5 μl 40 mg/ml 的 1-乙基-(3-二甲基-丙烷)氢氯化二亚胺(EDC)作为催化剂,混合后室温条件下孵育 30 min(第 15 分钟时涡漩混匀一次),然后加入新鲜配制的 EDC 溶液 2.5 μl,室温条件下孵育 30 min;加入 1 ml 0.02% 吐温–20,上下颠倒摇匀洗涤,13 000 r/min 离心 2 min,吸除上清;加入 1 ml 0.1% SDS(十二烷基硫酸钠),重悬 Beads,上下颠倒混匀洗涤;12 000 r/min 离心 2 min,吸除上清;50 μl Tris-EDTA缓冲液(pH 8.0,NaN3)重悬 Beads,涡漩混匀,4避光保存备用。
②质检:选取型别已知,针对各探针反应结果均有阴性和阳性的不同标本作为质控标本,杂交检测,探针表现和理论一致,阳性、阴性对应出现,则表明耦联成功,质检合格。
1.2.1.3 微珠的制备 探针耦联质检后混合,使每种编号微珠数量为 5 000 个/μl,组成液相杂交微珠。
1.2.2 样品的制备
1.2.2.1 对称 PCR 扩增 ①反应体系:模板DNA 2 μl(50 ng/μl),P1、P2 引物量均为 0.4 μmol/L,Taq DNA 聚合酶 0.2 μl(5 U/μl),10´Buffer 2 μl,加双蒸水 dd H2O 至终体积 20 μl。②PCR 反应条件:96 ℃,3 min;96 ℃,20 s,60 ℃,20 s,72 ℃,20 s,5 个循环;然后 95 ℃,10 s,60℃,15 s,72 ℃,20 s,35 个循环;再 72 ℃延伸 10 min。每一样品分别做 3 个平行扩增反应。
1.2.2.2 不对称 PCR 扩增 固定下游引物 P2 量为0.4 μmol/L,提高引物 P1:P2 比例至 1:2、1:4、1:8、1:20、1:50 和 1:100。PCR 反应循环条件同对称 PCR 条件,每一样品分别做 3 个平行扩增反应。取其中一批两种方式 PCR 扩增产物各5 μl,用含有溴乙锭的 3%琼脂糖凝胶进行电泳后观察结果。
1.2.3 芯片杂交及清洗 杂交体积为 20 μl:每孔加 5 μl PCR 扩增产物,15 μl 杂交混合液[耦联好探针的微珠混合液 2 μl,13 μl 1.5´杂交液(4.5 mol/L氯化四甲基铵(TMAC),75 mmol/L Tris,4 mmol/L EDTA,0.15% Sarkosyl 月桂酰-N-甲基氨基乙酸钠,pH 8.0)]。将杂交板用膜密封好后,低速充分震荡混匀,PCR 仪 97 ℃变性 7 min,60 ℃孵育 15 min;从 PCR 仪上取下杂交板,每孔立即加 100 μl 的洗涤液(WB),覆膜,离心半径 18 cm,3 000 r/min 离心 5 min,取出杂交板,迅速甩掉上清液,然后倒置在吸水纸上,去除杂交板面上残余的液体。震荡混匀直至白色沉淀完全悬浮,每孔加入 120 μl WB,覆膜,离心半径 18 cm,3 000 r/min 离心 5 min(期间准备 1´PJ31S 荧光蛋白溶液,把 PJ31S 浓缩液 250 倍稀释于 1´杂交液中);取出杂交板后,迅速甩掉上清液。震荡混匀直至白色沉淀完全悬浮,每孔加 20 μl 的 1´PJ31S,覆膜,密封后,低速震荡充分混匀。PCR 仪60 ℃孵育 6 min;从 PCR 仪上取下杂交板,每孔立即加 100 μl 的 WB。离心半径 18 cm,3 000 r/min 离心 5 min。甩掉洗涤液,每孔加 75 μl 的 WB,吹打混匀后转移到读板上。
1.3 数据处理
Luminex 100 仪器读取标本,收集数据。转化成标准化值(T 值),杂交检测标准化值 T:T =(MFIProbe-MFIDNA)/(MFIDPC2-MFIDNA)× 100。阳性信号的判断标准为:荧光强度 > 1000,荧光强度标准化值明显大于阴性标本对应的标准化值,其比值> 3,否则为阴性。
2 结果
2.1 引物浓度梯度配比 PCR 扩增产物
引物浓度梯度配比 PCR 产物电泳,结果如图 1 所示。PCR 扩增产物目的片段的大小为 288 bp,引物浓度配比 1:100(0.004 μmol/L:0.4 μmol/L)、1:50(0.008 μmol/L:0.4 μmol/L)均有较亮的非特异性扩增条带,前者未观察到目的片段,后者目的条带也很弱。对称 PCR(1:1 配比,0.4 μmol/L:0.4 μmol/L)产物双链 DNA 片段最亮,但未观察到单链 DNA,其他配比均有效扩增出目的片段,为双链 DNA 和单链 DNA 混合物,且随着浓度不对称配比的缩小,电泳条带亮度逐渐增加,但0.1 μmol/L:0.4 μmol/L 配比的 PCR 产物单链 DNA 条带最亮,同时也获得了较亮的双链 DNA,具有最好的扩增效率和稳定性。
2.2 引物浓度配比对液相微珠杂交结果的影响
为避免实验数据随机性,PCR 扩增时,每个样品做 3 次平行考察。在相同条件下将所得扩增产物与寡核苷酸液相微珠进行杂交检测,得到相关平均值(具体每个平行孔检测数据未显示),如图 2A、2B 所示。图 2 中a、b、c 对应标本依次为 C2-008、C2-024、C2-025,其中图 2A 为不同引物浓度配比 PCR 产物杂交后荧光强度均值比较,引物浓度配比为 1:100 的不对称 PCR 和 1:1 的对称 PCR 时,各标本对应阳性探针荧光值均明显低于其他配比杂交结果,小于 1 000(C2-024 标本中 PD05 探针除外)。其中 1:20 配比检测结果荧光值最高,1:8、1:4、1:2 配比检测结果荧光值接近。图 2B 为杂交后荧光强度标准化值比较,引物浓度配比为 1:1 时,标本对应阳性探针其标准化值均明显低于其他配比的杂交结果,其中在 C2-024 和C2-025 标本中,探针 PD13 标准化值与其阴性标本 C2-008 中的标准化值很接近,未见有阳性荧光信号(假阴性),探针 PD05 与 PD07 阳性也明显降低。引物浓度配比为 1:100 时,阳性探针标准化值最大,但由于内对照阳性探针 DPC2 荧光值很低,故整体结果不理想。其他配比探针阳性标准化值接近,比较稳定。
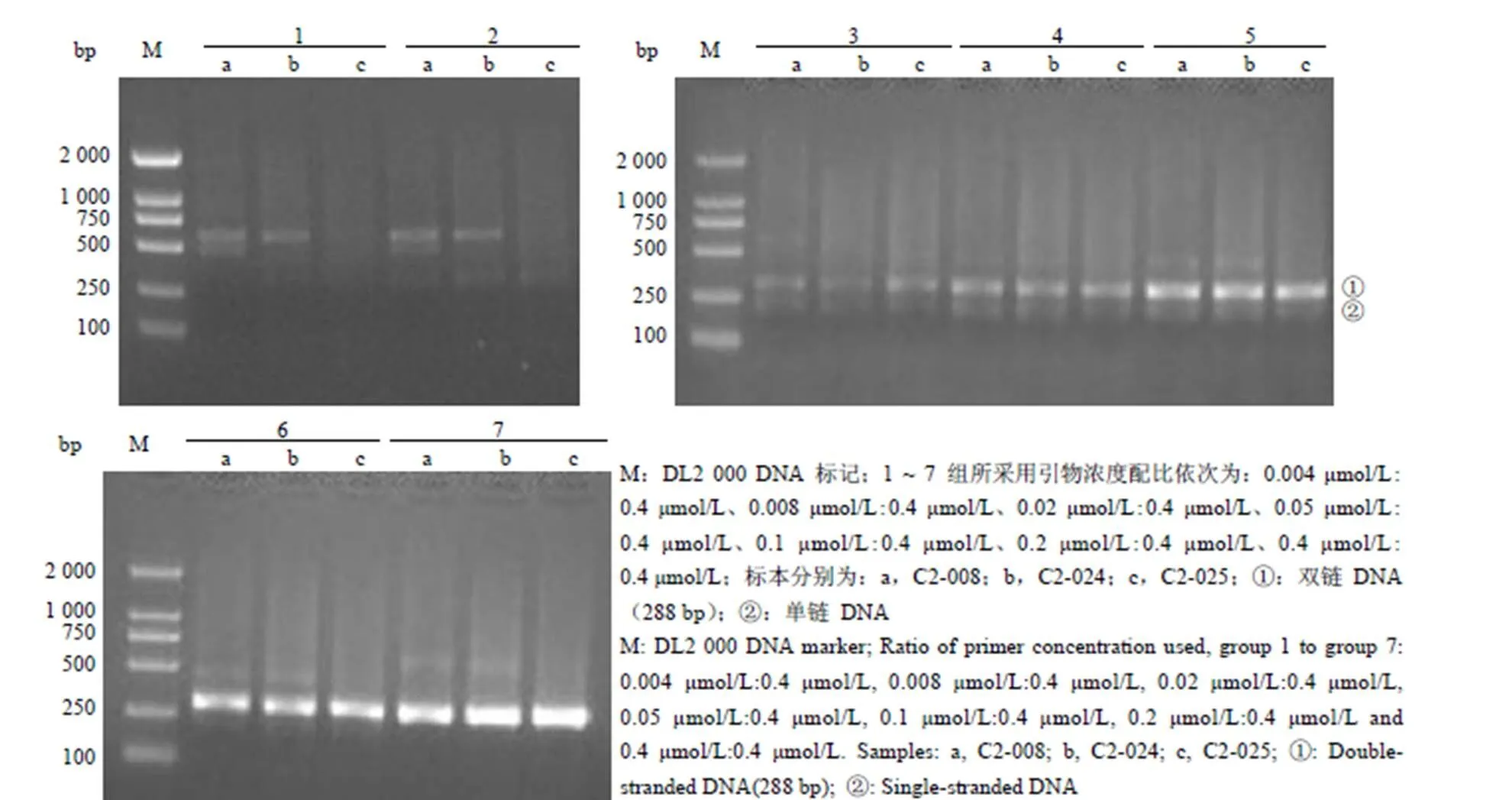
图 1 PCR 扩增产物电泳比较
Figure 1 Comparison of amplification products by agarose gel electrophoresis
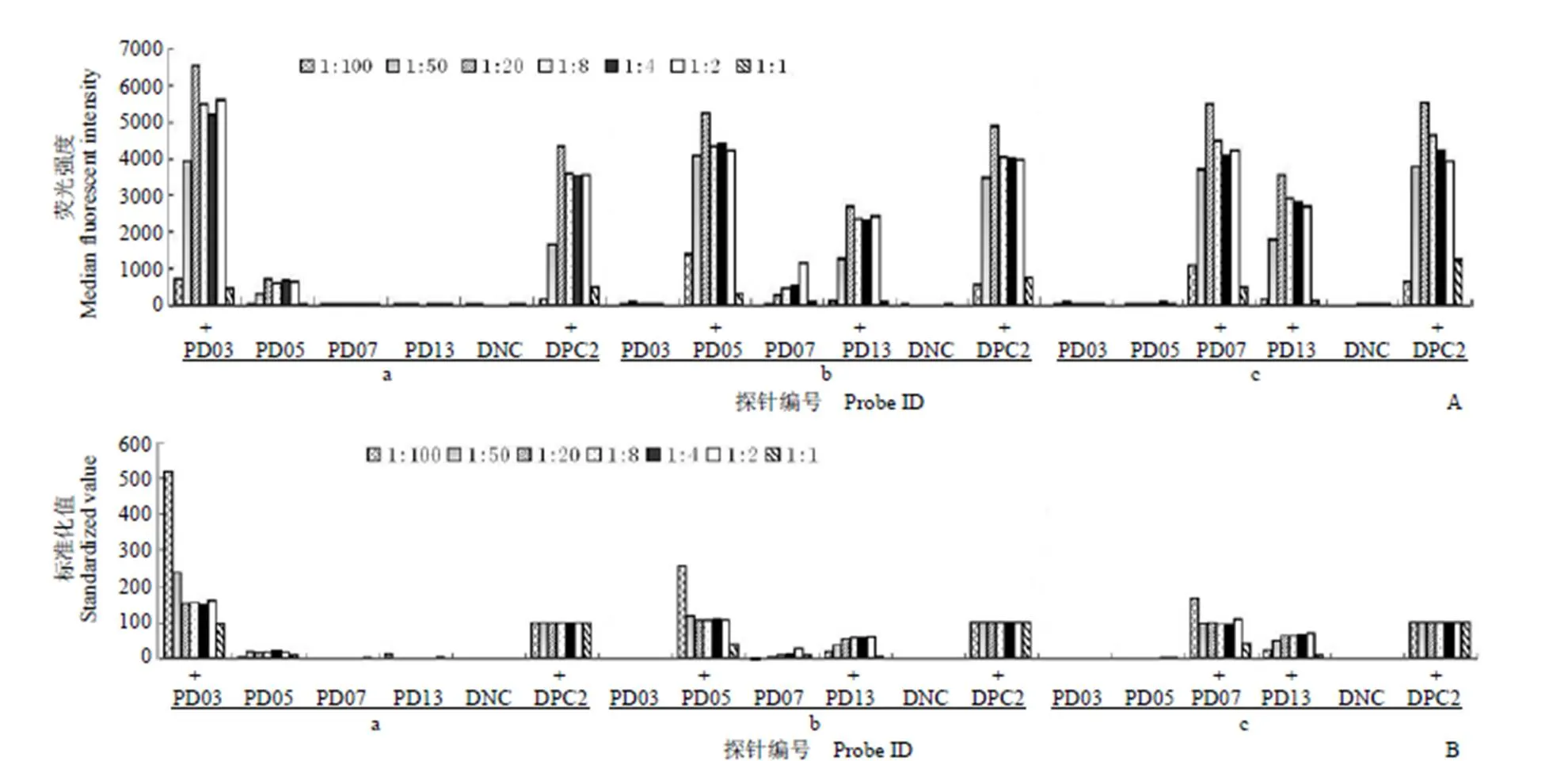
在同一条件下杂交检测不同引物浓度配比所得扩增产物,各柱状图颜色表示不同引物浓度配比。标本分别为 a:C2-008;b:C2-024;c:C2-025。探针为阳性反应时用“+”号表示。
Figure 2 Oligo liquid-bead hybridization results obtained from different primer concentration ratios. [A: Indicate comparison of signal intensity (average products from three individual amplifications); B: Indicate comparison of standardized value of signal intensity]
根据阳性信号是否与阳性标本相符表明:引物浓度配比为 1:100 的不对称 PCR 和 1:1 的对称 PCR 检测效果差,易出现假阴性;1:2、1:4、1:8、1:20 配比检测效果较好,比较稳定。
3 讨论
DNA 液相杂交较复杂,尤其当 PCR 扩增效率低或所得产物为双链 DNA 时,导致许多拷贝数低的基因无法有效检测,许多探针出现假阴性,检测灵敏性和稳定性差。我们在试剂研发、配制生产过程中发现:同一序列引物,合成后按对称 PCR 扩增质检,检测效果好,阳性信号强,但再次合成后按同一引物浓度配比进行对称 PCR 扩增检测,电泳观察,目的片段大小正确,条带很亮,但杂交检测阳性信号很弱,按对称 PCR 方式调整引物浓度,检测结果也无改观。按不对称 PCR 方式调整引物浓度配比后,电泳条带相对较弱,甚至很弱时也获得了较好的检测结果。因此,建立具有一定扩增效率,同时又能产生大量单链的 PCR 方法、提高液相芯片的重复性、可靠性和敏感性非常重要。
DNA 双链中只有一条链可与芯片进行杂交反应,另一条链则作为干扰链存在。本研究结果与此一致:引物浓度配比为 1:1 的对称 PCR 产物,电泳条带虽很亮,但杂交后阳性探针(DPC2)荧光值很弱,较其他不对称 PCR(浓度配比为 1:2、1:4、1:8、1:20、1:50)的荧光值偏低很多。在 C2-024、C2-025 标本中,探针 PD13 未见有阳性荧光信号,出现假阴性;对应 C2-025 标本,PD07 探针荧光值信号与阴性标本(C2-024)荧光值信号接近,也未见有明显阳性荧光信号(假阴性);C2-024 标本中,PD05 探针荧光值信号也明显低于其他配比检测到的荧光值信号。Wei 等[8]也观察到:当引物浓度高于 0.63 μmol/L 时,随着双链 DNA 量的增加,杂交检测的信号强度反而降低。对此现象很难找出具体原因,高浓度的双链靶分子可能存在较高的自我退火比率,增加了杂交的竞争压力,从而降低杂交效率。另外,微珠表面一定范围内靶分子太多,可能造成空间拥挤,反而降低杂交效率,不易与探针杂交。我们在室温下加入适量强碱反应15 min,使双链变性,用适量醋酸中和再进行后续杂交检测,但结果与热变性结果一致:杂交对称 PCR 产物,探针仍有假阴性出现(数据未显示),可能在杂交过程中互补链仍会与探针竞争与靶链 DNA 的杂交,使反应体系中实际用于杂交的靶序列浓度降低,从而影响杂交效率。
不对称 PCR 产物杂交检测结果,均没有假阴性情况出现,而且阳性信号较强、较稳定,用单链进行杂交可排除双链干扰、得到理想杂交结果[8-10]。引物浓度配比为 1:100 时,标本对应阳性探针均很强,但由于内对照阳性探针 DPC2 荧光值很低,故整体结果不理想,不能采用。
综上所述:对称式扩增产物杂交结果不理想,而浓度配比分别为 1:20、1:8、1:4、1:2 的不对称式扩增显著地提高杂交效率,有利于寡核苷酸液相杂交微珠的应用。采用 1:4(0.1 μmol/L:0.4 μmol/L)引物配比进行不对称 PCR 扩增,可保证一定的扩增效率和单链 DNA 的生成,配制 PCR 引物反应液时,可以此引物浓度配比为基准进行测试调整,为快速成功配制 PCR 试剂奠定了基础。
[1] Fulton RJ, Mc Dade RL, Smith PL, et al. Advanced multiplexed analysis with the FlowMetrix system. Clin Chem, 1997, 43(9):1749- 1756.
[2] Sun K, Wang Q. Research and application progress of liquid chip technology. Chin J Exp Surg, 2005, 22(5):639-640. (in Chinese)
孙凯, 汪谦. 液相芯片技术研究应用进展. 中华实验外科杂志, 2005, 22(5):639-640.
[3] Ye F, Li MS, Taylor JD, et al. Flourescent microsphere-based readout technology for multiplexed human single nucleotide polymorphism analysis and bacterial identification. Hum Mutat, 2001, 17(4):305- 316.
[4] Dalva K, Beksac M. HLA typing with sequence-specific oligonucleotide primed PCR (PCR-SSO)and use of the Luminex technology.Methods Mol Med, 2007, 134:61-69.
[5] Lawrie GA, Robinson J, Corrie S, et al. Multiplexed microsphere diagnostic tools in gene expression applications: factors and futures. Int J Nanomedicine, 2006, 1(2):195-201.
[6] Chen C, Wang W, Wang Z, et al. Influence of secondary structure on kinetics and reaction mechanism of DNA hybridization. Nucleic Acids Res, 2007, 35(9):2875-2884.
[7] Chen C, Wang W, Ge J, et al. Kinetics and thermodynamics of DNA hybridization on gold nanoparticles. Nucleic Acids Res, 2009, 11(37): 3756-3765.
[8] Wei Q, Liu S, Huang J, et al. Comparison of hybridization behavior between double and single strand of targets and the application of asymmetric PCR targets in cDNA microarray. J Biochem Mol Biol, 2004, 4(37):439-444.
[9] Zhang HY, Ma WL, Li L, et al. Enhancing the hybridization efficiency of oligo microarray by asymmetric PCR. Acad J PLA Postgrad Med Sch, 2005, 26(4):266-268. (in Chinese)
张海燕, 马文丽, 李凌, 等. 应用不对称PCR技术提高寡核苷酸基因芯片杂交效率. 军医进修学院学报, 2005, 26(4):266-268.
[10] Gao HF, Tao SC, Wang D, et al. Comparison of different methods for preparing single stranded DNA for oligonucleotide microarray. Analy Lett, 2003, 13(36):2849-2863.
[11] Gyllensten UB, Erlich HA. Generation of single-stranded DNA by the polymerase chain reaction and its application to direct sequencing of the HLA-DQA locus. Proc Natl Acad Sci U S A, 1988, 85(20):7652- 7656.
[12] Innis M, Gelfand DH, Sninsky JJ, et al. PCR protocols:A guide to methods and applications(Spiral-bound). Salt Lake City, UT, USA: Academic Press, 1989:76-83.
[13] Gyllensten UB, Allen M. Sequencing of in vitro amplified DNA. Methods Enzymol, 1993, 218:3-16.
Effects of the primer concentration on the liquid-phase oligonucleotide hybridization
LI Yi-liang, YI Jin-hua, XIA Jia-hui, ZHOU Wen-yan, FAN Li-li
Author Affiliation: Shanghai Fudan-Zhangjiang Bio-Pharmaceutical Co., Ltd., 201210, China
This study investigated the impact of ratios of PCR primer concentration on the liquid-Bead hybridization efficiency to find appropriate ratio of primer concentration with a stronger hybridization signal and the hybrid stability.
Database of HLA-DRB1 alleles was established. Probes were designed according to the sequence of exon 2 of HLA-DRB1 locus. Conserved sequence were selected for positive control probe design (DPC2). Negative control probe was synthesized through a mutation from T to A in the middle of the sequence of DPC2. Six oligo probes about 21 bp were designed specially targeted to allele sequences from samples C2-008, C2-024 and C2-025 separately. The 5'-terminal sequences of each probe were modified by NH2. Genomic DNA from cell lines with known types was amplified with different ratios of primer concentration (1:100, 1:50, 1:20, 1:8, 1:4, 1:2, 1:1). Target fragments were obtained except from amplification with 1:100 ratio. PCR products were hybridized with oligonucleotide probes by liquid hybridization under same conditions.
Hybridization results from symmetric PCR products by concentration ratio of 1:1 are not satisfactory, while mixture of single-strand DNA and double-stranded DNA under test was obtained from asymmetric amplifications by ratios of 1:20, 1:8, 1:4, and 1:2, in which the best amplification efficiency and stability from the concentration ratio of 1:4. From the consistency of positive samples and positive signals, false negative results were common due to ratios of primer concentration 1:100 and 1:1.
The concentration ratio of PCR primers affects the efficiency of liquid-phase bead hybridization. Asymmetric PCR products help improve the hybridization efficiency. Our results established the foundation to prepare PCR reagents quickly and successfully in favour of liquid-phase oligonucleotide chip applications. Better results and stability would be expected using other ratios.
Polymerase chain reaction; Oligonucleotide array sequence analysis; Nucleic acid hybridization
LI Yi-liang, Email: yiliangli@yahoo.com.cn
李义良,Email:yiliangli@yahoo.com.cn
2009-11-23
10.3969/cmba.j.issn.1673-713X.2010.02.008
