贴膏剂微生物限度检查法研究
2010-06-01任安民由亚宁王小亮绳金房
任安民,由亚宁,王小亮,绳金房
(1.陕西省食品药品检验所,陕西 西安 710061; 2.西安交通大学药学院,陕西 西安 710061)
贴膏剂包括橡胶膏剂、巴布膏剂(凝胶膏剂)和贴剂,是由药材提取物、药材或/和化学药物与适宜的基质和基材制成的,供皮肤贴敷,可产生局部或全身性作用的一类片状外用制剂。2005年版《中国药典》收载贴膏剂7种、贴剂2种。BP2007版、EP6.0版、USP30版及美国、欧洲和日本三方协调一致的药品微生物限度检测方法中,均对透皮贴剂规定了检测方法和限度标准。BP2007版规定每贴不得检出金黄色葡萄球菌、铜绿假单胞菌和肠杆菌科与其他革兰阴性菌,需氧菌(细菌与真菌)不得过5×102CFU;USP30版规定每贴不得检出金黄色葡萄球菌、铜绿假单胞菌,细菌数不得过2×102CFU,霉菌和酵母菌数不得过20 CFU(国外贴剂与中国贴剂规格、大小略有不同)。2005年版《中国药典(二部)》[1]微生物限度检查法引入验证理念,使得检测结果更科学准确。实际工作中,贴膏剂微生物限度标准中供试品溶液的制备方法不十分明确,不利于贴膏剂质量控制。笔者参考文献[2-3]对两种市售贴膏剂微生物限度检查方法进行了方法学验证,报道如下。
1 试验材料
菌种:金黄色葡萄球菌(Staphylocous aureus)[CMCC(B)26 003],铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104],枯草芽孢杆菌(Bacillus subilis)[CMCC(B)63501],大肠埃希菌(Escherichia coli)[CMCC(B)44102],黑 曲 霉(Aspergillus niger)[CMCC(F)98003]。
稀释液:pH=7.0的氯化钠-蛋白胨缓冲液。
冲洗液:0.1%蛋白胨水溶液。
培养基:胰酪胨大豆肉汤培养基(批号为080121),沙氏葡萄糖琼脂培养基(批号为080215),pH=7.0氯化钠-蛋白胨(批号为080626),均由北京第三制药厂生产;胰酪胨大豆琼脂培养基(批号为080324,北京陆桥技术有限责任公司)。
供试品:伤湿止痛贴膏(西安强生药业有限公司,规格为7 cm×10 cm,批号为20080231);正伤消痛膏(西安千禾制药有限公司,规格为7.6 cm×11 cm,批号为20080503)。
其他:无菌吸管、试管、器皿、镊子、剪刀、集菌仪、集菌器、90 mm平皿、约为100 cm2灭菌玻璃板、振荡器、约为80 cm2灭菌纱布等。
2 方法与结果
2.1 预试验
2.1.1 稀释剂选择
配制各种稀释剂,即A液为pH=7.0的氯化钠蛋白胨缓冲液,B液为A液+3%吐温80+十四烷酸(B1为5%,B2为10%,B3为15%,B4为 20% ),C液为 A液+6%吐温 80+十四烷酸(C1为5%,C2为10%,C3为15%,C4为20%),D液为A液+9%吐温80+十四烷酸(D1为5%,D2为10%,D3为15%,D4为20% ),E液为A液+12%吐温80+十四烷酸(E1为5%,E2为10%,E3为15%,E4为20%),F液为A液+十四烷酸(20%)。选用各稀释液,分别采用振荡法(振荡30 min)与均质器拍击法对贴膏剂进行供试液制备试验,观察其分散情况,以便选择适合该供试品的稀释剂。结果以A液为释释剂时,供试液较澄清,便于取用,但膏剂之间相互粘连(可采用在黏胶层粘贴纱布消除),适用于常规法与薄膜法检验;以B液为稀释剂时,B1液部分分散,B4液分散较强,B2液与B3液分散适中,供试液因有黏性,适用于常规法,但不适用于薄膜法检验;以C液(与B液基本相似)为稀释剂时,供试液比B供试液略显黏、浑;以D液与E液(基本相似)为稀释剂时,供试液较黏稠,不便于吸取;以F液为稀释剂时,供试液略显稀、浑,有明显的油水分层,不便于检验操作。因此选A液作为稀释剂,采用在黏胶层粘贴纱布以消除相互粘连。
2.1.2 供试液制备方法
进行了振荡法(30 mm)与均质器拍击法(拍击3,6,9 min)比较试验。拍击法操作时间较短,但其无菌操作的安全性与简便性却不如振荡法,且设备成本大于振荡法。结果拍击3 min时,分散效果不太理想;拍击6 min与9 min时,会不同程度出现橡胶黏团而影响供试液吸取。综合考虑,选用振荡法(30 min)。
2.1.3 取样量选择
取10贴(规格为7 cm×10 cm)溶于500 mL稀释剂时根本无法振荡,若采用容量大于500 mL的三角瓶,则使试验难度增加且不符合实际。取5贴(规格为7 cm×10 cm)溶于500 mL稀释剂时振荡效果尚可,但三角瓶会在振荡器中摆动而不安全;若取2贴溶于200 mL稀释剂,由于各产品规格不同,不能按贴报告。若按100 cm2大小取贴剂,溶于100 mL稀释剂,则适用于不同类型、规格的贴膏剂。因此采用按100 cm2大小取贴剂溶于100 mL稀释剂的方法取样,以10 cm2报告结果。
2.2 伤湿止痛贴膏微生物限度检查
2.2.1 菌回收率测定
1)菌悬液制备
分别接种金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的新鲜培养物至胰酪胨大豆肉汤培养基,于35℃培养24 h;分别接种白色念珠菌和黑曲霉的新鲜培养物至沙氏葡萄糖肉汤和沙氏葡萄糖琼脂培养基,于25℃分别培养3 d和7 d。将上述培养物均用pH=7.0的无菌氯化钠-蛋白胨缓冲液制备成每1 mL所含菌数不大于100 CFU的菌悬液。
2)供试液制备
取伤湿止痛贴膏,置灭菌玻璃板上,将粘面朝上,以无菌操作揭除粘胶层,粘贴灭菌纱布,剪取大小约100 cm2的块状,溶于100 mL稀释液中,振荡30 min,作为1∶10的供试液。
3)常规法[4]
试验组:取1∶10供试液1 mL和试验菌50~100 CFU,采用常规法进行细菌、霉菌和酵母菌菌数测定;供试品对照组:取1∶10供试液1 mL,按试验组方法(不加试验菌)测定供试品的本底菌菌数;菌液组:依法测定所加的试验菌菌数。结果见表1。可见,金黄色葡萄球菌回收率低于70%,不可采用常规法;试验组霉菌和酵母菌的回收率均高于70%,可采用常规法。
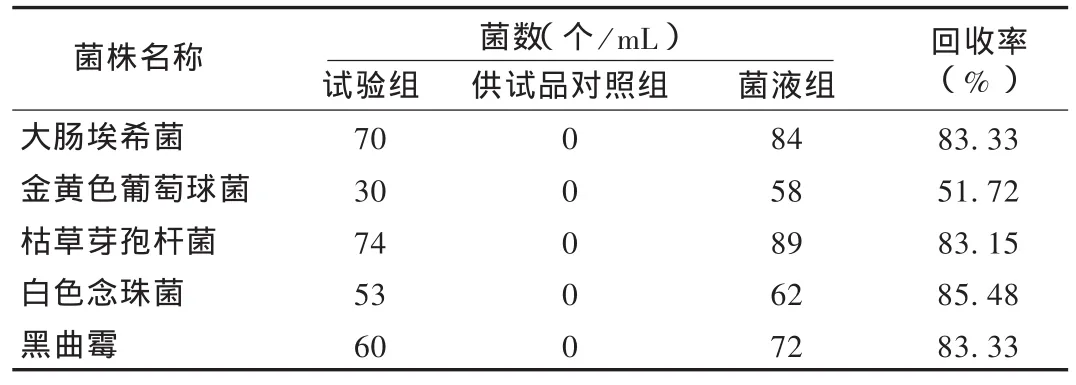
表1 伤湿止痛贴膏常规法菌回收率测定结果(n=2)
4)薄膜过滤法
取1∶10的供试液10 mL,加入含50 mL稀释液的薄膜过滤器中过滤,用冲洗液(100 mL/次)冲洗3次。在最后一次冲洗液中加入50~100 CFU试验菌,取出滤膜贴于已制备的培养基上,平行2皿,求其平均数,测定其菌数。结果试验组、供试品对照组、菌液组金黄色葡萄球菌的菌数分别为73,0,79个/mL,回收率为92.40%,说明可采用薄膜过滤法(冲洗液100 mL/次,冲洗3次)对样品进行细菌菌数测定。
2.2.2 控制菌验证
试验组:取菌回收率测定项下供试液10 mL和金黄色葡萄球菌试验菌液1 mL,加入到100 mL营养肉汤培养基中,按金黄色葡萄球菌检查法试验;取菌回收率测定项下供试液10 mL和铜绿假单胞菌试验菌液1 mL,加入到100 mL胆盐乳糖增菌培养基中,按铜绿假单胞菌检查法试验。
阴性对照组:取菌回收率测定项下供试液10 mL和大肠埃希菌试验菌液1 mL,加入到100 mL营养肉汤培养基中,按金黄色葡萄球菌检查法试验;取菌回收率测定项下供试液10 mL和大肠埃希菌试验菌液1 mL,加入到100 mL胆盐乳糖增菌培养基中,按铜绿假单胞菌检查法试验。结果见表2。可见,试验组未检出试验菌,阴性对照组未检出阴性对照菌。

表2 伤湿止痛贴膏和正伤消痛膏控制菌验证试验结果
2.3 正伤消痛膏微生物限度检查
2.3.1 菌回收率测定
常规法:菌悬液制备及测定方法同2.2.1项下方法,结果见表 3。可见,金黄色葡萄球菌回收率低于70%,不可采用常规法;试验组霉菌和酵母菌的回收率均高于70%,可采用常规法。
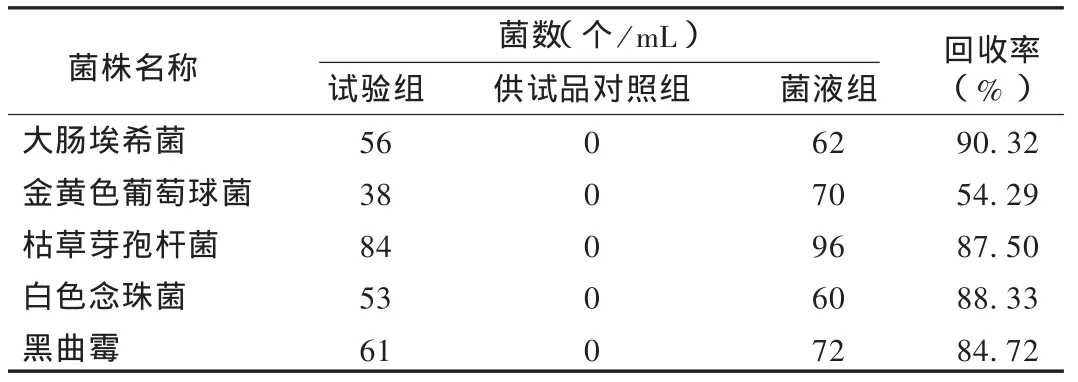
表3 正伤止痛贴膏常规法菌回收率测定结果(n=2)
稀释法:取1∶10的供试液1 mL,按0.5 mL/皿与0.2 mL/皿接种量,同时加入试验菌50~100 CFU,采用培养基稀释法进行金黄色葡萄球菌回收率测定,每组平行2份测定其菌数。结果金黄色葡萄球菌接种量为0.5 mL/皿时,试验组、对照组、菌液组菌数分别为38,0,70个/mL,回收率为54.29%;接种量为0.2 mL/皿时,试验组、供试品对照组、菌液组菌数分别为84,0,88个/mL,回收率为95.45%。可见,可采用稀释法(0.2 mL/皿)对样品进行细菌数测定。
2.3.2 控制菌验证
验证方法同2.2.2项下方法,结果与伤湿止痛贴膏控制菌验证试验结果相同(表2)。
3 讨论
按2005年版《中国药典(一部)》附录微生物限度检查法进行检验,本品可采用培养基稀释法(0.2 mL/皿)进行细菌数检查,采用常规法进行霉菌和酵母菌数检查,采用常规法进行控制菌检查。
因橡胶膏剂制备过程中常用溶剂有汽油、正己烷,材料为橡胶、松香、松香衍生物、凡士林、羊毛脂等,试验中不易找到可使背衬层与药物贴库层、粘胶层分离的适宜溶剂,故选用pH=7.0的无菌氯化钠-蛋白胨缓冲液,通过振荡可使大部分药物贴库层中可能存在的菌体沉降入水相中。验证试验结果表明,各菌回收率均大于70%,方法可靠。巴布膏剂常用的材料有聚丙烯酸钠、羧甲基纤维素钠、明胶、甘油和微粉硅胶等亲水性基质,制备过程用pH=7.0的无菌氯化钠-蛋白胨缓冲液振荡30 min,粘胶层迅速膨胀并有小碎片掉落,故考虑振荡时间应在30 min以内。另外,巴布膏剂因系中药熬制,若有抑菌作用,其供试液也可用稀释法或薄膜法进行验证。
药典收载品种和非药典收载品种的贴膏剂面积、规格不同,建议取样量为100 cm2大小溶于100 mL稀释液,结果以10 cm2为单位报告。若以每贴为单位报告,可取2贴溶于200 mL稀释液,吸取10 mL,采用薄膜法过滤,取滤膜贴与相应的培养基计数结果乘以10,即为每贴含菌量。另外,建议限度标准可规定每10 cm2中细菌数不得过100 CFU,霉菌数不得过10 CFU,不得检出金黄色葡萄球菌和铜绿假单胞菌,也可折算后按每贴报告。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:93-101.
[2]任安民,李秋菲,绳金房,等.注射剂无菌检查的方法学验证试验[J].西北药学杂志,2009,24(1):51-52.
[3]李秋菲,唐振宏,徐长根,等.5中外用制剂微生物限度检查法中菌落计数方法验证[J]. 中国药业,2008,17(22):39.
[4]应国红,邓 颖,冯丰凑,等.外用制剂微生物限度检查方法研究[J〛.中国药业,2008,17(21):32-33.
