人脐静脉内皮细胞分离培养及鉴定技术
2010-05-30吴金义张秀英曲丽梅
吴金义,张 蕾*,张秀英,曲丽梅
(1.吉林大学中日联谊医院心内科,吉林长春130033;2.吉林大学基础医学院;3.吉林大学第一医院病理科)
血管内皮细胞是一种多功能细胞,它不仅是血液和组织间物质交换的选择性通透屏障,而且在造血调控、血管动力学、血管生成、炎症和免疫应答等许多方面有十分重要的作用[1]。血管内皮细胞是通过合成和分泌多种生物活性皮物质,参与机体多种病理生理过程,并成为动脉粥样硬化等心血管疾病、炎症等的靶点。血管内皮细胞损伤或激活产生机能障碍可表现为血管收缩、血压增高、血栓形成、动脉粥样硬化及管腔狭窄、闭塞等。因此,成功分离和培养血管内皮细胞,为心脑血管等疾病的研究提供了细胞学基础。本实验参考Jaffe法,并进行改进,建立HUVEC体外分离原代培养的方法,并总结对培养的细胞鉴定方法,为多学科多种疾病病理生理机制的研究提供了基础。
1 材料与方法
1.1 实验材料 脐带:吉林大学第二医院妇产科;0.25%胰蛋白酶(Difco);血清(武汉大学)M199培养基(GIBCO);IMDM培养基(GIBCO);鼠抗人VIII因子单克隆抗体(Santa Cruz);辣根酶标记的二抗(北京中杉金桥生物技术有限公司)。
1.2 实验方法
1.2.1 HUVECs分离、培养 本实验参考Jaffe法,并进行改进,应用胰蛋白酶灌注脐静脉收集内皮细胞.在无菌条件下于健康产妇分娩后立即取新生儿脐带,挤出脐带血管中的血液,放入装有含青链霉素的PBS液瓶中,2 h之内行脐静脉内皮细胞培养。在无菌条件下取新生儿脐带,剪去钳痕和凝血块阻塞部分,找到脐静脉。一端插上带有胶管的玻璃管结扎固定,经胶管接注射器,用生理盐水灌洗。待脐静脉内的残血除净后,用37℃PBS(0.01 molL,pH7.6),冲洗两次,将另一端用铁夹夹闭,向脐静脉内灌注0.25%胰蛋白酶(Difco)8-10 ml,夹闭胶管放入已灭菌的大平皿中。37℃孵育12 min,在此期间经常翻动脐带使酶溶液在血管内流动以促使内皮细胞均匀与酶接触。取出脐带后轻轻挤压管壁,将含有内皮细胞的胰蛋白酶注入50 ml锥形离心管中,加入小牛血清2 ml终止酶反应。再以30 ml PBS冲洗管腔,流出液一并入离心管,1 000 r/min离心10 min,弃上清,加入含有10%小牛血清的IMDM(Gibco)培养液,充分混合制成细胞悬液。取0.1ml细胞悬液在血细胞计数板计数。最后调细胞数,以1×105/ml接种至24孔培养板中,每孔1ml。置于 5%CO2,37℃静止培养24 h更换培养液,以除去未贴壁的细胞。以后每隔2 d换液1次,以维持细胞的营养和内环境的稳定。
1.2.2 HUVECs传代 原代内皮细胞融合后用培养液冲洗两次,然后用0.25%胰酶和0.25%ETDA1∶1充分混匀后加入到内皮细胞中,每孔0.3 ml。边消化边在倒置显微镜下观察。细胞皱缩、彼此分离或呈大片状分离即可终止消化。加入含有10%小牛血清的培养液,吸管吹打,制成细胞悬液,计数后按105个细胞/ml,继续培养。
1.2.3 培养HUVECs的三种方法鉴定 本实验应用Olympus倒置显微镜对细胞形态及生长情况进行观察;透射电镜下观察培养的内皮细胞超微结构的透射电镜观察;人脐静脉内皮细胞第VIII因子相关抗原的SP免疫组织化学染色法检测相关抗原。
2 结果
2.1 形态学观察 培养过程中用Olympus倒置显微镜对细胞形态及生长情况进行观察(如图1)。早期细胞呈小多角、球形、呈团状,少数细胞伸展,24 h后可见细胞贴壁,48-72 h生长最快,逐渐生长成梭形,有些细胞排列呈鱼贯状相连,间有旋祸状排列。核清晰,呈圆形或椭圆形,核分裂相多见,1-2核仁,胞浆丰富。于3-4 d后融合,7-10 d胞体呈多角形,相互嵌合,为单层呈铺路石状排列。
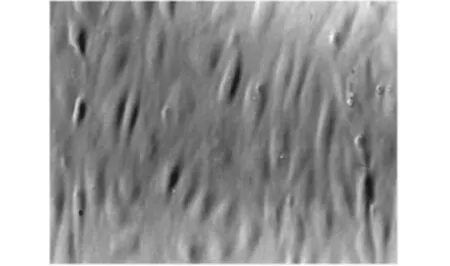
图1 HUVECs形态观察:单层铺路石样排列
2.2 人脐静脉内皮细胞超微结构的透射电镜观察
透射电镜下观察培养的内皮细胞,可见细胞呈多角形,表面有胞浆突起形成的细绒毛。有较多的胞浆空泡,有丰富的线粒体、核糖体、粗面内质网、高尔基复合体及溶酶体。胞浆内还有作用为人内皮细胞特征性标志的Weibel-Palade小体(W-P小体),其横切面呈圆形或椭圆形,纵切面呈杆状,均可见小管状结构(图2)。
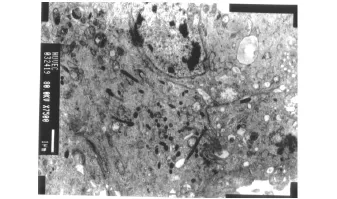
图2 HUVECs超微结构,典型 Weibel-Palade小体
2.3 内皮细胞中人第VIII因子相关抗原的检测[2]
人脐静脉内皮细胞第VIII因子相关抗原的SP免疫组织化学染色法可见细胞呈圆形、梭形或多边形,胞浆丰富,并有棕黄色的染色颗粒,即为阳性反应,证实培养的细胞为内皮细胞。对照组细胞为阴性结果 。(图 3)
2.4 HUVECs各阶段生长状况(图4-6)
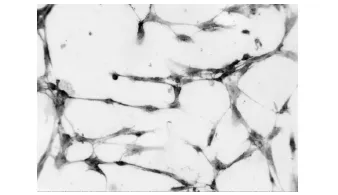
图3 FⅧAg强阳性
图4 第2天脐静脉内皮细胞培养结果
3 讨论

图5 第4天脐静脉内皮细胞培养结果
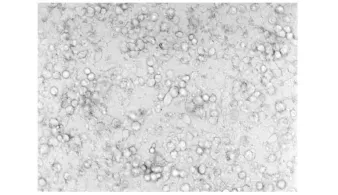
图6 第7天脐静脉内皮细胞培养结果
人脐静脉作为培养血管内皮细胞的来源,是因为它具有取材、操作方便,技术较成熟,获得细胞数多,为心脑血管疾病病理生理机制的研究提供了方便。在培养细胞的获取方法上,有机械刮取、组织块移植和酶消化法三种。机械刮取法即将脐静脉沿纵轴剪开,用消毒手术刀背等刮取ECs,发现这一种方法不是因为刮得太轻取得的细胞数太少,就是过度刮取导致含有较多其它非内皮细胞成分,需进一步纯化,或损伤细胞,导致存活率不高。灌注消化法因为消化时间难于掌握,不是因为消化时间过短取得的细胞数太少,就是消化过度致使细胞存活率低,因此,这两种方法均难于获得满意效果[3]。现在大多数学者在研究中应用胰蛋白酶灌注脐静脉收集内皮细胞,接种后很快贴壁生长。我们经过多次实验比较,以0.25%的胰酶、作用8 min及温度为37℃为最佳条件。如果温度过高,时间过长都会增加纤维母细胞和平滑肌细胞脱落混入内皮细胞以及内皮细胞成活率低。取材要新鲜,保存时间以6 h之内为好,超过6 h时间会使细胞存活率降低。有研究表明[4]人脐带静脉离体后,随着时间的延长,内皮细胞某些物质的含量会发生变化,离体超过6 h,内皮细胞Ⅷ因子相关抗原释放量以及前列环素生成量均随放置时间延长而呈下降超势,变化显著,且脐带离体时间与细胞成活率是负相关。培养液的pH值是影响细胞生长的因素之一,内皮细胞生长的最适pH值为7.2-7.4,初期培养液的pH值宜稍低(pH7.0左右),这样细胞易贴壁和生长。培养液中需加一定浓度的血清。原因可能是血液在凝固过程中血小板聚集时所释放的各种因子有刺激内皮细胞生长的作用,尤其是血小板能够释放一种血小板衍生因子,促进内皮细胞的生长繁殖。血清的质量也很重要,培养液用于培养细胞时,必须附加一定量的血清,否则细胞贴壁伸展能力较弱,贴壁细胞繁殖速度慢,且以后多悬浮、死亡,我们的经验是进口胎牛血清培养的细胞成长好,成功率高。关于内皮细胞的鉴定,WebelER等在1964年研究发现动脉内皮细胞浆中有杆状多管小体,Jaffe和Gimbrene等提出内皮细胞鉴定法的根据是:①相差显微镜下,细胞呈多角形,单层铺路石状排列,或短梭形细胞呈鱼贯样排列。②荧光抗体法证明胞浆中有VWF因子。③透射电镜下,胞浆内有Weibel-palade小体。结果符合上述鉴定标准,可确定为内皮细胞。Jaffe[5]进一步研究认为VWF相关抗原免疫荧光检测最为可靠,因为在人体内,除内皮细胞外,仅在血小板和巨核细胞中存在因子VWF相关抗原,故可与血管平滑肌和成纤维细胞相鉴别。至于Weibel-palabe小体在胞浆中检出,固然对内皮细胞鉴定具有特异性,但并非每个细胞皆能检出,故意义不大。总之,我们综合了上述多个学者的经验成功培养出脐静脉内皮细胞并进行多个鉴定方法的尝试,为血管内皮细胞的研究提供了实验模型。最新研究发现[6],血管内皮细胞生长因子和碱性成纤维细胞生长因子等有助于培养的胚胎干细胞分化为内皮细胞,胚胎干细胞有望成为新的种子细胞来源。
[1]Oruckaptan HH,Senmevsim O,Ozcan OE,et al.Pituitary adenomas results of 684 surgically treated patients and review of the literature[J].Surg Neurol,2000,53(3):211.
[2]李孟彬,王为忠,张宏伟,等.猪血管内皮细胞的培养与表型鉴定[J].第四军医大学学报,2004,25(24):45.
[3]Gomez DE,Alonso DF,Yoshiji H,etal.Tissue inhibitors of metal-proteinases structure,regulation and biological functions[J].Eur J Cell Boil,1997,74:111.
[4]王建民,刘萌秋,赖西南.正常脐静脉离体后不同时间内某些物质含量的变化[J].第三军医大学学报,1995,17:86.
[5]Jaffe EA.Synthesis of antibemophilic factor antigen by cultured humanendothelialcells[J].J Clin Invest,1973,52:2757.
[6]Savore C,Zhang C,MuirC,et al.Perlecan Knockdown inmetastatic prostate cancer cells reduces heparin-binding growth factor responses in vitro and tumor growth in vivo[J].Clin ExpMetastasis,2005,22(5):377.
