单宁酸对高糖及AGEs引起肾小球系膜细胞增殖和Ⅳ型胶原生成的影响
2010-05-30魏海峰魏雁虹苗春生
魏海峰,李 才,魏雁虹,刘 辉,孙 波,苗春生
(1.吉林大学药学院实验药理与毒理学教研室,吉林长春130021;2.长春中医药大学附属医院;3.吉林省人民医院检验科)
本研究拟观察高糖及糖基化终末产物(AGEs)环境对肾小球系膜细胞(GMC)的增殖能力和细胞培养上清中Ⅳ型胶原含量的变化,以及具有调节糖脂代谢、抗氧化等功能的单宁酸对此作用的影响,探讨延缓肾小球硬化的作用机制。
1 材料与方法
1.1 试剂与仪器 大鼠肾小球系膜细胞株,由吉林大学病理生理学教研室惠赠。单宁酸(TA,Sigma),分子式C76H52O46,分子量1701。氨基胍(AG,Sigma),牛血清白蛋白(BSA,组分Ⅴ)。DMEM 培养基(Gibco),小牛血清(FBS,天津灏洋生物技术有限公司),胰蛋白酶(Gibco),MTT(Sigma),兔抗大鼠Ⅳ型胶原(Santa Cruz),过氧化物酶标记的羊抗兔IgG(武汉博士德)。CO2培养箱(SHEL-LAB),XSB-1A倒置生物显微镜,DG5031型酶联免疫检测仪,RF-540型荧光分光光度计。
1.2 实验方法
1.2.1 AGEs的制备 将牛血清白蛋白(组分Ⅴ)10 mg/ml,葡萄糖 0.5 mol/L,EDTA 1 mmol/L,青霉素100 u/ml,链霉素 100 μ g/ml,溶于 pH 7.2 PBS,过滤除菌,37℃恒温箱避光孵育2个月,透析除糖后制备糖化牛血清白蛋白(AGEs)。同样条件下孵育不含葡萄糖的牛血清白蛋白(BSA)作为阴性对照,荧光分光光度计测定AGEs和BSA含量分别为28.7和4.3任意荧光单位。
1.2.2 细胞培养及实验分组 将大鼠肾小球系膜细胞株接种于含10%FBS的DMEM低糖培养基中,37℃,5%CO2及饱和湿度条件下培养,待细胞生长至亚融合状态时,更换为含0.5%FBS的DMEM低糖培养基继续培养24 h,使细胞同步化。然后将细胞分为正常对照组(含5.6 mmol/L D-葡萄糖)、高糖组(含30 mmol/L D-葡萄糖)、甘露醇组(含25 mmol/L甘露醇)、AGEs及BSA组:将AGEs或 BSA加入低糖DMEM培养液中,使AGEs及BSA终浓度均为0、25、50、100、200、400 mg/L。药物处理组:在高糖或AGEs处理的同时加入药物,单宁酸分为10、20、40及80 μ mol/L四个浓度组,氨基胍(AG)作为阳性对照药 ,终浓度为 250 μ mmol/L 。
1.2.3 GMC增殖的检测 将同步化的细胞密度调整至1×103个/孔,以 100 μ l/孔接种于 96孔培养板,按上述分组进行处理,每组设6个复孔。在培养相应时间段(24、48 h)后取出细胞培养板,在倒置显微镜下观察,每孔加入MTT溶液 20 μ l/孔,于 37℃、5%CO2培养箱中孵育4 h,终止培养,小心吸弃孔内培养上清液,加入DMSO液 150 μ l/孔,室温下将96孔板置于微孔板振荡器上振荡10 min。利用酶标仪在波长490 nm处测定各孔吸光度(A)。
1.2.4 ELISA法检测GMC培养上清中Ⅳ型胶原的水平 取对数生长期的细胞,以2×104个/孔接种至24孔培养板中,细胞贴壁后,无血清饥饿24 h,使同步化,然后加入各条件培养液继续培养48 h,收集培养上清,-20℃保存备用。ELISA具体方法:将条件培养基和包被液按一定比例加入到96孔酶标板中,100 μ l/孔,4℃过夜。吸出上清液,加入封闭液200 μ l/孔 ,37℃孵育 1.5 h。加入 100 μ l稀释的第一抗体(1∶1000),37 ℃孵育2 h。加入100 μ l稀释的第二抗体(1∶2000),37 ℃孵育1.5 h。加入100 μ l DAB显色液,室温避光3-5 min,终止液终止反应。于酶标仪490 nm波长处测定每孔的吸光度(A)。
2 结果
2.1 不同浓度单宁酸对高糖环境下GMC增殖和Ⅳ型胶原生成的影响
见表1。甘露醇组与对照组无明显差别,数据未在下表列出。
表1 单宁酸对高糖环境下GMC增殖的影响和培养上清中Ⅳ型胶原的含量(±s,n=6)
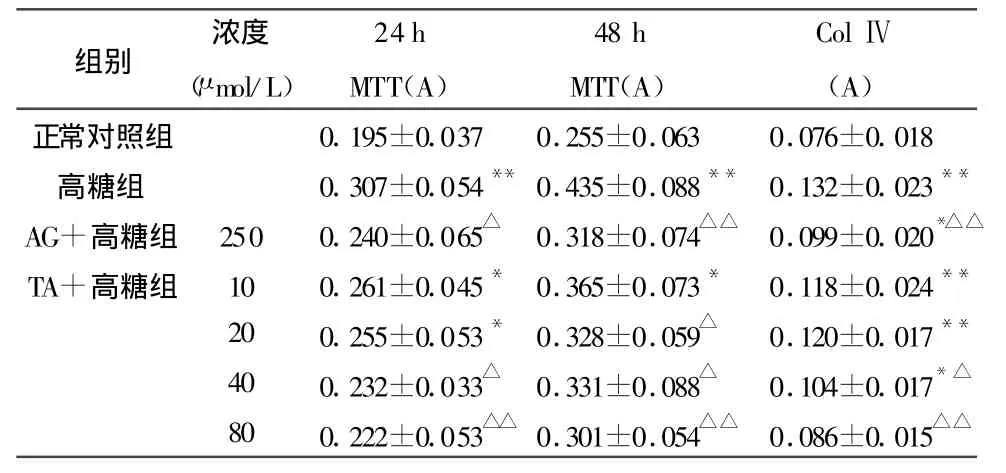
表1 单宁酸对高糖环境下GMC增殖的影响和培养上清中Ⅳ型胶原的含量(±s,n=6)
注:与正常对照组比较,*P<0.05,**P<0.01;与高糖组比较,△P<0.05,△△P<0.01
正常对照组 0.195±0.037 0.255±0.063 0.076±0.018高糖组 0.307±0.054**0.435±0.088** 0.132±0.023**AG+高糖组 250 0.240±0.065△ 0.318±0.074△△ 0.099±0.020*△△TA+高糖组 10 0.261±0.045* 0.365±0.073* 0.118±0.024**20 0.255±0.053* 0.328±0.059△ 0.120±0.017**40 0.232±0.033△ 0.331±0.088△ 0.104±0.017*△80 0.222±0.053△△ 0.301±0.054△△ 0.086±0.015△△
2.2 不同浓度AGEs对GMC增殖和Ⅳ型胶原生成的影响
用AGEs(50-200 mg/L)处理后可明显刺激GMC增殖和促进细胞外Ⅳ型胶原生成,与相同浓度的BSA组比较,差异具有显著性意义,见图1、图2。其中200 mg/L AGEs刺激细胞增殖和Ⅳ型胶原生成的作用均明显(P<0.01),400 mg/L AGEs刺激细胞增殖的作用有所降低,但仍可明显促进Ⅳ型胶原生成(P<0.01)。因此,在下面研究中选用200 mg/L AGEs这一浓度。
2.3 不同浓度单宁酸对AGEs所致GMC增殖和Ⅳ型胶原生成的影响
与不含药物的AGEs组比较,单宁酸(20、40、80 μ mol/L)可明显抑制AGEs(200 mg/L)引起的GMC增殖,以 40 μ mol/L单宁酸的作用最为显著(P<0.01)。10 μ mol/L单宁酸即能明显减少AGEs诱导Ⅳ型胶原的生成,20、40和 80 μ mol/L单宁酸能使Ⅳ型胶原生成进一步降低,与BSA组比较无显著差别,结果见表2。
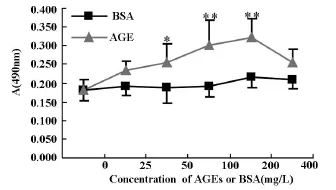
图1 不同浓度AGEs对GMC增殖的影响(±s,n=6)
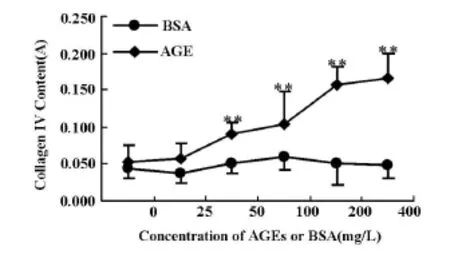
图2 不同浓度AGEs对Ⅳ型胶原生成的影响(±s,n=6)
表2 单宁酸对AGEs所致GMC增殖的影响和培养上清中Ⅳ型胶原的含量(±s,n=6)
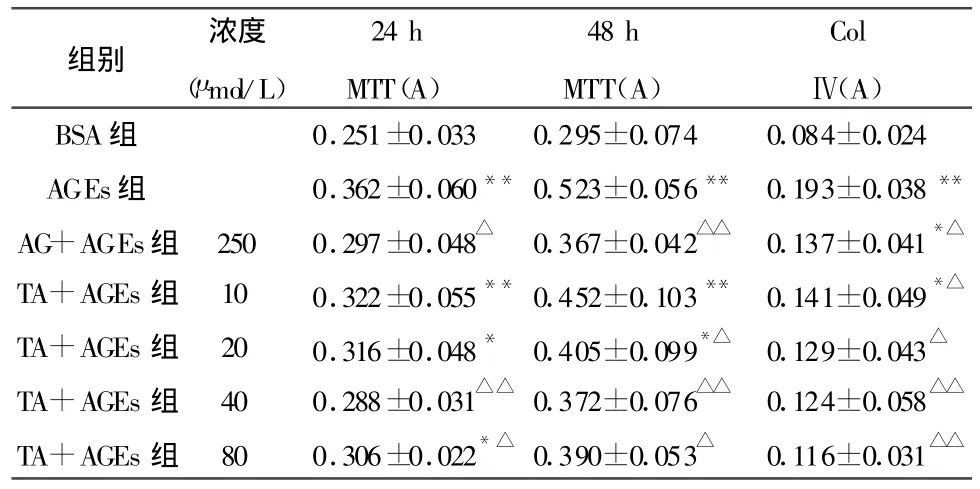
表2 单宁酸对AGEs所致GMC增殖的影响和培养上清中Ⅳ型胶原的含量(±s,n=6)
注:与 BSA组比较,*P<0.05,**P<0.01;与 AGEs组比较,△P<0.05,△△P<0.01
组别 浓度(μ mol/L)24 h MTT(A)48 h MTT(A)ColⅣ(A)BSA组 0.251±0.033 0.295±0.074 0.084±0.024 AGEs组 0.362±0.060**0.523±0.056** 0.193±0.038**AG+AGEs组 250 0.297±0.048△ 0.367±0.042△△ 0.137±0.041*△TA+AGEs组 10 0.322±0.055**0.452±0.103** 0.141±0.049*△TA+AGEs组 20 0.316±0.048* 0.405±0.099*△ 0.129±0.043△TA+AGEs组 40 0.288±0.031△△ 0.372±0.076△△ 0.124±0.058△△TA+AGEs组 80 0.306±0.022*△ 0.390±0.053△ 0.116±0.031△△
3 讨论
在正常情况下,体外培养的GMC增殖能力和分泌ECM的能力很弱,在一定刺激因素的作用下GMC的生物学行为发生改变。有研究表明,10 mmol/L以上的高浓度葡萄糖可以促进GMC增殖和胶原生成[1],其增殖效应可能与各种生长因子及炎症因子的介导及一些信号通路的激活有关[2-4]。本研究选用30 mmol/L的葡萄糖作用于GMC,在24、48 h时间段观察GMC的变化。研究结果显示,同正常对照组相比,高糖诱导24h和48 h后,GMC增殖显著增加,Ⅳ型胶原生成增多,甘露醇组细胞未见明显变化。本研究再次证明高糖可以促进GMC的增殖以及ECM成分的积聚。
在持续高血糖状态下,葡萄糖及其代谢产物与多种蛋白质发生的非酶促糖基化反应形成不可逆的AGEs,这种蛋白质抑制ECM酶降解,使肾小球基底膜成分交联增多,使蛋白更易透过滤过膜,滤过的白蛋白堆积在系膜区可促进系膜细胞增殖及导致ECM积聚。AGEs的积聚与DN的肾组织损伤、肾功能改变有密切关系。本研究检测了不同浓度AGEs作用于GMC,发现AGEs可明显刺激GMC的增殖和促进细胞外Ⅳ型胶原的生成,并且基本上呈浓度依赖性。在无糖的情况下,AGEs可单独引起GMC的病理改变,且与高糖的作用相似,提示AGEs的形成与高血糖在DN的发病中扮演同样重要的角色。AGEs通过形成交联与受体相互作用,诱导一系列细胞因子的释放和ECM的产生及增加氧化应激来发挥多种生物学效应,因此,通过减少AGEs的生成或应用特异性AGEs抑制剂、抗氧化剂阻止AGEs的不利作用可以缓解AGEs引起的组织或细胞损伤,延缓DN的发生发展。
单宁酸又称为鞣酸、鞣质,广泛存在于植物界,约70%以上的中草药及茶叶、某些食物中均含有此类化合物。研究表明,单宁酸具有抗炎、抗氧化、降低血糖、血压,调整脂代谢等多种作用[5,6]。Tikoo等[7]研究显示,单宁酸可改善糖尿病大鼠的一般状况及肾功能。本研究组应用单宁酸治疗糖尿病大鼠10周,电镜下观察治疗组糖尿病大鼠肾脏肾小球基底膜增厚情况明显减轻,系膜细胞及基质未见明显增多(另文发表)。本次体外实验观察到单宁酸能明显抑制高糖或AGEs引起的GMC增殖,减少Ⅳ型胶原的生成,并呈一定浓度依赖性,与体内实验的结果一致。我们推测单宁酸的这种作用可能是通过改善细胞内环境,抑制了细胞内的非酶糖基化、氧化应激、炎症因子等的表达而实现的。因此,深入研究单宁酸调节系膜细胞增殖和胶原生成的机制,可能为糖尿病肾病的防治提供有用的药物。
[1]张 艳,关广聚,陈 兵,等.酶酚酸酯对高糖所致大鼠肾小球系膜细胞增殖的影响[J].山东大学学报(医学版),2006,44(7):718.
[2]Nakajima T,Hasegawa G,Kamiuchi K,et al.Differential regulation of int racellular redox state by ext racellular mat rix proteins in glomerular mesangial cells:Potential role in diabetic nephropathy[J].Redox Rep,2006,11(5):223.
[3]Mora C,Navarro JF.Inflammation and diabetic nephropathy[J].Curr Diab Rep,2006,6(6):463.
[4]Tuttle KR,et al.Linking Metabolismand Immunology:Diabetic Nephropathy Is an Inflammatory Disease[J].Am Soc ephrol,2005,16(6):1537.
[5]沈忠明,殷建伟,袁海波,等.虎杖鞣质的降血糖作用研究[J].天然产物研究与开发,2004,16(3):220.
[6]姚思宇,赵 鹏,等.鞣质降血脂作用的动物实验研究[J].中国热带医学,2004,4(6):945.
[7]Chandak PG,Gaikwad AB,Tikoo K et al.Gallotannin ameliorates the development of streptozotocin-induced diabetic nephropathy by preventing the Activation of PARP[J].Phytother Res,2009,23(1):72.
