水通道AQP2在多囊肾上皮中的表达及意义
2010-05-30杨龙飞宗敏茹何成彦冯学超
杨龙飞,朱 娜,宗敏茹,何成彦,冯学超*
(1.东北师范大学膜通道实验室,吉林 长春130024;2.吉林大学中日联谊医院,吉林 长春130033)
多囊肾病(Polycystic kidney disease,PKD)是一种常见的严重危害人类健康的遗传疾病,以双侧肾脏肾小管形成多个进行性增大的囊肿为主要特征,是终末期肾衰的主要原因之一[1]。研究证明,多囊肾形成过程中,涉及囊腔液中cAMP浓度异常增高、cAMP依附的氯离子等通道持续开放Cl-、Na+和水分子向囊肿内持续过程,造成积液增多和囊肿不断增大[2-4]。进而使肾脏体积增大并压迫肾实质,造多钱成肾功能损害,由此可见,在多囊肾形成过程中,水分子持续跨膜转运具用重要作用。
为了研究水通道蛋白2(AQP2)在多囊肾形成中的作用,本文对水通道蛋白AQP2在多囊肾囊肿上皮中表达情况进行研究,为确定水通道是否参与多囊肾的形成过程及其在该过程中的作用奠定基础,同时也为多囊肾疾病提供新的分子机理。
1 材料与方法
1.1 材料
1.1.1 试剂 总 RNA提取试剂盒(RNeasy micro kit,QIAGEN)、First strand cDNA amplification kit(Invitrogen)、核酸分子量标准品(λ-Hind Ⅲ +φ X174-HaeⅢdigest,TaKaRa),兔抗人水通道AQP2抗体(Santa)为一抗,辣根过氧化酶标记的羊抗兔抗体(HRPGoat Anti-rabbit IgG)(Sigma)为二抗。
1.1.2 设备 Legend Micro 17R高速冷冻离心机(Sorvall,美国)、DU640分光光度计(Beckman Culture,美国)、PTC100 PCR仪(MJ Reseach,Inc.,美国)、FluorChem HD2凝胶成像分析系统(Alpha Innotech,,美国)、LEICA SM 2000R 切片机(leica,德国)、T10高速组织匀浆器(IKA,德国)。
1.1.3 标本 多囊肾组织和分离的单个囊肿来自临床上接受肾移植或由于并发症而部分或全部切除的病肾,阴性对照取自肝病患者手术切除的病灶旁组织,阳性对照取自非多囊肾肾病患者手术切除的病灶旁组织,所有标本的取得事先均征得患者同意。
1.2 方法
1.2.1 细胞总RNA提取 在显微镜下分离足够数量的肾囊肿,然后用高速组织匀浆器进行匀浆,用RNA提取试剂盒提取总RNA。1%非变性琼脂糖凝胶,电泳后,经溴化乙锭染色,凝胶成相仪扫描后观察结果。
1.2.2 RT-PCR检测 将上述所得RNA用逆转录试剂盒合成cDNA。以此cDNA为模板,用人AQP2特异性引物对cDNA进行PCR扩增,AQP2引物序列为:forward 5′-AGCTGGTGCTCTGCATCTTCG-3′,reverse 5′-AGGCTCTTGGCTGGCGGAAAC-3′。 扩 增 产 物 为cDNA 3'端约300 bp大小的片段。RT-PCR产物通过琼脂糖凝胶电泳分离检验,用同样方法检测阴性对照和阳性对照。
1.2.3 免疫组织化学分析 将新鲜囊肿组织放入10%中性甲醛中固定24 h,然后按常规方法脱水、透明、浸蜡、包埋、切片并用一抗及二抗进行免疫染色,最后进行封片镜检。
2 结果
2.1 细胞总RNA提取 将提取的囊肿组织总RNA用1%非变性琼脂糖凝胶电泳进行检测,电泳结果显示RNA是完整未降解(28S、18S和5S核糖体RNA泳带均清晰,未见降解)(图1A)。其260 nm和280 nm吸光度的比值OD260/280为1.96,表明提取的RNA纯度较高,可用于cDNA合成。
2.2 囊肿组织中水通道的表达 应用人AQP2特异性引物对新鲜囊中组织进行RT-PCR分析,以肝脏组织为阴性对照,以非多囊肾肾组织为阳性对照,结果发现在水通道AQP2在囊肿中表达较高(图1B);免疫组织化学结果也显示AQP2在囊肿组织上皮中高表达,尤其值得注意的是:AQP2在上皮细胞近囊腔侧膜的表达水平明显高于胞浆(图2A、2B)。
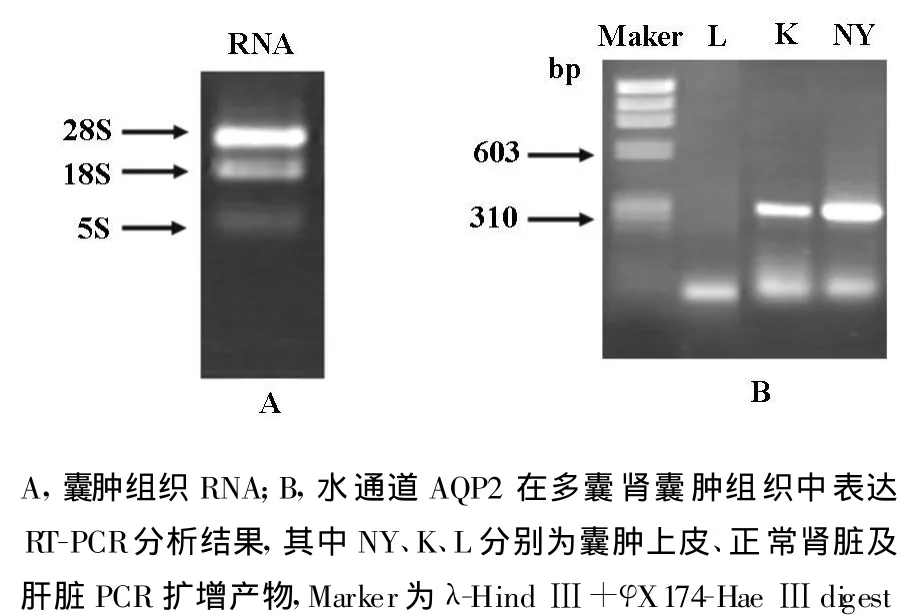
图1 水通道AQP2在多囊肾囊肿上皮中表达的RT-PCR分析结果
3 讨论
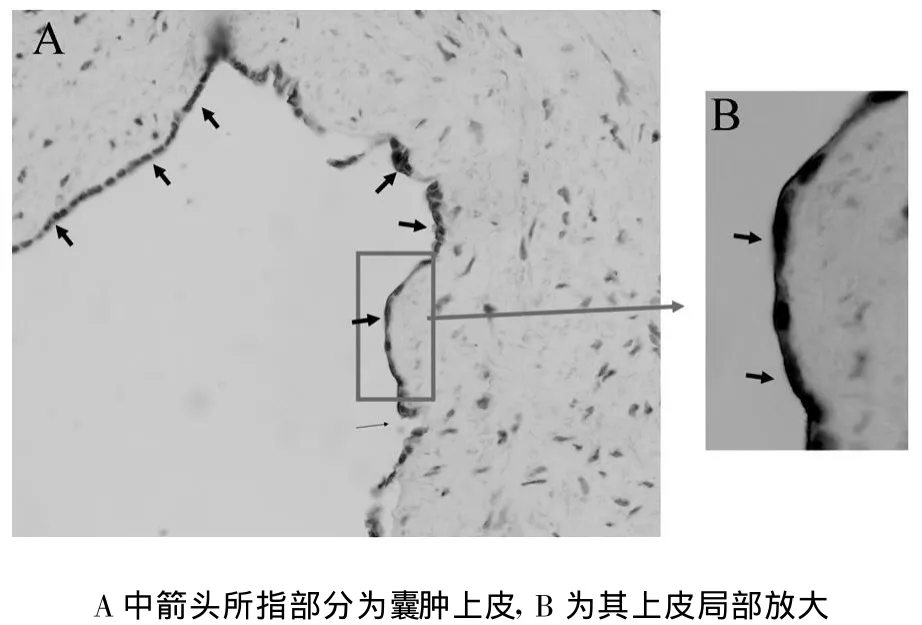
图2 水通道AQP2在多囊肾囊肿上皮中表达的免疫组织化分析结果
水通道蛋白广泛表达于与体液分泌和吸收密切相关组织的多种上皮和内皮细胞膜上,参与多种生理病理过程。正常肾脏中,水通道AQP2主要表达于集合管上皮细胞内囊泡膜上[5],本研究发现水通道AQP2高表达在源于肾小管的囊肿上皮细胞上,提示AQP2可能参与多囊肾的形成过程,深入研究AQP2在多囊肾形成中的作用,可能为多囊肾疾病形成的分子机理提供了新的内容。
在正常情况下,肾脏中集合管上皮细胞的管腔侧膜及近管腔侧的胞浆囊泡内的AQP2主要受血管加压素的调节,通过穿梭机制参与尿液水分的重吸收,维持机体水分平衡[6,7]。在此过程中,血管加压素激活V2受体而产生第二信使cAMP是AQP2功能的直接调控因素。因此,多囊肾囊腔中异常高浓度的cAMP也可能参与囊腔中AQP2功能调节。本研究发现AQP2在上皮细胞近囊腔侧膜的表达水平明显高于胞浆的事实也间接证明多囊肾囊腔中的cAMP参与囊腔AQP2功能调节。
[1]Wilson PD.Polycystic kidney disease[J].N Engl J Med,2004,350:151.
[2]Morales MM,Falkenstein D,Lopes AG.The cystic fibrosis transmembrane regulator(CFTR)in the kidney[J].An Acad Bras Ci,2000,72(3):399.
[3]Grantham JJ,Ye M,Gattone II VH,et al.In vitro fluid secretion by epithelium from polysystic kidneys[J].J Clin Invest,1995,95:195.
[4]Yamaguchi T,Pelling JC,Ramaswamy NT,et al.cAMP stimulates the in vitro proliferation of ranal cyst epithelial cells by activation the extracellular signal-regulated kinase pathway[J].Kidney Int,2000;,57:1460.
[5]Fushimi K,F Marumo.Water channels[J].Curr Opin Nephrol Hyper,1995,4:392.
[6]Umenishi F,Verbavatz JM,VerkmanAS.cAMP regulated membrane diffusion of a green fluorescent protein-aquaporin 2 chimera[J].Biophys J,2000,78(2):1024.
[7]Brown D,Katsura T,Gustafson CE.Cellularmechanisms of aquaporin trafficking[J].Am J Physiol,1998,275(3 Pt 2):F328.
