GRIN2B启动子区多态性与散发性阿尔茨海默病关系的功能学分析
2010-05-30江汉秋张晓君马中华贾建平
江汉秋,张晓君,刘 瑾,马中华,贾建平
(1.首都医科大学附属北京同仁医院神经内科,北京100073;2.北京健宫医院神经内科,北京100053;3.首都医科大学宣武医院 神经内科,北京100053)
N-甲基-D-天冬氨酸受体2B(N-methyl-D-aspartate receptor 2B,NR2B)是 N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体的重要亚基,其结构中包含谷氨酸与NMDA受体结合的位点[1],被认为是NMDA受体发挥药理学、电生理学及行为学作用的主要亚基。在之前的研究中,我们发现中国北方汉族人群GRIN2B基因近似启动子区共存在4个变异位 点,为分 别 为-200T/G(rs1019385)、-421C/A(rs3764028)、-1447T/C(ENS10557853)和-1497G/A(rs12368476),并通过对362例SAD患者和334例健康老年人的遗传学分析得出,-421C/A多态性与AD发病有明显的相关性。为此,本研究预从功能学角度进一步探讨GRIN2B启动子区变异与SAD的发病关系。
1 材料与方法
1.1 构建报告基因质粒
1.1.1 基因重组 我们用Primer Premier 5软件设计引物,两端分别加入KpnⅠ和NheⅠ识别序列及相应保护碱基。引物序列为:
上游:5'-GGGGTACCAACTGCAAACCTGCCCGATA-3'
下游:5'-CTAGCTAGCACCCTTGACGAGCACTCTC-3'
其中GGTACC为KpnⅠ内切酶的酶切序列,GCTAGC为NheⅠ内切酶的酶切序列。
以本课题组之前研究证实含有-200T/-421C/-1447T/-1497G和-200G/-421A/-1447C/-1497A单体型的纯合子基因组DNA为模板,进行GRIN2B启动子片段PCR扩增(共1798 bp)。反应体系为:DDH2O 32.4 μ l,10 ×缓冲液 5.0 μ l,MgCl2(2 5mM)3.0 μ l,dNTP(10 mM)1.6 μ l,上 、下游引物(10 pmol/μ l)各 2.0 μ l,KOD Plus(1 U/μ l)2.0 μ l,模板 2.0 μ l;PCR 反应条件为:94℃预变性5 min,94℃30 s,68℃30 s,72℃2 min,共30循环,72℃再延伸7 min。获得的目的片段与pGL3-Basic质粒用KpnⅠ和NheⅠ分别双酶切,之后将全部的酶切产物按凝胶回收试剂盒操作说明进行DNA纯化、回收。按连接试剂盒操作说明进行载体DNA与插入DNA目的片段的连接。连接产物直接转化大肠杆菌DH-5α,后经菌落PCR及对极可能的阳性克隆扩增得到的菌液进行直接测序,鉴定得到的阳性克隆。按质粒提取试剂盒操作说明进行质粒提取,最后经双酶切及直接测序法进一步证实连接是否成功。
1.1.2 定点突变 由于我们需要对GRIN2B启动子区-200T/-421A/-1447T/-1497G单体型进行功能学研究,而在本实验的样本中,GRIN2B启动子不存在这样的纯合型个体,故我们应用QuickChange○R定点突变试剂盒经过一步法进行定点突变。定点突变所需引物为:
上游:5'-TTCCGTCCCCCTTCCATCC A CCTTACCACCCCACTTCC-3'
下游:5'-GGAAGTGGGGTGGTAAGG T GGATGGAAGGGGGACGG-3'
加框碱基为定点突变位点C→A,G→T。
PCR反应体系为:DDH2O 36.4 μ l,10×缓冲液5.0 μ l,dNTP(2.5 mM)1.0 μ l,上 、下游引物(100 ng/μ l)各 1.8 μ l,野生质粒(10 ng/μ l)4.0 μ l,pfuTurbo 酶(2.5 U/μ l)1.0 μ l。PCR反应条件为:95℃预变性 30 s,95℃30 s,55℃1 min,68℃8 min,共18个循环。向扩增后的PCR 产物中直接加1 μ l(10 U/μ l)DpnⅠ用于消化甲基化的野生型质粒。最后进行转化大肠杆菌、菌落PCR、测序及质粒提取等,得到突变质粒。
1.2 细胞培养、转染及报告基因检测
SH-SY5Y和HeLa细胞分别用含有10%和5%胎牛血清的DMEM培养基(已加入200 IU/ml青霉素和200 μ g/ml链霉素)进行培养。待细胞生长状态良好后,SH-SY5Y和HeLa细胞分别以4×104个/孔和1×104个/孔的密度铺96孔板,100 μ l/孔。细胞在96孔板生长24 h后,按照操作说明书用脂质体Lipofectamine 2000(Lipo2000)进行质粒转染。在此过程中,pGL3-Basic质粒作阴性对照,pGL3-Control质粒作阳性对照。当转染细胞在96孔板中培养48 h后,按照说明书操作,进行裂解细胞,用GloMaxTM96微孔荧光分析仪检测萤火虫荧光素酶活性(luciferase activity of firefly,LAF)及海肾荧光素酶活性(luciferase activity of renilla,LAR),并自动计算出RLA,记录所有数据。每次每种质粒至少铺孔6个,相同实验重复至少3次。
1.3 细胞干预
当细胞同前进行转染24 h后,将Na2S2O41 mM、H2O225 μ M 和 Aβ25-3515 μ M 最终工作浓度分别加入相应细胞孔中,剥夺血清则是用无血清DMEM培养基替换正常DMEM培养基。待各种干预因素作用24 h后,裂解细胞进行荧光素酶活性检测并计算RLA(同前)。同样每种质粒相同条件下每次铺孔至少6个,相同实验重复至少3次。
1.4 统计分析
2 结果
2.1 报告基因质粒的建立
利用基因重组和定点突变技术,我们成功构建了三种GRIN2B启动子报告基因质粒,分别为pGLTCTG(-200T/-421C/-1447T/-1497G)、pGL-TATG(-200T/-421A/-1447T/-1497G)和pGL-GACA(-200G/-421A/-1447C/-1497A)。
以pGL-TCTG为例,我们通过两端分别加有KpnⅠ和NheⅠ的引物扩增出基因型为-200T/-421C/-1447T/-1497G的GRIN2B启动子连接片段。经基因重组技术,扩增、提取出野生质粒。其中,菌落PCR电泳结果可初步证实极可能连接成功的阳性克隆(图1);双酶切进一步证实、鉴定阳性克隆(图2);最后经测序证实成功构建了pGL-TCTG质粒。

图1 菌落PCR电泳图
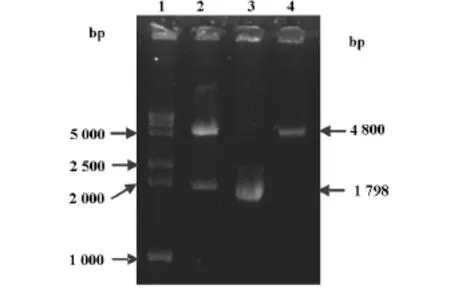
图2 阳性克隆双酶切电泳图
我们以pGL-TCTG为模板,经一步法PCR扩增突变体pGL-TATG,DpnⅠ消化PCR产物,酶切产物直接转化感受态细胞,提取质粒。测序证实目的突变点被成功引入(图3),且没有引入其它新的突变,即突变质粒构建成功。
2.2 不同单体型GRIN2B启动子转录效率的比较
通过对pGL-TCTG、pGL-GACA和pGL-TATG这三种GRIN2B启动子转录效率分析,两种细胞系的所有启动子转录活性在SH-SY5Y细胞中都较HeLa细胞高(表1、图4)。

图3 -421A型质粒突变成功测序图
瞬时转染SH-SY5Y和HeLa细胞后的报告基因检测结果显示:pGL-TCTG和pGL-GACA两者的RLA没有差异(SH-SY5Y细胞,pGL-TCTG:13.66±1.32,pGL-GACA:12.93±1.63,P=0.149;HeLa细胞,pGLTCTG:2.81±0.39,pGL-GACA:2.66±0.45,P=0.288)(表1、图4)。然而,我们检测到无论是在SHSY5Y还是在HeLa细胞中,pGL-TATG的转录活性与pGL-TCTG相比有显著性差异,转录活性约增加1.5-1.7倍(SH-SY5Y细胞,pGL-TATG:20.92±1.66,P=0.000;HeLa细胞,pGL-TATG:4.67±0.67,P=0.000)(表1、图4)。
表1 三种 GRIN2B启动子质粒的RLA比较(±s)
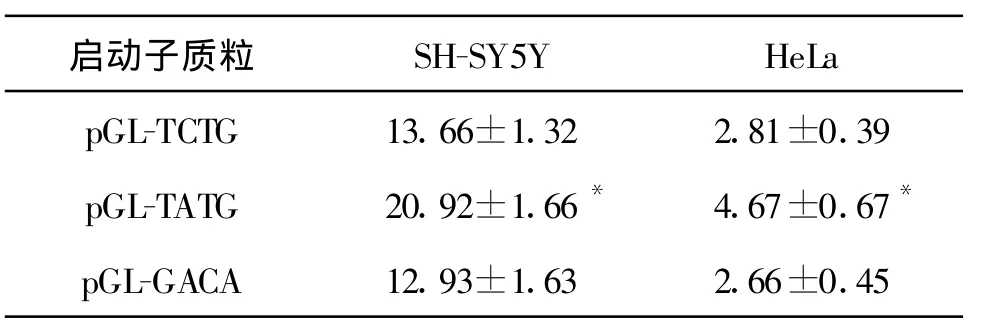
表1 三种 GRIN2B启动子质粒的RLA比较(±s)
注:*与相同细胞系pGL-TCTG的RLA相比有显著性差异,P<0.05。
?

图4 不同GRIN2B启动子转录效率的比较
2.3 不同处理因素下GRIN2B启动子转录活性的变化
对比各种处理因素下GRIN2B启动子质粒的RLA,我们发现无论是在SH-SY5Y细胞中,还是在HeLa细胞中,每种GRIN2B启动子质粒在血清剥夺、Na2S2O4、H2O2及Aβ25-35干预下的 RLA与非处理组相比均无显著性差异(P>0.05),即这些处理因素对GRIN2B启动子的 RLA无影响(表2,表3)。
表2 三种质粒在SH-SY5Y细胞中不同处理因素下的RLA比较(±s)
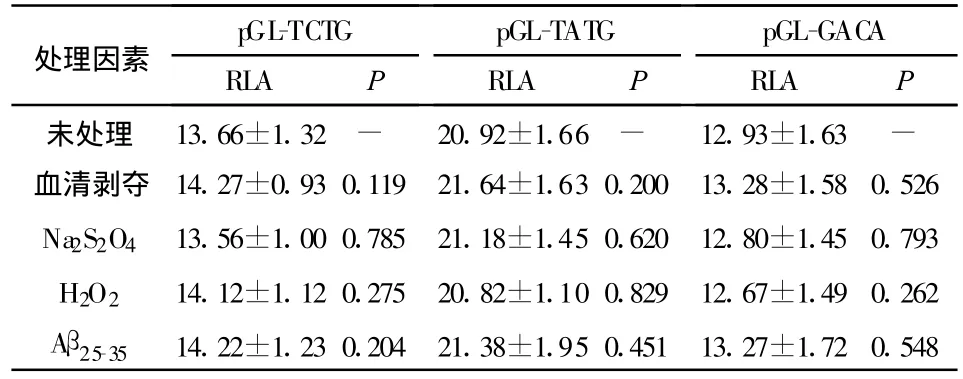
表2 三种质粒在SH-SY5Y细胞中不同处理因素下的RLA比较(±s)
注:P值为相同质粒不同处理因素下与未处理组相比所得数值。
p GL-TCTG pGL-TATG pGL-GACA处理因素RLA P RLA P RLA P未处理 13.66±1.32 - 20.92±1.66 - 12.93±1.63 -血清剥夺 14.27±0.93 0.119 21.64±1.63 0.200 13.28±1.58 0.526 Na2S2O4 13.56±1.00 0.785 21.18±1.45 0.620 12.80±1.45 0.793 H2O2 14.12±1.12 0.275 20.82±1.10 0.829 12.67±1.49 0.262 Aβ25-35 14.22±1.23 0.204 21.38±1.95 0.451 13.27±1.72 0.548
表3 三种质粒在HeLa细胞中不同处理因素下的 RLA比较(±s)

表3 三种质粒在HeLa细胞中不同处理因素下的 RLA比较(±s)
注:P值为相同质粒不同处理因素下与未处理组相比所得数值。
处理因素p GL-TCTG pGL-TATG pGL-GACA RLA P RLA P RLA P未处理 2.81±0.39 - 4.67±0.67 - 2.66±0.45 -血清剥夺 3.01±0.39 0.136 4.48±0.65 0.381 2.52±0.410.322 Na2S2O4 2.86±0.50 0.741 4.71±0.68 0.883 2.67±0.410.959 H2O2 2.75±0.43 0.632 4.59±0.66 0.707 2.68±0.430.923 Aβ25-35 3.05±0.42 0.086 4.99±0.48 0.107 2.72±0.460.720
3 讨论
GRIN2B启动子区有多个转录起始点,有一个CpG岛,缺乏TATA和CAAT盒,并具有神经元表达的选择性[2-5]。已有研究报道,GRIN2B近似启动子区含有多个可能的调节转录的转录因子(transcription factor,TF)结合位点[2,5-8]。如果一些基因变异发生在转录因子的结合位点上,那么碱基的变化就很有可能改变了GRIN2B启动子的转录活性。
在荧光素酶报告分析中,我们发现在SH-SY5Y细胞中各种GRIN2B启动子的活性都较HeLa细胞中高,约是HeLa细胞的5倍左右。这是因为NMDA受体是突触后膜的一种跨膜蛋白,在神经系统中具有高表达性,NR2B亚基是NMDA受体的重要组成部分,其同样具有神经系统高选择性[5]。
瞬时转染SH-SY5Y和HeLa细胞后的报告基因检测结果显示含有pGL-TATG启动子的转录活性比pGL-TCTG增加了1.5-1.7倍。pGL-TATG和pGLTCTG相比,只有-421位点上的碱基不同,却导致转录活性的明显差异,这表明-421C/A多态性位点在GRIN2B启动子启动转录方面起到非常重要的作用。含有-421A等位基因的GRIN2B启动子可能具有更强的转录活性,从而引起NR2B蛋白表达增多,而-421C等位基因则使其表达减少,这可能是其在AD发病中发挥作用的主要方面。
为了证实我们之前发现的4个多态性位点是否位于转录调节区,我们应用MatInspector(http://www.genomatix.de/products/MatInspector/index.html)[9]来进一步进行评估。我们发现,当-421位点为C碱基时,会产生一个可能的锌指蛋白ras-应答元件结合蛋白(ras-responsive element binding protein,RREB)的结合位点,而当此位点是A碱基时,却没有显示可能的转录因子能与之相结合。已有研究证实,RREB可能是一种负性调控TF,它可下调一些基因启动子的活性从而抑制这些蛋白的表达[10]。此外,通过RNA干扰抑制RREB的表达可促使一些基因的启动活性及蛋白表达增加[11]。因此我们推测,携带有-421C等位基因的GRIN2B启动子可能含有RREB的结合位点,从而抑制了GRIN2B的转录水平,而携带有-421A等位基因的GRIN2B启动子却促使GRIN2B转录水平升高,上调NR2B蛋白的表达。由此可见,RREB可能是GRIN2B启动子区的一个重要的转录因子结合蛋白,可直接影响GRIN2B的转录水平。
我们还发现,虽然-200T/G和-1497G/A位点由于碱基的改变,也使GRIN2B启动子与转录因子的结合能力和所结合的蛋白发生了一些改变,但功能研究证实pGL-TCTG和pGL-GACA的RLA并没有差异,我们推测可能是因为这些转录因子表达的蛋白所发挥的转录功能具有相似性,或者启动子与各种转录因子的结合能力的差异性,再或者这些转录因子在与启动子相结合的过程中存在相互作用,而导致并没有真正引起GRIN2B启动活性的明显变化。虽然这只是我们的推论,但之前的研究结果也证实了-200T/G和-1497G/A多态性与AD的发病没有关系,这也进一步证明了我们的假设。
已有研究发现MNDA受体在AD中发挥的毒性作用与多种环境因素关系密切,如中细胞凋亡[12]、Aβ[13,14]和炎症[15]等环境。此外,在对GRIN2B启动子区-200T/G的研究中,Miyatake等人[16]还发现在神经生长因子的环境下,pGL3-200T的转录活性明显增加。然而,我们的研究结果显示,各种干预下并没有引起GRIN2B启动子转录活性的变化。分析原因可能有:一方面,由于GRIN2B启动子对这些干预因素敏感性较低,以上变化尚不能引起其转录活性的改变;另一方面,RREB可能不受以上环境因素的调节,以上因素的选择缺乏特异性;还有可能由于单一的一种环境因素尚不能成功模拟AD的环境;最后,由于在体内各种因素的相互作用才是AD发生的真正环境,这也可能是导致出现以上阴性结果的主要原因。
通过以上的研究,我们发现了-421C/A碱基的改变引起了GRIN2B启动子活性改变,继而可能引起了NR2B蛋白表达的变化,从而导致AD的发病。但是,寻找有意义的对RREB有影响的干预因素、明确对GRIN2B启动子敏感的因素,模拟真正AD体内的体外环境还需进一步的深入研究,从而明确GRIN2B在AD中的作用机制。
[1]Laube B,Hirai H,Sturgess M,et al.Molecular determinants of agonist discriminationby NMDA receptor subunits:analysis of the glutamate binding site on the NR2B subunit[J].Neuron,2007,18:493.
[2]Klein M,Pieri I,Uhlmann F,et al.Cloning and characterization of promoter and 5'-UTR of the NMDA receptor subunit epsilon 2:evidence for alternative splicing of 5'-non-coding exon[J].Gene,1998,208:259.
[3]Sasner M,Buonanno A.Distinct N-methyl-D-aspartate receptor 2B subunit gene sequences confer neural and developmental specific expression[J].J Biol Chem,1996,271:21316.
[4]Myers SJ,Dingledine R,Borges K.Genetic regulation of glutamate receptor ion channels[J].Annu Rev Pharmacol Toxicol,1999,39:221.
[5]Marutha Ravindran CR,Ticku MK.Role of CpG islands in the up-regulation of NMDA receptor NR2B gene expression following chronic ethanol treatment of cultured cortical neurons of mice[J].Neurochem Int,2005,46:313.
[6]Rani CS,Qiang M,Ticku MK.Potential role of cAMP response elementbinding protein in ethanol-induced N-methyl-D-aspartate receptor 2B subunit gene transcription in fetal mouse cortical cells[J].Mol Pharmacol,2005,67:2126.
[7]Wang GS,Hong CJ,YenTY,et al.Transcriptional modification by a CASK-interacting nucleosome assembly protein[J].Neuron,2004,42:113.
[8]Wang TF,Ding CN,Wang GS,et al.Identification of Tbr-1/CASK complex target genes in neurons[J].J Neurochem,2004,91:1483.
[9]Quandt K,Frech K,Karas H,et al.MatInd and MatInspector:new fast and versatile toolsfor detection of consensus matches in nucleotide sequence data[J].Nucleic Acids Res,1995,23:4878.
[10]Zhang S,QianX,Redman C,et al.p16 INK4a gene promoter variation and differential binding of a repressor,the ras-responsive zinc-finger transcription factor,RREB[J].Oncogene,2003,22:2285.
[11]Mukhopadhyay NK,Cinar B,Mukhopadhyay L,et al.The zinc finger protein ras-responsive element binding protein-1 is a coregulatorof the androgen receptor:implications forthe role of the Ras pathway in enhancing androgenic signaling in prostate cancer[J].Mol Endocrinol,2007,21:2056.
[12]Fang M,Li J,Tiu SC,et al.N-methyl-D-aspartate receptor and apoptosis in Alzheimer's disease and multiinfarct dementia[J].J Neurosci Res,2005,81:269.
[13]Ye CP,Selkoe DJ,Hartley DM.Protofibrils of amyloid beta-protein inhibit specific K+currents in neocortical cultures[J].Neurobiol Dis,2003,13:177.
[14]Ye C,Walsh DM,Selkoe DJ,et al.Amyloidβ-protein induced electrophysiological changes are dependent on aggregation state:N-methyl-D-aspartate(NMDA)versus non-NMDA receptor/channel activation[J].Neurosci Lett,2004,366:320.
[15]Takeuchi H,Mizuno T,Zhang G,et al.Neuritic beading induced by activated microglia is an early feature of neuronal dysfunction toward neuronal death by inhibition of mitochondrial respiration and axonal transport[J].J Biol Chem,2005,280:10444.
[16]Miyatake R,Furukawa A,Suwaki H.Identification of a novel variant of the human NR2B gene promoter region and its possible association with schizophrenia[J].Mol Psychiatry,2002,7:1101.
