N-乙酰半胱氨酸对G/GO诱导hRPE细胞氧化损伤的保护作用
2010-05-30苏冠方
朱 超,苏冠方
(吉林大学第二医院眼科,吉林长春130041)
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病最为常见和严重的微血管并发症之一,也是目前发达国家成人致盲的主要原因。糖尿病患者的长期高血糖状态与DR的发生及发展密切相关。在高血糖情况下,葡萄糖被氧化成醛糖后,能够造成视网膜色素上皮(retinal pigment epithelium,RPE)细胞的损伤,影响视网膜外屏障功能。但是高糖引起RPE细胞损伤的机制尚不十分清楚。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是一种强有力的抗氧化剂,其自身具有自由基清除功能,并且在进入细胞后去乙酰化生成半胱氨酸,能促进谷胱甘肽(glutathione,GSH)的合成,后者是细胞对抗氧化应激损伤的主要力量。我们将观察NAC是否能够通过其自身的抗氧化特性对抗葡萄糖/葡萄糖氧化酶(Glucose/Glucose oxidase,G/GO)造成的RPE细胞的损伤而发挥其保护作用。
1 材料与方法
1.1 材料
人视网膜色素上皮(human Retinal pigment epithelium,hRPE)细胞株D407购自中山大学动物实验中心细胞库。DMEM培养基、胰蛋白酶购自Gibco公司。标准胎牛血清购自杭州四季青生物工程公司。MTT、DHR购自Sigma公司。GO购自Amresco公司。NAC购自北京鼎国昌盛生物技术有限责任公司。iNOS单克隆抗体购自美国Upstate公司;ECL化学发光底物购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养及分组 细胞在含10%胎牛血清的低糖(5.5 mM葡萄糖)DMEM培养液中,于37℃、体积分数95%空气、5%CO2常规培养箱培养。取传至第6代的RPE细胞接种于96孔或6孔板,待细胞长至40%-50%时,倾去培养液,PBS洗2遍后分成4组,即低糖组:用含5.5 mM葡萄糖的DMEM培养液;高糖组:用含33 mM葡萄糖的DMEM培养液;对照组:用低糖+15 mU GO的DMEM培养液;G/GO组:用高糖+不同浓度GO的DMEM培养液;+NAC组:G/GO组+NAC的DMEM培养液;以上各组均置于常规培养箱中继续培养6 h。
1.2.2 MTT检测细胞增殖 取对数生长期细胞,以5×105cells/well的浓度100 μ l接种于 96孔培养板。每组6个孔,经药物处理6 h后,每孔加5g/L MTT20 μ l,继续培养 4 h,倾去培养液 ,每孔加 150μ l DMSO,室温振荡 10 min后,用酶标仪(TECAN-GENious,Switzerland)在570 nm波长处记录吸光度值(OD值)。取10孔OD值的均数按公式计算细胞存活率,即细胞存活率(%)=处理组OD值/对照组OD值 ×100%。实验重复3次。
1.2.3 细胞内ROS水平的测定 hRPE细胞分组处理4 h,倾去培养基,用无血清培养基洗2次,收集细胞,用含 1 μ M DHR的无血清培养基制成3×105cells/L的细胞悬液,流式细胞仪(FACS Calibur,Becton Dickinson)检测(激发:488 nm;发射波长:525 nm),每个样品测定10 000个活细胞,直方图下面积代表Rh123的平均荧光强度(mean flourscence indensity,MFI),不同处理因素作用下的ROS水平以MFI表示。
1.2.4 Western免疫印迹法检测iNOS蛋白的表达
各组细胞提取总蛋白,定量后,经聚丙烯酰胺凝胶电泳,再将蛋白转移至硝酸纤维素膜,进行抗原-抗体反应和显色反应。计算iNOS/β-actin灰度比值。
1.3 统计学方法
2 结果
2.1 G/GO对RPE细胞存活率的影响
10 mU、15 mU和20 mU GO作用于hRPE细胞6 h后,hRPE细胞的存活率分别减少为81.4%±8.7%、69.2%±8.2%、32.5%±7.5%,均 P <0.05。GO 5-20 mU的浓度范围内呈剂量依赖性地抑制hRPE细胞的存活率(图1)。

图1 不同浓度的GO对hRPE细胞存活率的影响
2.2 NAC拮抗G/GO对RPE细胞存活率的抑制作用
2.5 mM、5 mM NAC对hRPE细胞存活率无明显影响,但是能够减轻10 mU和15 mU GO的细胞毒性,使hRPE细胞存活率显著地提高(P<0.05)(图2)。
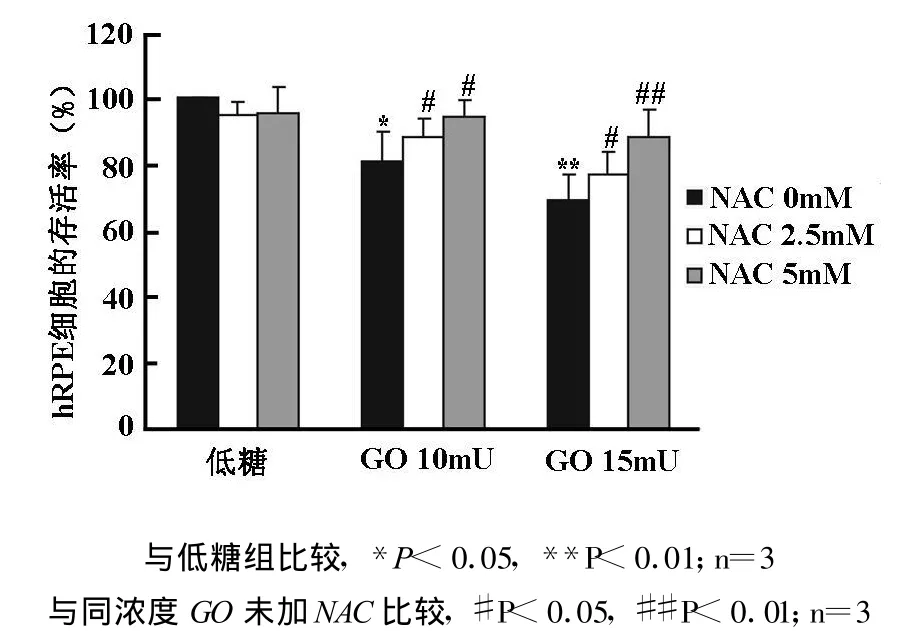
图2 NAC对G/G O抑制hRPE细胞存活率的影响
2.3 NAC抑制G/GO诱导的RPE细胞释放ROS
15 mUGO处理hRPE细胞4 h后,胞内MFI较对照组明显地增强(P<0.05),在应用15mU GO和2.5 mM、5 mM NAC作用于hRPE细胞能使MFI较G/GO时明显降低(P<0.05)(图3)。结果表明,NAC可显著地抑制G/GO引起的hRPE细胞内ROS的堆积。
2.4 NAC抑制G/GO诱导的RPE细胞iNOS表达
正常对照组iNOS的表达很低(灰度值为0.19);G/GO组明显刺激iNOS表达(灰度值为0.89),与对照组相比,iNOS蛋白表达量明显增加(P<0.05);同时加入2.5 mM、5 mM NAC处理后,iNOS的条带明显变浅(灰度值为0.52,0.27),与G/GO组相比,iN-OS蛋白表达量明显降低(P<0.05)(图4)。

图3 NAC对G/G O增加hRPE细胞内ROS水平的影响
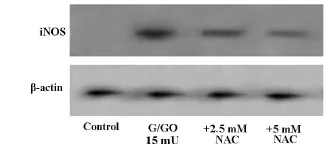
图4 NAC对G/G O增加hRPE细胞iNOS表达的影响
3 讨论
DR早期RPE细胞出现异常荧光素渗漏,其渗透性增加并伴随基底膜增厚等组织学的改变。视觉电生理研究也表明RPE细胞的改变要早于糖尿病视网膜血管内病变的发生。但是,RPE细胞在DR早期发生改变的机制尚不清楚。
诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)能够刺激产生大量的NO,NO与增多的O2-可快速反应生成过氧亚硝基阴离子(peroxynitrite,ONOO-)。ONOO-及其衍生物的氧化能力比H2O2大2000倍,是目前已知氧化作用最强的一类物质,可选择性的使蛋白质中的酪氨酸发生硝基化,生成3-硝基酪氨酸,对生物膜、蛋白酶、DNA造成氧化损伤,影响蛋白质结构和功能。有资料表明高糖促使RPE细胞iNOS表达增加,从而生成过量的NO,造成细胞损伤[1]。
一直以来,如何保护RPE细胞免受高血糖的损伤继而延缓DR发生发展的问题备受学者们的关注。NAC是一种强有力的抗氧化剂,能促进GSH的合成。GSH是细胞对抗氧化应激损伤的主要力量。正常情况下RPE细胞通过合成GSH来清除自由基以保证感光细胞的正常功能。当视网膜发生氧化损伤时,GSH被大量消耗。通过外源性补充GSH被证实是维持RPE细胞内GSH含量较为有效的方法[2]。Tsai等人发现NAC对链脲佐菌素诱导的早期DR大鼠具有保护作用[3],NAC的自由基清除能力有效的减少了DR早期病变的发生。
高血糖情况下,葡萄糖被氧化成醛糖,从而产生相当多的山梨醇,山梨醇在细胞内聚集,产生高渗作用,导致细胞损伤[4]。本实验模拟高糖环境,应用GO能够在体外催化葡萄糖发生自身氧化的原理而建立氧化损伤细胞的模型。我们采用含G/GO的DMEM培养液处理hRPE细胞6 h,MTT法检测结果显示,G/GO组细胞存活率明显低于低糖对照组,差异有统计学意义,表明G/GO作用6 h已经造成hRPE细胞损伤;而加入NAC处理后,细胞存活率比G/GO组升高,差异有统计学意义,表明NAC可以减轻细胞损伤,对细胞具有保护作用。GO在体外催化葡萄糖发生氧化并释放ROS而氧化损伤了hRPE细胞,NAC通过自身抗氧化作用而减少了ROS的生成。此外,NAC还通过抑制iNOS来减少NO的生成,提示G/GO导致的hRPE细胞损伤可能与iNOS的激活及NO的大量产生有关。Western免疫印迹法结果显示,在正常培养条件下,hRPE细胞中iNOS几乎不表达;而在G/GO培养条件下,hRPE细胞中iNOS表达显著升高,从而生成过量的NO,造成细胞损伤;而加入NAC处理后,hRPE细胞中iNOS表达明显降低,差异有统计学意义,证实G/GO导致的hRPE细胞损伤可能与iNOS的激活及NO的大量产生有关,而NAC保护损伤细胞。
综上所述,我们推测NAC对抗G/GO对hRPE细胞的氧化应激作用可能主要与其抑制NOS活性,减少NO生成,进而减轻细胞内ROS的堆积有关。然而,有关NAC对hRPE保护作用的分子机制有待我们进行进一步的研究。
[1]Yuan Z,Feng W,Hong J,et al.p38MAPK and ERK promote nitric oxide production in cultured human retinal pigmented epithelial cells induced by high concentration glucose[J].Nitric Oxide,2009,20(1):9.
[2]Wefers H,Sies H.Hepatic low-level chemiluminescence during redox cycling of menadione and the menadione-glutathione conjugate:relation to glutathione and NAD(P)H:quinone reductase(DT-diaphorase)activity[J].Arch Biochem Biophys,1983,224(2):568.
[3]Tsai GY,Cui JZ,Syed H,et al.Effect of N-acetylcysteine on the early expression of inflammatory markers in the retina and plasma of diabetic rats[J].Clin Experiment Ophthalmol,2009,37(2):223.
[4]张承芬,张惠蓉.糖尿病的眼部并发症及治疗[M].北京:人民卫生出版社,2003:132-133.
