絮凝剂-树脂联合法从琼胶中制备琼脂糖工艺研究
2020-10-09张全斌
鞠 豪 , 张全斌
(1. 中国科学院海洋研究所 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京100049;3. 中国科学院 海洋大科学研究中心, 山东 青岛 266071)
琼胶是一种从石花菜属(Gelidiumsp.)、江蓠藻属(Gracilariasp.)、伊谷藻属(Ahnfeltiasp.)、紫菜属(Pyropia/Porphyraspp.)和鸡毛菜属(Plerocladiasp.)等红藻的细胞壁中提取的天然水溶性高分子多糖物质[1]。琼胶主要由中性的琼脂糖(agarose)和硫琼胶(agaropectin) 组成。琼脂糖是不含有硫酸基的非离子型线性半乳聚糖,由1, 3 连接的β-D-半乳糖和1, 4 连接的α-3, 6-内醚半乳糖构成的琼二糖线性交替连接形成的共聚物,具有凝胶功能[2]; 硫琼胶[3]是琼胶中部分硫酸化的复杂多糖且不具有凝胶功能。琼脂糖具有相对较低的电内渗作用并且不吸附碱性染料和蛋白质, 常用于电泳[4]和色谱法[5]。同时, 琼脂糖因具有良好的物理、化学和热稳定性而广泛用于多糖等活性物质的分离[5]、组织工程、填充剂、药物输送、染料吸附、重金属吸附、生物分子吸附和水中多环芳烃的测定[6]。
目前, 琼脂糖制备方法很多。根据分离原理, 这些方法可大致分为硫琼胶沉淀法[7]、琼脂糖沉淀法[8]、离子交换法[9]、离子液体[10]等方法。DEAE-纤维素法[9]制备的琼脂糖品质优良, 其硫酸基含量较低且凝胶强度较高, 适用于生物技术级琼脂糖的生产, 然而DEAE-纤维素的高昂价格限制了其工业应用。乙酰化法[11]制备琼脂糖存在乙酰化过程中部分琼脂糖降解的缺陷。季铵沉淀法[11]制备琼脂糖的关键挑战在于生产过程中会形成乳状沉淀, 该沉淀很难通过离心、过滤、加热从琼脂糖溶液中分离纯化出来。聚乙二醇法[8]制备的琼脂糖具有相对较高的凝胶强度和较小的电内渗值, 但是聚乙二醇在制备过程中还可以吸附色素导致琼脂糖着色, 使琼脂糖产品呈现出淡黄或微黄色。尿素法、EDTA-Na2螯合法和磷酸钠法[6]在制备过程中引入了新的杂质导致琼脂糖产品纯度较低。考虑到当前这些方法的局限性, 开发制备琼脂糖的新方法很有必要。采用聚丙烯酰胺-树脂联合法制备琼脂糖, 目前国内外尚未见相关的文献报道。本文通过单因素试验确定聚丙烯酰胺-树脂联合法从江蓠琼胶中分离精制琼脂糖的最佳工艺条件,为开发琼脂糖制备新方法提供参考。
1 材料和方法
1.1 仪器与试剂
H-2K4 恒温四孔水浴锅(巩义市予华仪器有限责任公司); 凝胶强度仪(中国科学院海洋研究所);CIC-D100 型离子色谱仪(青岛盛瀚色谱技术有限公司); Nicolet iS10 傅里叶变换红外光谱仪(Nicolet IS10 FT-TR)。
江蓠琼胶, 由绿新(福建)食品有限公司提供; 聚丙烯酰胺(AR 200-1400 万阳离子), 购于山东西亚试剂; 盐酸、氢氧化钠、碳酸氢钠、碳酸钠、D-果糖均为分析纯, 购于国药集团化学试剂; 间苯二酚、1, 1-乙缩醛均为分析纯, 购于上海阿拉丁生化科技股份有限公司; 弱碱性苯丙烯系阴离子交换树脂, 购于生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 琼脂糖制备方法
通过预实验, 综合考虑制备效果和成本, 我们选择聚丙烯酰胺和弱碱性苯丙烯系阴离子交换树脂进行进一步优化。我们通过单因素试验对弱碱性苯丙烯系阴离子交换树脂的反应工艺进行确定。
将活化后的弱碱性苯丙烯系阴离子交换树脂加入到1%(w/w)的琼胶溶液中。将混合物在一定温度下搅拌一定时间。反应完成后, 立即将热混合物过滤,然后将滤液置于室温下以形成凝胶, 将得到的凝胶冷冻干燥并粉碎, 得到白色琼脂糖粉末。选取对弱碱性苯丙烯系阴离子交换树脂制备琼脂糖的主要指标有显著影响的3 个因素(树脂使用量、反应时间、反应温度)进行单因素试验, 主要指标为硫酸基含量,在反应过程中兼顾产品的白度, 从而确定各单因素的最优水平。
(1) 弱碱性苯丙烯系阴离子交换树脂添加量:固定反应温度80℃、反应时间150 min、琼胶溶液浓度为1%, 选取2︰1、1︰1、1︰2、1︰3、1︰4、1︰5等6 个不同的琼胶与弱碱性苯丙烯系阴离子交换树脂质量比进行单因素试验。
(2) 弱碱性苯丙烯系阴离子交换树脂的反应时间:固定琼胶原料与弱碱性苯丙烯系阴离子交换树脂质量比为1︰3、反应温度80℃、琼胶溶液浓度为1%, 选取60 min、90 min、120 min、150 min、180 min、210 min 等6 个不同的反应时间进行单因素试验。
(3) 弱碱性苯丙烯系阴离子交换树脂的反应温度:固定琼胶与弱碱性苯丙烯系阴离子交换树脂质量比为1︰3、反应时间150 min、琼胶溶液浓度为1%, 选取50℃、60℃、70℃、80℃、90℃等5 个不同的反应温度进行单因素试验。
1.2.2 琼脂糖理化性质测定
(1) 凝胶强度测定 参照GB1975-2010 和王晓龙等人的方法并进行适当改进。称取适量(扣除水分后计算所得的试样量, 精确至0.001 g)样品加入适量的蒸馏水, 室温下溶胀2 h, 加热配制1.5%的琼脂糖溶液。趁热分别倒入称量瓶中, 待冷却凝固后置于4℃冰箱中过夜, 30℃水浴锅恒温60 min 使凝胶稳定,然后用凝胶强度仪测定凝胶强度, 取平均值[12-13]。
(2) 硫酸基测定 采用离子色谱法测定琼脂糖样品中的硫酸基含量[14]。称取0.1 g 左右粉碎的琼脂糖粉末放入安瓿瓶中, 加入8 mL 2 mol/L 的盐酸, 室温溶胀2 h, 封管, 105℃下水解4 h, 冷却至室温, 用氢氧化钠溶液中和至pH 为6~7, 过滤, 定容至50 mL。离子色谱法测定硫酸基含量, 采用SH-AC-1型阴离子色谱柱, 淋洗液组成为4.5 mmol/L 的NaHCO3溶液和3.6 mmol/L 的Na2CO3溶液, 流速为1.5 mL/min。
(3) 水分测定 参照GB5009.3-2010 的方法测定水分[15]。称取适量的琼脂糖粉末放入已经干燥至恒重的称量瓶中105℃干燥至恒重。
(4) 透明度测定 取琼脂糖样品配制成1%溶液, 将热胶液(大于95℃)倒入比色皿中, 室温放置24 h, 用紫外分光光度计在400~800 nm 间扫描, 确定最大吸收波长700 nm, 在最大吸收波长处测定样品的透光率(T)[16]。
(5) 融化温度和凝固温度 称取适量琼脂糖在沸水中溶解制成1.5%的琼脂糖溶液, 取5.0 mL 溶液装入试管中, 于2~4℃冰箱内冷却过夜, 在凝胶表面放置一个小钢珠, 将试管置于30℃水浴中, 待胶体稳定后在以每分钟升高1℃的速度升温, 当小钢珠从凝胶表面下落时, 此刻的温度即为融化温度[17]。配制1.5%的琼脂糖溶液, 室温下使琼脂糖溶液的温度以每分钟降低1℃的速度降低, 待试管内凝胶凝固, 即倾斜试管倾斜90℃时, 凝胶表面能保持不变且抽出温度计凝胶表面不变形, 此刻的温度即为凝固温度[17]。
(6) 红外光谱 将干燥的琼脂糖样品粉末, 压片,利用Nicolet Is10 傅里叶变换红外光谱仪进行测定。
(7) 白度测定 将干燥的琼脂糖样品粉末置于研钵研磨后, 利用CR-400/410 色彩色差计进行测定,待示数稳定时, 记录此时的数值即为样品的白度。
1.3 统计分析
所有实验均重复3 次。数据表示为平均值±标准偏差(SD)。使用SPSS 19.0 版使用单向方差分析(ANOVA)进行统计分析。在P<0.05 时, 结果被认为有显著差异。
2 结果与分析
2.1 琼脂糖制备工艺
硫酸基含量是决定琼脂糖质量好坏的重要指标。本研究采用江蓠琼胶为原料, 琼胶硫酸基含量为1.27%(表1)。在前期研究中, 我们通过单因素试验获得聚丙烯酰胺法制备琼脂糖的最优工艺。在60℃下,0.8%(w/w)的聚丙烯酰胺溶液以料液比1︰4 的比例加入琼胶溶液中反应120 min。此条件下制备的琼脂糖硫酸基含量为0.4%, 较琼胶硫酸基含量降低了2/3以上, 但在此条件下制备的琼脂糖硫酸基的含量仍然较高, 还有继续降低的必要性。

表1 琼脂和琼脂糖的理化特性Tab. 1 Physicochemical properties of agar and agarose
在预实验中, 我们发现用弱碱性苯丙烯系阴离子交换树脂处理琼胶可以降低其硫酸基含量。因此,我们通过单因素试验优化其制备工艺。如图1 所示,所得琼脂糖硫酸基含量随树脂使用量的增加而降低,即硫酸基含量由琼胶原料的1.27%减少到0.74%(琼胶与树脂质量比为2︰1), 再减少到0.32%(琼胶与树脂质量比为1︰3), 此后硫酸基含量并不会随着树脂用量的增加而降低, 反而趋于稳定。该结果表明琼胶中带负电的硫酸基已经被阴离子树脂充分吸附, 再增加树脂的使用量对硫酸基吸附效果并不明显, 因而树脂使用量最终确定为琼胶与树脂质量比为1︰3。

图1 树脂法中树脂使用量对琼脂糖硫酸基含量的影响Fig. 1 Effect of resin usage on the agarose sulfate content in the resin method
图2 显示了反应时间对琼脂糖硫酸基含量的影响。120 min 以前, 琼脂糖硫酸基含量下降趋势比较明显, 硫酸基含量从琼胶原料的1.27%迅速下降到0.35%, 120 min 以后硫酸基含量下降开始放缓, 直至150 min 以后, 硫酸基含量趋于稳定, 稳定在0.32%。因而, 150 min 是获得琼脂糖的最佳时间。
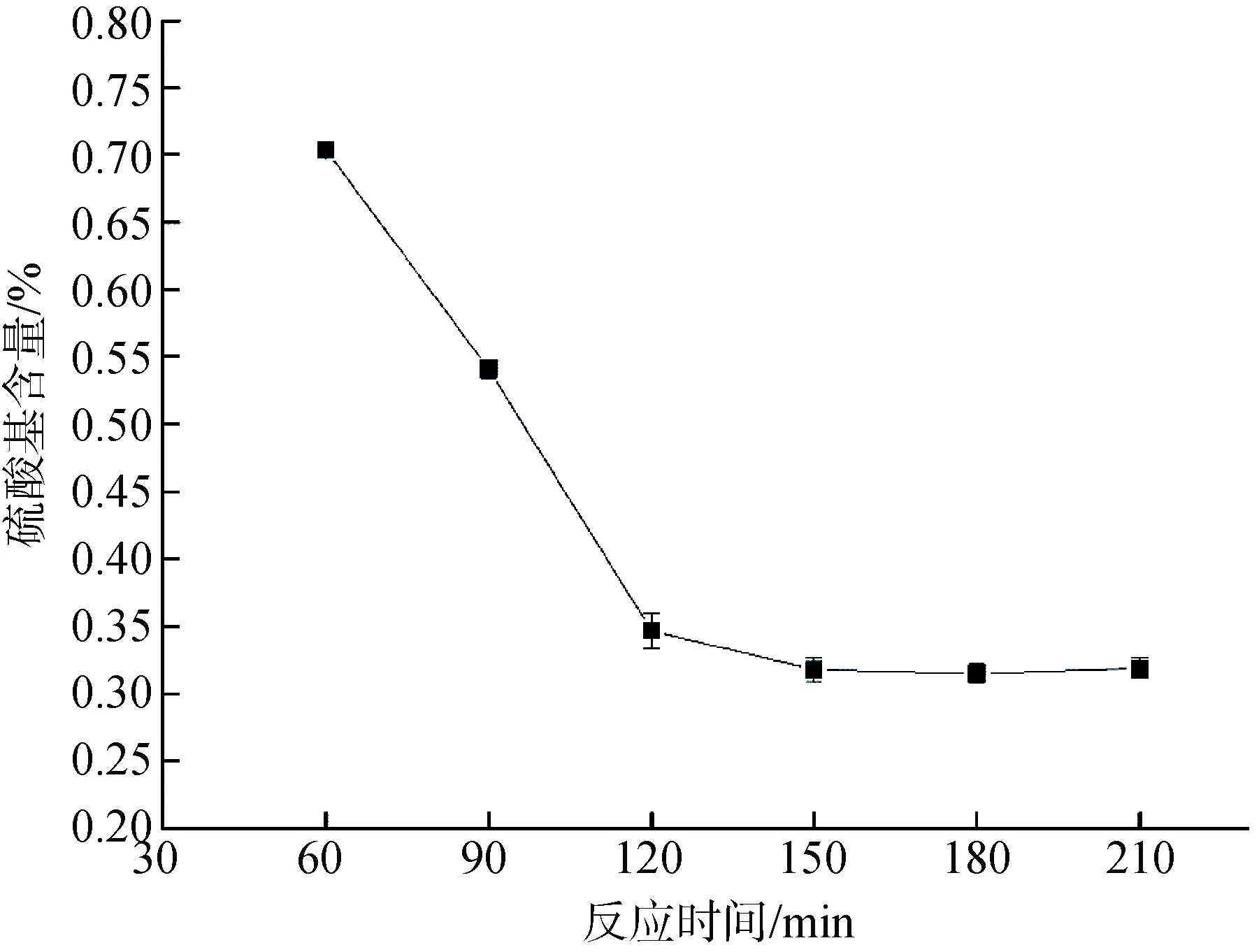
图2 树脂法中反应时间对琼脂糖硫酸基含量的影响Fig. 2 Effect of reaction time on the agarose sulfate content in the resin method
反应温度对硫酸基含量的影响如图3 所示, 当温度从50℃升高到80℃时, 所得琼脂糖硫酸基含量总体呈现出下降趋势, 硫酸基含量从0.55%降低至0.32%。随着反应温度的继续增加, 硫酸基含量反而呈现出上升的趋势。考虑反应温度对硫酸基含量的影响, 我们选取80℃为最佳反应温度。
因此弱碱性苯丙烯系阴离子交换树脂法的最佳反应条件为: 在80℃下, 琼胶原料与树脂质量比为1︰3的弱碱性苯丙烯系阴离子交换树脂在琼胶溶液中反应150 min。
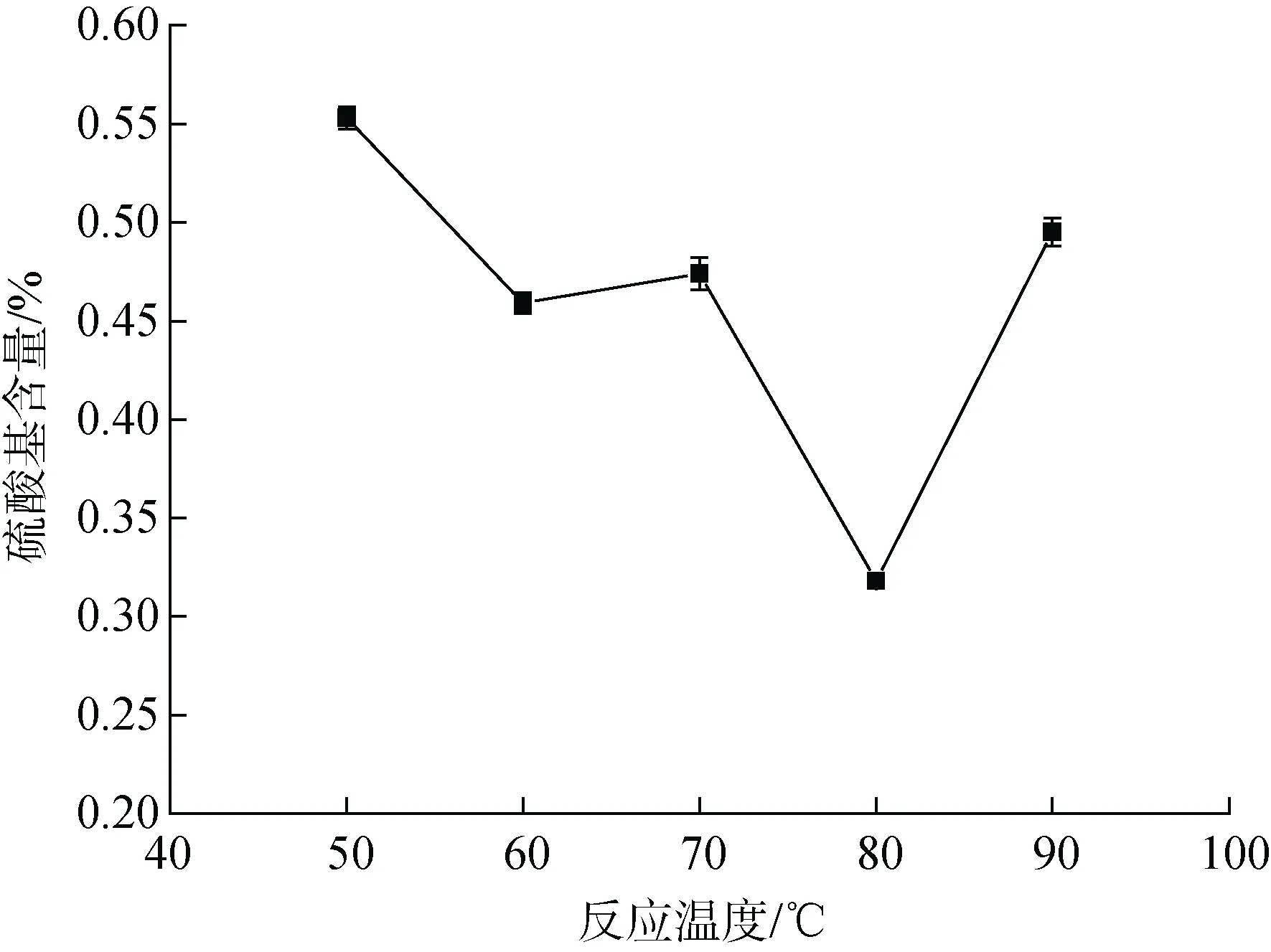
图3 树脂法中反应温度对琼脂糖硫酸基含量的影响Fig. 3 Effect of reaction temperature on agarose sulfate content in resin method
单用弱碱性苯丙烯系阴离子交换树脂或聚丙烯酰胺处理时, 两者都只能除掉琼胶中大部分硫琼胶,为了提高硫琼胶脱除效率, 我们将聚丙烯酰胺和弱碱性苯丙烯系阴离子交换树脂联合使用。根据单因素试验结果, 确定的联合处理反应条件为: 0.8%(w/w)聚丙烯酰胺溶液以料液比为 1︰4 的比例加入到1%(w/w)的琼胶溶液中, 在60℃下搅拌120 min, 反应完成后, 立即将热混合物过滤, 然后将琼胶原料3倍质量的树脂加入到滤液中, 在80℃下搅拌150 min,趁热过滤, 将滤液置于室温下以形成凝胶, 将凝胶冷冻干燥并粉碎, 得到白色琼脂糖粉末。在此条件下,所得到的琼脂糖的硫酸基含量为0.22%, 较单独处理时有较大改善, 表明该方法能够用于制备琼脂糖。
2.2 琼脂糖的理化性质
在联用法最佳工艺下, 我们进行3 个批次独立实验来制备琼脂糖并测定了处理前后样品的凝胶强度、硫酸基含量、水分、透明度、融化温度、凝固温度和白度。如表1 所示, 琼胶和琼脂糖的硫酸基含量分别为1.27%和0.22%, 这表明该方法可以有效地去除硫琼胶。琼脂糖的凝胶强度为1 523.7 g/cm2, 凝固温度为39.7℃, 融化温度为87.6℃。与琼胶原料相比, 琼脂糖的凝胶强度和白度显著提高,硫酸基含量显著降低, 表明该方法可以用于琼脂糖的生产。
从图4 中可以看出, 自制江蓠琼脂糖与Biowest琼脂糖两者的红外图谱几乎重合且主要特征吸收峰相似, 表明两种琼脂糖的主要成分和官能团种类基本相同。两者在3 354 cm–1、2 898 cm–1、1 400~1 200 cm–1、1 200~1 000 cm–1处都有多糖特征性的吸收峰存在,1 150 cm–1为C-O 的伸缩振动及O-H 变形振动峰,3 000 cm–1附近的峰为环内C-H 的信号峰, 3 400 cm–1左右处的吸收峰为-OH 的信号峰, 这些吸收峰的存在表明琼脂糖是一种糖类化合物; 同时, 谱图在820~851 cm–1附近没有特征峰, 该结果表明D-半乳糖在C4 和C6 位上面没有直键硫酸基的存在; 在930 cm–1处的吸收峰为3, 6-内醚半乳糖的特征吸收峰并且较尖锐, 表明3, 6-内醚半乳糖含量较高; 1 250 cm–1处为总硫的特征吸收, 谱图显示此处没有吸收峰, 表明自制琼脂糖的总硫含量很低; 1 369 cm–1有较弱的C=O 的对称吸收峰, 此峰是琼脂糖中羟基化的特征吸收峰[18]。

图4 Biowest 琼脂糖和自制琼脂糖的红外光谱Fig. 4 Infrared spectra of Biowest agarose and self-made agarose
3 讨论
琼脂糖制备技术的关键在于将琼胶中的硫琼胶与琼脂糖分离开来并尽可能地降低琼脂糖中硫酸基等带电基团的含量。在本研究中, 我们成功地通过聚丙烯酰胺-弱碱性苯丙烯系阴离子交换树脂联合法将硫琼胶从琼胶中分离出来, 从而获得琼脂糖。琼脂糖的质量主要取决于凝胶强度和硫酸基含量。琼脂糖硫酸基含量的多少直接决定了琼脂糖的用途, 因此本试验以硫酸基含量为指标对试验条件进行了优化。
在制备过程中, 琼脂糖硫酸基的含量随着弱碱性苯丙烯系阴离子交换树脂添加量的增加而呈现出先降低后趋于稳定的趋势。这可能因为随着弱碱性苯丙烯系阴离子交换树脂用量的增加, 阴离子交换树脂的离子交换容量增大, 琼胶溶液中的硫琼胶部分被阴离子交换树脂充分吸附, 制备的琼脂糖硫酸基含量越来越低, 当琼胶原料与阴离子交换树脂的质量比为1︰3 时, 阴离子交换树脂的交换能力可以满足琼胶溶液中以硫酸基为主的带负电基团的交换吸附, 琼胶中的硫琼胶被充分吸附, 再增加阴离子交换树脂的质量对硫酸基吸附量增加效果不明显。在反应过程中, 随着时间的增加, 琼脂糖硫酸基的含量也呈现出先下降后趋于稳定的趋势。这种变化出现的原因可能是反应刚开始时提取时间的增加,阴离子交换树脂对胶液中的硫琼胶吸附增多, 继续增加反应时间, 硫琼胶大部分被吸附而使反应趋于平衡, 阴离子交换树脂不会在对硫琼胶进行吸附,因而自制琼脂糖的硫酸基含量也就趋于稳定。同时,我们发现自制琼脂糖的硫酸基含量随反应温度的不同整体上呈现出接近V 型变化, 即先下降后上升。在琼胶溶液温度较低时, 琼胶溶液流动性较差, 溶液的黏稠性会阻碍硫琼胶与阴离子交换树脂离子交换的进行。随着反应温度的升高, 琼胶溶液的黏度减小, 溶液中树脂和琼胶的混合更加均匀, 两者可以充分接触, 使得离子交换吸附可以进行完全, 因而可以获得硫酸基含量比较低的琼脂糖。当温度继续升高时, 过高的温度会对阴离子交换树脂的活性基团产生影响, 树脂本身的结构也可能会遭到破坏[19]。这些因素会对反应过程造成影响, 使得树脂的使用效率降低, 自制琼脂糖的硫酸基含量升高, 同时, 过高的温度也会使已被交换吸附至阴离子交换树脂上的硫琼胶重新溶解于过热的琼胶溶液中, 从而对自制琼脂糖硫酸基含量产生影响。因而80℃是弱碱性苯丙烯系阴离子交换树脂的最佳反应温度。
戚勃等人[20]通过KMnO4-H2C2O4法对琼脂糖进行漂白, 其白度达到92.72。尽管该漂白方法在反应过程中最大程度的保护了琼脂糖的凝胶强度, 但反应过程中的酸性环境仍然对琼脂糖结构产生破坏,导致了其凝胶强度的降低。孙宁等人[16]用聚乙二醇法制备的琼脂糖透明度高, 但是聚乙二醇也会吸附色素等可溶性杂质, 导致琼脂糖白度降低。在本研究中, 自制琼脂糖白度和透明度分别达到 88.32%±0.04%和58.88%±3.0%。反应过程中聚丙烯酰胺可以有效地吸附琼胶中硫酸基等带电基团且部分可溶性杂质也被吸附, 从而提高了琼脂糖的透明度和白度。同时, 弱碱性苯丙烯系阴离子交换树脂也可以有效吸附琼胶中带有硫酸基等荷电基团的物质, 从而获得中性的琼脂糖。因此, 该方法适用于琼脂糖的制备。由于不需要额外的漂白过程, 因此该方法可以减少化学试剂的使用, 简化反应步骤并降低生产成本。
凝胶强度是琼脂糖质量的重要参数。琼脂糖的凝胶强度受许多因素影响, 并与其化学组成和结构密切相关[21]。我们发现自制琼脂糖的凝胶强度略低于Sigma 低电泳琼脂糖的凝胶强度。其原因可能是在琼胶溶解过程中, 加热解可能会导致琼胶轻微的降解,同时树脂法中, 琼胶需要在80℃下反应150 min, 长时间的搅拌和加热也会造成琼脂糖的部分降解。虽然发生了降解, 但是硫琼胶的除去使琼脂糖凝胶强度仍然远远高于琼胶原料, 表明该方法可以适用于琼脂糖的制备。Araki 等人[2]认为在琼脂糖制备过程中很难完全去除硫酸根基团。与原料相比, 研究中琼脂糖的硫酸基含量降低80%以上。达到了琼脂糖的基本要求。
4 结论
本研究采用的聚丙烯酰胺是日常生活中用于污水处理的常见的絮凝剂, 价格低廉且不会对环境造成污染; 弱碱性苯丙烯系阴离子交换树脂是工业生产中常见的树脂, 与DEAE-纤维素相比, 其价格低廉且可以重复使用。因此, 该方法整个制备过程相对简单且便宜、试剂消耗量少、反应时间短、操作方便、不同批次产品之间差异性较小。但是目前该制备方法仅实现了实验室级小批量制备, 未来我们将进行中试放大生产, 确定大批量制备的工艺条件,从而最终实现工业生产。
在本研究中, 我们以从江蓠中获得的商业琼脂用作原料, 通过聚丙烯酰胺-弱碱性苯丙烯系阴离子交换树脂法制备的琼脂糖硫酸基含量为0.22%、凝胶强度为1 524 g/cm2、透明度为58.9%, 凝固温度为39.7℃、融化温度为87.6℃。其凝胶强度与Sigma琼脂糖(A4679, 凝胶强度≥1 200 g/cm2)相当。与琼胶原料相比, 自制琼脂糖具有高凝胶强度、低硫酸基含量、高透明度和高白度等多种优点, 其各项指标满足了普通级琼脂糖的要求。因此, 本研究建立了一种新的、简单、快速、污染少的联合方法, 以从江蓠琼胶中制备琼脂糖。
