酮通颗粒质量标准研究
2010-05-22余晓东武夏明刘田云赵广成刘逢芹山东大学附属千佛山医院济南市5004山东大学药学院济南市500
余晓东,武夏明,刘田云,赵广成,刘逢芹(.山东大学附属千佛山医院,济南市 5004;.山东大学药学院,济南市 500)
随着社会人群老龄化趋势的发展,缺血性脑病(中风)发病率呈上升趋势[1,2]。酮通颗粒原处方是本院临床协定方,在临床上应用多年,疗效确切。笔者在此方剂基础上研制开发的制剂酮通颗粒具有活血通络、祛瘀通脉的作用。为更好地控制该制剂质量,笔者对其进行了质量标准研究。
1 仪器与试药
Mettler AE-241型电子分析天平(上海梅特勒-托利多仪器有限公司);515型高效液相色谱(HPLC)仪(美国Waters公司);Model 500 labAlliance检测器(美国SSI公司);ANASTAR数据处理系统(美国SUNTEK公司);KQ-100D型超声波清洗器(昆山市超声仪器有限公司);DZF-6050型真空干燥箱(上海博迅有限公司);HHS-118型恒温水浴锅(上海医疗器械五厂)。
槲皮素、山柰素、异鼠李素对照品(中国药品生物制品检定所,批号分别为 100081-200406、110861-200606、110860-200407);银杏叶、三七、葛根对照药材(中国药品生物制品检定所,批号分别为 110866-200803、120941-200807、121178-200302);酮通颗粒由本院制剂室制备(规格:双铝箔复合袋包装,每袋5 g,批号:080311);甲醇(色谱纯,天津市科密欧化学试剂有限公司,批号:20070110);娃哈哈纯净水(杭州娃哈哈集团有限公司,批号:1222YS);硅胶G、硅胶H(青岛海洋化工有限公司)。
2 方法与结果
2.1 定性鉴别
2.1.1 三七的TLC鉴别 精密称取样品3 g,加入数滴水浸润、搅匀,加以水饱和的正丁醇30 mL,超声30 min,放置2 h,离心,取上清液,加30 mL的正丁醇饱和水,摇匀,放置使分层,取正丁醇层,蒸干,残渣加水溶解后用乙醚萃取2次(每次20 mL),弃去乙醚液,水层溶液蒸干,残渣加甲醇5 mL溶解,作为供试品溶液;取三七对照药材0.5 g,加入70%乙醇15 mL,超声30 min,过滤,滤液蒸去乙醇后加水溶解,用乙醚萃取2次(每次20 mL),弃去乙醚液,水层用正丁醇萃取2次(每次20 mL),取正丁醇液蒸干,残渣加甲醇5 mL溶解,作为对照药材溶液;按酮通颗粒制备工艺制得缺三七药材的阴性样品,同法制得阴性对照溶液。吸取上述3种溶液各3µL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-水(15∶40∶22∶10)在10℃以下放置的下层溶液为展开剂,上行展开10 cm,取出,晾干,喷以10%H2SO4-乙醇溶液,于105℃加热至斑点显色清晰,置365 nm紫外光灯下检视。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性对照无干扰。三七的TLC见图1。
2.1.2 银杏叶的TLC鉴别[3]精密称取样品2 g,加甲醇20 mL,加热回流10 min,放冷,滤过,滤液蒸干,加水20 mL溶解,氯仿萃取2次(每次20 mL),水层蒸干,残渣加甲醇5 mL溶解,作为供试品溶液;取银杏叶对照药材0.5 g,加甲醇10 mL,加热回流,放冷滤过,溶液蒸干,加水10 mL溶解,氯仿萃取2次(每次10 mL),水层蒸干,残渣加甲醇溶解制得对照药材溶液;取槲皮素对照品,加甲醇制成每1 mL含0.03 mg的溶液,作为对照品溶液;按酮通颗粒制备工艺制得缺银杏叶药材的阴性样品,同法制备阴性对照溶液。吸取上述4种溶液各6µL,分别点于同一含4%醋酸钠的硅胶G薄层板上,以乙酸乙酯-丙酮-甲醇-水(5∶3∶1∶1)为展开剂,展开,取出,晾干,喷以3%三氯化铝乙酸溶液,热风吹干,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材及对照品色谱相应位置上,显相同颜色的荧光斑点;阴性对照无干扰。银杏叶的TLC见图2。
2.1.3 葛根的TLC鉴别 称取样品3 g,加甲醇30 mL,超声30 min,放置2 h,滤过,滤液蒸干,残渣加甲醇2 mL溶解,作为供试品溶液;取葛根对照药材0.5 g,加甲醇15 mL,超声30 min,放置2 h,取上清液蒸干,残渣加甲醇2 mL溶解,作为对照药材溶液;按处方比例制备缺葛根的阴性样品,同法制得阴性对照溶液。吸取上述3种溶液各10 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上,以三氯甲烷-甲醇-水(7∶2.5∶0.25)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。结果,供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;阴性对照无干扰。葛根的TLC见图3。

图1 三七的TLC1.供试品;2.阴性对照;3.三七对照药材Fig 1 TLC of P.notoginseng1.test sample;2.negative control;3.Radix Notoginseng
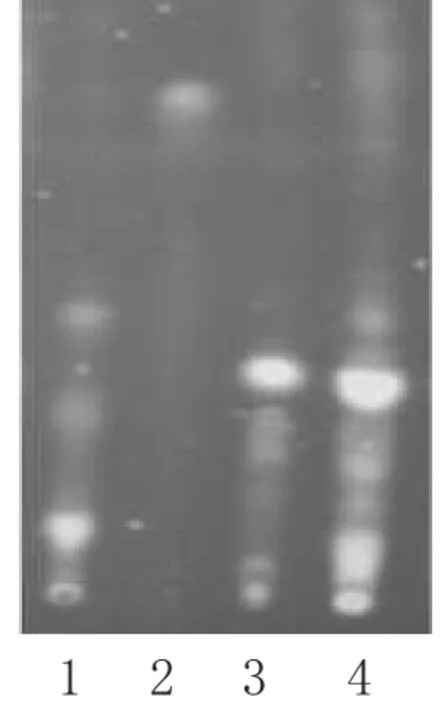
图2 银杏叶的TLC1.阴性对照;2.槲皮素对照品;3.银杏叶对照药材;4.供试品Fig 2 TLC of G.biloba1.negative control;2.quercetin control;3.Folium Ginkgo;4.test sample

图3 葛根的TLC1.阴性对照;2.葛根对照药材;3.供试品Fig 3 TLC of P.lobata1.negative control;2.Radix Puerariae;3.test sample
2.2 定量分析
2.2.1 溶液的制备[4,5]取样品2 g,精密称定(约相当于银杏叶药材1 g),加甲醇-25%盐酸溶液(4∶1)25 mL,置水浴中加热回流30 min,冷却至室温,转移至50 mL量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;按酮通颗粒制备工艺制得缺三七药材的阴性样品,同法制得阴性对照溶液;再分别精密称取经五氧化二磷干燥过夜的槲皮素对照品2.62 mg、山柰素对照品2.28 mg、异鼠李素对照品1.24 mg,置于同一25 mL容量瓶中,加甲醇溶解并稀释到刻度,制得混合对照品溶液。
2.2.2 色谱条件与系统适用性试验色谱柱:Diamond C18(250 mm×4.5 mm,5 μm);流动相:甲醇-0.4%H3PO4(55∶45);流速:1 mL·min-1;检测波长:360 nm;柱温:35 ℃;进样量:20 μL;柱压<1200 Pa。理论塔板数按槲皮素峰计算应不低于2500。色谱见图4。
2.2.3 线性关系考察 按上述色谱条件,精密吸取上述混合对照品溶液0.5、1、2、4、6、8 mL,置10 mL容量瓶中,加甲醇稀释至刻度,注入液相色谱仪,测得峰面积。以槲皮素、山柰素、异鼠李素浓度(C)为横坐标,峰面积积分值(A)为纵坐标,制备标准曲线,并分别进行线性回归,得回归方程,见表1。
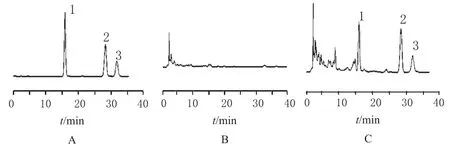
图4 高效液相色谱图A.混合对照品;B.阴性对照;C.供试品;1.槲皮素;2.山柰素;3.异鼠李素Fig 4 HPLC chromatogramsA.mixture control;B.negative control;C.test sample;1.meletin;2.kaempferide;3.isorhamnetin
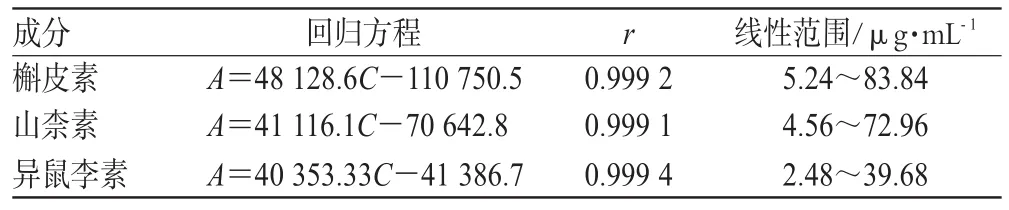
表1 总黄酮醇苷的回归方程及线性范围Tab 1 Regression equation and linear range of total flavonol glyconsides
2.2.4 精密度试验 精密吸取同一混合对照品溶液20µL,连续进样6次,记录峰面积。结果,峰面积的RSD分别为槲皮素1.21%、山柰素0.83%、异鼠李素1.63%。
2.2.5 稳定性试验 精密吸取同一混合对照品溶液和供试品溶液各20µL,每间隔2 h进一针,连续考察8 h。结果,对照品峰面积的RSD分别为槲皮素0.31%、山柰素0.72%、异鼠李素0.59%,供试品峰面积的RSD分别为槲皮素1.68%、山柰素1.74%、异鼠李素1.92%。
2.2.6 重复性试验 取同一批样品,精密称取5份,按样品测定项下的方法测定。结果,槲皮素、山柰素、异鼠李素的RSD分别为2.88%、4.61%、1.80%。
2.2.7 加样回收率试验 取已知含量的同一批样品适量,共5份,精密称定,分别精密加入槲皮素、山柰素、异鼠李素对照品溶液各1 mL,按“2.2.1”项下方法制成供试品溶液,照样品测定项下的方法测定。结果,平均回收率分别为96.21%、99.14%和95.00%,RSD分别为2.06%、1.19%、1.31%。
2.2.8 样品含量测定 称取3份酮通颗粒,每份各2 g,精密称定,按“2.2.1”项下方法制得供试品溶液。吸取同批号供试品溶液和槲皮素浓度为62.88 μg·mL-1、山柰素浓度为54.72 μg·mL-1、异鼠李素浓度为29.76 μg·mL-1的对照品溶液各20 μL,依照“2.2.2”项下方法测定,记录各峰面积,以外标法计算总黄酮醇苷含量(总黄酮醇苷含量=(槲皮素含量+山柰素含量+异鼠李素含量)×2.51),结果见表2。
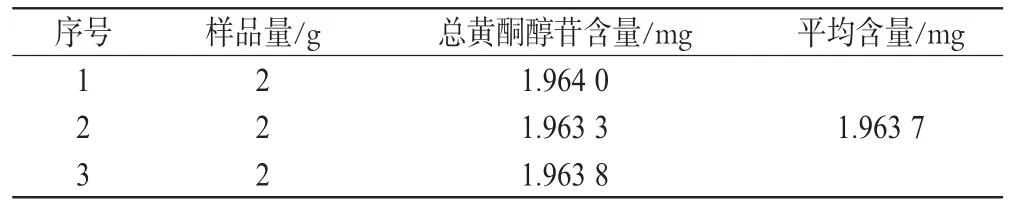
表2 样品总黄酮醇苷含量测定结果(n=3)Tab 2 Content determination of total flavonol glyconsides in samples(n=3)
3 讨论
本试验建立了酮通颗粒的质量标准,采用TLC对处方中银杏叶、三七、葛根进行了定性鉴别,采用HPLC建立了银杏叶总黄酮醇苷的含量测定方法,并经多批次检验,方法可行,结果重复性较好。
本制剂中银杏叶总黄酮醇苷是其主要药效成分,直接影响到治疗效果,故选择测定银杏叶总黄酮醇苷作为该制剂质量标准的含量测定方法。该标准的建立对于保证制剂质量、缩小制剂批间差异、确保临床疗效具有重要意义。
[1]李留霞.论缺血性脑中风的发病机理[J].光明中医,2007,22(5):14.
[2]刘亚敏,徐秋英.中医药治疗缺血性中风的现状[J].长春中医学院学报,2002,18(2):57.
[3]国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:220.
[4]李彦博,孙 静,弭 玮,等.银杏叶中总黄酮醇苷的含量测定[J].中国实用医药,2008,3(6):16.
[5]罗 瑛,高秋芳.高效液相色谱法测定银杏磷脂胶囊中总黄酮醇苷的含量[J].中外健康文摘(临床医药版),2007,4(10):16.
