缺血性脑损伤后OX1 R的表达变化及电刺激小脑顶核对其调节作用
2010-03-21贾延劼滕军放董为伟张博爱
彭 涛 贾延劼△ 滕军放 董为伟 谢 鹏 张博爱
1)郑州大学第一附属医院神经内科 郑州 450052 2)重庆医科大学神经病学研究所 重庆 410008
Orexin是一种下丘脑神经肽,参与肥胖、摄食、睡眠觉醒周期、激素分泌等多种生理活动[1]。研究发现,缺血性脑损伤可以导致皮层OX-1受体(OX1R)分布的改变[2]。预先电刺激小脑顶核(fastigial nucleus stimulation,FNS)对脑缺血具有明显的神经保护作用,其机制可能涉及多个环节[3-4]。但是FNS对于下丘脑神经肽系统的作用报道不多,在此基础上,本文通过研究FNS对缺血性脑损伤OX1R的影响,初步探讨FNS对下丘脑神经肽系统的作用及其机制。
1 材料与方法
1.1 主要试剂 山羊抗多克隆OX1R抗体均购自Santa C ruz公司;大鼠O rexin-A EIA试剂盒购自Peninsula Laboratories公司;SABC免疫组织化学试剂盒(山羊)购自武汉博士德公司;鹅膏氨酸购自Sigma公司;其余生化试剂均为进口分装或国产分析纯。
1.2 实验动物 健康雄性清洁级W istar大鼠,体质量200~250 g,由本校动物实验部授权使用。实验过程中对动物的饲养及取材均遵守实验动物管理条例的规定。
1.3 实验分组 随机分为假手术组(PO)、FNS假手术组(PO-FNS)、缺血组(PI)、缺血后FNS治疗组(PI-FNS),预先行小脑顶核毁损,再缺血行FNS治疗组(FNL-PI-FNS)。PO组进行FNS模型和MCAO手术操作,但不进行电刺激和插入丝线;缺血组及其相应FNS组均各分1 h、3 h、6 h、12 h及24 h五个亚组。
1.4 小脑顶核电刺激模型 参照Reis等方法[5]制备小脑顶核电刺激模型。排除及纳入标准:大鼠接受FNS干预后,虽有一过性呼吸、血压等生命体征的变化,但其小脑连续切片HE染色发现刺激部位不在小脑顶核者排除本研究。
1.5 毁损小脑顶核(lesioning cerebellar fastigial nucleus,FNL) 参照G lickstein SB等方法[6],制备毁损小脑顶核模型。排除及纳入标准:毁损小脑顶核(FNL)的大鼠,不同时相点断头取脑后,作小脑连续切片,尼氏染色发现小脑顶核内神经细胞数量减少、尼氏体大量消失,表明小脑顶核毁损成功者纳入本研究,其大脑可用于检测,否则排除本研究。
1.6 局灶性脑缺血模型 采用持续性MCAO模型[2]。
1.7 免疫组织化学染色 各组动物达到规定时间点时,采用10%水合氯醛麻醉,用20 m L注射器接穿刺针小心插入左心室,同时剪开右心耳,注入灭菌温生理盐水,直至流出的液体变清后,再灌注4%多聚甲醛0.1 mol/L PBS(pH 7.2)约60 m L,再断头取脑后置4%多聚甲醛0.1 mol/L PBS固定8 h,再转入30%蔗糖0.1 mol/L PBS(pH 7.2)中4℃平衡。组织块下沉后,连续冠状冰冻切片,片厚20μm。连续取2张切片(分别用于OX1R免疫组化染色、HE染色)后,间隔100μm,重复同样切片取片。应用SABC染色试剂盒进行免疫组化染色,计算平均OD值。
1.8 O rexin-A测定 下丘脑及血标本处理参考李峻岭等的方法[7]。采用酶联免疫法测定,吸收波长450 nm,标准曲线0~25 ng/m L,样品批内及批间变异系数均<7%。
2 结果
2.1 OX1R的免疫组织化学变化 PO组OX1R在许多脑区包括前额叶和大脑皮质、海马、室旁丘脑核、下丘脑腹内侧核、背缝核、蓝斑等广泛表达,所以本研究选取缺血侧(右侧)大脑皮层区观察OX1R表达。PO-FNS组的免疫反应性(平均OD值)相似(P>0.05)。
大脑皮层OX1R从缺血6 h开始显著增高,与PO组、PO-FNS组相比有显著性差异(P<0.05),以后随着缺血时间延长,平均OD值不断增高,缺血12 h达到高峰;缺血24 h,虽然显微镜视野内细胞基本崩溃,无法测定平均OD值,但间质内密布免疫反应阳性颗粒。PI-FNS组基本变化趋势类似于PI组,但与其相应PI组相比,其变化程度明显减低,差别具有统计学意义(缺血6 h、12 h组,P<0.05)。缺血24 h,虽然显微镜视野内细胞基本崩溃,但与其相应PI组相比,其完整细胞数量较多。FNL-PI-FNS组结果与PI组差异无统计学意义(P>0.05),但是与相应PI-FNS组差异有统计学意义(P<0.05),见图1。

表1 局灶性脑缺血后OX1R的免疫组织化学OD值的变化
2.2 Orexin-A测定 虽然各组血浆Orexin-A水平无显著性差异(P>0.05),但是下丘脑组织却有差异。PI组O rexin-A水平随着缺血时间延长,呈不断降低趋势。缺血12 h,与PO组、PO-FNS组相比,差异有统计学意义(P<0.05),缺血24 h,虽较缺血12 h有所升高,但是两者之间差异无统计学意义(P>0.05)。PI-FNS组在缺血12 h、24 h,与PO组、PO-FNS组相比,有显著性差异(P<0.05)。FNL-PI-FNS组结果与PI组差异无统计学意义(P>0.05),缺血12 h、24 h,与PO组、PO-FNS组、PI-FNS组相比,差异有统计学意义(P<0.05),见图2。
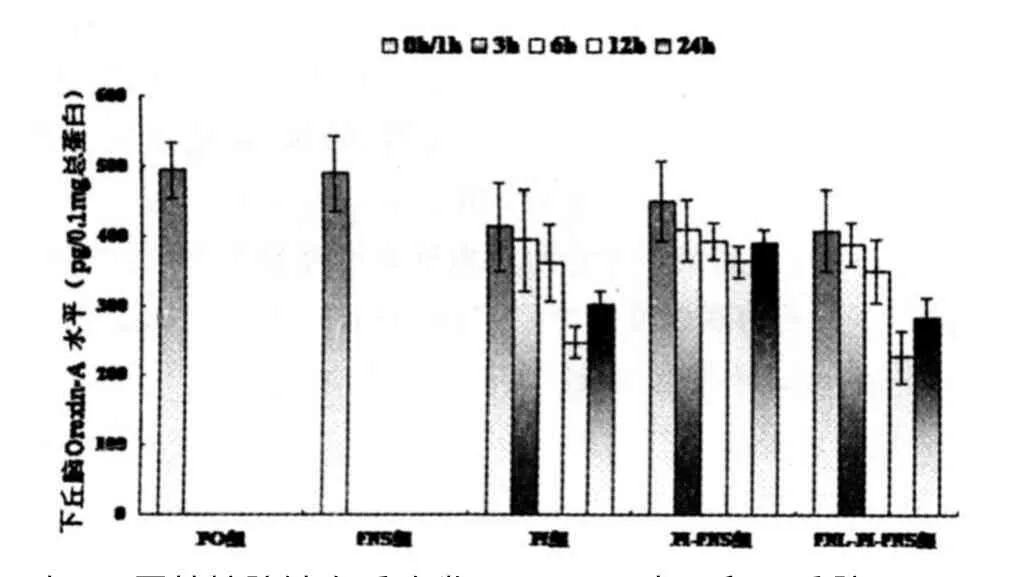
表2 局灶性脑缺血后血浆O rexin-A水平和下丘脑O rexin-A含量的变化
3 讨论
Orexin是下丘脑中的神经肽,最早在大鼠下丘脑外侧区(LH A)发现,现在已知O rexin存在A、B两个不同C-末端乙酰化的单体[1]。Orexin系统有两个G蛋白偶联受体:OX1R和OX2R。OX1R与神经肽Y2r结构相似,对Orexin-A比O rexin-B有更高的亲和力。OX2R则可与O rexin-A及O rexin-B结合。因此一般认为OX1R是Orexin-A的选择性受体[1]。本研究发现,持续性MCAO模型大鼠在缺血早期(<3 h),O rexin系统改变不明显;随着缺血时间的延长,在缺血中期(3~12 h),皮层的OX1R蛋白表达增高,与此同时,下丘脑组织O rexin-A含量减少;缺血后期(>12 h),下丘脑组织O rexin-A逐步增多,这一结果与Irving等报道类似[2]。其机制尚不清楚,可能与O rexin系统在应激反应中作用有关。已有报道,O rexin参与调节儿茶酚胺、糖皮质激素、血糖水平等与缺血应激相关事件及交感神经系统兴奋性[8-9]。缺血早期,O rexin-A尚未对应激条件产生效应;缺血中期,由于免疫和应激反应刺激O rexin-A释放,O rexin-A可以促进神经肽Y、皮质激素释放因子(CRF)、ACTH升高,进而导致糖皮质激素、肾上腺素的增加。但是,体内交感、副交感神经系统过度活化,大量的CRH、糖皮质激素和神经肽Y对Orexin-A产生更强烈的反馈抑制作用,加上自由基对Orexin-A的破坏作用,最终使O rexin-A表达下调,皮层的OX1R反应性增高;缺血后期,免疫和应激反应逐渐减弱,CRF、糖皮质激素自由基和神经肽Y水平下降,O rexin-A表达开始上调,恢复新的平衡[10-11]。对于慢性脑缺血也有类似的情况[12]。
预先电刺激小脑顶核(Fastigial Nucleus Stimulation,FNS)对脑缺血具有明显的神经保护作用,其机制可能涉及抑制病灶周围电活动、减少缺血区脑组织白细胞浸润及血管炎症反应、降低神经细胞兴奋性损害、下调nNOS表达,抑制钙蛋白酶的活性及阻断细胞凋亡事件等多个环节[3]。本研究表明,预先FNS可以显著的减轻缺血对O rexin-A系统的影响,抑制皮质OX1R反应性增高。而且,毁损小脑顶核后,这种调节作用消失。由于Orexin参与摄食、能量代谢、觉醒等许多最基本的活动,O rexin水平的降低,将直接影响机体基本生理活动的进行。例如,O rexin-A水平的降低后,导致胆碱能、单胺能、5-羟色胺能神经元兴奋性下降,胆碱能神经元活动相对增加,抑制了皮质活动,觉醒程度下降,造成睡眠-觉醒周期的紊乱,可能导致卒中后睡眠障碍的发生[13]。因此,预先FNS通过调节缺血性脑损伤后OX1R表达的变化,维持神经内分泌系统的稳定,对于缺血性脑损伤的治疗和康复将具有深远的意义。
[1] Tsu jino N,Sakurai T.Orexin/Hypocretin:a neuropeptide at the interface of sleep,energy homeostasis,and reward system[J].Pharmacol Rev,2009,61(2):162-176.
[2] Irving EA,Harrison DC,Babbs AJ,et al.Increased cortical expression of the orexin-1 receptor following permanent middle cerebral artery occlusion in the rat[J].Neurosci Lett,2002,324:53-56.
[3] 董为伟.电刺激小脑顶核与中枢神经源性神经保护[J].中国工程科学,2001,3:32-38.
[4] Zhao YY,Guo L,Du J,et al.The orexin system in insulin resistance rat model induce by high-fructose diet[J].Chin M ed Sci J,2003,18:150-154.
[5] Reis DJ,Kobylarz K,Yamam oto S,et al.Briefelectrical stimulation of cerebellar fastigial nucleus conditions long-lasting salvage from focal cerebralischemia:conditioned central neu rogenic neuroprotection[J].Brain Res,1998,780:161-165.
[6] Glickstein SB,Ilch CP,Reis DJ,et al.Stimulation of the subthalamic vasodilator area and fastigial nucleus independently protects the b rain against focal ischemia[J].Brain Res,2001,912:47-59.
[7] 李峻岭,郑法雷,谭会兵,等.慢性肾功能衰竭大鼠下丘脑组织和血浆食欲素A及神经肽Y水平的变化及其意义[J].中华医学杂志,2003,83:992-995.
[8] DohiK,Nishino S,Nakamachi T,et al.CSF orexin A con cen-trations and expressions of the orexin-1 receptor in rat hippocampus after cardiac arrest[J].Neuropeptides,2006,40:245-50.
[9] Stricker-K rongrada A,Beck B.Modulation of hy pothalamic hypocretin/Orexinm RNA expression by glucocorticoids[J].Biochem Biophys Res Commun,2002,296:129-133.
[10] Taylor MM,Sam sonWK.The other side of theO rexins:endocrine and metabolic actions[J].Am J Phy siol Endocrinol Metab,2003,284:E13-17.
[11] Nakamachi T,Endo S,Ohtaki H,et al.Orexin-1 receptor expression after global is chemia in mice[J].Regul Pept,2005,126:49-54.
[12] 吕瑞娟,张博爱,贾延劼.慢性脑缺血大鼠脑OX-1R表达的变化[J].中国病理生理杂志,2008,24:519-522.
[13] Hermann DM,Bassetti CL.Sleep-related breathing and sleep-wake disturbances in ischemic stroke[J].Neurology,2009,73:1 313-1 322.
