高产D-乳酸生产菌株的选育
2010-03-15于培星
于培星
(河南金丹乳酸科技有限公司,河南郸城477150)
D-乳酸是重要的手性中间体与有机合成原料,是多种手性物质的前体,广泛应用于制药、化妆品和高效低毒农药及除草剂等领域的手性合成。D-乳酸市场前景广阔,D-乳酸的工业生产主要采用微生物发酵法[1-3],目前国外仅有2~3家D-乳酸生产企业,而我国目前尚未开展D-乳酸制备方面的研究,也没有工业化生产的企业,因此研究开发D-乳酸生产技术,对于扩大我国乳酸产品的种类和应用领域具有十分重要的意义。微生物发酵法[4]利用可再生的淀粉质资源为主要原料生产D-乳酸,具有生产成本低、产物光学纯度高、生产条件温和、污染小等优点,是目前生产D-乳酸的主要方法。国外的D-乳酸发酵生产中采用的生产菌株有德氏乳杆菌、保加利亚乳杆菌和左旋乳酸芽孢杆菌[5]等。作者选用了所产D-乳酸纯度较高、糖酸转化率高的凝结芽孢乳杆菌作为出发菌株,通过物理与化学复合诱变筛选出一株D-乳酸光学纯度高、产酸率高的突变株,为D-乳酸的发酵生产奠定了基础。
1 材料和方法
1.1 材料
1.1.1 出发菌株 JD-063D,河南金丹乳酸科技有限公司技术中心分离选育和保藏。
1.1.2 培养基 MRS培养基:蛋白胨 10.0 g,肉浸膏10.0 g,酵母抽提物5.0 g,葡萄糖20.0 g,三水醋酸钠晶体5.0 g,柠檬酸三铵2.0 g,K2HPO42.0 g,MgSO4·7H2O 0.2 g,MnSO4·2H2O 0.05 g,Tween 801.0 mL,蒸馏水定容1 000 mL,调节p H值为7.0,高压115℃灭菌15 min,固体培养基加入琼脂15.0 g。
种子培养基:葡萄糖40 g,蛋白胨20 g,酵母抽提物10 g,碳酸钙10 g,分装250 mL三角瓶,每瓶40 mL,8层纱布扎口,高压115℃灭菌15 min。
摇瓶发酵培养基:葡萄糖160 g,蛋白胨1.5 g,酵母粉15.0 g,柠檬酸三铵2.0 g,K2HPO42.0 g,MgSO4·7H2O 0.2 g,MnSO4·2H2O 0.05 g,Tween 80 1.0 mL,蒸馏水1 000 mL,高压115 ℃灭菌15 min。
1.1.3 试剂 酵母抽提物、蛋白胨:英国 OXOID公司产品;L-乳酸标样:Sigma公司产品;L-和D-乳酸试剂盒:山东省科学院提供;葡萄糖、K2HPO4等主要试剂均为分析纯。
1.1.4 主要仪器设备 5升发酵罐:上海保兴生物设备工程有限公司产品;250B型恒温培养箱:江苏金坛大中仪器厂产品;752型紫外分光光度计:郑州市精科分析仪器有限公司产品;数码生物显微镜:上海光学仪器厂产品;PHS—2C型酸度计:上海伟业仪器厂产品、SBA-生物传感分析仪:山东省科学院生物研究所产品;台式离心机:上海科学仪器厂产品;全自动高压蒸汽灭菌器:上海申安医疗器械厂产品。
1.2 方法
1.2.1 紫外线(UV)诱变 出发菌株经活化培养后,制备细胞菌悬液。取5 mL菌悬液放置于经过灭菌的带磁力棒的培养皿(直径90 mm)中,培养皿放置在磁力搅拌器载物台上,开启搅拌器,在的紫外灯下(距离为30 cm)边照射边搅拌,并计时。分别在 0.5、1.0、1.5、3.0、5.0 min 各取 2 mL 菌液混合,进行倍数稀释后,涂布于p H4.2的 YE平板,45℃,培养箱避光培养[6-8]。
1.2.2 硫酸二乙酯(DES)诱变 向一定浓度的菌悬液中加入1%的DES,振荡20~120 min后立即加入质量分数25%的Na2S2O3溶液终止反应,处理后的菌悬液稀释至一定浓度涂布于p H 4.0的 YE平板,45℃,恒温振荡培养箱培养48 h。计算DES不同处理时间的致死率和形态变异率,确定DES的最适处理时间。
1.2.3 钴60诱变 取10 mL菌悬液于无菌试管中,分别以 15、10万伦琴进行钴 60γ-射线照射处理。
1.2.4 微波诱变 取10 mL菌悬液放入直径15 cm的平皿中,调整微波功率为650 W,脉冲频率为2 450 Hz,辐照处理 20、40、60 s,迅速取出作稀释处理。
1.2.5 发酵试验 将JD-063D和复合诱变后突变菌株于50℃MRS静止过夜培养,再接种于MRS培养基中,50℃培养15 h,按体积分数5%接种量于5 L发酵罐,3.5 L工作体积,转速150 r/min,以质量分数25%的Ca(OH)2控制发酵液p H值。每隔两小时取样,测定菌体密度(A600)、乳酸浓度和葡萄糖质量浓度。
1.3 分析方法
1.3.1 生物量分析 细胞密度用紫外分光光度计测定A600:将发酵液离心后收集菌体,生理盐水洗涤两次,然后重悬于生理盐水中,调整细胞密度A600在10左右,取50 mL菌体溶液于称量瓶中105℃干燥至恒重,称重并计算。每单位菌体密度相当于0.35 g/L菌体干重。
1.3.2 EDTA滴定法定量分析乳酸钙 取发酵液2 mL,8 000 r/min,离心5 min,取上清液1 mL于100 mL的蒸馏水中,加入1.0 mol/L的NaOH 10 mL,加钙指示剂2滴,用 0.05 mol/L EDTANa2试剂滴定,终点为溶液颜色变为纯蓝色。由滴定的EDTANa2体积计算乳酸钙和乳酸的含量。计算公式如下:
其中:V为滴定消耗EDTANa2的量(mL);c为EDTANa2的浓度(mol/L)
1.3.3 乳酸分析 发酵液中乳酸用 HPLC方法检测[9],实验仪器为美国 Waters2575高效液相色分析仪,检测条件如下:
色谱分离柱:SCR-101H柱;检测器:1525紫外检测器;流动相:0.01 mol/L
磷酸盐缓冲溶液(p H 2.5);流动相流速:0.8 mL/min;紫外检测波长:210 nm;柱温:30 ℃;进样量:5μL。
L-和D-乳酸采用手性色谱柱进行分离测定。
发酵液L-乳酸采用SBA-40C葡萄糖-乳酸生物传感分析仪分析[10]。
1.3.4 葡萄糖分析 采用费林试剂法和SBA-40C葡萄糖-乳酸生物传感分析仪分析。
2 结果与分析
2.1 出发菌株选育
出发菌株凝结芽孢JD-063D在固体平板培养上培养时,形成微小圆形菌落,在CaCO3—MRS平板上培养48 h后,菌落呈白色,且在菌落周围能形成明显的透明圈和变色圈。将变色圈明显和透明圈大的菌落转入试管保存,并作为诱变的出发菌株。
2.1.1 出发菌株降糖曲线和产酸曲线 按照2.1所述方法,在发酵培养基中进行培养,JD-063D葡萄糖发酵结果如图1所示。
由图1可以看出JD-063D乳酸发酵主要代谢葡萄糖产生乳酸,随着发酵液中葡萄糖质量浓度的逐步下降,乳酸质量浓度逐渐增加,当发酵液中葡萄糖质量浓度下降到25 g/L以后,产酸基本停止,葡萄糖也不再被消耗,故确定最终发酵时间为92 h,此时发酵产酸61 g/L,葡萄糖转化率为85.6%。
2.1.2 出发菌株JD-063D的生长曲线 出发菌株JD-063D在种子培养基中,45℃静止培养的生长曲线如图2所示。
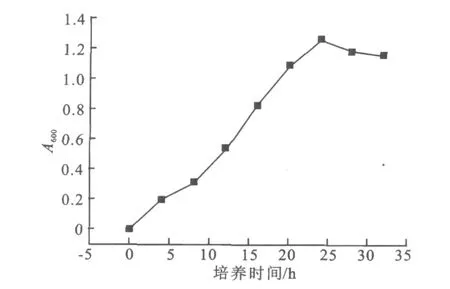
图2 出发菌株JD-063的生长曲线Fig.2 G rowth curve of the starting strain JD-063D
由图可知,JD-063D在培养8 h后进入对数生长期,菌体量呈现出指数增长,同时p H值开始下降。在14~16 h左右对数生长结束,转入稳定期,使A600保持1.2以上,故选取培养时间为12 h的细胞作为诱变用菌体。
2.2 D-乳酸生产菌的诱变路线
D-乳酸生产菌的诱变路线,见图3。

图3 D-乳酸生产菌的诱变路线图Fig.3 Mutant roadmap of D-lactic acid production strain
2.3 D-乳酸生产菌株诱变选育结果与讨论
以凝结芽孢杆菌JD-063D为出发菌株,经紫外线、硫酸二乙酯、钴60γ-射线、微波进行交替诱变处理,其诱变结果如表1。
从表1可以看出,以凝结芽孢杆菌JD-063D为出发菌株,采用紫外线诱变时间为5~20 min,共挑选菌株59株,经发酵筛选后获得正突变株33株,其中ZLA-18产酸较高,产酸87 g/L,较出发菌株(61 g/L)提高42.6%,产酸提高幅度较大,效果非常明显。又以ZLA-18为出发菌株,用硫酸二乙酯进行不同时间的诱变处理,共挑选菌落51株,经发酵试验初筛获得正突变株17株,其中 ZLB-47产酸较高,产酸率达到110 g/L,较出发菌株提高26.4%,以ZLB-47为出发菌株进行钴60γ-射线辐照处理,根据经验选择剂量为15万、10万伦琴,共挑选菌落38株,初筛后获得正突变株 17株,其中 ZLC-26、ZLC-28产酸较高,产酸率分别达到128、123 g/L,较出发菌株分别提高11.63%和11.18%,经重复试验,ZLC-26重现性较ZLC-28好。产酸提高幅度不大的原因可能是菌株敏感度降低或钴60γ-射线处理剂量不够造成;然后以ZLC-26为出发菌株,选择了微波诱变,分别处理20、40、60 s,挑选菌株57株正突变27株,ZLD-58产酸较高,产酸率达到145 g/L,产酸率较出发菌株 ZLC-26提高13.28%,较原出发菌株JD-063D提高137.7%,取得良好效果,将突变菌株ZLD-58命名为JD-76D。
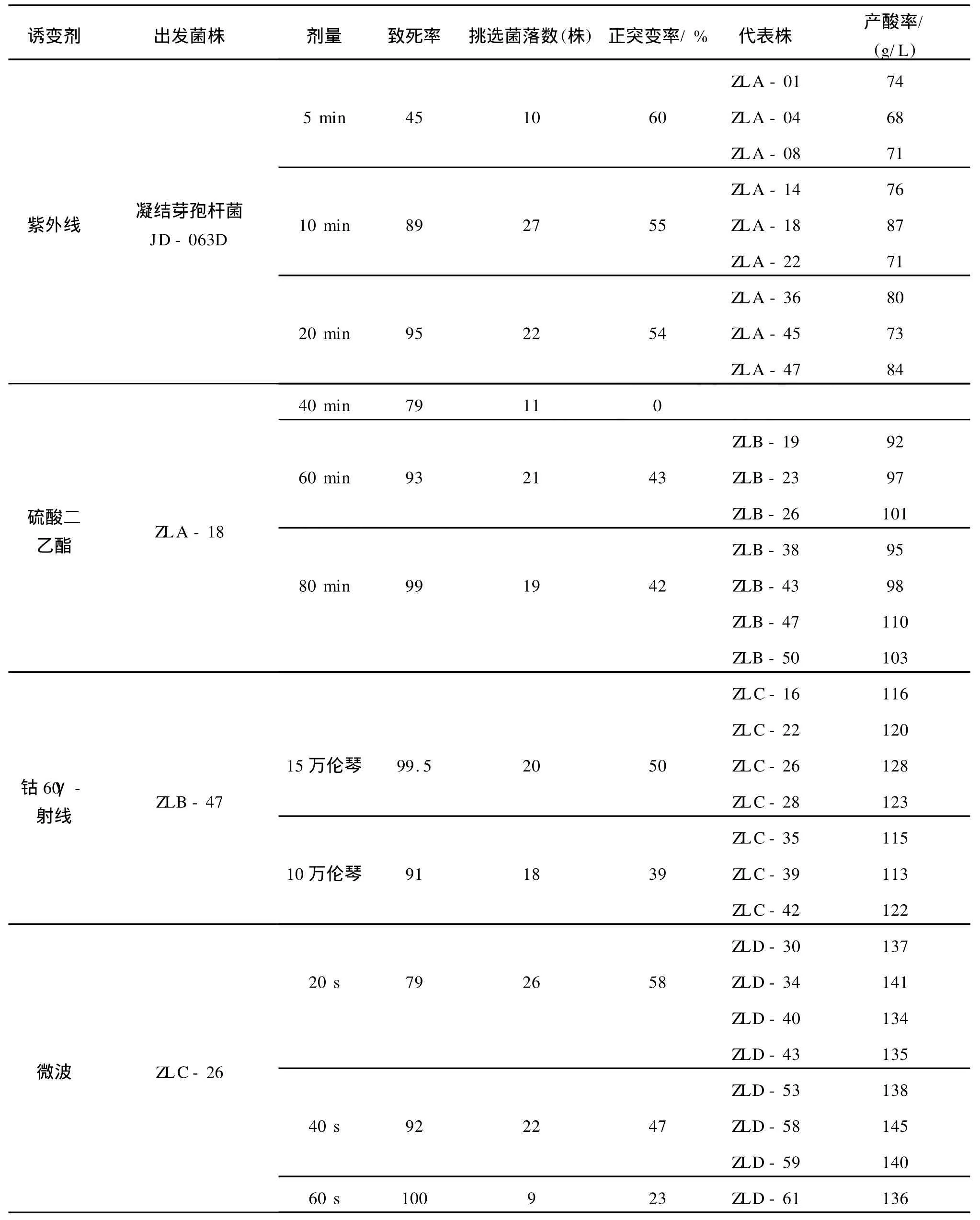
表1 D-乳酸生产菌株诱变选育结果Tab.1 The mutation results of D-lactic acid production strain
2.4 突变菌株的发酵性能试验
将复合诱变得到的突变菌株JD-76D与出发菌株JD-063D分别在含15%CaCO3的发酵培养基的摇瓶中发酵48 h,观察其乳酸发酵情况。结果如图4所示,复合诱变的突变菌株JD-76D产酸率提高显著,产酸速率提高了59%。,而多次复合诱变得到的菌株JD-76D的产酸速率在1.50 g/(L·h)左右,比出发菌株提高0.3 g/(L·h)。
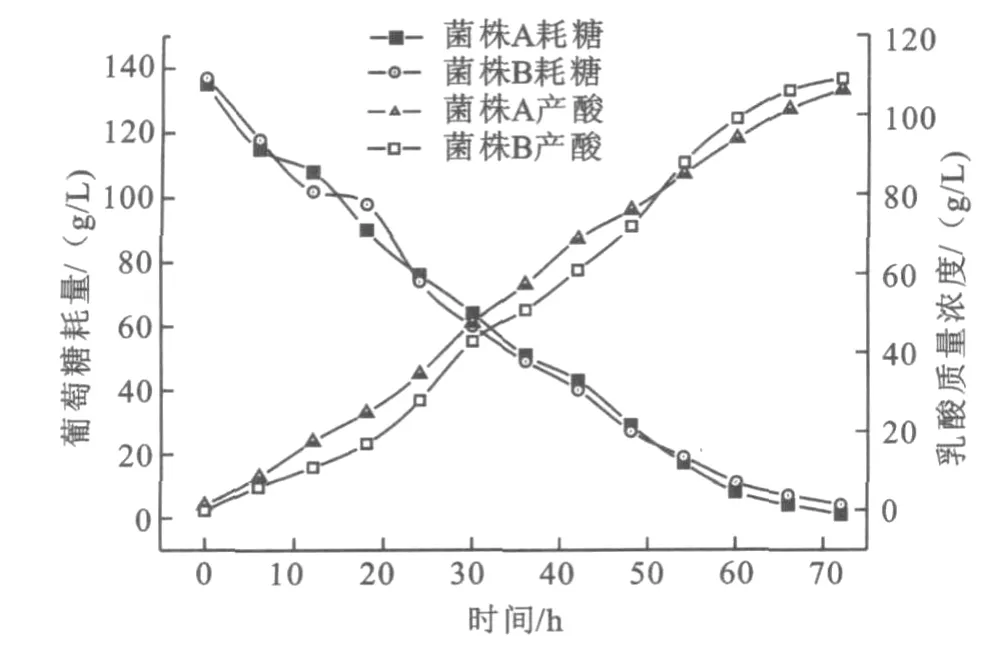
图4 复合诱变后菌株JD-76D的耗糖与产酸曲线Fig.4 The curves between glucose and lactic acid of JD-76D after multiple mutation
2.5 突变菌株的稳定性试验
为了确保筛选到的高产菌JD-76D的遗传稳定性,对其做了遗传稳定性考察。每代实验过程:高产菌株自然分离→单菌落→斜面→种瓶→摇瓶发酵,测L-乳酸产量等指标。共传10代,每代均做3个平行样。突变菌株JD-76D产酸基本维持在145 g/L左右,产酸速率维持在1.50 g/(L·h)左右,D-乳酸纯度98.5%以上,其发酵产品液相色谱图见图5,说明菌株JD-76D遗传稳定性较好。
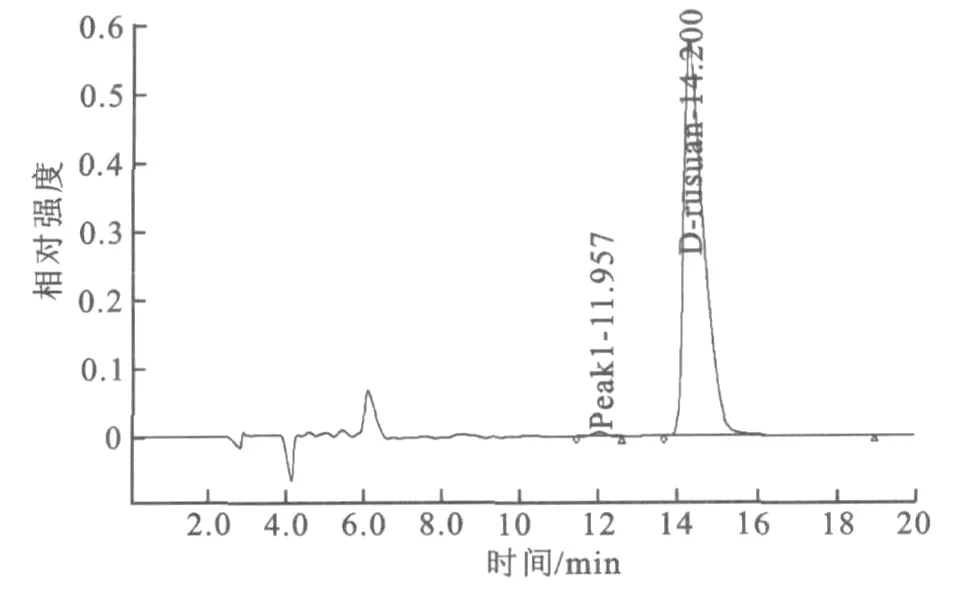
图5 菌株ZLD-58发酵产品液相色谱检测结果Fig.5 The testing results of the fermentation product of Strain ZLD-58 using liquid chromatography
3 结 语
通过对出发菌株JD-063D进行物理化学复合诱变,筛选得到了一株高产菌株JD-76D,产酸由出发菌株的61 g/L提高到145 g/L、D-乳酸纯度由原菌株的97.5%增加到98.7%以上,该菌株通过工艺优化有着较高的工业化生产应用价值。
[1]金其荣,张继,徐勤.有机酸发酵工艺学[M].北京:中国轻工业出版社,2000,339-406.
[2]刘振民,骆承痒.乳酸菌发酵制剂生物工程技术[J].食品与发酵工业,2000,26(4):68-72.LIU Zhen-min,LUO Cheng-yang.Progress in biotechnology of lactic acid bacteria strarter cultures[J].Foodand Fermentation Industries,2000,26(4):68-72.(in Chinese)
[3]陈坚,堵国成,李寅,等.发酵工程实验技术[M].化学工业出版社,2003.230-298.
[4]杜连样.乳酸菌及其发酵制品生产技术[M].天津科技出版社,1999.183.
[5]杨洁彬,郭兴华,凌代文,等.乳酸菌——生物学基础及运用[M].北京:中国轻工业出版社,1996.174-184.
[6]赵有玺,龚平.雄甾烯酮转化菌的诱变育种和发酵条件优化[J].食品与生物技术学报,2010,29(1):150-154.ZHAO You-xi,GONG Ping.Mutant and optimization of androstenone translation strain mycobacterium sp.SH5[J].Journal of Food Science and Biotechnology,2010,29(1):150-154.(in Chinese)
[7]Zhou Y,Guo X C,Yi T,et al.Two continuous spectrophotometric assays for methionine aminopeptidase[J].Analytical Biochemistry,2000,280(1):159-165.
[8]Ara K,Meguro S,Hase T,et al.Effect of spore-bearing lactic acid forming bacteria(Bacillus coagulans SANK 70258)administration on the intestinal environment,defection frequency,fecal characteristics and dermal characteristics in humans and rats[J].Microbial Ecology in Health and Disease,2002,14(1):4-13.
[9]凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[10]天津轻工业学院,大连轻工业学院,无锡轻工业学院,等.工业发酵分析[M].北京:轻工业出版社,1994.
