假单胞菌L-3对氧化乐果降解条件的优化
2010-03-15王立东阮长青郎双静
王立东, 阮长青, 郎双静
(1.黑龙江省农产品加工工程技术研究中心,黑龙江大庆163319;2.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
氧化乐果是目前中国常用的大吨位农药品种之一,虽然该农药的使用为保证农作物的丰收起到了重要的作用,但其高毒、对农产品和环境存在较严重的污染等问题,越来越引起人们的重视[1]。微生物降解是消除有机磷农药污染最主要的途径,国外从20世纪50年代开始研究有机磷农药的治理技术,确认微生物降解有机磷农药具有费用省、环境影响少、可最大限度降低污染物浓度、可用于其他技术难以应用的场地等优点[2-3]。Wackett等[4]从土壤中分离出一株假单胞菌能降解除草剂阿特拉津,能以阿特拉津为惟一氮源,在90 min内使100 mg/L阿特拉津完全降解。杨惠芳等5]研究发现,添加降解菌可促进土壤中杀虫剂单甲咪的降解。由此可见,用微生物控制农药污染的生物修复技术显示出广阔的应用前景,但是由于农药污染环境的化合物组成很不稳定,环境中温度、p H值及通气量等波动也较大,有可能抑制特定优势微生物的生长。另外,投放到环境中去的特定微生物种群还会受到该环境土著微生物种群的影响,甚至受到拮抗而不能在该环境中成为优势种群[6-8]。
作者通过对实验室筛选出的菌株L-3对氧化乐果降解培养基及环境条件的优化,希望探寻更有利于菌体生长的条件,从而提高对氧化乐果的降解效果,为氧化乐果降解试验的进一步研究提供依据。
1 材料与方法
1.1 试验仪器
GC-9900气相色谱仪:上海科创色谱仪器有限公司制造;NDP-9052型电热恒温培养箱、TGL-16B台式离心机、722S型分光光度计:上海精密科学仪器有限公司生产;LRH-280型微电脑控制生化培养箱:广东省医疗器械厂制造;SG2型p H计:梅特勒-托利多仪器上海有限公司生产。
1.2 培养基与试剂
普通培养基:牛肉膏 3.0 g,蛋白胨 10.0 g,NaCl 5.0 g,蒸馏水 1 000 mL,p H 7.0。
基础培养基:NaCl 0.5 g,KH2PO40.5 g,K2HPO41.5 g,MgSO40.5 g,蒸馏水1 000 mL,p H 7.0。
分离培养基A:NH4NO30.5 g,Na2HPO41.19 g,KH2PO40.45 g,MgSO40.45 g,琼脂 15 g,蒸馏水1 000 mL,p H 7.0,使用前加入500 mg/L氧化乐果溶液。
分离培养基B:NaNO32 g,KCl 0.5 g,MgSO40.5 g,MnSO40.10 g,BaCl20.05 g,CaCl20.05 g,琼脂15 g,蒸馏水1 000 mL,p H 7.0,使用前加入500 mg/L氧化乐果溶液。
发酵培养基:蔗糖17 g,牛肉蛋白胨9.2 g,KH2PO41.84 g,KCl 1.0 g,MgSO40.50 g,MnSO40.10 g,BaCl20.05 g,CaCl20.05 g,蒸馏水 1 000 mL,p H 7.0,氧化乐果500 mg/L。
菌种:黑龙江八一农垦大学食品学院实验室分离制得,鉴定为假单胞菌,命名为L-3。
农药试剂:40%氧化乐果乳油,北京金宏大生化有限公司产品。
1.3 菌株活化的方法
接种菌株于普通培养基中,30℃下于160 r/min振荡培养 12~18 h,备用[8]。
1.4 气相色谱的检测条件、方法及降解率的计算方法
1.4.1 检测条件 GC-9900气相色谱仪。条件:不锈钢柱SE-30(4 mm×1 m)。柱温180℃、气化室225℃、检测器温度220℃;氮气流量50 mL/min,氢气流量60 mL/min,空气流量46 mL/min;检测器为FPD。
1.4.2 检测方法 采用国标GB/T 14552-2003的方法进行测定。
1.4.3 降解率计算

1.5 试验方法
1.5.1 碳源的选择及其质量浓度对氧化乐果降解的影响 在含500 mg/L氧化乐果的分离培养基A中分别加入0.5 g/dL的不同碳源,并将制备好的菌悬液以3%的接种体积分数接入到培养液中,在p H 7.0、30 ℃、160 r/min振荡培养3 d,用气相色谱法测定降解前后氧化乐果的质量浓度,计算降解率,同时测定OD600值。
将优选出最适碳源以不同质量浓度添加到含500 mg/L氧化乐果的分离培养基A中,测定不同底物质量浓度条件下氧化乐果的降解率,选出最适碳源质量浓度。
1.5.2 氮源的选择及质量浓度对氧化乐果降解的影响 以相同质量浓度的其它氮源代替含500 mg/L氧化乐果的分离培养基B中的NaNO3,并将制备好的菌悬液以3%的接种体积分数接入到培养液中 ,在 p H 7.0、30 ℃、160 r/min 振荡培养 3 d,用气相色谱法测定降解前后氧化乐果的体积分数,计算降解率,同时测定OD600值。
将优选出最适氮源以不同质量浓度添加到含500 mg/L氧化乐果的分离培养基B中,测定不同氮源质量浓度条件下氧化乐果的降解率,选出最适氮源质量浓度。
1.5.3 磷源的选择及质量浓度对氧化乐果降解的影响 在含500 mg/L氧化乐果的分离培养基A和分离培养基B中加入一定的蔗糖,接种培养3 d后,测定不同培养基中氧化乐果的降解率,并过对培养基中成分进行分析。
将优选出磷源以不同质量浓度添加到含500 mg/L氧化乐果的分离培养基B中,测定不同磷源质量浓度条件下氧化乐果的降解率,选出最适磷源质量浓度。
1.5.4 二次回归正交旋转实验确定降解培养基降解培养基中C、N、P最佳质量浓度的确定采用二次回归正交旋转组合设计,实验因子的水平及编码见表1[9]。数据统计分析:采用DPS软件(3.01专业版)进行数据统计分析。
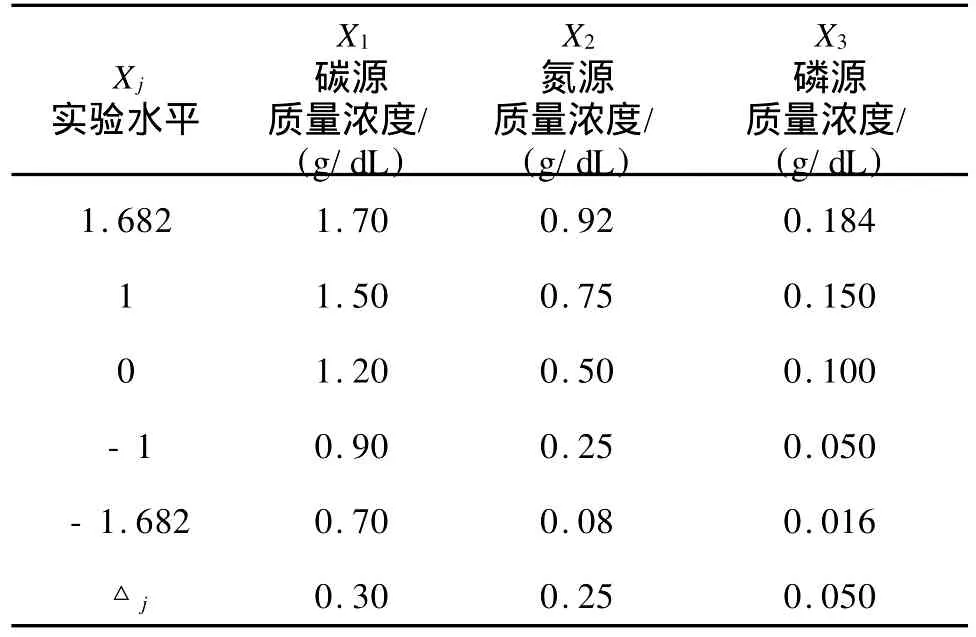
表1 实验因素与水平Tab.1 Test facts and levels
1.5.5 不同环境条件对降解的影响
1)不同p H值对降解效率的影响:制备菌悬液,以3%的接种体积分数接种于优化的降解培养液中,调p H 值依次为 5、6、7、8、9、10,添加 500 mg/L氧化乐果,设不接菌的空白为对照,每处理重复3次,测定降解率。
2)不同温度对降解效率的影响:制备菌悬液,以3%的接种体积分数接种于含500 mg/L氧化乐果的100 mL优化的降解培养液(p H 7.0)中,同时设不接菌的空白对照 ,分别于 15、20、25、30、35、40℃控温摇床培养72 h,摇床转速160 r/min,每处理重复3次,测定降解率。
3)不同接种接体积分数对降解效率的影响:制备菌悬液,分别以 1%、2%、3%、4%、5%的接种体积分数接种于含500 mg/L氧化乐果的100 mL优化的降解培养液(p H 7)中,30 ℃、160 r/min,摇床培养72 h,设不接菌的空白对照,每处理重复3次,测定降解率。
4)不同初始氧化乐果的质量浓度对菌株L-3降解效率的影响:制备菌悬液,分别接种于含50、100、200、400、800 mg/L 氧化乐果的 100 mL 优化的降解培养液中,30℃、160 r/min振荡培养,每隔24 h测定氧化乐果的降解率,绘制生长曲线。
2 结果与讨论
2.1 不同碳源对L-3菌落降解氧化乐果能力的影响
不同碳源对氧化乐果降解效率的影响见图1。由图1可以看出,添加的碳源中,蔗糖的降解率最高,降解率高达72.03%,添加葡萄糖、果糖、乳糖的培养液也能够降解氧化乐果,但稍低于蔗糖,添加可溶性淀粉的培养液对氧化乐果的降解率很低,所以选择蔗糖作为培养液的碳源;培养基中菌体的生长状况与对氧化乐果降解情况一致,即在碳源为蔗糖时菌体的生长量也达到最大。
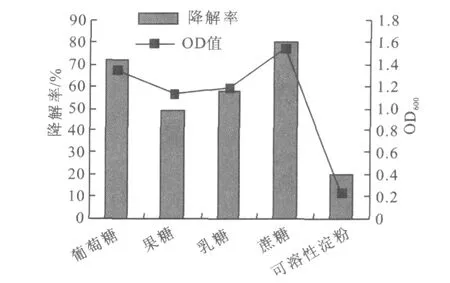
图1 碳源对氧化乐果降解的影响Fig.1 Influence of different carbon source during degradation
2.2 蔗糖质量浓度对L-3菌降解氧化乐果的影响
不同的蔗糖质量浓度对氧化乐果降解效果的影响见图2。
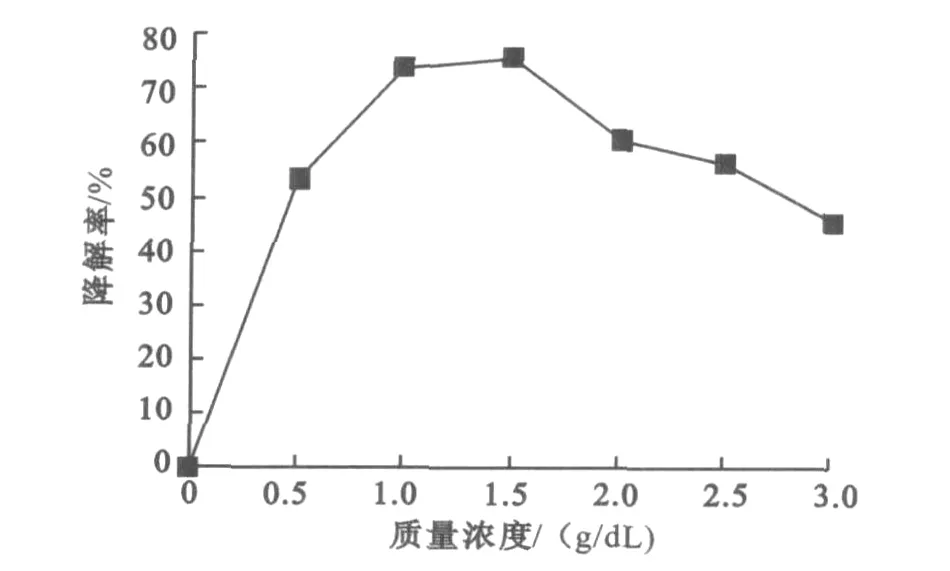
图2 不同蔗糖质量浓度对氧化乐果降解的影响Fig.2 Effect of sucrose concentration on degradation rate
从图2可以看出,在氧化乐果质量浓度一定的条件下,无蔗糖的存在,菌株不能降解氧化乐果,随着蔗糖质量浓度的升高,菌株对氧化乐果的降解率明显提高,菌株含量在1%~1.5%的范围时,氧化乐果的降解率最高,随着蔗糖质量浓度进一步升高,降解率反而下降。
2.3 不同氮源对L-3菌落降解氧化乐果能力的影响
不同的氮源对氧化乐果降解效率的影响见图3。从图3可以看出,有机氮比其它无机氮有利于菌体的生长,降解效果好。在有机氮中,牛肉蛋白胨的降解效果高于胰蛋白胨和酵母浸粉,为最适的氮源;培养基中菌体的生长状况与对氧化乐果的降解情况一致,即在氮源为牛肉蛋白胨时菌体的生长量达到最大。
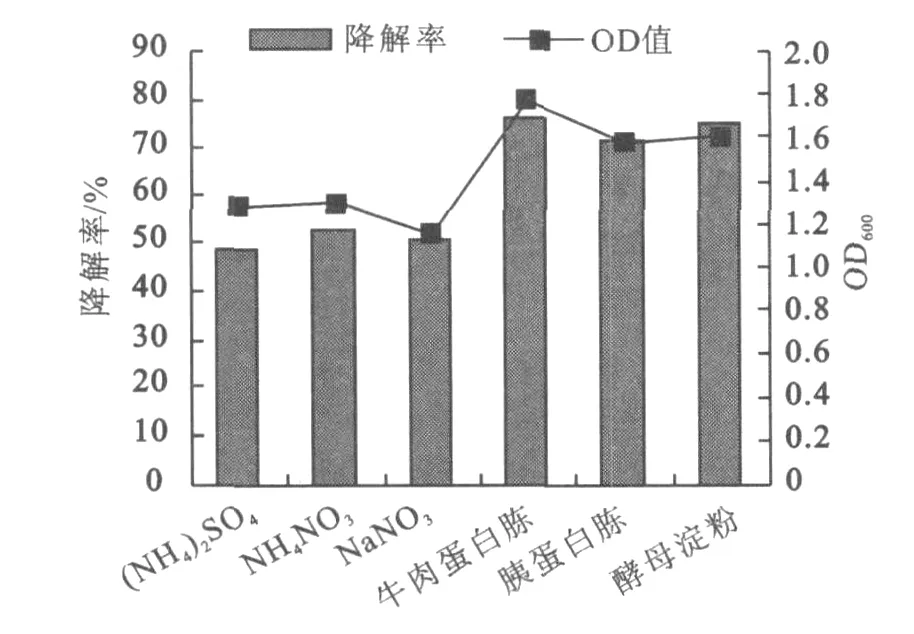
图3 不同氮源对氧化乐果降解率的影响Fig.3 Influence of different nitrogen source during degradation
2.4 牛肉蛋白胨质量浓度对L-3菌降解氧化乐果的影响
不同的牛肉蛋白胨质量浓度对氧化乐果降解效果的影响见图4。
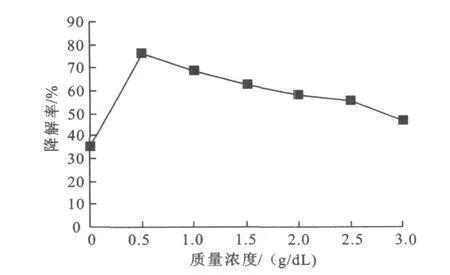
图4 不同牛肉蛋白胨质量浓度对氧化乐果降解率的影响Fig.4 Effect of different beef peptone concentration on degradation rate
从图4可以看出,在未添加外加氮源时,菌株能够降解氧化乐果,说明菌株能以氧化乐果为惟一氮源生长。当牛肉蛋白胨的质量浓度为0.5 g/dL时,降解效果最好,降解率高达76.32%,随着牛肉蛋白胨质量浓度的增加,降解率有所下降。
2.5 KH2PO4质量浓度对L-3菌降解氧化乐果的影响
不同磷源培养基中氧化乐果的降解率见表2。通过表2可以看出,接种3 d后的分离培养基A中的氧化乐果的降解率为74.34%,分离培养基B中的降解率为45.67%,分离培养基A比分离培养基B高出相差28.67%。同时分离培养基B中不含磷元素,说明菌株能够以氧化乐果为惟一磷源,磷钼蓝分光光度法检测发酵液无磷酸生成。

表2 不同磷源培养基中氧化乐果的降解率Tab.2 Degradation rate of different phosphorus source medium
KH2PO4质量浓度对氧化乐果降解率的影响见图5。由图5可以看出,加入一定量的 KH2PO4对降解有促进作用,当 KH2PO4的质量浓度为0.1 g/dL时,降解效果最好,降解率高达78.58%,随着KH2PO4质量浓度的增大,降解率有所下降。
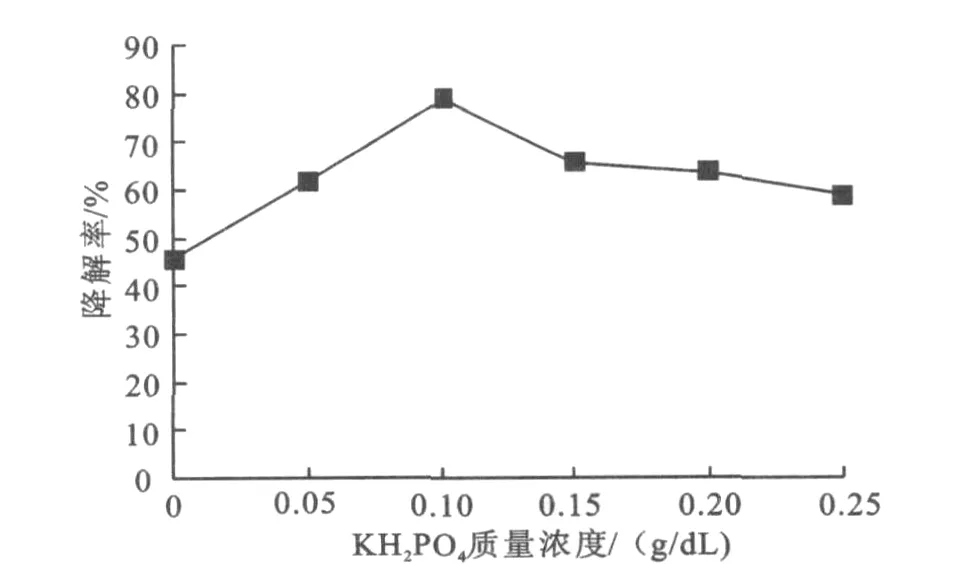
图5 KH2PO4质量浓度对氧化乐果降解率的影响Fig.5 Effect of KH2PO4concentration on degradation rate
2.6 二次正交实验结果与分析
通过以上的单因素实验研究了培养基的C,N,P组分对降解的影响,最佳C,N,P质量浓度为:蔗糖1.50 g/dL,牛肉蛋白胨 0.5 g/dL,KH2P040.1 g/dL。根据单因素最佳C,N,P含量确定因素的上下限,从而进一步通过二次正交实验确定降解培养基的组成。各处理的降解率的测定结果见表3。
2.6.1 回归方程的建立 为考察各因素对氧化乐果降解的影响,根据表3中试验结果,以降解率为指标,对实验结果进行分析,见表4,可得出三因素与降解率之间的回归方程为:
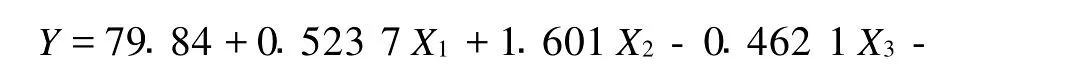
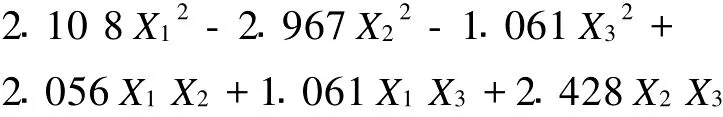
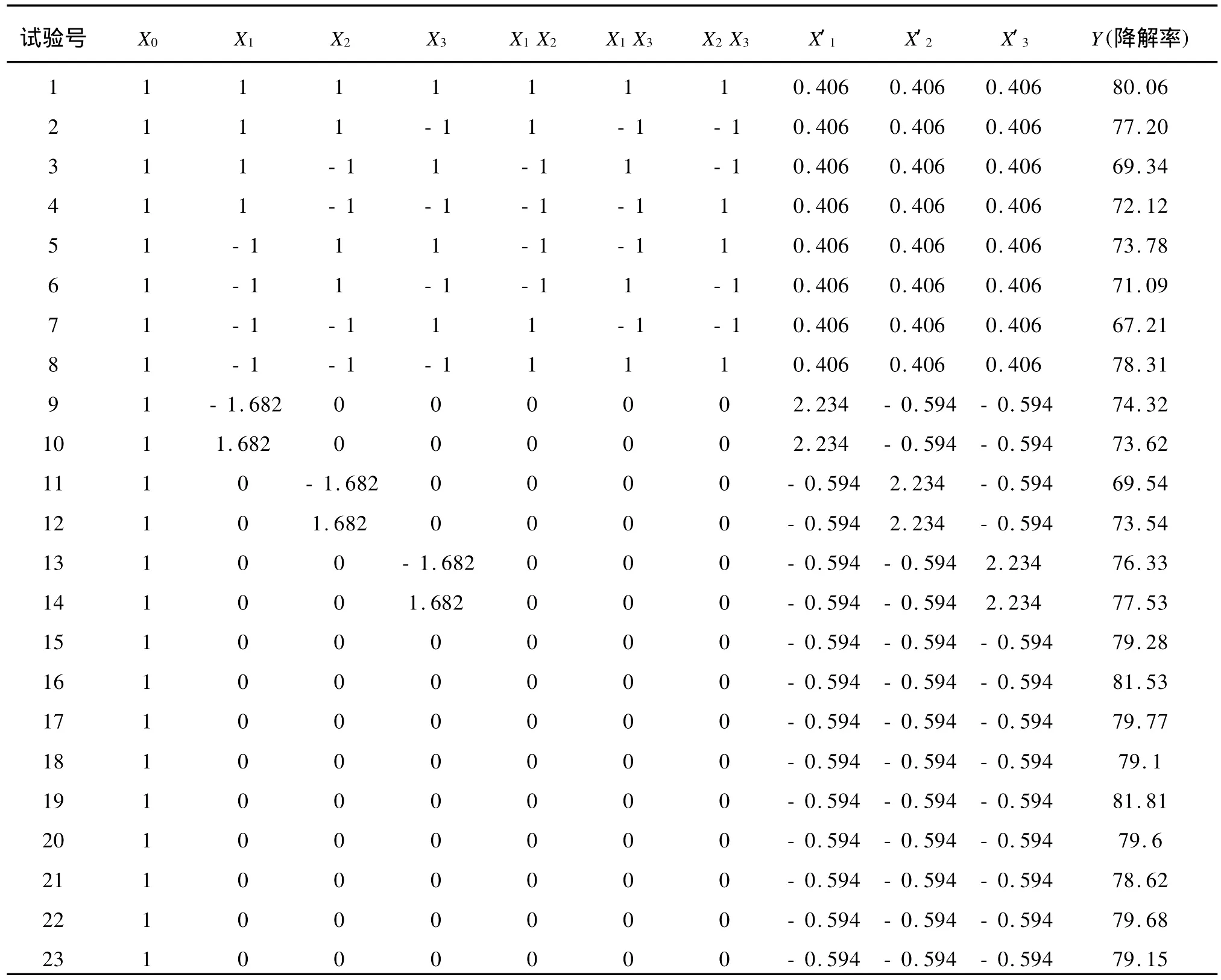
表3 培养基中C、N、P含量对降解率的影响Tab.3 Effect of carbon、nitrogen and phosphorsources ondegradation rate
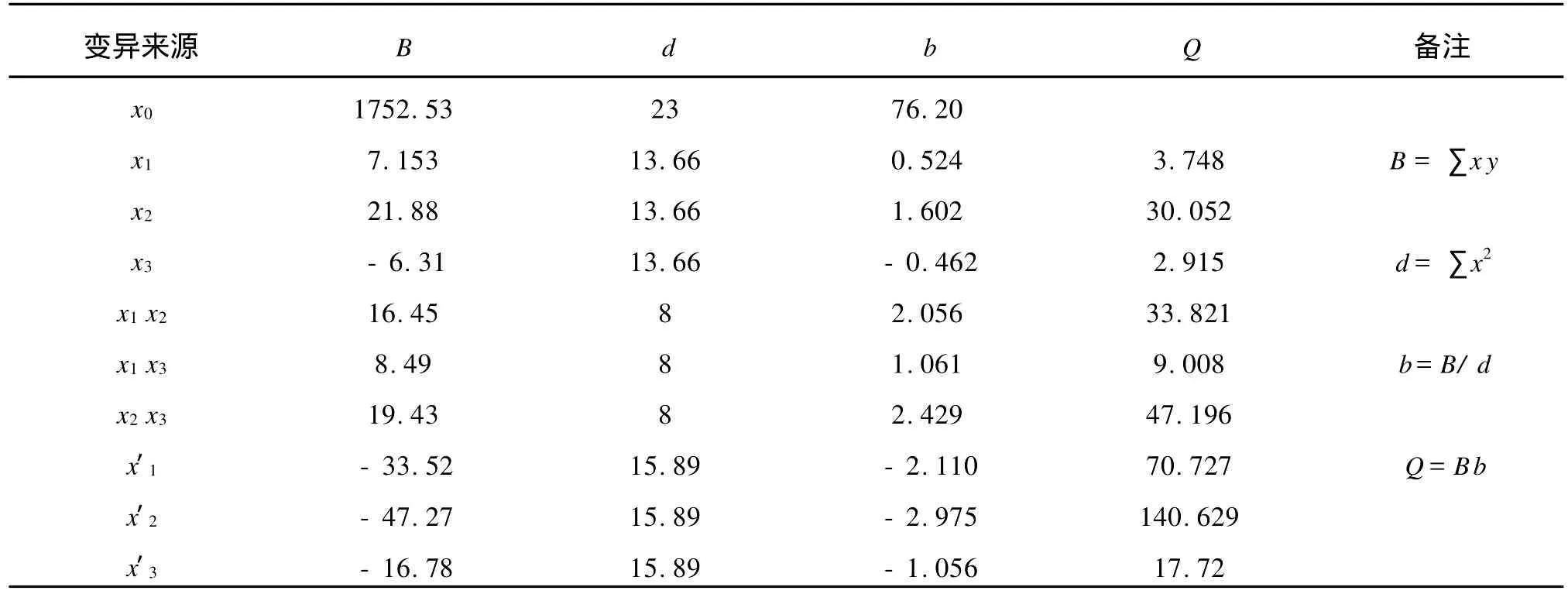
表4 回归旋转正交组合计算结果Tab.4 Calculating results of two revolving orthogonal experiment
2.6.2 回归方程的显著性检验 为了检验回归方程的显著性,计算各类偏差平方和,结果见表5。
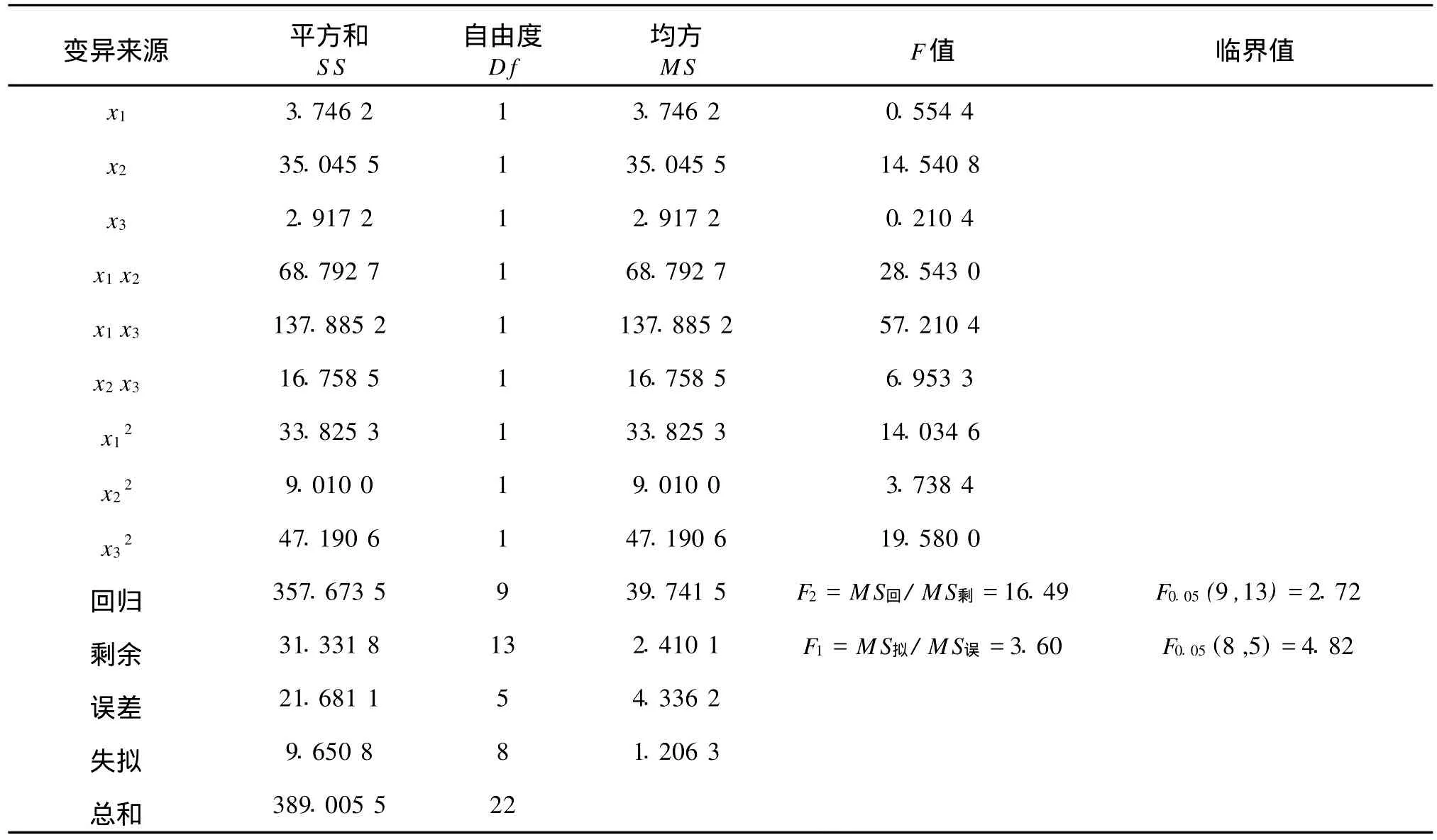
表5 回归旋转正交组合方差分析Tab.5 Error analysis of two revolving orthogonal experiment
首先,用F1来检验回归方程拟合情况,由表5可知,F1=3.60
2.6.3 回归方程系数的显著性检验 由于是正交旋转设计,可用各偏回归平方和Q进行F检验或t检验,实验中选择t检验剔除回归方程的不显著项。经t检验可知,回归方程中t1、t3不显著,被剔除,其他回归系数均在不同程度上显著,因此回归方程可写为:

2.6.4 回归方程的优化分析 方程局部最优点是最佳的实验水平,利用求偏导数的方法求解最优水平,对回归方程求一阶偏导,并当到达局部最优点时,导数为零,此计算点为驻点,可能为回归方程的极值,再计算回归方程在其定义域内各端点的函数值进行比较,则其中的最大值为回归方程的最优值。求偏导解方程组得到:x1=0.717,x2=0.812,x3=0.718,计算驻点f(0.717,0.812,0.718)及回归方程在其定义域内各端点值发现,其中端点f(1.682,-1.682,1.682)为最大值,将编码值换算成实际值时,按Zj=Z0j+xjΔj进行计算,确定优化条件。
即当蔗糖为1.7 g/dL,牛肉蛋白胨为0.92 g/dL,KH2PO4为0.184 g/dL,菌株降解氧化乐果的能力最强,此时培养基组成为优化的降解培养基组成。
最适培养基降解效果验证试验:在优化培养基中,菌种培养3 d氧化乐果的降解率为82.59%,测定结果均高于三元二次旋转正交设计实施的23次实验。
2.6.5 各因素重要性分析 对于由实验数据所建立的二次回归方程,可利用对二次方程系数的检验结果,来判断因素对氧化乐果降解率的影响,即求出方程各因素对指标的贡献率大小。
利用贡献率判断因素主次,对二次方程按如下公式求得回归系数方差比F(j)、F(jj)、F(ij)。
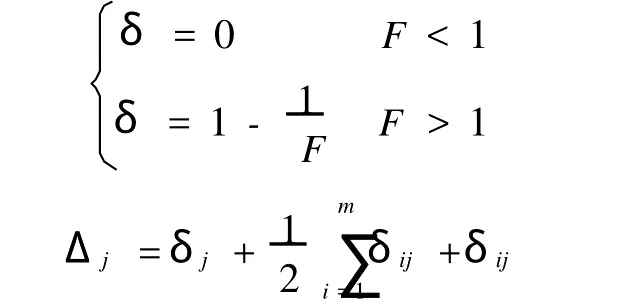

由以上计算可知:Δ1>Δ2>Δ3,所以对于氧化乐果降解的过程中,得到各个不同因素的影响效果顺序为:碳源>氮源>磷源。
2.7 不同环境条件对氧化乐果降解的影响
2.7.1 p H值对降解效率的影响 不同p H条件下菌株L-3对氧化乐果的降解效果见图6。
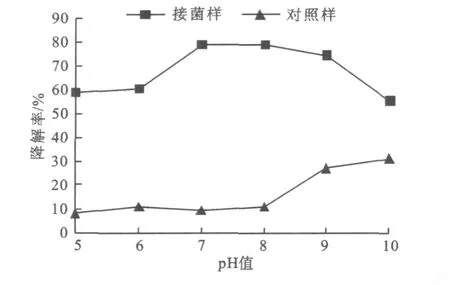
图6 L-3在不同pH值条件下对氧化乐果的降解效果Fig.6 Degradations of omethoate by isolate L-3 under different culture pH
由图6可以看出,在p H 5~10范围内,氧化乐果都能降解,以p H 7效果最好。在较强的碱性条件下(p H 9~10),氧化乐果有一部分自然降解,可知氧化乐果在弱酸和中性的条件下生长稳定。
2.7.2 温度对降解效率的影响 不同温度条件下菌株L-3对氧化乐果的降解效果见图7。
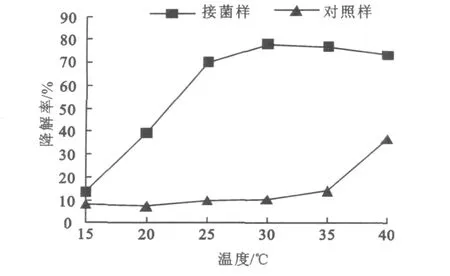
图7 培养温度对菌株降解效果的影响Fig.7 Degradations of omethoate by isolate L-3 under different culture temperature
由图7可以看出,在15~25 ℃范围内,氧化乐果的降解率偏低,说明低温条件不利于氧化乐果的降解;在25~40℃范围内,氧化乐果的降解效果较好,30℃时降解率最高。L-3菌株降解氧化乐果的最适温度与其最适生长温度是一致的。在较高的温度条件下35~40℃氧化乐果有一部分自然降解。
2.7.3 不同接菌种体积分数对降解效率的影响不同接菌体积分数条件下菌株L-3对氧化乐果的降解效果见图8。
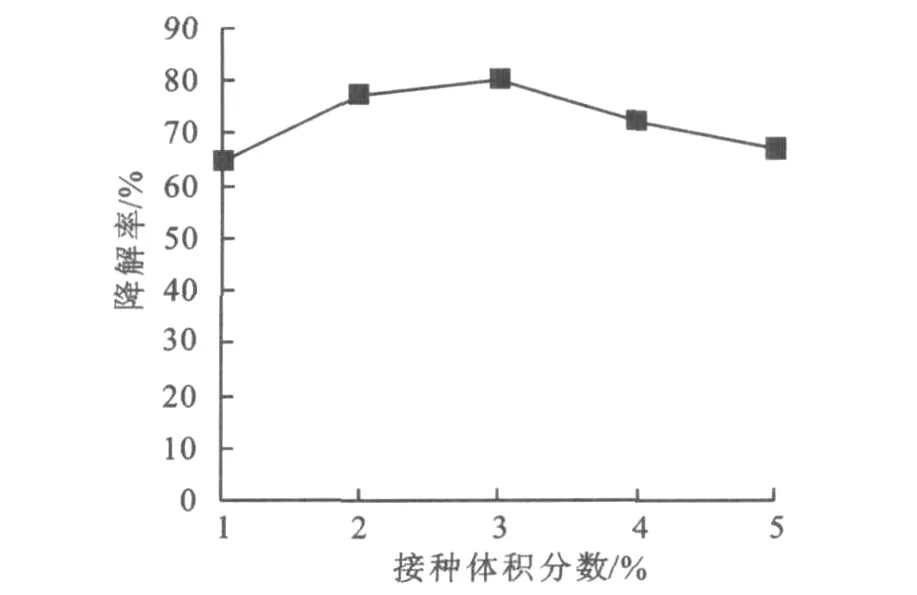
图8 接种体积分数对氧化乐果降解效果的影响Fig.8 Degradation of omethoate by isolate L-3 with different inocula quantities
由图8可以得出,随着接种体积分数的增加,菌株L-3对氧化乐果的降解率呈先升后降的趋势,当菌体接种体积分数为3%时,氧化乐果的降解率最高,达80.16%。
2.7.4 菌株L-3对不同初始质量浓度氧化乐果的降解 菌株L-3对不同初始氧化乐果浓度的降解效果见图9。
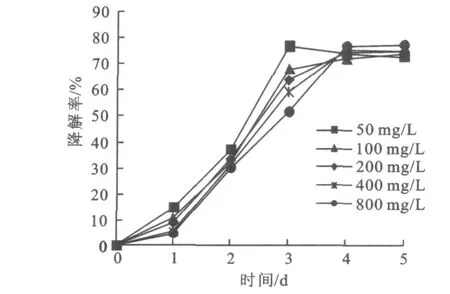
图9 不同初始质量浓度氧化乐果对降解率的影响Fig.9 Effect of different omethoate concentration on degradation rate
从图9可以看出,经过5 d的培养,降解率为72.58%~77.71%。50 mg/L的氧化乐果降解速度相对较快,3 d后降解基本稳定,最终降解率为72.58%;其它几种质量浓度氧化乐果的降解趋势基本相似,5 d后降解趋于稳定。
3 结 语
作者对从农药生产厂污泥中筛选出能够高效降解氧化乐果的假单胞菌L-3的降解条件进行优化,并对环境条件对氧化乐果降解效果的的影响进行了研究,得出菌株L-3最适的降解条件:碳源为蔗糖、氮源为牛肉蛋白胨、磷源为 KH2PO4;二次正交回归设计得出最佳的降解条件为蔗糖质量浓度为1.7 g/dL、牛肉蛋白胨质量浓度为0.92 g/dL、KH2PO4质量浓度为0.184 g/dL,在优化的培养基中对氧化乐果进行降解,其降解率高达82.59%;最适的环境条件为p H 7~8,温度30℃,接种体积分数3%,初始氧化乐果质量浓度为50 mg/L;优化后氧化乐果的降解率高达82.59%。
[1]仲维科,郝戬,孙梅心,等.我国食品的农药污染问题[J].农药,2000,39(7):1-3.ZHONG Wei-ke,HAO Ji,SUN Min-xin,et al.Pestides residues in food in China[J].Pesticides,2000,39(7):1-3.(in Chinese)
[2]Donna Chaw,Ulrica Stoklas.Composting of cattle manure and hydrocarbon contaminated flare pit soil[J].Compost Science and Utilization,2001,9(4):322-335.
[3]Harruta S,Cui Z,Huang Z.Construction of a stable microbial community with high cellulose-degradation ability[J].Applied Microbiol Biotechnology,2002,59:529-534.
[4]Wackett,Prenafeta-Bold F X,Opsteeg J L,et al.Biodegradation of azo hyes in coculture of anaerobic granular sludge with aerobic aromatic amine degrading enrichment culture[J].Appl Microbil Biotechnol,1999,51:865-871.
[5]王保军,刘志培,杨慧芳.甲单咪农药的微生物降解代谢研究[J].环境科学学报,1998,18(3):298-302.WANGBao-jun,LIU Zhi-pei,YANG Hui-fang.Microbiological deterioration metabolism of jdm pesticide[J].Environmental Science Journal,1998,18(3):298-302.(in Chinese)
[6]Kauatner M,Mahro B.Microbial degradation of polycyclic aromatic hydrocarbons in soils affected by the orgnic matix of compost[J].Appl Microbil Biotechnol,1996,44:668-675.
[7]Filippi C,Bedini S,Levi-Minzi R,et al.Cocomposting of olive oil mill by-productis:chemcial and mocrodiological evaluations[J].Compost Science and Utilization,2002,10(1):63-71.
[8]Fang M,Wong M H,Wong J W C.Digestion activity of thermophilic bacterial isolated from ash-amended sewage sludge compost[J].Water,Air and Soil Pollution,2001,126:8-12.
