嗜酸乳杆菌β-半乳糖苷酶基因的克隆及其作为食品级筛选标记的研究
2010-03-15贺松龚芳红张德纯刘明方程芳郭亚楠
贺松, 龚芳红, 张德纯*, 刘明方, 程芳, 郭亚楠
(1.重庆医科大学分子医学与肿瘤研究中心,重庆400016;2.西安交通大学医学院,陕西西安710061)
乳酸菌是食品安全性微生物,利用乳酸菌表达重要的医药功能蛋白以赋予乳酸菌新的生理功能,是开发乳酸菌应用的新领域[1]。但是目前构建的重组乳酸菌多经过了遗传修饰,带有抗生素抗性标记,这些抗生素抗性基因若投放到环境中或人和动物体内,由于抗性因子的转移,会存在严重的生物安全隐患,因此在应用中也将受到限制。食品级载体系统的研究为重组乳酸菌的潜在应用提供了可能。目前国内外已有许多关于食品级筛选标记研究的报道,包括细菌素抗性及免疫性标记[2-3]、重金属抗性标记[4]、噬菌体抗性标记[5]、营养缺陷互补标记[6-8]和糖类利用筛选标记[9]等。作者借鉴蓝白筛选转化子的思路,从嗜酸乳杆菌中克隆β-半乳糖苷酶(lacZ)基因,利用X-gal显色筛选大肠杆菌和乳酸乳球菌中的阳性克隆子,并观察以lacZ基因作为食品级筛选标记的筛选效果和稳定性。
1 材料与方法
1.1 实验材料
1.1.1 菌种和质粒 嗜酸乳杆菌(L.acidophilusATCC4356):购自中国科学院微生物所菌种保藏中心;乳酸乳球菌(L.lactisMG1363)和质粒pMG36e:由荷兰 Groningen University J.Kok博士惠赠;大肠杆菌(E.coliDH5α):作者所在实验室保存菌株。
1.1.2 主要试剂 M17培养基及LB培养基购自Oxoid公司;DNA回收试剂盒:购自Omega公司;基因组提取试剂盒,质粒抽提试剂盒,限制性核酸内切酶XbaⅠ和PstⅠ:均为 Promega公司产品;PCR及连接相关试剂:均购自 Takara公司;X-gal和ONPG:Sigma公司产品。
1.2 方法
1.2.1 含有lacZ基因重组体的构建 根据 Gen-Bank公布的嗜酸乳杆菌ATCC4356β-半乳糖苷酶(lacZ)基因序列(2 017 bp,编号:EU590652)设计一对特异性引物。

以嗜酸乳杆菌ATCC4356染色体DNA为模板,进行PCR扩增获得lacZ基因。反应条件为:94℃预变性5 min;94℃变性40 s,55℃退火30 s,72℃延伸130 s,共26个循环;最后72 ℃延伸10 min。将PCR产物切胶回收,回收产物与质粒pMG36e同步进行XbaⅠ和PstⅠ双酶切回收处理。之后两者在 T4 DNA连接酶作用下连接,构建的重组质粒名为pMG36e-lacZ。重组质粒转化大肠杆菌DH5α感受态细胞,转化菌涂布于LB-Ery-X-gal平板(含200μg/mL红霉素,临用前2小时吸取X-gal DM F溶液50μL涂布平板)表面,37℃培养18~24 h,挑取蓝色菌落(命名为DH5α/pMG36e-lacZ)进行传代培养,并对重组质粒进行 PCR、酶切和测序鉴定(由 Invitrogen公司进行)。
1.2.2 重组体电转乳酸乳球菌MG1363
1)重组质粒的提取:大肠杆菌阳性转化子DH5α/pMG36e-lacZ接种于 LB-Ery-X-gal平板(红霉素终质量浓度增加为250μg/mL,其他同前),挑取蓝色菌落接种于LB液体培养基(红霉素终质量浓度为250μg/mL),37℃振荡培养过夜,并用质粒抽提试剂盒提取重组质粒pMG36e-lacZ。
2)乳酸乳球菌MG1363感受态细胞制备:接种MG1363于M17肉汤培养基,30℃培养至OD600为0.5~0.8,在结束培养之前1小时加入氨苄青霉素至终质量浓度为20μg/mL。培养结束后将细菌培养物冰浴5 min,离心收集菌体,用冰冷的甘油缓冲液(100 mg/mL甘油,0.5 mmol/L蔗糖)洗涤菌体5次,然后用1∶100的甘油缓冲液重悬菌体。
3)电穿孔转化MG1363:参见文献[10]。电穿孔条件:电压为2 kV,时间为5 ms。电转化后的菌液涂布于 M17-LSCaMg-Ery-X-gal平板(含 0.5 g/dL乳糖、0.3 mol/L 蔗糖、20 mmol/L MgCl2、2 mmol/L CaCl2、5 mg/L红霉素,临用前2小时吸取X-gal DM F溶液50μL涂布平板),30℃培养48~72 h,筛选蓝色菌落即为阳性重组菌,记为MG1363/pMG36e-lacZ。
1.2.3 重组菌β-半乳糖苷酶的表达 将重组乳酸乳球菌MG1363/pMG36e-lacZ接种于10 mL LM17-Ery肉汤培养基(含0.5 g/dL乳糖、5 mg/L红霉素),在30 ℃、220 r/min振荡培养24 h。取5 mL细菌培养液,离心收集菌体用500μL双蒸水充分重悬菌体,在冰上超声破碎菌体,然后离心收集上清液。超声沉淀用少量水重悬后与超声上清液、菌液一并做10 g/dL SDS-PAGE和 native-PAGE电泳分析。其中SDS-PAGE电泳后的凝胶经考马斯亮蓝R-250染色;native-PAGE电泳后的凝胶铺在涂有100μL浓度为2 g/dL的X-gal溶液的M17平板上,30℃孵育2 h,蓝色条带显示β-半乳糖苷酶的存在。
1.2.4lacZ基因作为筛选标记的活性及稳定性检测 重组乳酸乳球菌MG1363/pMG36e-lacZ分别在LM17-X-gal平板(含0.5 g/dL乳糖,临用前2 h吸取X-gal DM F溶液50μL涂布平板)和 M17-Ery平板(5 mg/L红霉素)上传60代。分别将两种平板上第1代和第60代的细菌接种于LM17肉汤(含0.5 g/dL乳糖),30 ℃、220 r/min振荡培养24 h。离心浓缩菌液并用培养菌液重悬菌体,在冰上超声破碎菌体,离心收集超声上清液,采用邻硝基苯-β-D-半乳糖吡喃糖苷(ONPG)法[11]测定β-半乳糖苷酶活性,结合Bradford法[12]计算β-半乳糖苷酶比活力,并对在 LM17-X-gal平板传 60代的MG1363/pMG36e-lacZ提质粒鉴定。
2 实验结果
2.1 重组质粒的鉴定
首先对重组质粒pMG36e-lacZ进行 PCR鉴定,1 g/dL琼脂糖凝胶电泳显示在约2 000 bp处有一明显条带(图1a)。再对重组质粒分别进行XbaⅠ、PstⅠ单酶切和双酶切鉴定(图1b),鉴定结果与预期目标一致。测序结果表明,pMG36e-lacZ中的lacZ基因序列与 GenBank中公布的序列符合率达97%。由此可见,重组质粒构建成功。
2.2 β-半乳糖苷酶的表达
重组菌株 DH5α/pMG36e-lacZ和 MG1363/pMG36e-lacZ在筛选平板上长出了蓝色菌落,初步说明能表达有活性的β-半乳糖苷酶。SDS-PAGE分析见图2。重组菌株在约70 000处可见一明显的表达条带,与天然lacZ的理论相对分子质量76 583相近。Native-PAGE分析结果见图3。菌液、超声上清液和超声菌体都具有β-半乳糖苷酶活性。
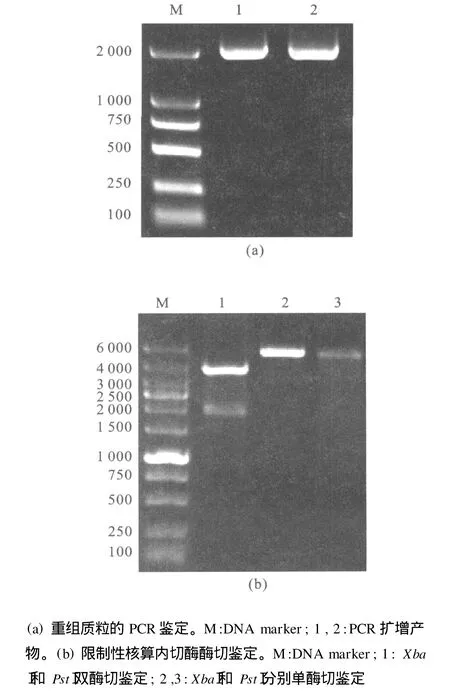
图1 重组质粒pMG36e-lacZ鉴定1Fig.1 Identification of recombinant plasmid(1)
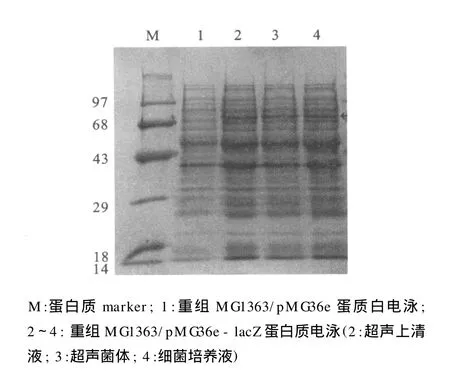
图2 SDS-PAG图显示重组菌株 MG1363/pMG36elacZ.分泌β-半乳糖苷酶Fig.2 The SDS-PAGE analysis ofβ-galactosidase secreted by recombinant strain MG 1363/pMG 36e-lacZ
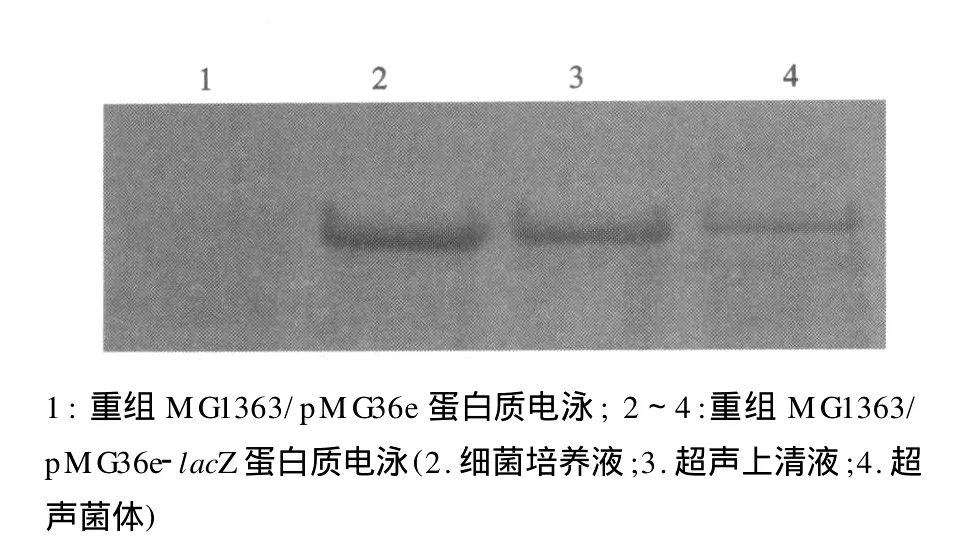
图3 重组菌株 MG1363/pMG36e-lacZ native-PAGE X-gal染色图Fig.3 The native-PAGE figure of recombinant strain MG1363/pMG36e-lacZ stained with X-gal
2.3 lacZ基因作为筛选标记的活性及稳定性检测
分别对红霉素和X-gal两种筛选方法筛选的第2代和第61代重组菌株MG1363/pMG36e-lacZ进行酶活和比活力测定,结果见表1。结果显示,在利用X-gal筛选60代后的重组菌株β-半乳糖苷酶比活力与第2代相比没有显著差异(P=0.592>0.05);与利用红霉素筛选60代后的重组菌株β-半乳糖苷酶比活力相比也没有显著差异(P=0.882>0.05),表明lacZ基因作为筛选标记具有较好的活性和稳定性。对X-gal筛选第60代的重组菌株提质粒进行PCR和酶切鉴定结果也表明该基因具有较好的稳定性,见图4。

表1 第2代和第61代重组菌株进行酶活和比活力测定Tab.1 β-galactosidase activity and specific activity of MG1363/pMG36e-lacZat t*he 2nd generation and the 61st generation respectively
表中数据为检测8次所得的均值±标准差。*X-gal筛选60代后的重组菌株β-半乳糖苷酶比活力与第2代相比,P>0.05。△X-gal筛选60代后的重组菌株β-半乳糖苷酶比活力与红霉素筛选60代后的重组菌株相比,P>0.05。
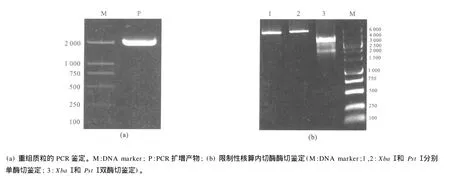
图4 重组质粒pMG36e-lacZ鉴定2Fig.4 Identification of recombinant plasmid(2)
3 结 语
β-半乳糖苷酶的主要功能是降解乳糖和合成低聚半乳糖,对生物无害,而且在生物利用碳水化合物营养中起着重要作用。它可以水解底物X-gal,呈现出蓝色,易于检测和观察,若将此基因作为筛选标记,通过检测蓝色菌落的形成即可成功筛选出阳性克隆子[13]。最为成功的应用就以pUC系列克隆载体为基础的蓝—白筛选系统,这一筛选系统利用了β-半乳糖苷酶基因的负性筛选特性。事实上,同样可以应用β-半乳糖苷酶基因编码产物的正性筛选方法也同样可以获得阳性克隆子。嗜酸乳杆菌是我们所熟悉的重要的益生菌,主要存在于酸奶等乳制品和人胃肠道中,对维持人体健康有益,甚至对一些消化道疾病有治疗作用[14]。最近嗜酸乳杆菌基因组被测序(GenBank No:CP000033)[15],发现基因组上有一个不同于大肠杆菌乳糖操纵子的lac基因簇。特别是该基因簇除拥有一个GHF-2β-半乳糖苷酶编码基因 lacLM外,还拥有一个GHF-42β-半乳糖苷酶基因lacZ。目前实验所用的筛选标记主要是还有红霉素抗性基因的,作者基于食品级载体的要求,从嗜酸乳杆菌ATCC4356中克隆lacZ基因,并观察其作为食品级筛选标记的活性和筛选稳定性。
作者借助载体pMG36e上的 P32启动子和嗜酸乳杆菌 ATCC4356lacZ基因的 RBS序列(TAGAGG),在乳酸乳球菌MG1363中成功表达了β-半乳糖苷酶,并通过该酶活性成功筛选出了阳性克隆子。通过对分别采用X-gal筛选和红霉素筛选两种方法传60代后的酶活分析表明,以β-半乳糖苷酶(lacZ)基因作为筛选标记,能够使载体在宿主菌中稳定遗传。因此,嗜酸乳杆菌ATCC4356lacZ基因可以作为一个新的食品级筛选标记应用于食品级表达系统。若将此食品级载体基因导入乳酸乳球菌,这种重组基因工程菌将是集菌体本身和有益基因于一体,制成活菌制剂被人利用则是安全方便的。
[1]Bermúdez-Humarán L G.L actococcus lactisas a live vector for mucosal delivery of therapeutic proteins[J].Hum Vaccin,2009,5(4):264-267.
[2]Takala T M,Saris P E.A food-grade cloning vector for lactic acid bacteria based on the nisin immunity gene nisI[J].Appl Microbiol Biotechnol,2002,59(4-5):467-471.
[3]Brede D A,Lothe S,Salehian Z,et al.Identification of the propionicin F bacteriocin immunity gene(pcfI)and development of a food-grade cloning system forPropionibacterium f reudenreichii[J].Appl Environ Microbiol,2007,73(23):7542-7547.
[4]Liu C Q,Su P,Khunajakr N,et al.Development of food-grade cloning and expression vectors forL actococcus lactis[J].J Appl Microbiol,2005,98(1):127-135.
[5]O’Sullivan D,Ross R P,Twomey D P,et al.Naturally occurring lactococcal plasmid pAH90 links bacteriophage resistance and mobility functions to a food-grade selectable marker[J].Appl Environ Microbiol,2001,67(2):929-937.
[6]Defoor E,Kryger M B,Martinussen J.The orotate transporter encoded byoroP fromL actococcus lactisis required for orotate utilization and has utility as a food-grade selectable marker[J].Microbiology,2007,153(11):3645-3659.
[7]Bron P A,Benchimol M G,Lambert J,et al.Use of the alr gene as a food-grade selection marker in lactic acid bacteria[J].Appl Environ Microbiol,2002,68(11):5663-5670.
[8]孙强正,熊衍文,叶长芸,等.食品级分泌表达载体的构建及报告蛋白在乳酸乳球菌中的表达[J].微生物学报,2008,48(3):293-298.SUN Qiang-zheng,XIONG Yan-wen,YE Chang-yun,et al.Construction of a food-grade secretion expression vector and use it for reporter protein expression inL actococcus lactis[J].Acta Microbiologica Sinica,2008,48(3):293-298.(in Chinese)
[9]Jeong D W,Lee J H,Kim K H,et al.A food-grade expression/secretion vector forL actococcus lactisthat uses an alphagalactosidase gene as a selection marker[J].Food Microbiol,2006,23(5):468-475.
[10]汪川,刘衡川,裴晓方,等.非融合表达β-半乳糖苷酶的重组乳酸乳球菌的构建和性能研究[J].四川大学学报:医学版,2009,40(1):29-32.WANG Cuan,LIU Heng-chuan,PEI Xiaofang,et al.Construction and property study of recombinant Lactococcus lactis with non-fusion expressing ofβ-galactosidase[J].J Sichuan Univ:Med Sci Edi,2009,40(1):29-32.(in Chinese)
[11]Nguyen T H,Splechtna B,Yamabhai M,et al.Cloning and expression of the beta-galactosidase genes fromL actobacillus reuteriinEscherichia coli[J].J Biotechnol,2007,129(4):581-591.
[12]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72(1-2):248-254.
[13]钟义华,唐蕾,吴亢,等.具有β-半乳糖苷酶转苷能力的菌株筛选及鉴定[J].食品与生物技术学报,2008,27(5):83-85.ZHONG Yi-hua,TANG Lei,WU Kang,et al.Screening and identification ofβ-galactosidase-producing microorganism with transgalactosylation activity[J].Journal of Food Science and Biotechnology,2008,27(5):83-85.(in Chinese)
[14]Borthakur A,Gill R K,Tyagi S,et al.The probioticL actobacillus acidophilusstimulates chloride/hydroxyl exchange activity in human intestinal epithelial cells[J].J Nutr,2008,138(7):1355-1359.
[15]Altermann E,Russell W M,Azcarate-Peril M A,et al.Complete genome sequence of the probiotic lactic acid bacteriumL actobacillus acidophilusNCFM[J].Proc Natl Acad Sci U S A,2005,102(11):3906-3912.
