乳酸乳杆菌胞外多糖的发酵条件优化
2010-03-15陈若雯李里段家彩潘思轶
陈若雯, 李里, 段家彩, 卢 琪, 高 丽, 潘思轶
(华中农业大学食品科学技术学院,湖北武汉430070)
乳酸菌(lactic acid bacteria,LAB)胞外多糖(exopolysaccharide,EPS)是乳酸菌在生长代谢过程中分泌到细胞壁外常渗于培养基的一类糖类化合物[1],除了对细菌自身具有生物学意义,它还赋予发酵乳制品特殊的质构和风味,因而广泛用于各种食品的增稠、稳定、乳化、胶凝及持水。近年来,欧美及日本一些学者对LAB的大量研究表明,LAB在抗变异原性、防癌抗癌和增强机体免疫力方面有着不可低估的作用[2],而它营养保健特性主要是通过其代谢过程中形成的胞外多糖物质来完成的[3]。
乳酸菌胞外多糖是微生物适应环境的产物[4],但产量低,菌株稳定性差,提取成本高,制约着大规模工业生产[5]。除与菌种的遗传特性有密切关系外,培养基的成份(碳源和氮源)和生长环境(温度、p H、培养时间)等都会直接影响乳酸菌胞外多糖的分泌积累[1],且不同营养条件和环境条件下产生的多糖的化学结构和生理功能也有差异[6-8]。所以发酵条件的优化,主要包括培养基的优化和生长环境变量的优化。
作者在确定乳酸乳杆菌最适目的培养基的基础上,采用SAS8.0中的 Plackett-Burman设计从发酵条件各变量找出对产量影响最大的因素[9-10],再以显著因子进行中心组合试验(CCD)[11],进行进一步的量的优化,确定稳定点的位置,得到最佳的发酵条件。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种、试剂及培养基 乳酸乳杆菌(来自酸奶):由作者所在研究室分离、鉴定并保藏;透析袋(截留相对分子质量为10 000);基础培养基(MRS)、M17培养基、APT培养基、SL培养基、EliKer培养基、TJA培养基。
1.1.2 主要仪器与设备 高速冷冻离心机(64RL):美国Beckman公司生产;紫外分光光度计(UV-6401):上海光谱仪器厂生产;p H计上海安亭电子仪器厂生产;全温振荡培养箱:太仓实验设备厂生产。
1.2 实验方法
1.2.1 EPS的提取和测定 活化菌种按体积分数1%接种于20 mL发酵培养基中,于37℃下培养24 h,将发酵液在4℃、12 000 r/min的条件下冷冻离心15 min,取上清液并弃去菌体沉淀。上清液和酒精按照1∶3的体积比于4℃条件下沉淀24 h,再次在4℃、12 000 r/min的条件下冷冻离心15 min,取沉淀利用蒸馏水复溶,透析过夜,定容得到粗多糖液[12]。以硫酸-苯酚法在490 nm下比色测定质量浓度[13]。
1.2.2 Plackett-Burman试验设计 采用N=16的Plackett-Burman试验设计,对培养基的成分和菌株生长条件等各变量进行考察[15],实验设计因素水平及编码见表1。
表中自变量编码方程为:xi=(Xi-X0)/ΔXi,式中,Xi为自变量编码值;X0为自变量实验水平中心点实际值;ΔXi为单变量增量[16-18]。
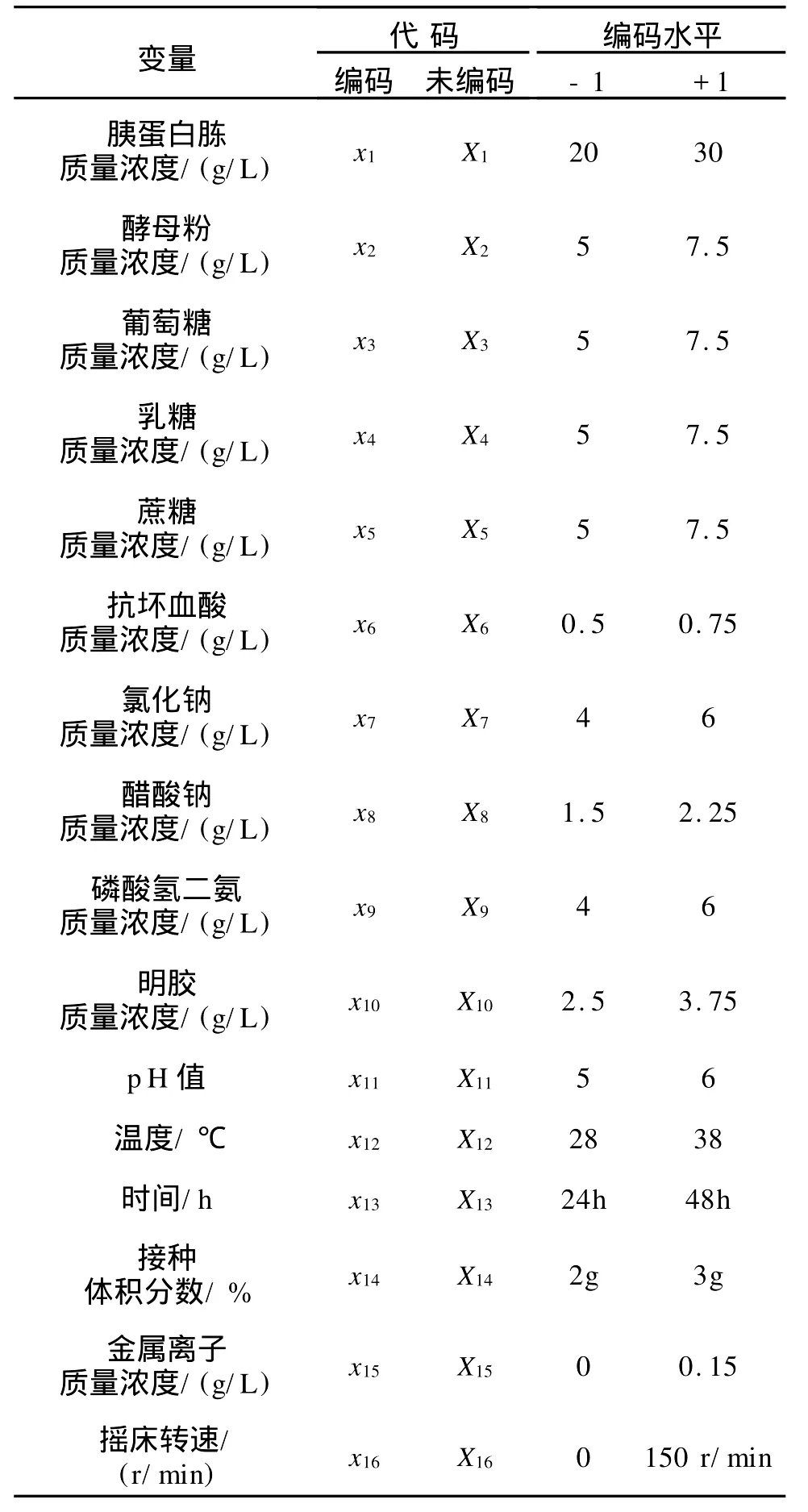
表1 Plackett–Burman实验设计因素水平及编码Tab.1 Coded factors and levels in Plackett-Burman design
1.2.3 中心组合试验设计 结合显著因子单因素的结果,选择下一步试验水平的中心点和各水平的步长以及显著因子的水平,中心组合试验的因素和水平设计[19]见表2,试验的设计[20-21]见表3。
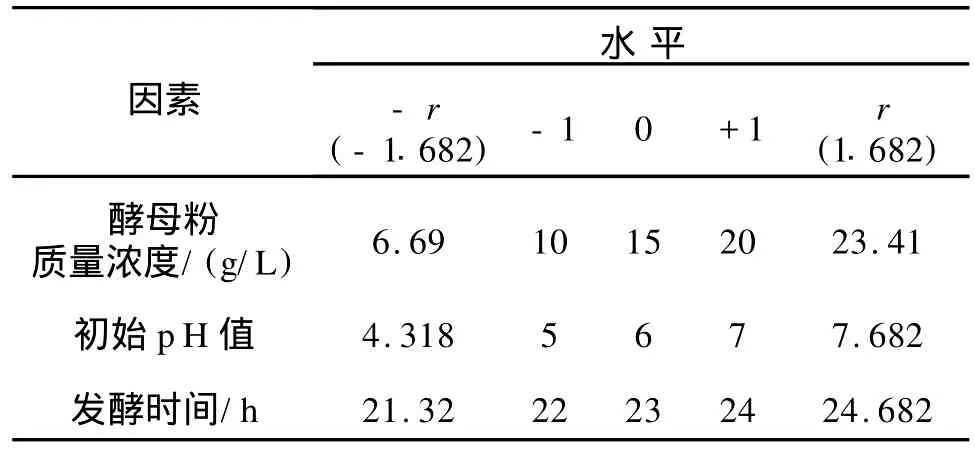
表2 试验因素与水平Tab.2 Factors and levels

表3 中心组合设计矩阵及试验结果Tab.3 Design and experimental results of of the central composite design
2 结果与分析
2.1 产胞外多糖最适发酵培养基的确定
在6种供试培养基中乳酸乳杆菌生长生物量、产酸及 EPS产量见表4。结果表明,MRS、APT、Eliker都较适合该菌株生长,MRS、Eliker的产量较高,但从材料易得及组分相对简单考虑,选择 Eliker作为发酵培养基。
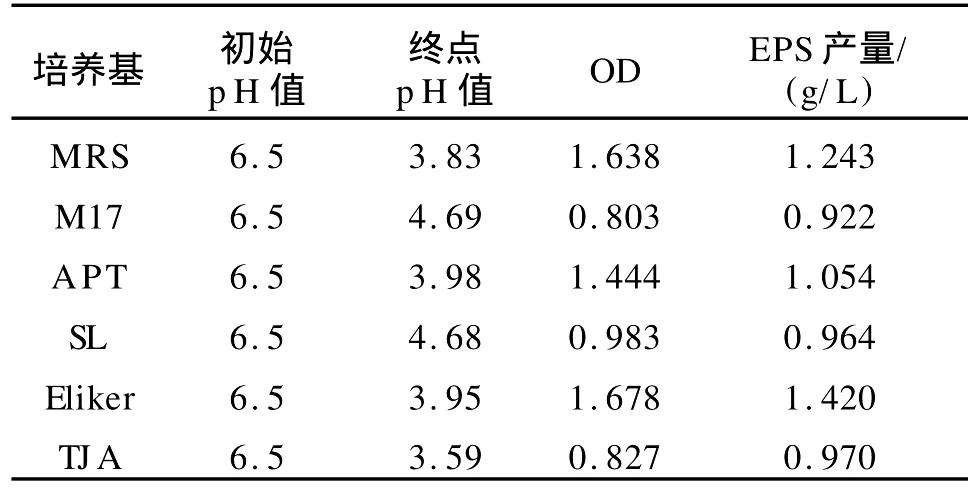
表4 不同培养基对乳酸乳杆菌生长的影响Tab.4 Effect of different media onLactobacillus lactisfermentation
2.2 影响胞外多糖产量显著因素的筛选
对Plackett-Burman试验结果进行方差分析,结果见表5。对乳酸乳杆菌产胞外多糖影响显著的因子有酵母粉(P<0.001)、初始 p H值(p H=0.036 0)和时间(P=0.004 7)。根据Plackett-Burman实验回归方程系数显著性检验(见表6),通过逐步回归分析获得最优多元一次回归方程为:Y=2.18 77+0.787 1x2+0.194 5x11-0.407 7x14式中Y为 EPS的预测值,由自变量编码方程可知:x2=(X2-25)/5,x11=(X11-5.5)/0.5;x14=(X14-36)/12。
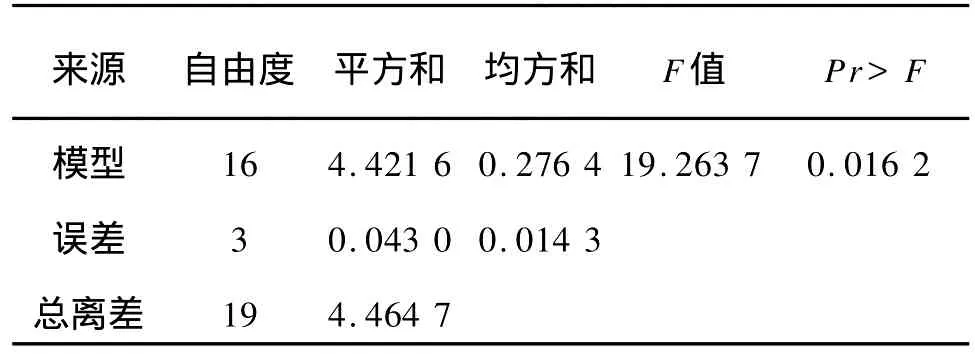
表5 回归模型方差分析表Tab.5 Analysis of variance for the regression equation
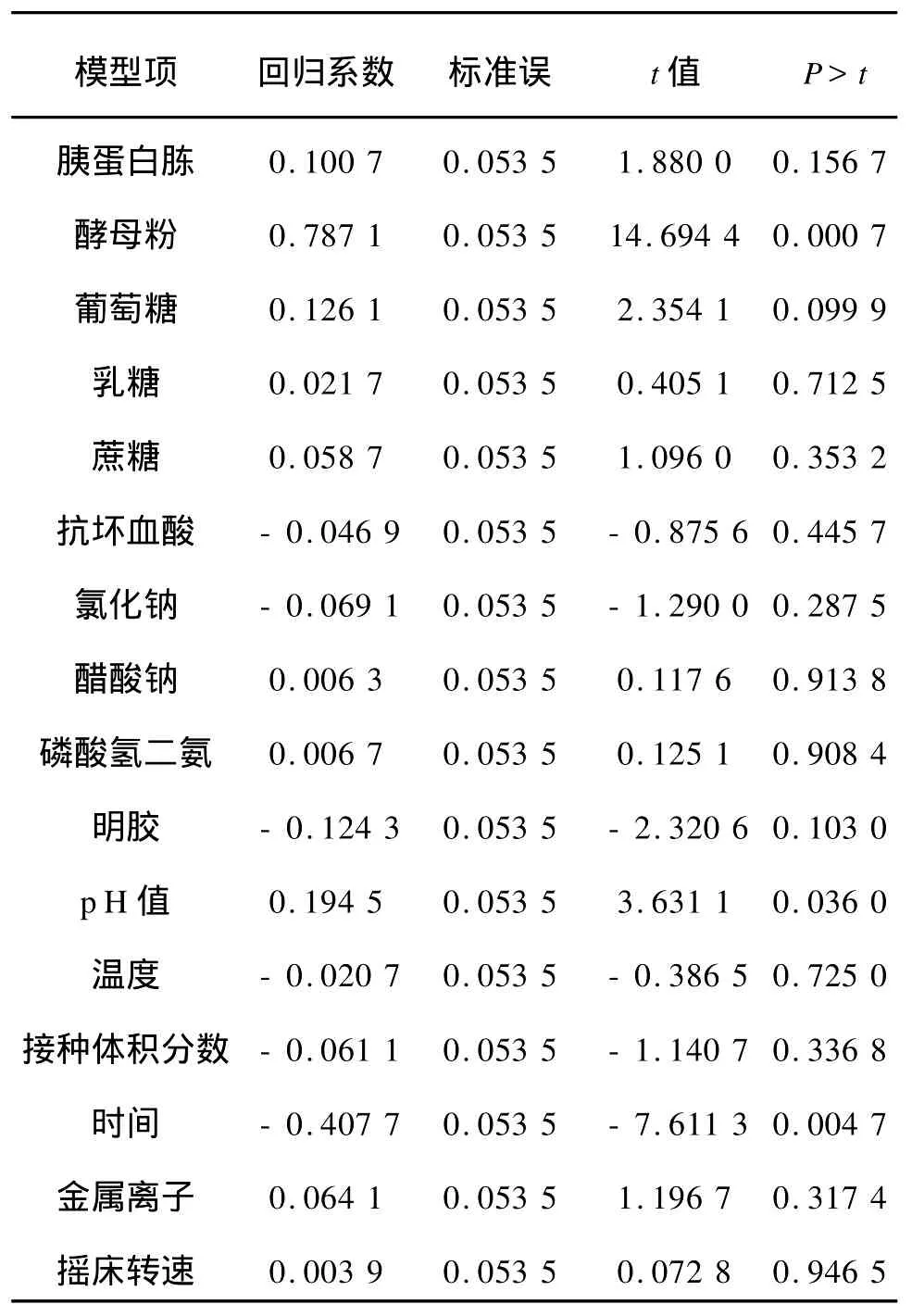
表6 回归方程系数显著性检验Tab.6 Significance of the regression coefficients
2.3 显著因子添加水平的研究
为了寻找合适的中心组合试验的中心点和大幅度减少试验工作量,采用单次单因子试验,对显著因子的添加水平进行研究[22-23]。因此,采用酵母粉0.3 g/L,初始p H值为6,时间为23 h为中心组合试验的中心点,结果见图1。
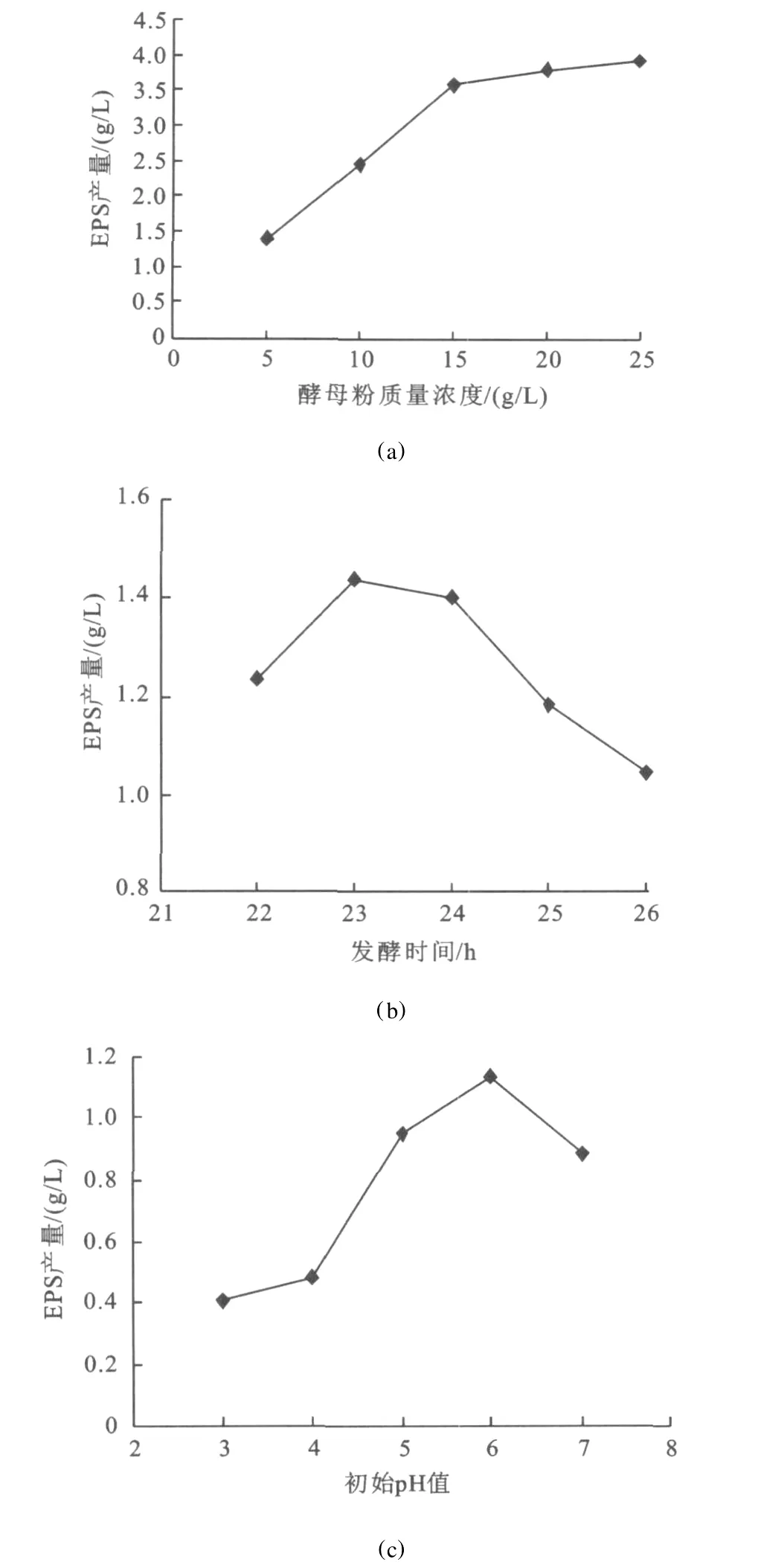
图1 酵母粉、初始 pH值、时间对胞外多糖生产的影响Fig.1 Effect of yeast extract、he initial pHand fermentation time on exopolysaccharide
2.4 中心组合试验结果
2.4.1 多元二次模型的建立以及回归分析检验确定了酵母粉质量浓度、初始pH值、发酵时间的添加水平,按照中心组合试验设计,具体试验方案及EPS质量浓度Y的测定结果见表7,得到二次响应面回归方程为:Y=3.699 355+0.578 7A-0.101 0B+0.155 1C-0.367 1A2-0.060 9AB-0.044 9AC-0.306 6B2-0.033 4B C-0.217 2C2。式中,Y为EPS产量,A为酵母粉,B为初始p H值,C为发酵时间。
由方差分析可知,实验所选用的模型显著(P=0.0001),预测值和实测值之间有高相关性(R2=0.982 1),能对试验数据进行较好的拟和,因此该模型可用于预测菌株的实际发酵。从表8可以看出,在试验设计的水平范围内,A、A2、B2、C2对 EPS产量的影响达到极显著水平(P<0.01),B、C的影响达显著水平(P<0.05),而AB、A C、B C项对 EPS产量不显著,从而确定出优化的回归方程:Y=3.699 355+0.578 7A-0.101 0B+0.155 1C-0.367 1A2-0.306 6B2-0.217 1C2。
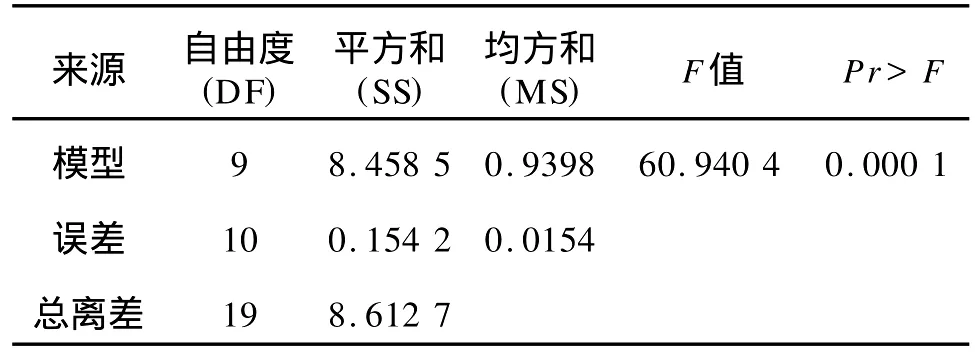
表7 二次多项回归模型方程方差分析结果Tab.7 ANOVA results for exopolysaccharide obtained from CCD
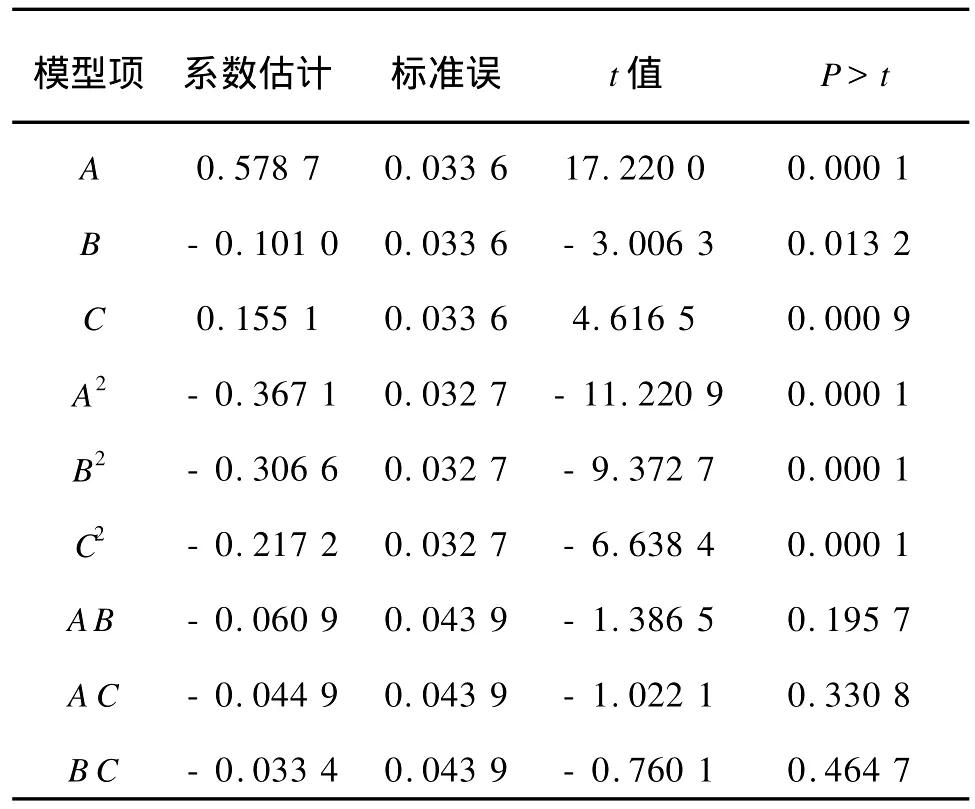
表8 模型的系数显著性检验的结果Tab.8 Regression coefficients and their significance of the quadratic model
2.4.2 EPS响应面分析 响应值Y在试验区域中有个稳定点(0.470 7,-0.154 2,0.175 6),代入回归方程Y=3.964 g/L。从图2~4可知,由响应面值的变化和等高线图的趋势,分析稳定值的性质,确定该稳定点为极大值点[11],从而确定最佳发酵条件为:酵母粉质量浓度 17.35 g/L,初始 p H值5.85,发酵时间为23.18 h。在预测发酵条件进行发酵实验,得到实际产量为3.910 g/L。
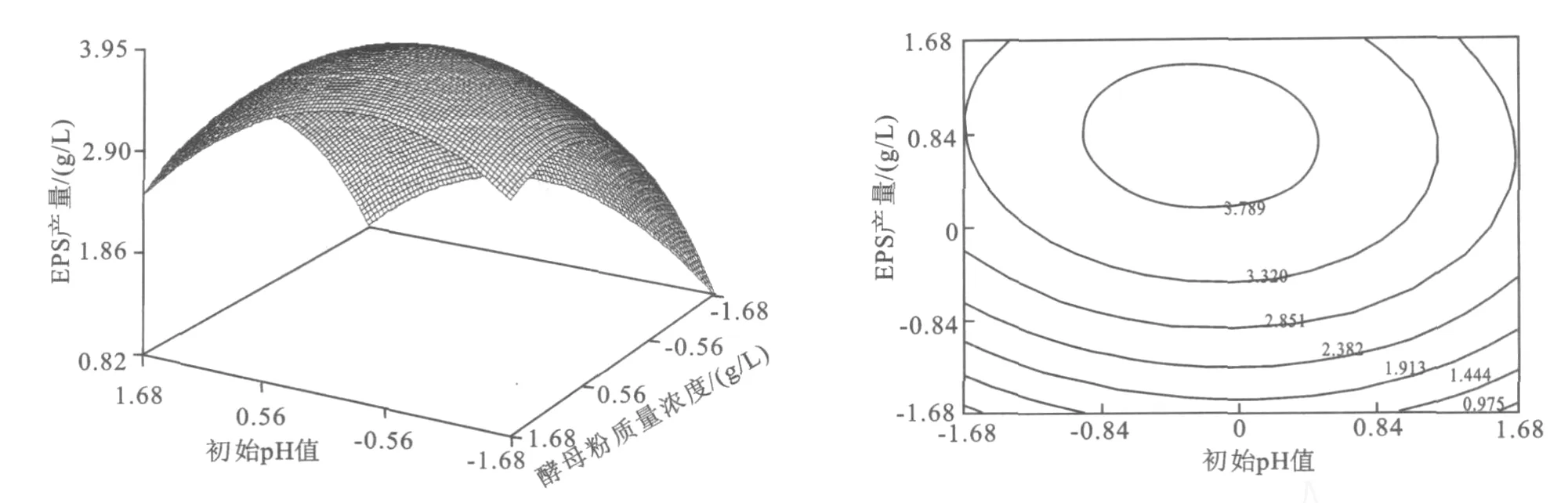
图2 酵母粉和初始pH值交互影响EPS产量的曲面图及其等高线图Fig.2 Three-dimensional plot and corresponding contour plot of EPS vs.yeast extract and the initial pH
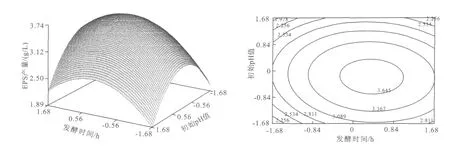
图3 初始pH值和发酵时间交互影响EPS产量的曲面图及其等高线图Fig.3 Three-dimensional plot and corresponding contour plot of EPS vs.the initial pHand fermentation time
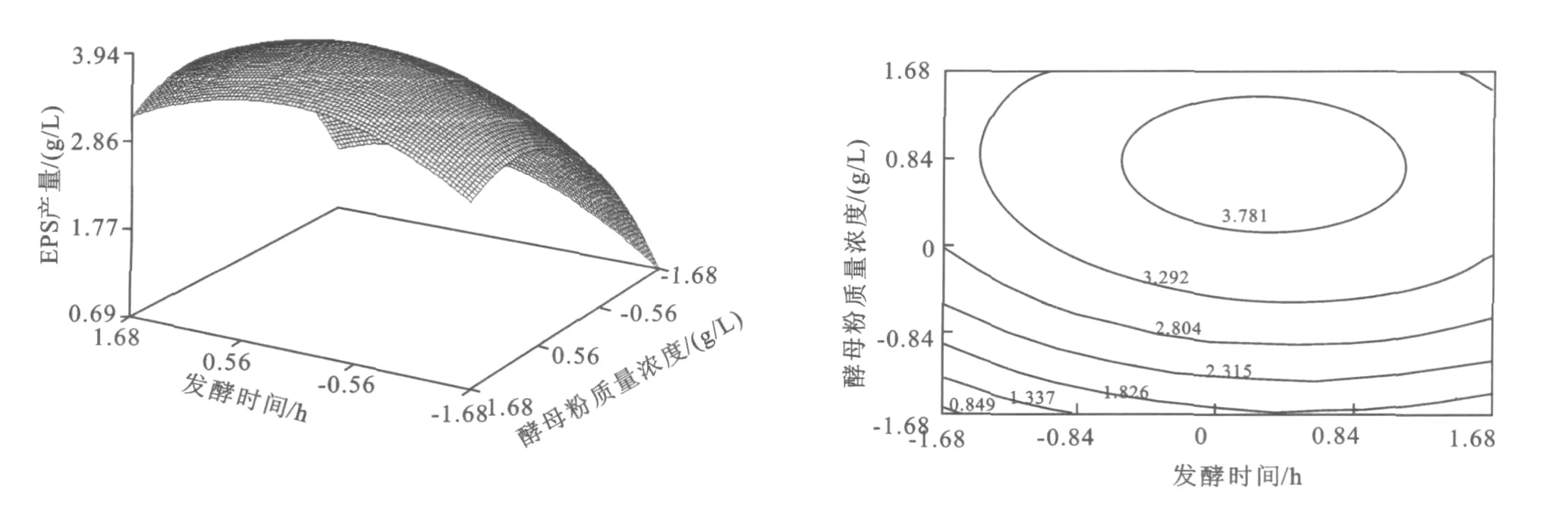
图4 酵母粉和发酵时间交互影响EPS产量的曲面图及其等高线图Fig.4 Three-dimensional plot and corresponding contour plot of EPS vs.yeast extract and fermentation time
3 结 语
在诸多适合于乳酸菌生长的培养基中,确定Eliker培养基最适合乳酸乳杆菌发酵产胞外多糖。由于乳酸菌代谢中减少乳酸形成,可能会使更多的碳原子脱离糖酵解反应进入EPS的合成,所以发酵过程p H值变化幅度小,有利于 EPS的积累。实验中还注意到EPS产量在达到最大时,细菌的生物量也最大。
利用 Plackett-Burman设计,评价了培养基各组分和主要工艺参数对胞外多糖合成的影响,成功筛选出关键因子。其中酵母粉作为菌株生长所需氮源影响最显著[24],其次是发酵时间,EPS显著降低可能与酶降解或培养基物理参数的改变有关[25],相对较小的是初始p H值,可能因为整个发酵过程变化幅度比较缓和。
中心组合设计是响应曲面分析法中用得最为广泛的二阶试验设计,作者通过回归方程的方差分析检验,确定关键因子对胞外多糖合成量影响的显著性程度,从而确定出优化的回归方程:Y=3.699 355+0.578 7A-0.101 0B+0.155 1C-0.367 1A2-0.306 6B2-0.217 1C2。根据回归方程的计算,求的最优酵母粉质量浓度17.35 g/L,初始p H 5.85,发酵时间23.18 h。利用最优条件进行试验验证,结果显示回归模型的预测值与试验的实测值较为接近,进一步证明回归模型具有较好的拟合度。
[1]李盛钰,曾宪鹏,杨贞耐.提高乳酸菌胞外多糖产量的途径[J].食品与生物技术学报,2008,28(3):289-293.LI Sheng-yu,ZENG Xian-peng,YANG Zhen-na.Strategies for increasing of exopolysaccharide production in Lactic acid bacteria[J].Journal of Food Science and Biotechnology,2008,28(3):289-293.(in Chinese)
[2]Marensson Olof,Oste Rickard,Holst Olle.Lactic acid bacteria in an oat-based non-dairy milk substitute:fermentation characteristics and exopolysaccharide formation[J].Lebensmittel-Wissenschaft and Technologie,2000,33(8):525-530.
[3]张英春,冯锐,曹维强.乳酸菌胞外多糖的合成及生理功能研究进展[J].中国甜菜糖业,2008,(3):33-36.ZHANG Ying-chun,FENG Rui,CAO Wei-qian.Research on the biosynthesis and physiological functions of exopolysaccharides produced by Lactic acid bacteria[J].China Beet and Sugar,2008,(3):33-36.(in Chinese)
[4]LucDe Vuyst,FilipDe Vin,Frederik Vaningelgem,et al.Recent developments in the biosynthesis and applications of heteropolysaccharides from lactic acid bacteria[J].International Dariy Journal,2001,11(9):687-707.
[5]Emma Arskold,Malin Svensson,Halfdan Grage,et al.Environmental influences on exopolysaccharide formation in Lactobacillus reuteri ATCC 55730[J].International Journal of Food Microbiology,2007,116:159-167.
[6]Welman A D,Maddox I S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends in Biotechnology,2003,21(6):269-274.
[7]Ruas-Madiedo P,Hugenholtz J,Zoon P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].Intern Dairy,2002,12(2-3):163-167.
[8]刘慧,熊利霞,易欣欣,等.藏灵菇中高产胞外多糖乳酸菌的筛选及其发酵性能的研究[J].食品科学,2007,28(5):211-215.LIU Hui,XIONG Li-xia,YI Xin-xin et al.Study on screening and fermentation capability of lactobacter yielding exopotysaccharide from Kefir Grains[J].Food Science,2007,28(5):211-215.(in Chinese)
[9]杨冀艳,胡磊,许杨.Plackett-Burman设计和响应面法优化荷叶总黄酮的提取工艺[J].食品科学,2009,30(6):29-33.YANGJi-yan,HU Lei,XU Yang.Optimization of extraction conditions of total flavonoids from lotus Leaves by Plackett-Burman design and response surface analysis[J].Food Science,2009,30(6):29-33.(in Chinese)
[10]周海鸥,汪传高,张益波,等.统计学分析方法应用于桑黄菌发酵培养基的优化[J].食品研究与开发,2009,30(5):44-48.ZHOU Hai-ou,WANG Chun-gao,ZHANG Yi-bo,et al.Statistical optimization of fermentation medium for mycelia production by phellinus igniarius[J].Food Research and Development,2009,30(6):29-33.(in Chinese)
[11]赵凤敏,李树君,方宪法,等.中心组合设计法优化马铃薯薯渣固态发酵工艺[J].农业机械学报,2006,37(8):45-48.ZHAO Feng-min,LI Shu-jun,FANG Xian-fa,et al.Optimization of potato residues solid substrate fermentation technology using central composite design[J].Transactions of the Chinese Society for Agricultural Machinery,2006,37(8):45-48.(in Chinese)
[12]孙巍,夏春雨,蔡和晖,等.中心组合设计试验优化毛云芝菌固体发酵培养条件[J].食品与生物技术学报,2009,28(5):688-692.SUN Wei,XIA Chun-yu,CAI He-Hu,et al.Culture condition optimization of solid substrate fermentation byCoriolus hirsutususing central composite design[J].Journal of Food Science and Biotechnology,2009,28(5):688-692.(in Chinese)
[13]K M Desai,S K Akolkar,Y P Badhe,et al.Optimization of fermentation media for exopolysaccharide production from Lactobacillus plantarum using artificial intelligence-based techniques[J].Process Biochemistry,2006,41:1842-1848.
[14]乌云达来,陆兆新,吕凤霞,等.嗜酸乳杆菌NX2-6液体发酵产细菌素培养基及其主要影响因子筛选[J].食品科学,2009,30(13):187-191.WUyun dalai,LU Zhao-xin,LU Feng-xia,et al.Screening of medium components and main fermentation conditions ofL actobacillus acidophilusNX2-6 for bactericin production[J].Food Science,2009,30(13):187-191.(in Chinese)
[15]王永斌,王允祥.雷蘑液态发酵工艺响应面法优化研究[J].食品科学,2006,22(6):76-82.WANG Yong-bin,WANG Yun-xiang.Optimization of submerged fermentation conditions for extracellular polysaccharide by clitocybe gigantean using response surface methodology[J].Food Science,2006,22(6):76-82.(in Chinese)
[16]鞠兴荣,王立峰,袁建,等.双低菜籽粕分离蛋白提取效果优化研究[J].中国粮油学报,2005,20(6):101-106.JU Xing-rong,WANGLi-feng,YUAN Jiao,et al.Optmization of extraction for orotein isolate In double-low rape meal[J].Journal of the Chinese Cereals and Oils Association,2005,20(6):101-106.(in Chinese)
[17]廖春丽,余晓斌,刘海丽.响应面优化β-胡萝卜素液体发酵培养基[J].食品与生物技术学报,2007,26(3):95-99.LIAO Chun-li,YU Xiao-bin,LIU Hai-li.Optimize the submerged fermentation media ofβ-carotene by using response surface methodology[J].Journal of Food Science and Biotechnology,2007,26(3):95-99.(in Chinese)
[18]Wu Qiu-li,Chen Tao,Chen Xun,et al.Optimization of nboflavin production by recombinantBacilus subtilisRH44 using statistical design[J].Appl Microbiol Biotechnol,2007,76(4):783-794.
[19]张亚琼,宁喜斌.温度、p H值、盐度交互作用优化福氏志核氏菌F2b培养条件[J],食品与生物技术学报,2009,28(3):408-412.ZHANG Ya-qiong,NING Xi-bi.Optimization of cultivation condition ofShigella glexneri2b by interaction experiments among temperature,p H and sodium chloride concentration[J].Journal of Food Science and Biotechnology,2009,28(3):408-412.(in Chinese)
[20]王维,师俊玲,杨保伟.茎点菌属产松脂醇二葡萄糖苷的培养条件优化[J].农业工程学报,2008,24(6):287-290.WANG Wei,SHI Jun-ling,YANGBao-wei.Optimization of conditions for production of pinoresinol diglucoside by a strain ofPhoma sp.[J].Transactions of the Chinese Society of Agricultural Engineering,2008,24(6):287-290.(in Chinese)
[21]苏俊,冯新忠,邝海菊,等.响应面法优化灰白翅孢壳发酵产胞外多糖的研究[J].食品工业科技,2008,(08):100-102.SU Jun,FENG Xin-zhong,KUANG Hai-ju,et al.Study on optimal producing condition of extracellular polysaccharide ofEmericellopsis pallidaby response surface method[J].Science and Technology of Food Industry,2008(08):100-102.(in Chinese)
[22]唐华,刘同军,杨海龙,等.产红色素海洋细菌Loktanella sp.发酵培养基的优化[J].浙江农业学报,2009,21(1):30-34.TANG Hua,LIU Tong-jun,YANG Hai-long,et al.Optimization of seawater cultivating marine bateriumLoktanella sp.for red pigment production[J].Acta Agriculturae Zhejiangens,2009,21(1):30-34.(in Chinese)
[23]Frederique Gancel,Georges Novel.Exopolysaccharide production by streptococcusSalivariusssp.thermophiluscultures[J].J Dairy Sci,1994,77:685-688.
[24]Stacy A,Kimmel,Robert F,et al.Development of a growth medium suitable for exopolysaccharide production byL actobacillus delbrueckiissp.bulgaricusRR[J].International Journal of Food Microbiology,1998,(40):87-92.
[25]R C McKellar,J Van Geest,W Cui.Influence of culture and environmental conditions on the composition of exopolysaccharide produced byA grobacterium radiobacter[J].Food Hydrocolloids,2003,(17):429-437.
