免疫酶吸附法评价纳米金对抗体Fc端的吸附效果
2010-03-15汤俊琪庞广昌高嘉荣梁新义
汤俊琪, 庞广昌, 高嘉荣, 梁新义
(天津市食品生物技术重点实验室,天津商业大学,天津300134)
近年来,纳米粒子以其独特的物理、化学、光学性能被广泛的用于生物测定分析中[1-4]。纳米金溶胶又叫胶体金,因其具有很高的比表面效应和较强的吸附能力,可与生物活性物质结合作为追踪标记探针,早在1971年Faulk等就利用金溶胶颗粒作为标记物用于免疫电镜技术[5-6]。对于胶体金和抗体等生物物质的结合,人们普遍认为是胶体金表面负电荷和抗体等高分子的正电荷基团因静电作用而吸附,并形成Au-S等稳定化学键而形成了牢固结合[7-9]。抗体等生物分子具有特定的功能区,如抗体Fc端不能识别其对应抗原,只有其 Fab端才具有识别抗原并与其相结合的能力,这样才可发挥抗体的特定作用[10]。为最大限度的保留抗体的生物活性,对抗体的固定吸附等修饰只能在Fc端进行。所以明确纳米金和抗体 Fc端的吸附情况至关重要,对于这方面的研究,目前尚未见报道。
作者利用常见的酶免疫吸附法,研究了以微波制作的纳米金和抗体的吸附情况。纳米金不仅能与抗体结合,而且可通过离心形成沉淀。因此,在纳米金吸附IgG的溶液中加入酶标羊抗兔 IgG的二抗,然后离心,可将纳米粒子/兔IgG/酶标羊抗兔IgG复合物从溶液中分离。则清液中的物质为未和兔IgG结合并保留下来的酶标抗体,加入底物显色液,就可正常显色。如果同时以同浓度的兔IgG溶液和酶标羊抗兔 IgG反应,加入底物显色液,显色后测定其OD值,通过两次OD值得对比,可得到纳米金对兔IgG即纳米金对抗体 Fc端的吸附率,实验过程见图1。

图1 简明实验过程图Fig.1 Schematic illustration of the stepwise experiment process
1 材料与方法
1.1 仪器与试剂
UV-2501紫外可见分光光度计:日本岛津公司产品;高速冷冻离心机:SIGMA公司产品;超声洗涤仪:昆山市超声仪器有限公司产品;电热恒温水浴器:上海一恒科学仪器有限公司产品;酶标仪:Thermo公司产品。
兔IgG(10 mg/mL);HRP-羊抗兔抗体(1:500~1000);牛血清白蛋白:BSA;氯金酸:天津科密欧公司产品;硼酸盐缓冲液(p H=9.0);质量分数10%的NaCl溶液;0.1 mol/L的 K2CO3;2 mol/L的H2SO4;0.15 mol/L的磷酸盐缓冲液(p H=7.4);邻苯二胺(OPD)溶液(10 mg OPD溶于 50 mL p H=5.0底物缓冲液中,再加双蒸水至100 mL);所有试剂都为分析纯,购买后未进行再纯化处理,整个过程都使用双蒸水。
1.2 实验过程
1.2.1 纳米金溶胶的制备 纳米金溶胶由质量分数0.01%的HAuCl4溶液和柠檬酸三钠溶液在微波炉中还原获得[11]。锥形瓶在酸缸浸泡过夜(浓硫酸、重铬酸钾混合液)、超声洗涤后,再用双蒸水洗涤3次。称取0.01g氯化金溶于100 mL的双蒸水中得到质量分数0.01%的氯金酸溶液。该溶液在微波炉中先高档沸腾2 min。迅速加入4 mL的质量分数1%柠檬酸三钠水溶液,再放入微波炉中中挡保持3 min,就可得到透明的橙红色溶液,即为15 nm左右的胶体金。改变柠檬酸三钠的用量可得到不同粒径的胶体金。制备好的金胶溶液在4℃避光保存备用。
1.2.2 纳米金对兔IgG的吸附 取5 mL纳米金溶液,用0.1 mol/L的 K2CO3溶液调节纳米金液的p H值。由于在p H=9.0时,纳米金和IgG结合最牢固最稳定。加入20μL 10 mg/mL的兔 IgG,温和混合2 h。再加入100μL质量分数1%的BSA溶液反应30 min,在4℃下15 000 r/min离心20 min。小心移取上清液,紫红色沉淀用1 mL 1%的BSA溶液溶解,摇匀后4℃下保存备用。
1.2.3 免疫反应和吸附效果的测定 取100μL的纳米金-兔IgG混合溶液,加入1 mL酶标羊抗兔溶液(p H=7.4的磷酸盐缓冲液稀释),37℃水浴反应60 min。4 ℃左右15 000 r/min离心20 min,取上清液100μL加入100μL邻苯二胺(OPD)底物溶液避光反应10 min,加入50μL 2 mol/L的硫酸溶液中止反应,在酶标仪中492 nm波长下测定O.D值。
对照实验中,将纳米金表面的活性位点以BSA溶液完全封闭,然后加入兔 IgG溶液,从而获得纳米金-BSA,兔IgG混合溶液。同样取100μL该混合溶液,加入酶标抗体后以邻苯二胺显色,步骤同上。或者直接以兔 IgG溶液加入酶标抗体后以邻苯二胺显色进行测定,实验条件也完全同上。
2 结果与讨论
2.1 纳米金溶液的表征
采用UV-2501紫外可见分光光度计测定双蒸水稀释2倍的纳米金溶液,在400~700 nm波长范围内扫描,表征纳米金溶液的特征吸收峰。图1是该金胶溶液的吸收曲线,由图可见,在519 nm左右有很强的吸收峰。光吸收性胶体金在可见光范围内有一单一光吸收峰,这个光吸收峰的波长(λmax)在510~550 nm范围内,随胶体金颗粒大小而变化。从而可知本研究制备的胶体金颗粒粒径在15 nm左右[12]。

图2 纳米金溶液的扫描图Fig.2 Spectral absorption curve of gold colloidal solution
2.2 纳米金和兔IgG的最适反应比例
纳米金标记 IgG的最佳p H值一般在9.0左右。将调好p H的胶体金,分装8管(见图3),每管1 mL。将IgG以0.005 mol/L p H=9.0硼酸盐缓冲液稀释为5~50μg/mL系列,分别取1 mL,加入到上述金胶溶液中(2~7号管),混匀。空白对照管(左1号管)只加1 mL缓冲液,空白对照管(右1号管)则加1 mL双蒸水。5 min后,在上述各管中加入0.1 mL质量分数10%NaCl溶液,混匀后静置2 h,观察结果。可以看出30~50μg/mL的抗体溶液能稳定胶体金溶液,说明此质量浓度下抗体胶体金比例合适。

图3 纳米金对不同浓度兔IgG的吸附Fig.3 Gold colloidal absorb rabbit IgG with different concentration
2.3 纳米金吸附兔IgG的表征
分别取2 mL金标抗体和纳米金溶液,稀释2倍后在分光光度计下以400~620 nm波长扫描,对比二者的扫描曲线(图4),可以看出纳米金溶液在518 nm处有最大的光吸收峰,而金标抗体溶液的最大光吸收峰在526 nm,相同的稀释倍数下,不仅金标抗体的吸收峰值明显降低,而且出现明显的红移现象。这表明抗体很好的吸附在纳米金表面。
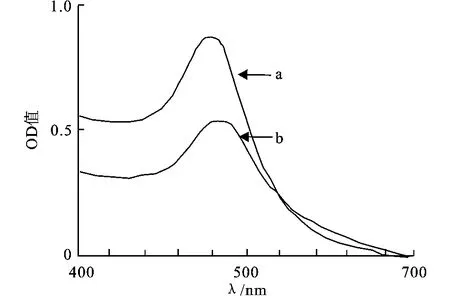
图4 相同稀释倍数的纳米金和纳米金-抗体溶液的光谱扫描图Fig.4 Spectral absorption curve of gold colloidal solution and nano-gold labeledantibody solution with the same dilution times:a—Nano-Au,b—Nano-Au-IgG
如将纳米金溶液稀释4倍,则可更加明显的看到纳米金吸附抗体前后,纳米金溶液的最大光吸收峰的红移现象(图4)。
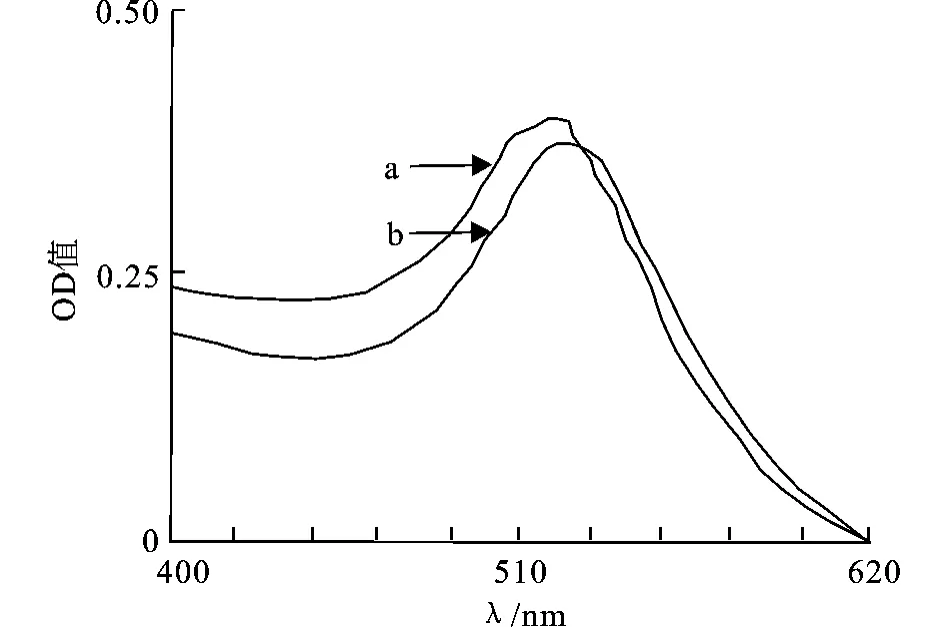
图5 纳米金和纳米金-抗体的光谱扫描图Fig.5 Spectral absorption curve of gold colloidal solution and nano-gold labeledantibody solution with the different dilution times:a—Nano-Au,b—Nano-Au-IgG
2.4 纳米金吸附兔IgG Fc端的效果测定
分别用 500、1 000、2 000、4 000、8 000、16 000倍的酶标抗体稀溶液来测定胶体金对抗体的吸附效果,所测都是上清液的OD值。3种情形在不同稀释倍数下的OD值如下表(表1)。
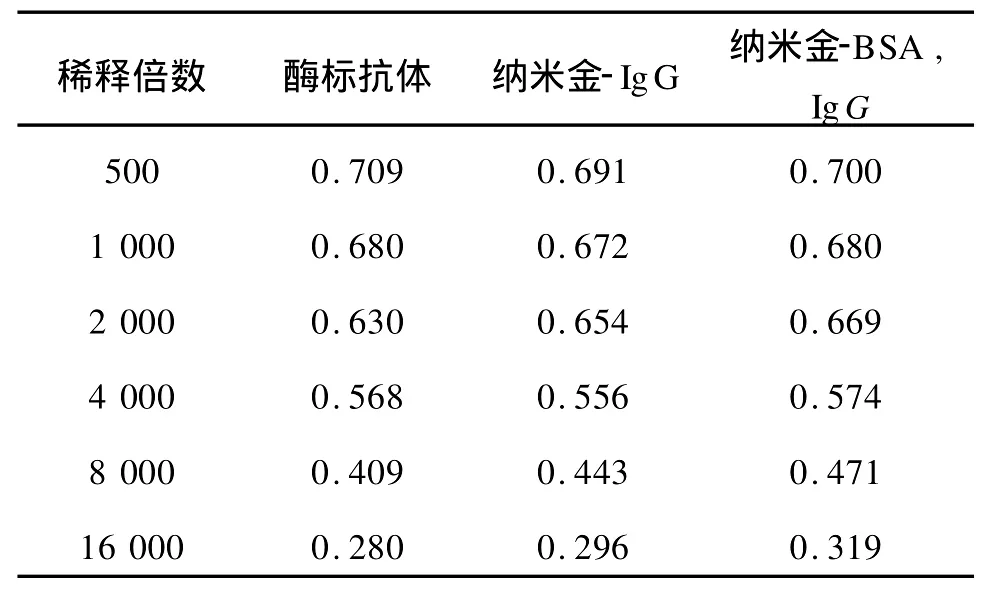
表1 不同稀释倍数下的OD值Tab.1 OD of different dilution multiple HRP-labeled rabbit IgG
以OD值为纵坐标,酶标抗体的不同稀释倍数为横坐标,结果见图图6。
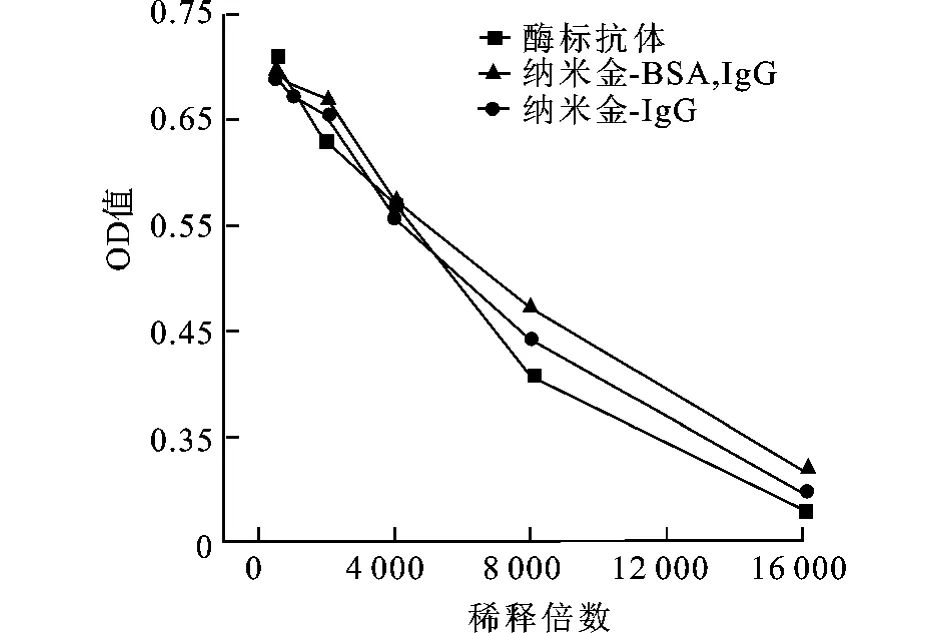
图6 不同稀释倍数下对应的OD值Fig.6 OD of different dilution multiple HRP-labeled rabbit IgG
获得纳米金对抗体的吸附效果,分别以纳米金-BSA,兔IgG混合溶液和兔 IgG溶液作为对照进行测定。研究中假定酶标抗体对暴露的兔IgG的Fc端具有完全的吸附能力,在不同的实验条件下,纳米金对兔IgG的 Fc端的吸附能力,就可通过对比而获得。当兔IgG加入到纳米金溶液中后,则认为纳米金要么吸附在其Fc端,要么吸附在其Fab端。兔IgG的Fc端被纳米金吸附后,就不能再和酶标羊抗兔相结合,凡是 Fc端没有被纳米金结合的兔IgG则可以和酶标羊抗兔抗体结合,发生这种结合后,经过离心,必然导致酶标抗体的量的减少。留在上清液中的酶标抗体,通过加入酶的底物显色可获得其对应的O.D值。如果兔 IgG的 Fc端完全被纳米金结合,则经过离心后酶标抗体的量不会减少,那么可以用兔IgG作为对照,假定这种情况下,酶标羊抗兔和兔 IgG的 Fc端结合率为100%。则可以推算出纳米金和抗体吸附效果。兔IgG和酶标羊抗兔反应后,经离心显色后可以发现纳米金确实对显色存在一定的影响。为避免纳米金对实验中显色的影响,故以纳米金-BSA,兔 IgG作为对照来推算这种效果(见表2)。
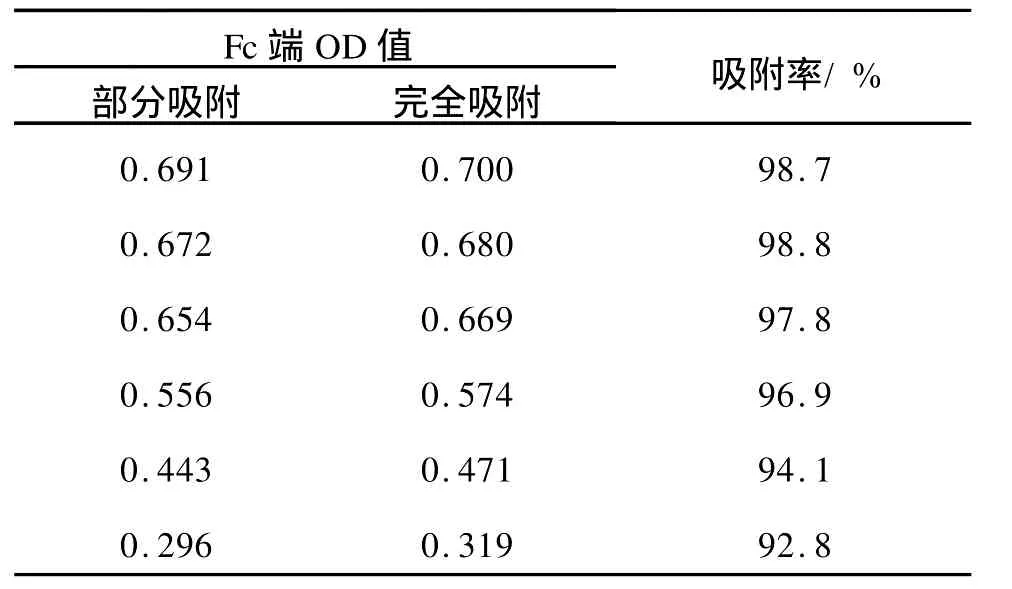
表2 纳米金对抗体Fc端的吸附率Tab.2 Absorption effect of nano-gold to antibody Fc
3 结 语
作者应用微波炉产生的微波来制作纳米金溶胶,方法简单而快速,并用简单的光谱法证明了获得的纳米金的光吸收特征,且证明了该纳米金粒子对抗体Fc端的吸附效果,说明纳米金对抗体的吸附效果比较优良,尤其对抗体 Fc端的吸附率非常的高,达到92%以上。该过程方法简单,利用了离心分离和酶标抗体的显色能力,通过免疫酶吸附技术进行测定,获得了较理想的结果,尽管可能存在一定的误差,但为以后应用纳米金对抗体进行修饰或固定,尤其是免疫传感器中定向固定抗体等具有一定的参考价值。
[1]LIU G D,LIN Y H.Nanomaterial labels in electrochemical immunosensors and immunoassays[J].Talanta,2007,74(3):308-317.
[3]ZHANG S B,WU Z S,GUO M M,et al.A novel immunoassay strategy based on combination of chitosan and a gold nanoparticle label[J].Talanta,2007,71(4):1530-1535.
[4]Olkhov R V,Shaw A M.Label-free antibody antigen binding detection by optical sensor array based on surface-synthesized gold nanoparticles[J].Biosensors and Bioelectronics,2008,23(8):1298-1302.
[5]Faulk W P,Taylor G M.An immunocolloid method for the electron microscope[J].Immunochemistry,1971,8:1081-1083.
[6]孙秀兰,赵晓联,汤坚.纳米金溶胶形成过程的可见光吸收光谱研究[J].无锡轻工大学学报(食品与生物技术学报),2004,23(4):86-89.SUN Xiu-lan,ZHAO Xiao-lian,TANG Jian.The UV-visible spectrum,studies on formation process of colloidal gold particles[J].Journal of Wuxi University of Light Industry,2004,23(4):86-89.(in Chinese)
[7]LIANG R P,QIU J D,CAI P X.A novel amperometric immunosensor based on three-dimensional sol gel network and nanoparticle self-assemble technique[J].Analytica Chimica Acta,2005,534(2):223-229.
[8]WU Z S,LI J S,LUO M H,et al.A novel capacitive immunosensor based on gold colloid monolayers associated with a sol gel matrix[J].Analytica Chimica Acta,2005,528(2):235-242.
[9]胡瑞省,刘善堂,朱涛,等.金纳米粒子通过形成Au—S键的组装[J].物理化学学报,1999,15(11):961-965.HU Rui-tang,LIU Shan-tang,ZHU Tao,et al.Nano-gold formed compound through Au-S bond assembled[J].Acta Physico-Chimica Sinica,1999,15(11):961-965.(in Chinese)
[10]周德庆.微生物教程,2版[M].北京:高等教育出出版,2002.309-314.
[11]王文勇,李玉松,赵一玲,等.一种快速、稳定制备胶体金的新方法[J].细胞与分子免疫学杂志,1997,13(增刊1):18-19.(in Chinese)WANG Wen-yong,LI Yu-song,ZHAO Yi-ling,et al.A simple and fast method to preparation colloidal gold[J].Journal of Cellular and Molecular Immunology,1997,13(Suppl.1):18-19.
[12]张先恩.生物传感器[M].北京:化学工业出版社,2005.368-369.
