电致化学发光方法检测肉的新鲜度
2010-03-15钮伟民孙秀兰张银志李在均宋启军李芳周磊
钮伟民, 孙秀兰, 张银志, 李在均, 宋启军, 李芳, 周磊
(1.无锡市疾病预防控制中心,无锡21402,2.江南大学食品学院,无锡214122;3.食品科学与技术国家重点实验室,江南大学,无锡214122;4.江南大学化工材料与工程学院,无锡214122)
随着人们生活水平的不断提高,肉类消费量日益增大,人们对于肉的品质要求也是不断提高,如何准确地评定肉品的新鲜程度关系着人们的切身利益。我国对鲜冻畜禽肉的卫生标准都有明文规定,根据卫生标准对肉品新鲜程度的评定主要采用感官标准与理化标准相结合的方法[1]。肉品的变质过程,就是肉品外在感观性状和内部成分逐渐腐败变化的过程,其过程中伴随着硫化物和氨气的产生[2]。目前判定肉品新鲜度主要从肉品的感观性状、腐败分解产物的特性及含量、细菌的数量及污染程度三个方面来进行[3-5],但是这些方法往往耗时比较长,设备复杂,而且灵敏度不是很好。本文采取电致化学发光的方法,通过检测肉类腐败变化的过程中产生的氨气,从而来检测肉的新鲜程度。
电致化学发光(ECL)是某些具有电致化学发光活性的物质处在一定的电位时,与溶液中氧化还原物质作用生成的不稳定激发态迁移回基态时所导致的化学发光[6]。国内外的学者对化学发光法的机制也进行了大量的研究[7-8]。它具有灵敏度高、重现性好、可连续检测、检测速度快和装置简单等特点。
1 材料与方法
1.1 试剂
盐酸,N,N′-二甲基甲酰胺(DMF),硝酸均购自中国医药公司上海分公司;0.05 mol/L磷酸缓冲溶液和多壁碳纳米管(MWNTs)作者所在实验室自制。
1.2 仪器
GS-3交直流两用大气采样机(上海宏伟环保设备厂);PHS-2ST数显酸度计,EL-204电子天平(梅特勒-托利多仪器有限公司);IM6e电化学测试仪(德国ZAHNER公司);MPI2B型多参数电致化学发光/化学发光分析测试系统(西安瑞迈电子科技有限公司)。
1.3 实验方法
1.3.1 MWNTs/PVA/铱配合物修饰电极的制备
MWN T经充分研磨后,在浓硝酸中加热回流3 h,用超纯水洗涤至中性,并在200℃下烘干3 h.称取2 mg处理过的MWNT,加入10 mL二甲基甲酰胺(DMF),超声30 min后,MWNT分散于DMF中,形成棕色溶液。玻碳电极修饰前使用0.3 mg氧化铝粉在抛光绒布上仔细打磨抛光5 min,用超纯水冲洗干净后,置于空气中晾干.用微量进样器移取10μL刚刚经过超声振荡的MWNT/DMF溶液滴加在电极的工作面上,置于红外灯下烘干.再移取5μL含0.1%Nation的乙醇溶液滴加于电极的表面,在空气中晾干,待溶剂挥发完全即可。修饰后的工作电极用超纯水冲洗干净,并保存于室温下。
1.3.2 样品处理与测定
将500 g新鲜肉至于密闭的容器里,每放置5小时,采用大气采样器抽取密闭容器里的气体,将采集的气体样品导入至10 mL 0.1 mol/L HCl溶液中,采样速率为0.5 L/min,采样时间为5 min。将导入气体的10 mL 0.1 mol/L HCl溶液的p H值调至6.5,以MWNTs/PVA/铱配合物修饰电极为工作电极[9],铂丝电极为对电极,Ag/AgCl电极为参比电极,进行循环伏安-电致化学发光扫描,扫描范围为0.2~1.8V,扫描速率为100 mv/s。
2 结果与讨论
2.1 扫描速率的影响
研究中发现,循环伏安-电致化学发光的扫描速率影响着体系的发光强度[10]。因此,对同一样品,采用不同的速率进行扫描,分别为10、50、100、150、200 mV/s,随着扫描速率的增大,体系的发光强度越来越大,但是超过一定扫描速率之后,发光值不再继续增大,并且在同一扫描速率下,发光值呈现不稳定的趋势。
2.2 酸度的影响
在循环伏安-电致化学发光体系中,溶液的p H值对ECL值影响很大[11],随着p H值的增大,ECL值逐渐增大,当p H值为6.5时,发光达到最大值,随着p H的继续增大,发光呈现减小的趋势(见图1)。产生上述这种现象,主要原因是由于溶液中的NH4+主要是以NH3的形式参与反应,在溶液中,NH4+和NH3的浓度其实是达到一个有效的平衡,当p H值较低时,主要是以N H4+的形式存在,溶液中的N H3就比较少;当p H值较高时,主要是以NH3的形式存在,但较高的p H使得溶液中的NH3又会溢出。所以,结合实验,我们选择最佳的p H值6.5。
2.3 线性范围及检出限
在p H为6.5的 PBS溶液中,以100 mV/s的速度在0.5~1.8 V电位范围内进行循环伏安-电致化学发光扫描,配制一系列的NH4+标准溶液测量用以得到不同浓度NH4+溶液的标准曲线,结果如图2所示。NH4+作为共反应物的发光值与NH4+浓度在1.8×10-7~1.0×10-9mol/L范围内呈良好的线性关系,其线性回归方程为:y=0.701 6x+46.884(R2=0.999 9),检出限为 1.2×10-13mol/L(S/N=3)。

图1 pH对修饰电极电致化学发光的影响Fig.1 Effect of pHon ELC

图2 MWNTs/PVA/(pq)2Ir(N-phMA)修饰电极检测NH4+的标准曲线,扫描速率100mV/sFig.2 the detection of NH4+with modified electrode assembled with MWNTs/PVA/(pq)2Ir(N-phMA)
2.4 MWNTs/PVA/(pq)2Ir(N-phMA)修饰电极的稳定性与重现性
同一电极平行测定2.0×10-5mol/L NH4+溶液10次,RSD为1.8%(见图3)。

图3 修饰电极的重现性Fig.3 Reproducibility of modified electrode
在相同条件下制作的5支电极测定2.0×10-5mol/L NH4+溶液,RSD为2.9%。电极测量完毕后,用蒸馏水清洗电极,室温下晾干,在4℃下储存。每隔一周测定1.0×10-5mol/L NH4+溶液,如图4所示。

图4 修饰电极的重现性与稳定性Fig.4 Stability of modified electrode
前10周内,测定的 ECL值较为稳定,其 RSD为 2.4%,说明 MWNTs/PVA/(pq)2Ir(N-phMA)修饰电极性能稳定。
2.5 干扰实验
空气中含有氮气﹑二氧化碳﹑硫化氢﹑二氧化硫,腐肉本身也会释放出硫化氢[12]。为了检验上述这些物质对氨气的检测是否有干扰,我们做了如下的干扰实验:(1)往p H为6.5的 PBS溶液中通氮气5 min;(2)往p H为6.5的PBS溶液中通硫化氢5 min;(3)往p H为6.5的PBS溶液中通二氧化碳5 min;(4)往p H为6.5的PBS溶液中通二氧化硫5 min,将制备的 MWNTs/PVA/(pq)2Ir(N-phMA)修饰电极分别插入上述4份溶液,进行电致化学发光扫描,结果发现,上述溶液均未能产生化学发光,这也就说明采用电致化学发光法来检测空气中氨气时,其它成分的存在不会对其测定产生干扰作用。
2.6 肉类新鲜程度的测定
当肉由于各种微生物的污染和作用引起了腐败现象,或者由于自身酶的分解作用引起酸臭性发酵时,会产生硫化物和其他挥发性物质如氨气,因此可根据肉类在不同时期产生气体释放的程度,通过采集不同时期的气体样品用于新鲜度的检测(见图5)。
从ECL数据显示,当新鲜肉刚刚放入密闭空间时,采集样品,我们并没有检测到发光,放置5 h之后,我们检测到 ECL,说明此时猪肉自身酶开始分解,释放出氨气,随着放置时间的增加,ECL响应值逐渐增大,说明猪肉腐化释放的氨气越来越多,猪肉的腐化越来越严重。当放置超过两天后,ECL值增至200,根据我们所作的标准曲线,采样速率以及采样的时间,我们可以计算出各个时间段氨气的浓度(如图6)。

图5 样品检测,每5 h进行一次采样和扫描,扫描速率100 mV/sFig.5 Sample detection,scanning once every 5 hours,the scanning rate of 100 mV/s
3 结 语
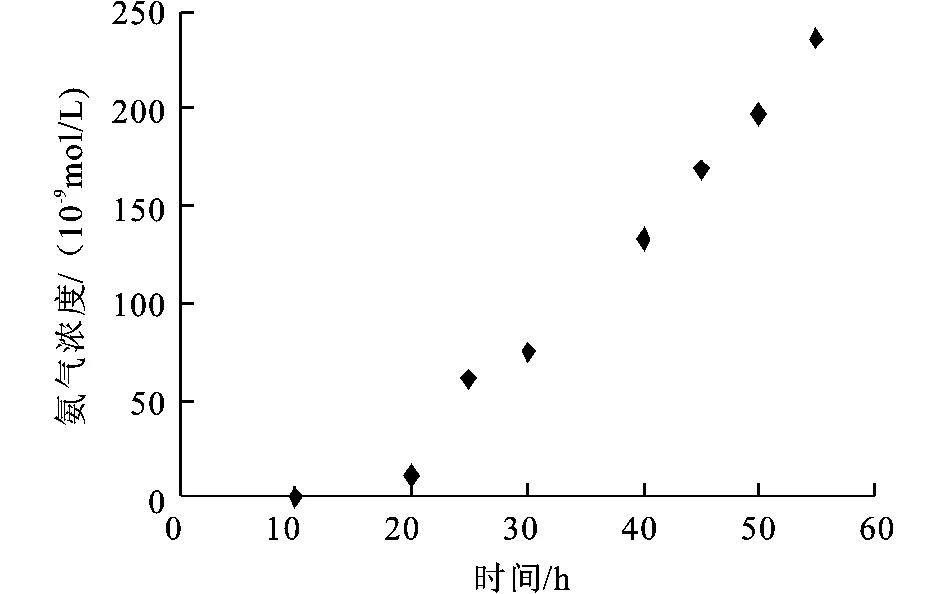
图6 氨气浓度随储存时间的变化Fig.6 Concentration of NH3changed with storage time
肉品腐败是一个非常复杂的物理化学过程,传统的肉新鲜度检测方法也比较多,但是都有一共同的缺点,都要求在检测前先制备肉浸液,过程繁琐且耗时较长,难以满足快速检测的要求。而用电致化学发光法检测肉的新鲜度,可以省去肉的预处理步骤,大大缩短了检测的时间,而且此方法还具有灵敏度高和检测结果稳定的特点,操作简便的特点,适宜于推广使用。
[1]薛慧文.肉品卫生监督与检验手册[M].金盾出版社,2003.440.
[2]孙钟雷.电子鼻筑术在猪肉新鲜度识别中的应用[J].肉类研究.2008,108(2):50-53.SUN Zhong-lei.Application of electronic nose technology in pork freshness recognition[J].2008,108(2):50-53.(in Chinese)
[3]Ivo Frebort,Lenka Skoupa,Pavel Pec.Amine oxidase-based flow biosensor for the assessment of fish freshness[J].Food Control,2000:13-18.
[4]G Vinci,M L Antonelli.Biogenic amines:quality index of freshness in red and white meat[J].Food Control,2002:519-524.
[5]陈家华.畜禽及其产品质量和安全分析技术[M].化学工业出版社,2007.81.
[6]管文军.电致化学发光生物检测技术的新进展[J].分析化学.2004,32(3):402-406 GUAN Wen-jun.The new progress in electrochemiluminescence bio-detection technology[J].Chinese Journal of Analytical Chemistry,2004,32(3):402-406.(in Chinese)
[7]Lai,Rebecca Yun Kay.Electrogenerated chemiluminescence of phenylquinoline-phenothiazine donor-acceptor molecules,dipyrromethene-boron fluoride laser dyes and bent-pyrene-containing cyclophanes[J].Dissertation Abstracts International,65-01,Section:B,0194
[8]Choi,Jai-Pil.Electrogenerated chemiluminescence with amine and benzoyl peroxide coreactants:Reactivity and reaction mechanism studies[J].Dissertation Abstracts International,64-12,Section:B,6057
[9]eleke,Abisake.Determination of cholesterol in foods by flow injection analysis with perroxyoxalate chemiluminescence[J].Masters Abstracts International,:44-06,:2798
[10]陶颖.多壁纳米碳管在固态电致化学发光中的应用研究[J].厦门大学.2007:24 TAO Yin.The studies and applications of carbon nanotubes in solid-state electrochemiluminescence[J].Xiamen Univercity,2007.24(in Chinese)
[11]陈毅挺,何伟文,林棋,等.基于多壁碳纳米管修饰电极的保泰松的电致化学发光检测[J].化学学报,2009,(67):1615-1620 CHEN Yi-ting,He weiwen,Lin qi,et al.Electrochemiluminescence determination of phenyIbutaz one based on modified electrode by multi-wall carbon nanotube[J].ACTA CHIMICA SINICA,2009(67):1615-1620(in Chinese)
[12]张敬平,钮伟民,叶扣贯.肉类分解产物及检测现状[J].中国卫生检验杂志,2006(16):1405-1408 ZHAN Jing-ping,NIU Wei-min,YE Kou-guan.Decomposition products of meat and testing status[J].Chinese Journal of Health Laboratory Technology,2006(16):1405-1408(in Chinese)
