微波与超声波提取杨梅汁多酚类物质的对比研究
2010-03-15郑利琴张慜孙金才丁占生
郑利琴, 张慜*, 孙金才, 丁占生,
(1.食品科学与技术国家重点实验室江南大学,江苏无锡214122;2.浙江海通食品有限公司,浙江慈溪315300)
杨梅(Myrica rubra)是我国特产水果,主要分布在长江以南的浙江和福建两省,其中浙江杨梅现有栽培面积近100万亩,产量突破25万t。杨梅中含有丰富的碳水化合物、蛋白质、氨基酸、有机酸、矿物质、维生素和多酚类物质[1]。杨梅多酚是杨梅中所含有的多酚类物质的总称,包括花色苷、黄酮醇、黄酮、没食子酸、原儿茶酸等[2],其中花色苷、黄酮及没食子酸属于含量较多的多酚类物质[3]。杨梅多酚的特点是此类化合物分子结构中含有较多的酚羟基,具有较强的提供氢离子的作用,能清除活性氧自由基,具有抗氧化性,抗肿瘤,抑菌,抗血小板凝聚等作用[4-5]。
从天然产物中提取多酚类物质的方法很多[6]。传统提取多酚类化合物的方法为乙醇浸提法或水浸提法,所需的时间较长,而且容易达到饱和,导致工业化生产成本高。微波提取技术具有设备简单、适用范围广、提取效率高、重现性好、节省时间、节省试剂、污染小、重现性好等特点[7];而超声波萃取技术可以有效克服浸出时间长、浸出温度高、有效成分受热过程长、杂质浸出多、能源消耗大等缺陷[8],从而提高植物多酚制取的经济效益。微波和超声波萃取技术是当前植物多酚最为常用的先进提取工艺之一。
1 材料与方法
1.1 材料
荸荠种杨梅制成的冷冻杨梅原汁,此杨梅原汁为杨梅鲜果去核后榨汁所得,为100%杨梅原汁,出汁率为75%,由浙江海通食品集团提供。
1.2 试剂
没食子酸标准物质购于 Sigma公司;无水乙醇、无水碳酸钠、Folin-酚、芦丁,硝酸铝,亚硝酸钠,氢氧化钠,柠檬酸钠,盐酸,醋酸钠,冰醋酸等均为分析纯。
1.3 仪器
752型紫外分光光度计:上海科学精密仪器有限公司产品;TDL-60B离心机:上海安亭科学有限公司产品;FA1104型电子天平:上海天平仪器厂产品;HH-2型数显恒温水浴锅:常州国华电器有限公司产品;MF-2270EG微波炉:青岛海海尔波制品有限公司产品;J Y98-3D超声波细胞粉碎机:宁波新芝生物科技股份有限公司产品。
1.4 方法
将冷冻杨梅原汁于冰箱中5℃解冻,置于阴凉处备用。
1.4.1 杨梅多酚类物质提取中提取剂的选择 有机溶剂与水的复合体系作为提取剂最适合多酚类物质的提取,有机溶剂的提取能力顺序为:丙醇<乙醇<甲醇<丙酮<四氢呋喃。其中应用最多的是丙酮-水体系,而丙酮-水体系中丙酮可引起其它物质(如蛋白质和多糖等)溶出量的增加,且超量丙酮吸入机体后会引起麻醉[9]。鉴于提取后的杨梅多酚用于制作食用产品,因此为防止提取物有机溶剂残留过多并保证产品安全性,最终选择乙醇-水体系作为提取剂。
1.4.2 杨梅原汁中多酚类物质的提取 准确量取5 mL的杨梅汁于100 mL的烧杯中,加入一定量的乙醇溶液,采用微波辅助浸提及超声波辅助浸提两种方法提取,将粗提液在转速4 000 r/min下离心10 min,上清液作为待测液。
1.4.3 总酚含量的测定 总酚含量的测定,选用杨梅多酚粗提物中3种含量较高且具代表性的多酚类物质:花色苷,黄酮,及没食子酸的测定,最后以这3种物质的加和为当量计算杨梅多酚提取物的量。
1)没食子酸含量的测定 配制质量分数10%饱和碳酸钠溶液,绘制标准曲线Folin-酚法[10]:用5 mL的无水乙醇溶解0.250 0 g没食子酸,定容至50 mL,分别移取 0、0.5、1.0、1.5、2.0、2.5、3.0、3.50、4.0 mL到50 mL容量瓶中,用水定容。这些溶液可以分别表示为质量浓度为0,50,100,150,250,350,500 mg/L的没食子酸溶液。从上述不同浓度的标准溶液中分别移取0.5 mL加入到50 mL容量瓶中,再分别加入30 mL的去离子水,混合;加入2.5mL的 Folin-酚试剂,摇匀后静置 3~4 min;加入7.5 mL质量分数为10%的碳酸钠溶液,混匀,定容。将上述标准溶液在25℃下放置2 h后,在765 nm下测定吸光值,绘制标准曲线(图1)。得到回归线性方程为:
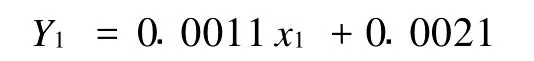
式中:Y1——吸光值;x1——没食子酸质量浓度,mg/L;R2=0.9971,具有很好的线性关系。
2)黄酮含量的测定 精确称取120℃干燥恒重芦丁(作黄酮标准对照品)10 mg,体积分数60%乙醇定容于100 mL容量瓶中,摇匀。分别移取芦丁对照品溶液 0、0.5、1.0、1.5、2.0、2.5 、3.0、3.5、4.0 mL置10 mL具塞试管中,加质量分数5%亚硝酸钠溶液和质量分数10%硝酸铝溶液各0.3 mL,放置6 min;加1 mol/L的 NaOH溶液4.0 mL,用体积分数60%乙醇溶液稀释至刻度,摇匀。放置15 min,于510 nm处测吸光度[11],测得的吸光值绘制标准曲线(图1)。得到回归线性方程为:
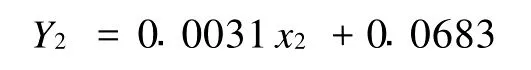
式中:Y2——吸光值;x2——芦丁质量浓度,mg/L;R2=0.9927,具有很好的线性关系。

图1 标准曲线Fig.1 Standard curve of gallic acid
3)花色苷含量的测定 取10 mL试管两支,各加入0.5 mL果汁,再分别加入p H 1.0缓冲液和p H 4.5缓冲液各9.5 mL,置于暗处平衡30 min,以蒸馏水作对照,用紫外-可见分光光计在510 nm和700 nm处分别测定其吸光度值A,每个样品重复3次,取平均值,计算花色苷含量[12]:
总吸光度A=(A510-A700)pH1.0-(A510-A700)pH 4.5
花色苷含量x3(mg/L)=(A/(L×ε))×1 000×MW×稀释倍数=(A/26 900)×1 000×449.2×稀释倍数
其中:L为比色杯的宽度,大多数分光光度计比色杯的宽度为1 cm,即L值为1,ε为杨梅中的主要花色苷矢车菊3-葡萄糖苷的摩尔吸光系数26 900,MW为矢车菊3-葡萄糖苷的相对分子质量449.2,稀释倍数根据实验方法中具体的倍数而定。
4)总酚含量的计算 杨梅汁中多酚含量的计算:X=x1+x2+x3;
样品中总酚含量的计算:量取1.4.2中一定量离心好的上清液,按照各种酚类物质测定方法,测定其吸光值,并计算杨梅汁中总酚含量。
2 结果与分析
2.1 单因素对多酚类化合物提取的影响
2.1.1 乙醇体积分数对杨梅多酚提取的影响 准确量取5 mL的杨梅汁于100 mL的烧杯中,分别在微波功率为500 W、微波辐射时间30 s、液料比为4 mL∶1 g的条件,及超声波功率500 W,超声时间30 min,液料比为4 mL∶1 g的条件下,考察不同乙醇体积分数对提取量的影响,分别以没食子酸,黄酮及花色苷为测定指标。乙醇体积分数分别为20%、30%、40%、50%、60%、70%、80%、90%,确定最佳乙醇体积分数。
在微波及超声波两种方法下,乙醇体积分数对杨梅多酚提取中主要酚类物质提取的影响见图2。从图中可看出,当乙醇体积分数增大时,杨梅多酚类化合物提取的量也随着提高,但超声波提取乙醇体积分数超过70%,微波提取乙醇体积分数超过80%后,杨梅多酚提取的量有所下降。这与杨梅的组分以及多酚的物理性质有关,多酚易溶于乙醇,植物多酚与植物组织中的蛋白质、生物碱、多糖等物质发生复合。乙醇与水的混合液可打断多酚类物质与蛋白质、多糖等物质的结合键,有利于多酚的提取。但乙醇浓度过高,会使杨梅汁中细胞失水而造成纤维间紧缩,影响多酚的渗出。此外,上图可看出,采用超声波提取得到的各个测定指标的量均比微波提取的量大。因此以下实验中,超声波提取均采用70%的乙醇溶液,微波提取均采用80%的乙醇体积分数来提取杨梅多酚。
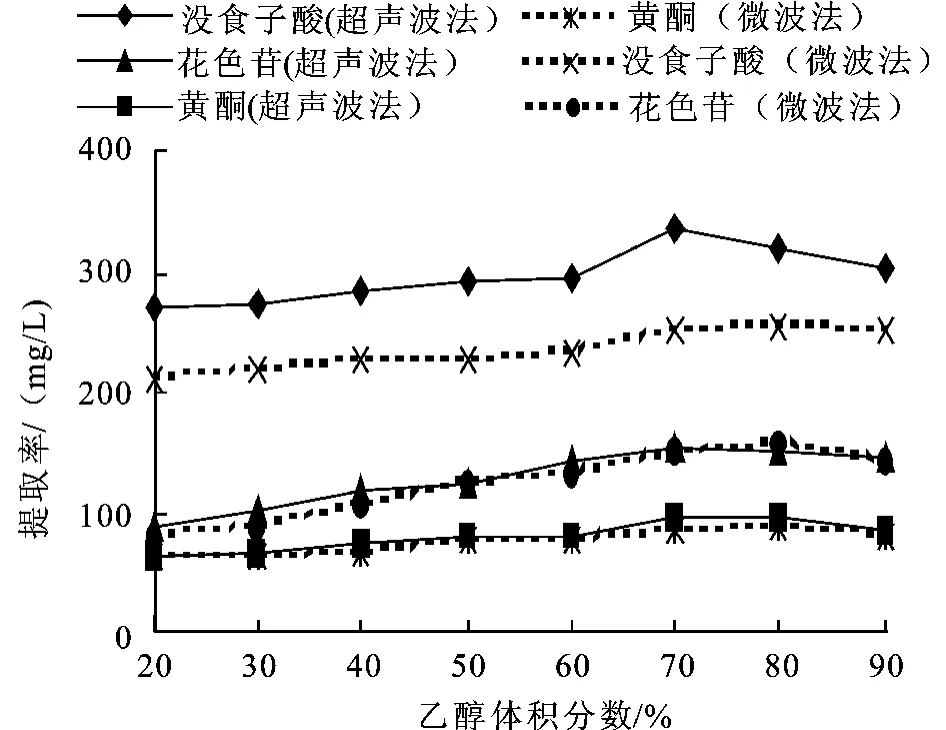
图2 乙醇体积分数对提取率的影响Fig.2 Effect of alcohol concentration on the extraction capacity
2.1.2 提取功率对杨梅多酚提取的影响 准确量取5 mL杨梅汁于100 mL的烧杯中,分别在乙醇体积分数为80%、微波辐射时间30 s、液料比为4 mL∶1 g的条件,及乙醇体积分数为70%、超声时间30 min、液料比为4 mL∶1 g的条件下,考察不同提取功率对提取量的影响,分别以没食子酸,黄酮及花色苷为测定指标。提取功率分别为 100、200、300、400、500、600 W,确定最佳的提取功率。
在微波及超声波两种方法下,微波及超声波提取功率对杨梅多酚提取的影响见图3。从图中可看出,当提取功率增大时,杨梅多酚类化合物提取量的各个指标也随着提高,但微波及超声功率超过500 W后,杨梅多酚提取的量有所下降。这主要是由于随着提取功率的增加,物料在单位时间内获得的能量逐步增加,会加剧杨梅汁中组织细胞的破裂,使得多酚类物质溶出,从而使提取量增加。但是当微波功率增加时,提取液温度在短时间内达到上限值,甚至沸腾,乙醇沸点低,挥发较快,使得多酚类化合物有所损失。而超声波提取时避免了提取液沸腾的现象。因此,从图中曲线可看出,超声波提取的多酚类物质的量相较微波提取量较大,且微波及超声波提取功率的最佳值均为500 W。因此,以下实验中提取功率均为500 W来提取杨梅多酚。
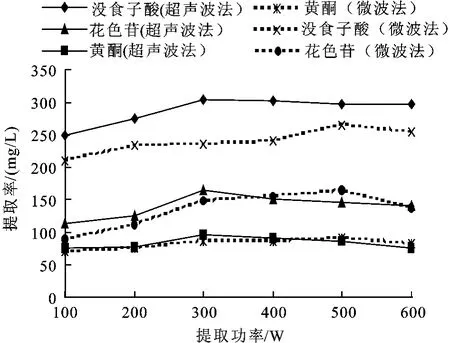
图3 提取功率对提取率的影响Fig.3 Effect of power on the extraction capacity
2.1.3 处理时间对杨梅多酚提取的影响 准确量取5 mL的杨梅汁于100 mL的烧杯中,分别在乙醇体积分数为80%、微波辐射功率为500 W、液料比为4 mL∶1 g的条件,及乙醇体积分数为70%、超声功率为500 W、液料比为4 mL∶1 g的条件下,考察不同提取时间对提取量的影响,分别以没食子酸,黄酮及花色苷为测定指标。微波提取时间为分别为 5、10、15、20、25、30、35、40 s,超声波提取时间分别为 5、10、15、20、25、30、35、40 min。确定两种提取方法最佳的提取时间。
在微波及超声波两种方法下,提取时间对杨梅多酚提取中主要酚类物质提取的影响见图4及图5。从图中可看出,当提取时间增加时,杨梅多酚类化合物提取量的各个指标也随着提高,但微波提取时间超过30 s,超声提取时间超过35 min后,杨梅多酚提取的量有所下降。这主要是由于随着提取时间的增加,有利于杨梅多酚提取物扩散在溶剂中,增加了提取量。但提取时间过长,会导致提取液温度过高,使得多酚类物质分解,减少提取量。因此,超声波及微波提取时间均不宜过长。从上图得出超声波最佳提取时间为35 min,微波最佳提取时间为30 s。通过曲线图得出结论,以下实验中,超声波提取时间为35 min,微波提取时间为30 s来提取杨梅中的多酚类物质。
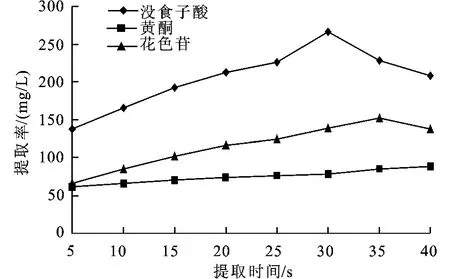
图4 微波处理时间对提取量的影响Fig.4 Effect of microwave treatment time on the extraction capacity
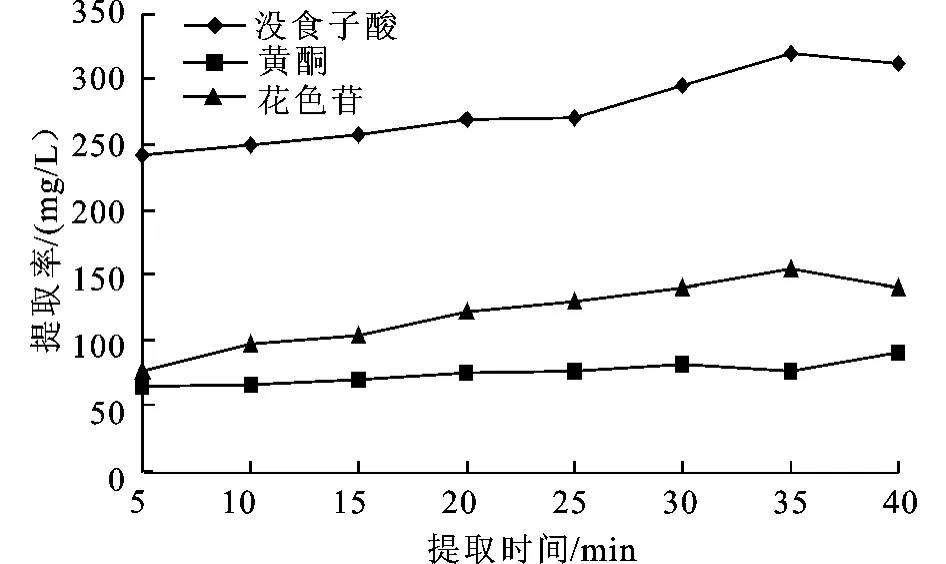
图5 超声波处理时间对提取量的影响Fig.5 Effect of ultrasonic treatment time on the extraction capacity
2.1.4 液料体积质量比对杨梅多酚提取的影响准确量取5 mL的杨梅汁于100 mL的烧杯中,分别在乙醇体积分数为80%、微波辐射功率为500 W、微波提取时间为30 s的条件,及乙醇体积分数为70%、超声功率为500 W、超声波提取时间为35 min的条件下,考察不同液料比对提取量的影响,分别以没食子酸,黄酮及花色苷为测定指标。两种方法的液料比均为2 mL ∶1 g、3 mL ∶1 g、4 mL ∶1 g、5 mL∶1 g、6 mL∶1 g,确定最佳液料体积质量比。
在微波及超声波两种方法下,提取液料体力体积质量比对杨梅多酚提取中主要酚类物质提取的影响见图6。
从图中可看出,随着溶剂量的增大,杨梅多酚类化合物提取的量呈现缓慢下降的趋势。考虑到如果溶剂量过少,虽然提取液中的各个指标的测定含量高,但是提取物较少,而且可能会提取不完全;而溶剂量过大又增加了乙醇的用量,且提取率也有所下降。结合两方面的原因,综合考虑,微波及超声波提取时采用液料体积质量比4 mL∶1 g为宜。

图6 液料体积质量比对提取量的影响Fig.6 Effect of the ratio of material to liquid on the extraction capacity
2.2 正交实验
2.2.1 微波辅助提取的正交实验 由于微波辅助浸提杨梅多酚的主要影响因素是受到乙醇体积分数、微波处理时间、微波处理功率、液料体积质量比4个因素交叉影响,而以上所做的实验都是单因素的影响,为了全面考察这4个因素的影响,设计了4因素3水平正交实验。选择乙醇体积分数、微波处理时间、微波处理功率、液料比为考察因素,选用L934正交表[13]对杨梅多酚提取工艺进行研究,因素水平见表1。以提取液中没食子酸、黄酮及花色苷代表性多酚类物质的含量为考察指标,结果见表2。
由表2及表3中的方差分析可知,四因素对杨梅总多酚提取效果的影响主次顺序为:微波处理时间、乙醇体积分数、微波处理功率、液料比。最优水平组合式A2B2C1D2,即采用乙醇体积分数为80%,微波功率为500 W,微波处理时间为25 s,液料体积质量比为4 mL/g。按照最佳提取工艺条件进行实验,测得杨梅汁中总多酚含量为514.837 mg/L,大于正交实验中最大提取量。

表1 正交因素水平选择表Tab.1 The level of orthogonal factors

表2 正交实验设计及结果Tab.2 The results of orthogonal experiment
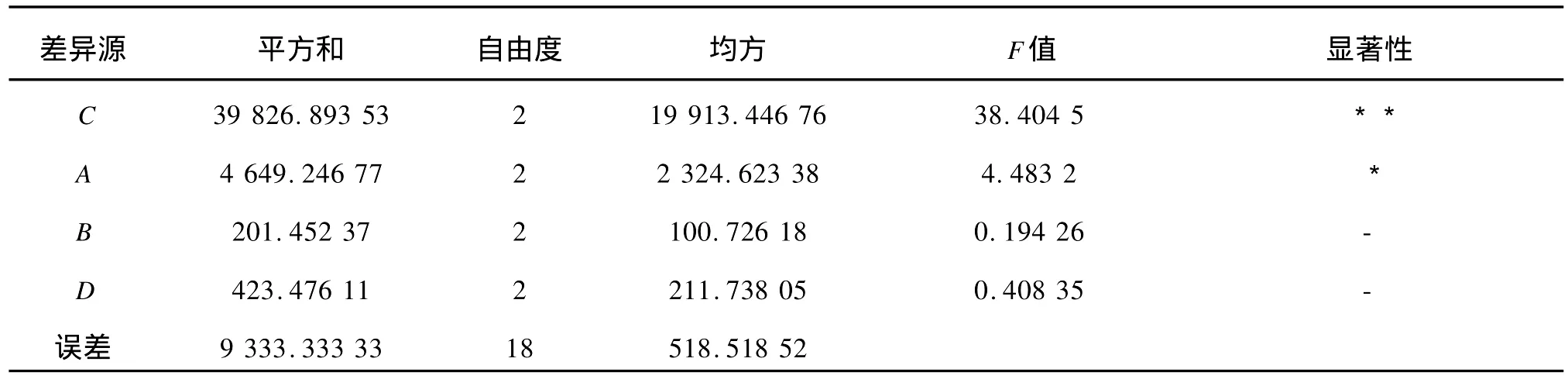
表3 正交设计各因素方差分析表(完全随机模型)Tab.3 Orthogonal factors analysis of variance(completely random model)
2.2.2 超声波辅助提取的正交实验 由于超声波辅助浸提杨梅多酚的主要影响因素是受到乙醇体积分数、超声波处理时间、超声波处理功率、液料比4个因素交叉影响,而以上实验都是单因素的影响,为了全面考察这4个因素的影响,设计了4因素3水平正交实验。选择乙醇体积分数、超声波处理时间、超声波处理功率、液料比为考察因素,选用L934正交表[13]对杨梅多酚提取工艺进行研究,因素水平见表3。以提取液中没食子酸、黄酮及花色苷代表性多酚类物质的含量为考察指标,结果见表4。

表4 正交因素水平选择表Tab.4 Level of orthogonal factors
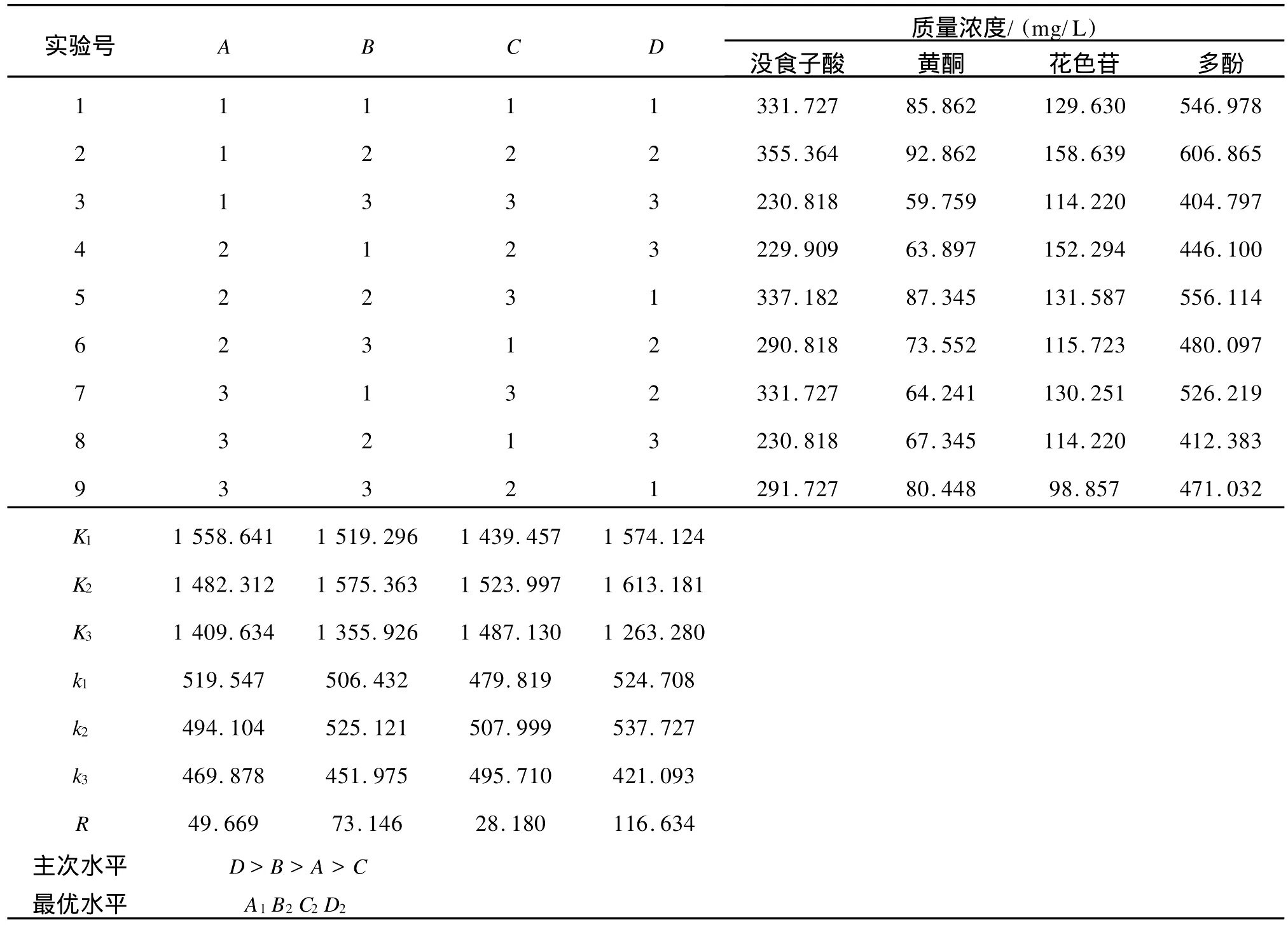
表5 正交实验设计及结果Tab.5 Results of orthogonal experiment

表6 正交设计各因素方差分析表(完全随机模型)Tab.6 Orthogonal factors analysis of variance(completely random model)
由表4及表5可知,四因素对杨梅总多酚提取效果的影响主次顺序为:液料体积质量比、超声波处理时间、乙醇体积分数、超声波处理功率。最优水平组合式A1B2C2D2,即采用乙醇体积分数为60%,超声波功率为500 W,超声波处理时间为35 min,液料体积质量比为4 mL/g。按照最佳提取工艺条件进行实验,测得杨梅汁中总多酚含量为609.256 mg/L,大于正交实验中最大提取量。
3 结 语
研究了采用超声波及微波辅助提取两种方法提取杨梅汁中的多酚类物质,以没食子酸、黄酮、花色苷质量分数3个测定指标来比较这两种方法的优劣。实验过程中,微波提取的主要缺点是随着微波提取的进行,会导致提取液温度过高,使得多酚类物质分解,减少提取量,且微波处理后提取液体积变小,多酚类化合物所占体积分数较大,但总的提取量较处理前反而下降,而利用超声波辅助浸提则可避免这一缺点,与微波辅助提取相比,超声波耗时很长。利用微波辅助提取方法处理时间大幅度减少,微波处理时间较短,可节省大量的生产时间。
[1]吴亚梅,陈健,李维锋.杨梅的综合研究与利用[J].食品科技,2007(10):75-78.WU Ya-mei,CHEN Jian,Li Wei-feng.Progress of the research on Myrica rubra and its potential as a resou rce of food[J].Food Science and Technology,2007(10):75-78.(in Chinese)
[2]李共国,马子骏.杨梅冰温贮藏保鲜研究[J].食品工业科技,2004,(3):130-131.LI Gong-guo,MA Zi-jun.The ice-temperature fresh storage study of bayberry[J].Science and technology of food industry,2004,(3):130-131.(in Chinese)
[3]方忠祥,张慜.杨梅清汁变色与混浊形成的机理与控制[D].无锡:江南大学,2007.
[4]夏其乐,程绍南.杨梅的营养价值及其加工进展[J].中国食物与营养,2005(6):21-22.XIA Qi-le,CHENG Shao-nan.The nutrition value and processing evolvement of bayberry[J].Foodand Nutrition in China,2005(6):21-22.(in Chinese)
[5]汤佩莲,迟文,曾洪辉.杨梅多酚对核辐射损伤小鼠血液系统的保护作用[J].海南医学院学报,2005,11(5):391-392.TANG Pei-lian,CHI Wen,ZENG Hong-Hui.Protective effects of bayberry polyphenol on mouse’s hematologic injury induced by nuclear radiation[J].Journal of H ainan Medical College,2005,11(5):391-392.(in Chinese)
[6]汪茂成,谢培山,王忠东,等.天然有机化合物提取分离与结构鉴定[M].北京:化学工业出版社,2004,5.
[7]张成,贾绍义.微波萃取技术及其应用[J].化学工业与工程,2004,21(6):444-448.ZHANG Cheng,J IA Shao-yi.Application and technology of microwave assisted extraction[J].Chemical industry and engineering,2004,21(6):444-448.(in Chinese)
[8]王葳,张绍志,陈光明.功率超声波在食品工艺中的应用[J].包装与食品机械,2001,19(5):12-16.WANG Wei,ZHANG Shao-zhi,CHEN Guang-ming.The uses of power ultrasound in food processing[J].Packaging and food mechanism,2001,19(5):12-16.(in Chinese)
[9]石碧,狄莹.植物多酚[M].北京:科学出版社,2007.
[10]孙敏,岳田利,袁亚宏.猕猴桃果汁多酚类物质的提取工艺[J].研究农产品加工学刊,2007,3(3):40-43.SUN Min,YUE Tian-li,YUAN Ya-li.Academic periodical of farm products processing[J].Academic Periodical of Farm Products Processing,2007,3(3):40-43.(in Chinese)
[11]陈双,史俊燕,钟洁.小麦麸皮中总黄酮微波辅助提取技术研究[J].粮食与饲料工业,2008(9):26-28.CHENG Shuang,SHIJun-yan,ZHONGJie.A study on extracting flavonoids from wheat bran with microwave-aided extraction[J].Cereal and feed industry,2008(9):26-28.(in Chinese)
[12]Giusti M M,Wrolstad R E.Current Protocols in Food Analytical Chemistry[M].New York:John Wiley&Sons,2001.
[13]石碧,狄莹.植物多酚[M].北京:科学出版社,2007.
[14]李云雁,胡传荣.试验设计与数据处理[M].北京:化学工业出版社,2005.
