铂催化分解过氧化氢的行为研究
2010-01-26李辉波王孝荣刘占元叶国安赵兴红
李辉波,王孝荣,刘占元,叶国安,赵兴红
中国原子能科学研究院 放射化学研究所,北京 102413
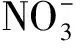
1 实验部分
1.1 主要试剂及设备
60%H2O2溶液,上海哈勃化学科技有限公司;铂网,天津艾达泽明金属材料有限公司;硫代硫酸钠基准试剂,北京化学试剂检测中心;其它化学试剂均为分析纯。
循环冷却反应器,自制;磁力搅拌器,北京长风仪器有限公司;LS-6000LL液体闪烁谱仪,美国Bechman公司;Octete plus α能谱,美国EG&G ORTEC公司。
1.2 实验方法
1.2.1溶液配制
(1) 溶液中不含钚:c(H2O2)=6 mol/L、c(HNO3)=2.5 mol/L的混合溶液200 mL;
(2) 溶液中含钚:c(H2O2)=6 mol/L、c(HNO3)=2.5 mol/L、ρ(Pu)=100 mg/L的混合溶液100 mL。
1.2.2实验方法 取上述配置的溶液100 mL注入带循环冷却系统的玻璃杯中,打开循环水,加入铂网并将搅拌转子置于铂网中心,开始搅拌,此时H2O2开始分解,可以观察到溶液中产生大量气泡,测量时每隔一定时间取样1次分析其H2O2浓度,并记录时间及温度。
1.3 分析方法
(1) H2O2浓度测定
分析原理:在酸性介质中,H2O2与过量的KI(已溶解)定量发应,生成单质I2;然后采用标准硫代硫酸钠溶液滴定,滴定在中性或微碱性条件下进行。根据滴定碘所消耗的硫代硫酸钠溶液体积来定量计算H2O2含量,反应方程式如下:


(1)
测定方法:准确移取待测溶液0.1 mL于250 mL碘量瓶中,加入80 mL去离子水、过量的KI溶液,加盖密封。在暗室中放置30 min后,加入NaHCO3固体,直至无气泡产生并稍微过量,用标准硫代硫酸钠溶液滴定溶液由棕黄色转为淡黄色时,加入淀粉指示剂2 mL,滴定至溶液颜色变为无色。
(2) 不同价态钚浓度的测定
对于H2O2催化分解工艺过程中四价及其它价态钚含量的测定,采用1-苯基-3-甲基-4-苯甲酰基吡唑酮-5(PMBP)-二甲苯萃取分离法,分别取水相、有机相溶液制源进行α能谱测定。
2 结果与讨论
2.1 HNO3浓度对H2O2浓度测定的影响
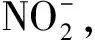

E⊖=0.996 V
E⊖=0.545 V

E⊖=1.776 V
(2)
2.2 NaHCO3加入量对测定的影响
用碘量法测定c(H2O2)是在中性或微碱性条件下进行,因此NaHCO3起着调节溶液pH值的作用,其用量与HNO3浓度有关。实验发现,当加入NaHCO3的量正好使溶液不产生气泡时,滴定终点颜色将提前到达,但不稳定,测定结果的相对误差大,重现性较差;当NaHCO3微过量时,滴定终点颜色变化较敏感;当NaHCO3过量0.5~1 g时,其对测量结果无影响,重现性好。

表1 HNO3浓度对c(H2O2)测定的影响Table 1 Effect of nitric acid on the analysis of hydrogen peroxide
注(Note):m(KI)=4.00 g,t=30 min
2.3 温度对铂催化破坏H2O2的影响

图1 温度对H2O2铂催化分解速度的影响Fig.1 Effect of temperature on velocity of catalyzing decomposition
常温常压下,在没有催化剂存在时,H2O2分解反应进行得非常慢,但是使用催化剂后可显著提高H2O2分解的反应速率。相同时间不同温度下H2O2的分解率(Y)变化曲线示于图1。由图1可知,在温度大于15 ℃时,铂均能催化分解H2O2,同时随着温度升高,H2O2催化分解速度加快。
2.4 H2O2浓度和铂催化表面积对分解速度的影响
铂催化分解H2O2的速度受铂催化面积、c(H2O2)及温度等因素影响,相同温度和铂催化面积下不同c(H2O2)对分解速度的影响示于图2。由图2可知,当铂催化面积一定时,随着c(H2O2)的增加,铂催化分解速度具有增加趋势,但当溶液中c(H2O2)>2 mol/L时,其分解速度趋于平稳。

图2 不同H2O2浓度对其分解速度的影响Fig.2 Effect of hydrogen peroxide on velocity of catalyzing decomposition θ=30 ℃,t=5 min
在相同温度和H2O2浓度下不同铂催化表面积(S)对H2O2分解量(n(H2O2))的影响示于图3。由图3可知,随着铂催化表面积的增加,H2O2的分解速度增加,同时通过控制反应溶液温度,能使H2O2分解速度平稳。

图3 不同铂催化表面积对H2O2分解速度的影响Fig.3 Effect of area of platinum on velocity of catalyzing decompositionS,mm2:*——8 800,▲——4 400,■——2 600,◆——2 200
2.5 加热和铂催化分解H2O2的比较
(1) 分解速度与温度关系
加热和铂催化分解H2O2的比较示于图4。由图4可知,在相同温度下,铂能明显加快H2O2的分解;同时,采用加热破坏H2O2过程中,当加热温度小于45 ℃时,溶液中H2O2几乎不分解,之后随着温度的升高,分解速度逐渐增加,特别当温度大于65 ℃时,分解速度急剧增加;而采用铂催化分解时,温度大于15 ℃时H2O2就可分解。
(2) 破坏过程中钚价态的变化
采用PMBP-二甲苯萃取分离,利用Pu(Ⅵ)和Pu(Ⅳ)在PMBP中分配系数的差异,Pu(Ⅵ)留在水相,而Pu(Ⅳ)被萃取到有机相,分别取水相制源,采用α能谱测定水相钚计数(Caq(Pu)),比较不同情况下生成的Pu(Ⅵ)质量分数(w(Pu(Ⅵ)))的变化,结果列入表2。由表2可知,在加热破坏过程,当温度达60 ℃时,随着H2O2的分解,溶液中开始产生Pu(Ⅵ),同时随着加热温度的升高和H2O2的破坏,产生Pu(Ⅵ)的量随之增加,而铂催化分解法在30~50 ℃的分解过程中均未产生明显的Pu(Ⅵ)。

图4 加热和铂催化分解H2O2的比较Fig.4 Comparison of catalyzing and heating decomposition 1——铂催化分解(Catalyzing decomposition),2——加热分解( Heating decomposition)

表2 加热和铂催化过程中钚价态的变化Table 2 Change of plutonium oxidation state
3 结 论
采用铂催化分解法在常温就能使H2O2分解,分解速度和铂的催化表面积成正比,并随温度增加而增加;在H2O2催化分解过程中,θ≤50 ℃时不会造成钚价态的变化,同时通过控制反应温度,能使H2O2分解速度平稳;采用加热破坏时,只有当θ>45 ℃时,H2O2才开始分解,分解温度大于60 ℃时,开始产生Pu(Ⅵ)。
[1] 姜圣阶,任凤仪.核燃料后处理工艺学[M].北京:原子能出版社,1995:197-200.
[2] Katz J J, Seaborg G T. The Chemistry of Actinide Elements[J]. New York: John Willey & Sons INC,1957: 239-243.
[3] 高宏成,王文清.钚(Ⅳ)-硝酸根络合常数测定[J].原子能科学技术,1981,4:48-51.
[4] 罗文宗,张文青.钚的分析化学[M].北京:原子能出版社,1991:61-66.
[5] 石双群,于德江.重金属离子对过氧化氢催化分解活性的对比研究[J].河北师范大学学报,1993,(1):63-65.
[6] Vanatta L E, Coleman D E. Reproducible Digestion Method for Ion-Chromatographic Analysis of Anions in 30% Hydrogen Peroxide[J]. J Chromatogr A, 2002, 956: 23-33.
