硫代硫酸钠对酪氨酸酶的抑制作用
2014-08-06王西瑶刘晓倩
芶 琳,卢 航,王西瑶,刘晓倩
(1.四川农业大学生命科学与理学院,2.四川农业大学风景园林学院,3.四川农业大学农学院,四川 成都 611130)
酪氨酸酶(EC 1.14.18.1)是一种含铜的金属氧化酶,广泛分布于生物体内,具有多重生物学功能,可催化L-酪氨酸(L-Try)羟化生成L-多巴(L-DOPA),还可催化L-DOPA氧化生成多巴醌,兼有单酚酶和二酚酶的活性,多巴醌再进一步反应则可形成黑色素[1-2].酪氨酸酶是生物体黑色素合成的关键酶,昆虫抗紫外线、果蔬褐变以及人体色素沉着性疾病都与酪氨酸酶的表达和活性密切相关[3-6].抑制酪氨酸酶的活性,有助于控制生物体黑色素的生成.因此,酪氨酸酶抑制剂的筛选受到了国内外学者的广泛关注.酪氨酸酶抑制剂不仅能作为化妆品中的美白成分以及防止果蔬褐变等,还可用于人体色素沉着性疾病药物的研发.关于酪氨酸酶抑制剂的研究已有较多的报道:杜志云等[7]报道了姜黄素类化合物及其衍生物作为酪氨酸酶抑制剂;陆珊等[8]研究了曲酸对酪氨酸酶的抑制;陈清西等[9-12]测定了3,5-二羟基二苯乙烯、甘醇酸、苯甲酸和VB1等对酪氨酸酶的抑制作用;汲逢源等[13]的研究表明,培养基中加入硫代硫酸钠等抗氧化剂能有效地抑制大豆下胚轴在组培过程中褐化发生.我们以酪氨酸酶为靶酶筛选该酶的抑制剂时,则发现硫代硫酸钠对酪氨酸酶有抑制作用,且未见相关报道.本文以硫代硫酸钠作为效应物,研究其对酪氨酸酶的抑制作用,分析其量效关系,并结合酶动力学方法研究硫代硫酸钠对酪氨酸酶的抑制机理,以期为酪氨酸酶抑制剂分子设计和实际应用提供理论依据.
1 材料与方法
1.1 材 料
蘑菇酪氨酸酶(tyrosinase,比活力 1 000 U/mg)、L-DOPA购自Sigma公司;L-Tyr购自Aldrich化学公司;硫代硫酸钠、磷酸盐等试剂均为国产分析纯.UV-1240 型紫外可见分光光度计购自SHIMADZU公司.
1.2 方 法
1.2.1 硫代硫酸钠对酪氨酸酶单酚酶活力的影响
单酚酶活力测定[14],以L-Tyr为底物,在含有不同浓度的硫代硫酸钠溶液中,加入酪氨酸酶(终质量浓度为32 μg/mL),30 ℃下,测定波长为475 nm的吸光值随时间的增长曲线.曲线呈直线关系后即达到酶促反应的稳定态,此时直线的斜率即为酪氨酸酶单酚酶稳定态活力,而直线与横轴的交点则为酶促反应的迟滞时间.
1.2.2 硫代硫酸钠对酪氨酸酶二酚酶活力的影响
酪氨酸酶二酚酶活力测定参考文献[15].酶活力测定体系为1 mL,在50 mmol/L pH 6.8磷酸盐缓冲液中,以2 mmol/LL-DOPA为底物,加入10 μL 0.4 mg/mL酪氨酸酶溶液,立即混匀,30 ℃恒温条件下,测定492 nm波长的吸光值,以每分钟吸光值的变化表示其酶活力.
硫代硫酸钠对酪氨酸酶二酚酶活力的影响:以L-DOPA为底物,加入不同浓度硫代硫酸钠溶液(由50 mmol/L,pH 6.8磷酸盐缓冲液配制的硫代硫酸钠溶液),其他条件同上,L-DOPA终浓度为2 mmol/L,磷酸盐缓冲液终浓度为50 mmol/L,pH 6.8,最后加入10 μL 0.4 mg/mL酪氨酸酶溶液,492 nm波长下测定酶的活力.
1.2.3 硫代硫酸钠对酪氨酸酶二酚酶的抑制动力学测定
在上述酶测活体系中,L-DOPA浓度不变,改变酶浓度,测定不同浓度的硫代硫酸钠对酪氨酸酶活力的影响.测定酶促反应速度与酶浓度的关系,根据其相关性来判断硫代硫酸钠对酪氨酸酶二酚酶活力的抑制是否可逆.
硫代硫酸钠与酪氨酸酶抑制类型测定,则在含有不同浓度硫代硫酸钠的测活体系中,固定酪氨酸酶的浓度,改变底物L-DOPA的浓度,测定不同浓度硫代硫酸钠对酶活力的影响.经Lineweaver-Burk 双倒数作图,确定抑制类型.并以截距对效应物浓度再二次作图,求抑制常数.
2 实验结果
2.1 硫代硫酸钠对酪氨酸酶单酚酶活力的影响
以L-Tyr为底物,测定不同浓度硫代硫酸钠对酪氨酸酶单酚酶活力的影响.结果显示(图1)随着硫代硫酸钠浓度的增大,酪氨酸酶单酚酶稳态的速率下降,且迟滞时间延长.迟滞时间和稳态酶活力分别对硫代硫酸钠浓度作图(图2,3).25 mmol/L 硫代硫酸钠可使单酚酶的迟滞时间从19.3 s 延长到52.6 s.稳态酶活力随着硫代硫酸钠浓度的升高而有所下降.实验结果表明硫代硫酸钠对酪氨酸酶单酚酶具有一定的抑制作用.
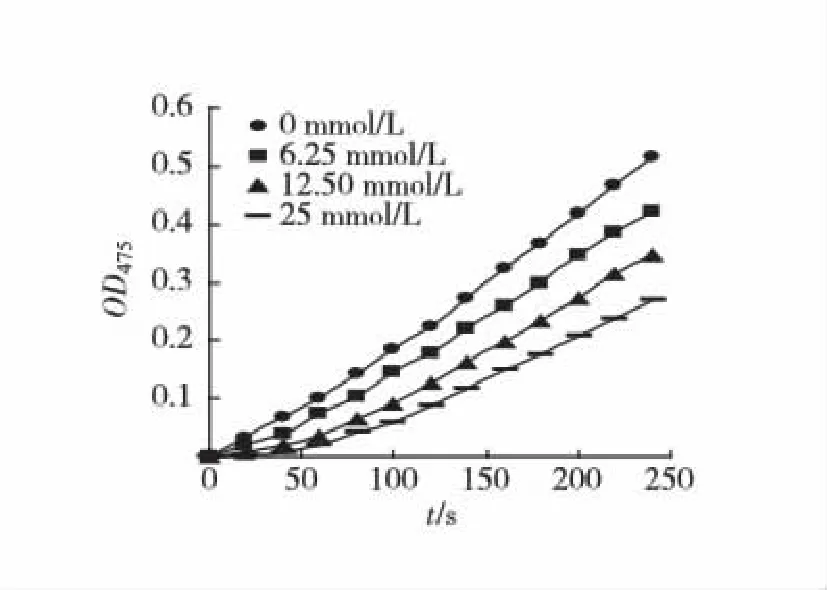
图1 硫代硫酸钠对酪氨酸酶单酚酶活力的影响Fig.1 Effects of sodium thiosulfate on the monphenolase activity of tyrosinase
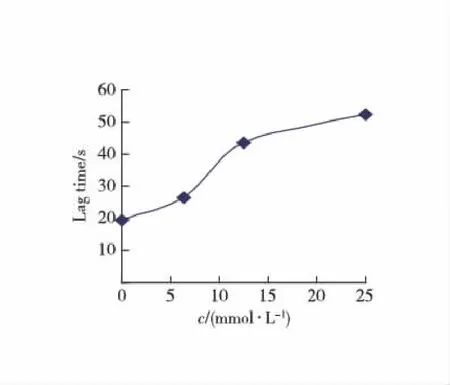
图2 硫代硫酸钠对迟滞时间的影响Fig.2 Effect of sodium thiosulfate on the lag time
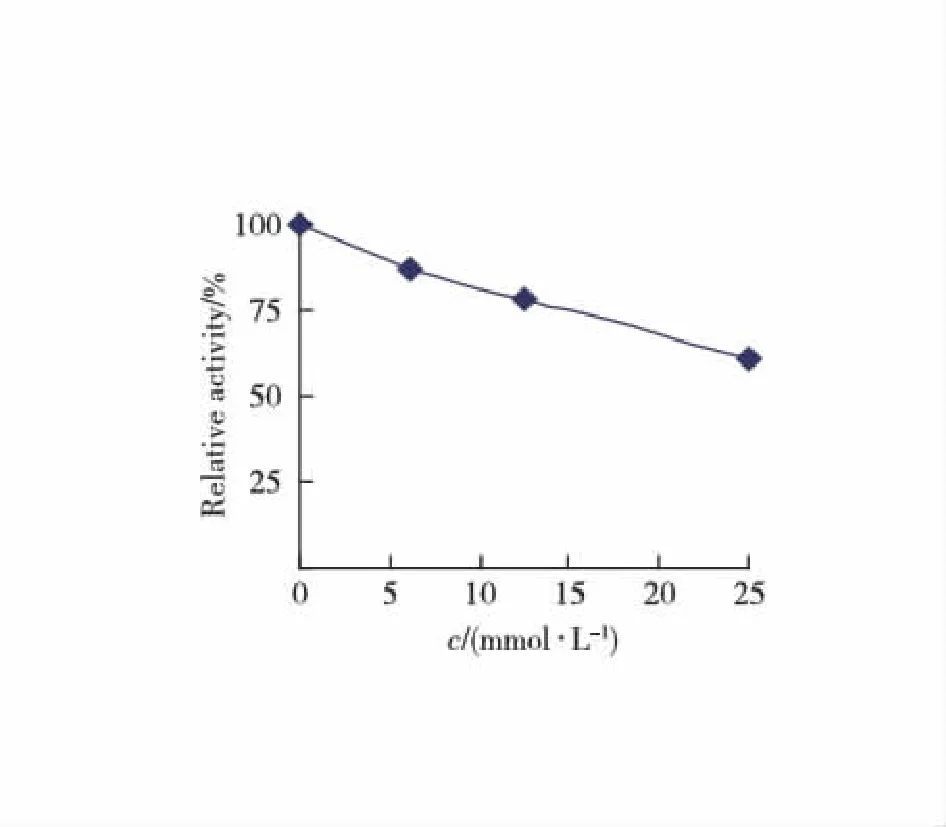
图3 硫代硫酸钠对稳定态速率的影响Fig.3 Effect of sodium thiosulfate on the steady state rate
2.2 硫代硫酸钠对酪氨酸酶二酚酶活力的影响
以L-DOPA为底物,在含有不同浓度的硫代硫酸钠的测活体系中检测酶活力,以不加硫代硫酸钠为对照,获得酶的相对剩余活力.结果显示(图4),硫代硫酸钠对酪氨酸酶有显著的抑制作用,随着硫代硫酸钠浓度的增大,酶活力逐渐下降,硫代硫酸钠浓度在2.5~15 mmol/L之间,酶活力下降较为明显,酶活力降至50%时的抑制剂浓度IC50为8.80 mmol/L.

图4 硫代硫酸钠对酪氨酸酶二酚酶活力的影响Fig.4 Effects of sodium thiosulfate on the diphenolase activity of tyrosinase
2.3 硫代硫酸钠对酪氨酸酶的抑制动力学
在测活体系中,固定底物L-DOPA的浓度,改变酪氨酸酶的浓度,测定不同硫代硫酸钠浓度下酪氨酸酶的活力.结果如图5,酶活力对酶量作图为一组经过原点的直线,随着硫代硫酸钠浓度的增大,直线斜率降低.表明硫代硫酸钠对酪氨酸酶的抑制作用属于可逆性抑制,即酶活力的下降不是通过酶量的减少所致,而是硫代硫酸钠对酪氨酸酶的抑制作用的结果.

图5 不同硫代硫酸钠浓度下酪氨酸酶活力和酶量的关系Fig.5 Effects of concentrations of sodium thiosulfate on the activity of tyrosinase
在含不同浓度硫代硫酸钠的测活体系中,测定酶催化不同浓度的L-DOPA反应的速率,经Lineweaver-Burk 双倒数作图,得到一组横轴截距不变的直线(见图6).由图可见,硫代硫酸钠作为酪氨酸酶的抑制剂,最大反应速度(Vm)随着抑制剂浓度的增大而减小,米氏常数(Km)值则保持不变,增加底物浓度并不能排除抑制剂对酶的抑制效应,其抑制类型为非竞争性.以不同浓度硫代硫酸钠的1/Vm(intercept)对抑制剂浓度作图(图7)为一条直线,从直线的斜率求得抑制常数KI,即KI=5.674 mmol/L.

图6 硫代硫酸钠对酪氨酸酶的抑制类型Fig.6 Inhibition type of sodium thiosulfate on tyrosinase

图7 抑制常数的测定Fig.7 Determination of inhibition constant
3 讨 论
酪氨酸酶作为生物黑色素形成过程中的关键酶,对生物黑色素的生成起到了重要的调控作用.由于果蔬的褐化、昆虫抗紫外线和皮肤沉着性疾病等都与酪氨酸酶的表达以及活性相关.在农业上抑制酪氨酸酶有助于保持果蔬的营养品质和提高感官品质,还可通过酪氨酸酶抑制效应物研制抗虫杀虫药物.而在医药上酪氨酸酶抑制剂则可用于预防和治疗皮肤沉着性疾病.除此之外,酪氨酸酶抑制剂还可作为皮肤美白成分添加到化妆品中.因此筛选和研制有效的酪氨酸酶抑制剂广受国内外学者的关注.关于小分子化合物作为酪氨酸酶抑制剂也已有报道[16],但硫代硫酸钠对酪氨酸酶的抑制作用还未见报道.本文以硫代硫酸钠作为效应物,探讨硫代硫酸钠对酪氨酸酶的抑制机理,经酶的抑制动力学研究表明,硫代硫酸钠对酪氨酸酶单酚酶和二酚酶均有抑制作用,单酚酶表现为迟滞时间延长,与大多数抑制剂对酪氨酸酶单酚酶的作用特征相同[17].对二酚酶则表现出明显的效应物浓度依赖关系,抑制作用为可逆非竞争性抑制,其特征是Km值不变,Vm陏抑制剂浓度增加而减小.抑制剂既能与游离的酶分子结合,还可以和底物-酶复合物结合,抑制剂与酶分子应是在酶活性中心以外的区域结合,最终由于形成底物-酶-抑制剂三元复合物而无法分解为产物,从而抑制了酪氨酸酶的催化活性.由此推测,硫代硫酸钠与酶分子结合后,可能诱导酶分子构象改变,引起酶活性下降.确切的证据有待于进一步研究.此项研究扩充了硫代硫酸钠的应用范围.作为酪氨酸酶抑制剂,本研究可为研发新型的酪氨酸酶抑制剂提供依据.
[1] Sánchez-Ferrer,Rodríguez-López J N,García-Cánovas F,et al.Tyrosinase:a comprehensive review of its mechanism[J].Biochim Biophys Acta,1995,1247:1-11.
[2] Körner A M,Pawelek J M.Mammalian tyrosinase catalyzes three reactions in the biosynthesis of melanin[J].Science,1982,217:1163-1165.
[3] Kim Y J,Uyama H.Tyrosinase inhibitors from natural and synthetic sources:structure,inhibition mechanism and perspective for the future[J].Cellular and Molecular Life Sciences,2005,62(15):1707-1723.
[4] Rescigno A,Sollai F,Pisu B,et al.Tyrosinase inhibition:general and applied aspects[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2002,17(4):207-218.
[5] Guerrero A,Rosell G.Biorational approaches for insect control by enzymatic inhibition[J].Current Medicinal Chemistry,2005,12(4):461-469.
[6] 陈清西,宋康康.酪氨酸酶的研究进展[J].厦门大学学报:自然科学版,2006,45 (5):731-737.
[7] 杜志云,徐学涛,潘文龙,等.姜黄素类化合物及姜黄素衍生物对酪氨酸酶抑制作用的研究[J].日用化学工业,2008,38 (3):172-175.
[8] 陆珊,胡源,刘鑫,等.曲酸对马铃薯酪氨酸酶的抑制作用研究[J].化学研究与应用,2005,17(6):729-732.
[9] Song Kang-Kang,Huang Hao,Han Peng,et al.Inhibitory effects of cis-and trans-isomers of 3,5-dihydroxystilbene on the activity of mushroom tyrosinase[J].Biochemical and Biophysical Research Communications,2006,342:1147-1151.
[10] 郭云集,宋康康,李智聪,等.甘醇酸对蘑菇酪氨酸酶的抑制作用[J].厦门大学学报:自然科学版,2008,47(3):383-386.
[11] 刘晓丹,黄璜,陈清西.苯甲酸对蘑菇酪氨酸酶抑制作用机理的研究[J].厦门大学学报:自然科学版,2003,42 (1):102-106.
[12] 陈桂霞,胡泳华,王伟,等.维生素B1 对蘑菇酪氨酸酶抑制作用机理的研究[J].厦门大学学报:自然科学版,2010,49 (4):558-560.
[13] 汲逢源,王戈亮,许亦农.抗氧化剂对农杆菌介导的大豆下胚轴GUS基因瞬时表达的影响[J].植物生态学报,2006,30 (2):330-334.
[14] Li Z C,Chen L H,Yu X J,et al.Inhibition kinetics of chlorobenzaldehyde thiosemicarbazones on mushroom tyrosinase[J].Journal of Agricultural and Food Chemistry,2010,58:12537-12540
[15] Gou Lin,Lü Zhirong,Park Daeui,et al.The effect of histidine residue modification on tyrosinase activity and conformation:inhibition kinetics and computational prediction[J].Journal Biomolecular Structure and Dynamics,2008,26(3):395-402.
[16] Lin Yifen,Hu Yonghua,Jia Yulong,et al.Inhibitory effects of naphthols on the activity of mushroom tyrosinase[J].International Journal of Biological Macromolecules,2012,51:32-36.
[17] Kubo I,Chen Q X,Nihei K,et al.Tyrosinase inhibition kinetics of anisic acid[J].Zeitschrift Fur Naturforschung C-A Journal of Biosciences,2003,58(9/10):713-718.
