蒙古牛皮肤Qa-1b/NKG2A的表达及Qa-1b纳米抗体的制备和功能鉴定
2025-01-27金聪俐贾琼任泓睿迟志端白瑞郭湘范瑞HerridMuren





摘 要: 本研究旨在通过检测蒙古牛皮肤Qa-1b/NKG2A的表达特征,分析其参与皮肤免疫的功能,及Qa-1b在抗黑素瘤发展中可能发挥的作用。通过实时定量PCR、Western blot、免疫组织化学方法以及免疫共沉淀法对Qa-1b/NKG2A在皮肤中的表达进行相对定量和定位以及互作关系分析;以Qa-1b多肽为抗原,使用噬菌体展示技术,从羊驼黑色素瘤细胞纳米抗体文库中进行淘筛,获得结合性较强的纳米抗体(Qa-1b-VHH)序列;构建pET28a-Qa-1b-VHH原核表达重组质粒,通过IPTG诱导表达和镍柱纯化,获得Qa-1b纳米抗体。经ELISA检测Qa-1b纳米抗体与抗原的特异性后,将Qa-1b纳米抗体应用于Western blot和免疫组织化学方法检测组织中Qa-1b的表达,以及添加到B16黑素瘤细胞培养基中,通过CCK8法、细胞划痕法和Western blot法检测其对B16细胞增殖及迁移的影响以及与增殖和迁移相关蛋白表达情况。结果显示:Qa-1b和NKG2A在蒙古牛皮肤组织的毛囊外根鞘和血管内皮中表达,在犊牛皮肤中的表达量显著高于成年牛(Plt;0.01或Plt;0.001)。且Qa-1b和NKG2A在皮肤中存在互作关系。所获得的Qa-1b纳米抗体特异性较强,可用作Western blot和免疫组织化学中的一抗检测其他组织中Qa-1b的表达;Qa-1b纳米抗体添加到B16细胞培养基中,应用CCK 8法和细胞划痕法检测该Qa-1b纳米抗体对B16细胞增殖和迁移有明显的抑制效果,细胞增殖过程中Ras、MEK1、CyclinD1、CDK4蛋白的表达显著下调(Plt;0.01或Plt;0.001)。本试验揭示了Qa-1b/NKG2A参与皮肤免疫以保证毛囊正常生长,尤其是犊牛;Qa-1b纳米抗体可抑制B16细胞增殖和迁移,为增强皮肤免疫及抗黑素瘤发展的抗体药物提供理论依据。
关键词: Qa-1b;NKG2A;纳米抗体;皮肤免疫;黑素瘤;B16细胞;蒙古牛
中图分类号: S857.5"""" 文献标志码:A"""" 文章编号: 0366-6964(2025)01-0404-13
收稿日期:2024-02-26
基金项目:内蒙古自治区“揭榜挂帅”项目(2022JBGS0023);山西省自然科学基金(202203021222348)
作者简介:金聪俐(1994-),女,河南周口人,硕士生,主要从事羊驼纳米抗体研究与应用研究,E-mail:18339908802@163.com
*通信作者:范瑞文,主要从事羊驼毛色形成机理及羊驼纳米抗体研究与应用研究,E-mail: ruiwenfan@163.com;HERRID Muren,主要从事动物遗传育种与繁殖研究,E-mail: mherrid@gmail.com
The Expression of Qa-1b/NKG2A in the Skins of Mongolia Cattle and Preparation and
Functional Roles of the Qa-1b Nanobody
JIN" Congli JIA" Qiong REN" Hongrui CHI" Zhiduan BAI" Rui GUO" Xiang3, FAN" Ruiwen ""HERRID" Muren
(1.College of Veterinary Medicine, Shanxi Agricultural University, Jinzhong 03080 China;
2.Grassland amp; Cattle Investment Co., Ltd, Hohhot 011500," China;
3.Shanxi Bethune Hospital, Taiyuan 030000, China)
Abstract: To detect the expression of Qa-1b/NKG2A in skins of Mongolia cattle for analyzing the potential roles in skin immunity and inhibition of development of melanoma cells of Qa-1b. The expression of Qa-1b/NKG2A in skins was quantitatively analyzed by quantitative real-time PCR, Western blot and immunohistochemistry, and by co-immunoprecipitation for interaction between Qa-1b and NKG2A. The sequence of Qa-1b nanoloody (Qa-1b-VHH) binding with Qa-1b was obtained by phage display technique from alpaca melanoma cell nanobady library using Qa-1b polypeptide as antigen, followed by the construction of pET28a-Qa-1b-VHH prokaryotic expression recombinant plasmid and expression through IPTG inducing and purification through nickel column. After the binding of Qa-1b nanobody to antigen was detected by ELISA, the Qa-1b nanobody was used as the primary antibody in immunohistochemistry and Western blot methods to detect Qa-1b expression in tissues. Qa-1b nanobody was added into B16 cell culture medium, and its effects on the proliferation and migration of B16 cells and the expression of proteins related to proliferation and migration were detected by CCK8, cell scratch and Western blot methods, respectively. The results showed that Qa-1b and NKG2A were expressed in the out root sheath of hair follicles and vascular endothelium in Mongolian cattle skins with significantly higher expression in skins of young cattle than that in skins of the adult cattle (Plt;0.01 or Plt;0.001). Moreover, there existed the interaction between Qa-1b and NKG2A. The Qa-1b nanobody with strong specificity was obtained, which could be used as a primary antibody for Western blot and immunohistochemistry to detect Qa-1b expression in other tissues. The supplement of Qa-1b nanobody in B16 culture medium resulted in the obvious inhibition of cell proliferation and migration, significant down-regulation of the expression of proteins such as Ras, MEK CyclinD and CDK4 during cell proliferation(Plt;0.01 or Plt;0.001). The results suggested that Qa-1b might play a role in the skin immunity to ensure the normal growth of hair follicles, especially in calves,and the Qa-1b nanobody could inhibit the proliferation and migration of B16 cells, which provided a theoretical basis for the strengthened skin immunity and anti-melanoma antibody drugs.
Key words: Qa-1b; NKG2A; nanobody; skin immunity; melanoma; B16 cells; Mongolian cattle
*Corresponding authors: FAN Ruiwen, E-mail: ruiwenfan@163.com; HERRID Muren, E-mail:mherrid@gmail.com
人类白细胞抗原-E(HLA-E)基因是一类非典型的MHC-1b类分子,Qa-1b是HLA-E在小鼠中的同源蛋白,编码基因位于17号染色体,相对分子质量约为48 ku[1]。Qa-1b分子仅在活化的造血细胞、树突状细胞、巨噬细胞、B细胞和抗原活化的T细胞表面表达[2]。Qa-1分子主要与Qdm肽(经典MHCI类抗原信号肽)结合,同时还可与一些感染或炎症相关的蛋白分子肽结合,Imani和Soloski[3]证实牛分枝杆菌的65 ku热休克蛋白(Hsp 65)的胰蛋白酶消化物,能够增强转染细胞表面Qa-1b的稳定表达,表明Qa-1b分子可能与热休克蛋白衍生出来的肽结合。NKG2A是自然杀伤细胞受体2(NKG2)家族中的一员,相对分子质量大约为43 ku,亦被称作NK细胞凝集素样受体C1(killer cell lectin-like receptor C KLRC1)[4],与CD94结合形成复合体,在多种免疫细胞如自然杀伤细胞、癌变组织侵袭的CD8阳性T细胞、辅助性T细胞2型以及自然杀伤T细胞的表面,均可观察到NKG2A/CD94的存在[5]。Qa-1b分子可以与NKG2A/CD94或NKG2C/CD94结合成为复合体,抑制NK细胞活化,调节免疫系统,在抗肿瘤免疫中具有重要的调控作用,是重要的“先天免疫检查点”或“肿瘤微环境检查点”[6]。
哺乳动物皮肤多发的黑色素瘤源于神经脊黑素细胞,是一种具有侵袭性和致死性的皮肤癌,目前缺乏特效药且预后差。纳米抗体是一种仅由一个重链可变区组成的单域抗体,其直径约2.5 nm,高约4 nm,相对分子质量仅有15 ku[7]。纳米抗体具有抗原结合能力,与常规抗体的Y型结构不同,其靠较长的互补决定区形成的凸形结构作为抗原结合位点[8-9],具有可穿透血脑屏障,强稳定性、强抗原结合能力和强特异性等优点,可应用于肿瘤等疾病的诊断和治疗[10-11]。本课题组前期已对NKG2A在小鼠黑素瘤细胞中的功能进行了研究,并制备了具有抑制黑素瘤生长和发展功能的NKG2A纳米抗体[12]。
哺乳动物皮肤能防止体液流失、稳定体温和传递感觉输入[13-14],其免疫微环境在维持组织稳态、防御和修复过程中起主要作用。蒙古牛原产于蒙古高原地区,是内蒙古自治区境内主要的地方品种,因长期的自然选择和人工选择而形成了抗寒、抗旱、抗病和耐粗饲等特点,适应性极强[15],是我国最为古老的牛品种,其品质优、商品性好[16]。其中,皮肤免疫在其抗寒和抗病能力中起重要作用[17]。关于Qa-1b/NKG2A在皮肤免疫中的作用鲜见报道。
本试验基于Qa-1b与NKG2A/CD94复合物结合后,有调节免疫系统的功能,因此通过二者基因表达、互作分析以揭示Qa-1b和NKG2A在蒙古牛皮肤免疫过程中可能发挥的作用。抑制Qa-1b的表达将发挥抗肿瘤功能,结合纳米抗体的优势,筛选和制备Qa-1b纳米抗体,为其应用于皮肤免疫以及对肿瘤生长的抑制等方面提供新思路。
1 材料与方法
1.1 材料
羊驼源黑色素瘤单域抗体噬菌体文库、大肠杆菌TG1、B16细胞、辅助噬菌体M13K07、NKG2A纳米抗体、pET28a载体均由本实验室保存提供。鼠源HLA-E抗体购自武汉三鹰生物技术有限公司;兔源NKG2A抗体、Qa-1b多肽购于北京博奥森生物技术有限公司;质粒小提中量试剂盒购自天根生化科技(北京)有限公司;DNA回收试剂盒、HRP偶联抗His标签抗体、2×Es Taq Maste Mix均购自康为世纪生物科技股份有限公司;SDS-PAGE凝胶试剂盒、TMB单组份显色液、ELISA终止液均购自北京索莱宝科技有限公司;蛋白质标记物(marker)购自赛默飞世尔科技;反转录试剂盒、荧光定量PCR试剂盒购自南京诺唯赞生物科技股份有限公司;镍柱购自Cytiva;蒙古牛皮肤取自内蒙古自治区阿拉善盟阿左旗;犬黑色素瘤组织由山西农业大学病理实验室提供。
1.2 Qa-1b/NKG2A在蒙古牛皮肤中的表达
1.2.1 皮肤总蛋白及RNA的提取
取约1 cm3皮肤组织研磨后平均分为两份,一份加入1 mL蛋白裂解液(PMSF∶RIPA=1∶100),冰上静置30 min,离心后取上清,备用;另一份加入1 mL Trizol,加入200 μL氯仿,混匀后置于冰上静置3 min,离心取水相后加入500 μL异丙醇,冰上静置10 min,离心弃上清,加入500 μL 75%的冰乙醇,轻弹管底以清洗沉淀,离心弃上清,置于滤纸上干燥,加DEPC水,溶解沉淀,测定RNA浓度和纯度。
1.2.2 Western blot" 将皮肤总蛋白上清与上样缓冲液1∶4混合均匀,沸水加热变性10 min,先80 V恒压,待蛋白分离至5%浓缩胶外后,120 V恒压,蛋白经10%分离胶彻底分离后,200 mA恒流将蛋白转至硝酸纤维素膜(NC膜)上,用5%MPBS室温封闭1 h,使用HLA-E抗体及实验室现存的NKG2A纳米抗体作为一抗,4 ℃过夜孵育,次日室温复温30 min,用goat anti-mouse IgG/HRP抗His-Tag抗体(1∶25 000)作为二抗,37 ℃孵育1 h,cECL法显色、曝光。
1.2.3 荧光定量PCR(qPCR)
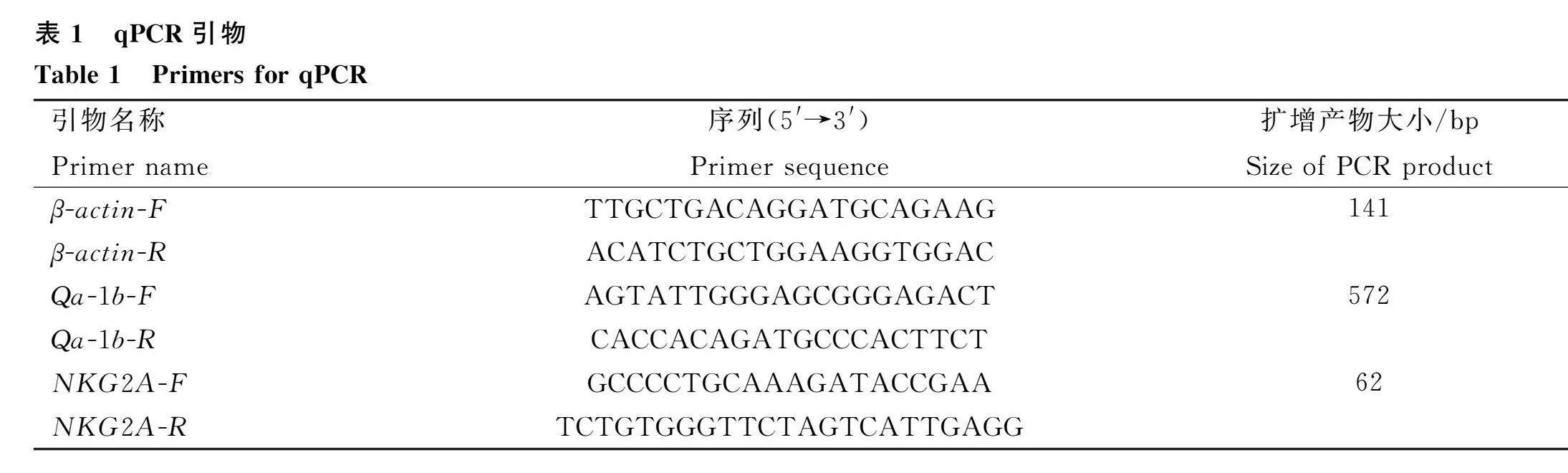
将RNA反转录为cDNA后,建立10 μL的反应体系:SYBR Green Master Mix 5 μL,上下游引物(表1)各0.2 μL,cDNA模板1 μL,ddH 2O补齐至10 μL;该反应体系用于荧光定量PCR反应,其条件为预变性95 ℃ 2 min;变性95 ℃ 5 s,退火59.5 ℃ 15 s,延伸72 ℃ 30 s,40个循环。以β-Actin为内参基因。
1.2.4 免疫共沉淀检测Qa-1b/NKG2A在皮肤中的互作
取5只蒙古牛的皮肤总蛋白,每只100 ng,混合后,用蛋白裂解液稀释到120 μL,分别加入10 μL的商业化兔来源NKG2A抗体、鼠来源HLA-E抗体和同源IgG,4 ℃过夜;次日在磁珠内加入蛋白裂解液,离心弃上清,取磁珠20 μL,加入蛋白和一抗的复合物中,4 ℃孵育3 h,离心收集磁珠和上清,用PBS洗涤磁珠,最后一次用蛋白裂解液洗涤,在磁珠和上清中加入5×SDS-PAGE Loading Buffer变性,进行Western blot检测。
1.3 Qa-1b-VHH的筛选
1.3.1 噬菌体展示技术筛选Qa-1b特异性重组噬菌体
用Qa-1b多肽包被免疫管,浓度为20 μg·mL- 体积为2 mL,4 ℃过夜;按实验室建立的方法进行淘筛,第二、三、四轮淘筛的包被蛋白浓度分别改为10、5、5 μg·L-1 [18]。
1.3.2 单克隆抗体上清的制备
从第四轮淘筛的菌板上,挑取96个单克隆菌落置于有2 YTAG培养基的96深孔板中,30 ℃振荡培养8 h,取20 μL转接到180 μL 2 YTAG,37 ℃振荡培养至对数生长期,加入M13KO7辅助噬菌体感染后,30 ℃震荡培养过夜。次日,离心深孔板20 min,取250 μL上清与250 μL 3%BSA溶液孵育1 h,用于间接ELISA检测。
1.3.3 间接ELISA筛选阳性菌株
将Qa-1b多肽以2 μg·mL-1、50 μL·孔- 包被于96孔酶标板,4 ℃过夜。次日,弃液体,加3%MPBS溶液,37 ℃封闭1 h,PBST洗板10次,加入BSA孵育过的上清100 μL·孔- 对照组加入PBS 100 μL,37 ℃孵育1 h,洗板,加入100 μL HRP-M13抗体(稀释度为1∶20 000),37 ℃孵育1 h,洗板,加入显色液,避光反应5 min,加入终止液,在酶标仪中测OD 450 nm处的吸收值,将阳性菌株送到生工生物工程有限公司测序,并对序列进行比对分析,获得阳性菌株Qa-1b-VHH。
1.4 Qa-1b纳米抗体的表达与纯化
1.4.1 pET28a-Qa-1b-VHH原核表达载体的构建
将测序正确的Qa-1b-VHH序列,用primer5软件设计引物,在引物的两端各设计保护性碱基及酶切位点BamHⅠ和EcoRⅠ,Qa-1bF:ATAGGATCCCTCGTGGAGTCGGGGGGAG;Qa-1bR:TAAGAATTCTGGAGCTGGGGTCTTCGC。将阳性菌株接入LB+Amp液体培养基中,振荡培养过夜,次日提质粒进行PCR扩增,PCR产物进行核酸电泳鉴定,回收400~500 bp DNA片段,用T4连接酶将目的片段与BamHⅠ和EcoRⅠ双酶切后的pET28a载体(His标签)连接,转化到大肠杆菌BL21(DE3)感受态细胞中,测序后与第一次的测序结果进行比对,序列比对正确的菌株,进行抗体的诱导表达。
1.4.2 Qa-1b纳米抗体诱导表达及纯化
取转化的BL21菌液接到 LB-Amp液体培养基中,37 ℃、200 r·min-1过夜培养,次日按5 mL·管-1分装,在每管中加入浓度梯度为0、0.2、0.4、0.5、0.6、0.8、1.0 mmol·L-1的IPTG,16 ℃,110 r·min-1振荡培养20 h,离心弃上清,用700 μL PBS重悬沉淀,进行超声破碎,60 w,超声2 s,间歇5 s,共2 min,离心取上清进行Western blot检测,对比最佳诱导条件,并进行大量诱导表达。取诱导表达的上清进行镍柱纯化,使用不同浓度的咪唑梯度进行洗脱,对各个梯度洗脱的产物再次进行Western blot验证,选取最佳咪唑洗脱浓度。
1.5 Qa-1b纳米抗体的功能鉴定
1.5.1 Qa-1b纳米抗体结合力验证
将Qa-1b多肽包被于96孔酶标板,浓度为2 μg·mL- 4 ℃过夜。次日,3%MPBS封闭1 h,PBST洗板10次,将纯化获得的Qa-1b纳米抗体稀释成不同梯度,作为一抗,37 ℃孵育1 h,洗板,加入HRP偶联抗His标签抗体(1∶20 000),37 ℃孵育1 h,洗板,加入显色液,避光反应5 min,加入终止液,在酶标仪中测OD 450 nm处的吸收值。
1.5.2 Qa-1b纳米抗体在检测组织中Qa-1b蛋白的应用
分别应用免疫组织化学和Western blot检测犬黑色素瘤和皮肤组织中Qa-1b的表达。取黑色素瘤组织制作石蜡切片,用柠檬酸钠抗原修复液高温修复10 min,PBS洗,在组织上滴加15%的H 2O "65 ℃ 15 min以脱黑色素颗粒;加入3%BSA,37 ℃封闭1 h,PBS洗,加入Qa-1b纳米抗体,于4 ℃过夜孵育,室温复温30 min,PBS洗,加HRP偶联抗His标签抗体(1∶100)37 ℃孵育1 h,DAB显色。Western blot参照“1.2.2”,Qa-1b纳米抗体作为一抗,HRP偶联抗His标签抗体作为二抗。
1.5.3 Qa-1b纳米抗体对B16细胞增殖、迁移的抑制作用
将B16细胞培养至对数生长期后,消化离心重新接种于96孔板内(2 000·孔-1),待细胞贴壁后,加入不同浓度(0、80、120 μg·mL-1)Qa-1b纳米抗体,并分别在0、6、12、24、48 h时添加CCK8,10 μL·孔- 共同孵育2 h后,在OD 450 "nm处测定吸光值;B16细胞接种于12孔板内,待细胞长至对数生长期后,弃去原培养基,用枪头在孔内划线,PBS洗2次,用无血清培养基稀释Qa-1b纳米抗体(基础浓度120 μg·mL-1),并设置PBS对照组,在0、12、24、48 h观察细胞迁移情况。
1.5.4 Qa-1b纳米抗体对细胞增殖相关蛋白的影响
使用CCK-8法检测到的抑制细胞增殖的条件,提取细胞总蛋白及RNA,应用Western blot和qPCR技术,方法参照(“1.2.1”和“1.2.2”)检测Ras、MEK1、CyclinD1、CDK4的蛋白及mRNA表达量(以β-Actin为内参基因)。
2 结 果
2.1 Qa-1b/NKG2A在蒙古牛皮肤中的表达
2.1.1 qPCR检测Qa-1b/NKG2A mRNA在皮肤中表达的相对定量
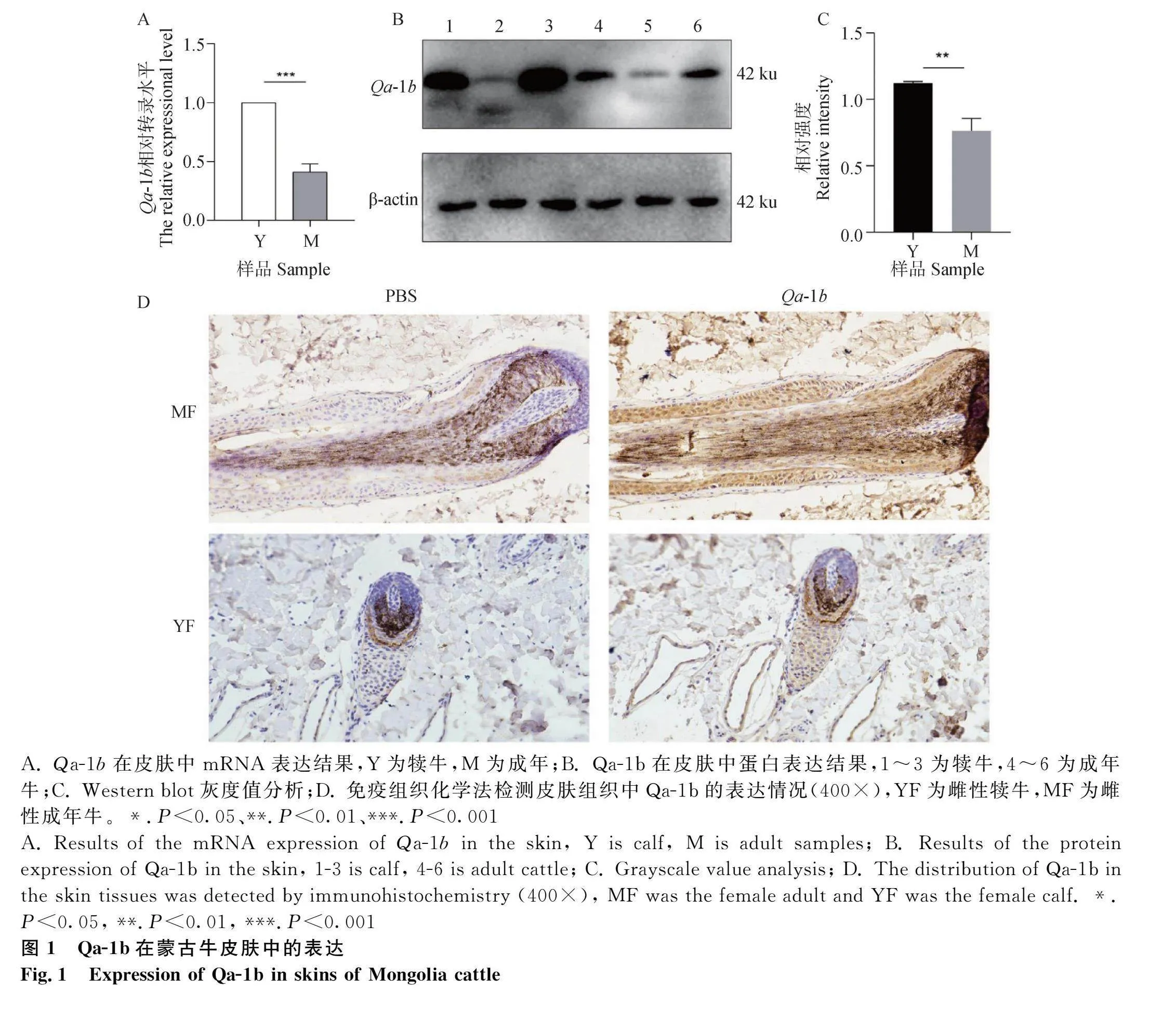
通过实时定量PCR法对不同年龄蒙古牛皮肤中的Qa-1b/NKG2A基因表达相对量进行检测,结果发现Qa-1b/NKG2A mRNA在皮肤中表达,且在犊牛皮肤中的表达量显著高于成年牛(Plt;0.01或Plt;0.001)(图1A、图2A)。
2.1.2 Western blot检测Qa-1b/NKG2A蛋白质在皮肤中表达的相对定量
为了验证Qa-1b及NKG2A蛋白质是否在皮肤中表达,用Western blot方法检测皮肤总蛋白中Qa-1b/NKG2A的相对表达量,结果显示,皮肤蛋白中能检测到Qa-1b/NKG2A的表达,且在犊牛皮肤中的表达量显著高于成年牛(Plt;0.01或Plt;0.001)(图1B、图2B)。
2.1.3 免疫组织化学法检测Qa-1b/NKG2A在皮肤中的定位
免疫组织化学法结果显示,与对照组相比,在皮肤的毛囊外根鞘中有强的Qa-1b/NKG2A阳性信号,此外,在皮肤血管内皮细胞中也可见其阳性信号,结果说明Qa-1b/NKG2A在皮肤中表达。通过对Qa-1b/NKG2A在皮肤中的表达情况,结果提示Qa-1b/NKG2A可能参与皮肤免疫过程,以维持皮肤正常的生理功能(图1D、图2D)。
2.1.4 Qa-1b/NKG2A在皮肤中的互作
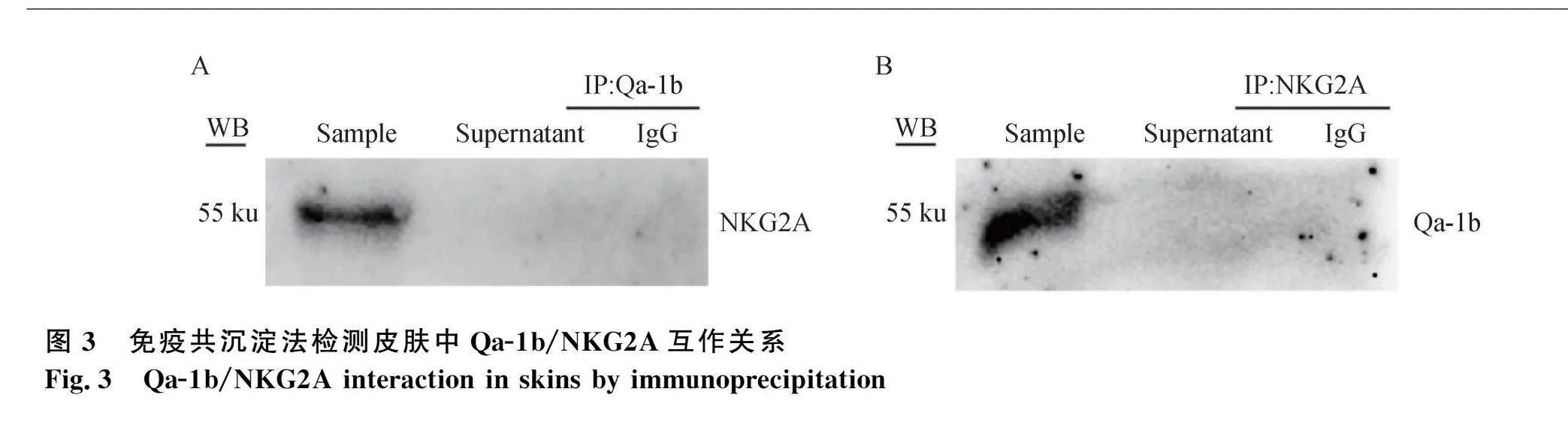
经免疫共沉淀法检测皮肤中是否存在Qa-1b/NKG2A互作关系,结果显示,与同源IgG抗体相比,用预先固化在琼脂糖珠上的Qa-1b抗体免疫沉淀Qa-1b蛋白后,Western blot法可检测到与Qa-1b结合的NKG2A蛋白(图3A);相反,用预先固化在琼脂糖珠上的NKG2A抗体免疫沉淀NKG2A蛋白后,Western blot法可检测到与NKG2A结合的Qa-1b蛋白(图3B)。
2.2 Qa-1b纳米抗体的制备
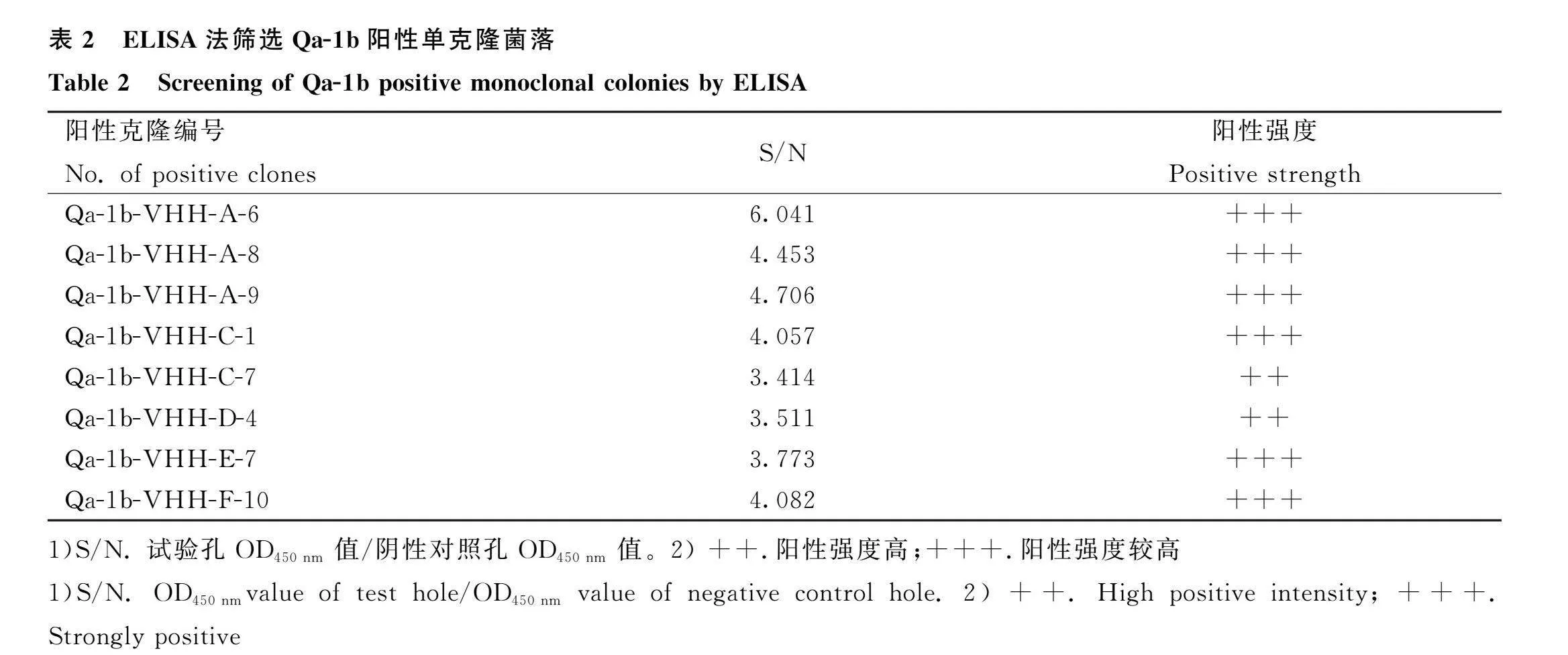
使用噬菌体展示技术,在已构建好的羊驼B16噬菌体文库菌中,用Qa-1b多肽进行4轮淘筛后,应用间接ELISA筛选阳性菌落(表2),经测序,选择阳性最强的菌落(Qa-1b-VHH-A-6)进行下一步试验。
将比对正确的Qa-1b纳米抗体序列翻译成氨基酸,与纳米抗体的结构序列分析,Qa-1b-VHH-A-6序列中有142个氨基酸,CDR3区有16个氨基酸"" (图4)。
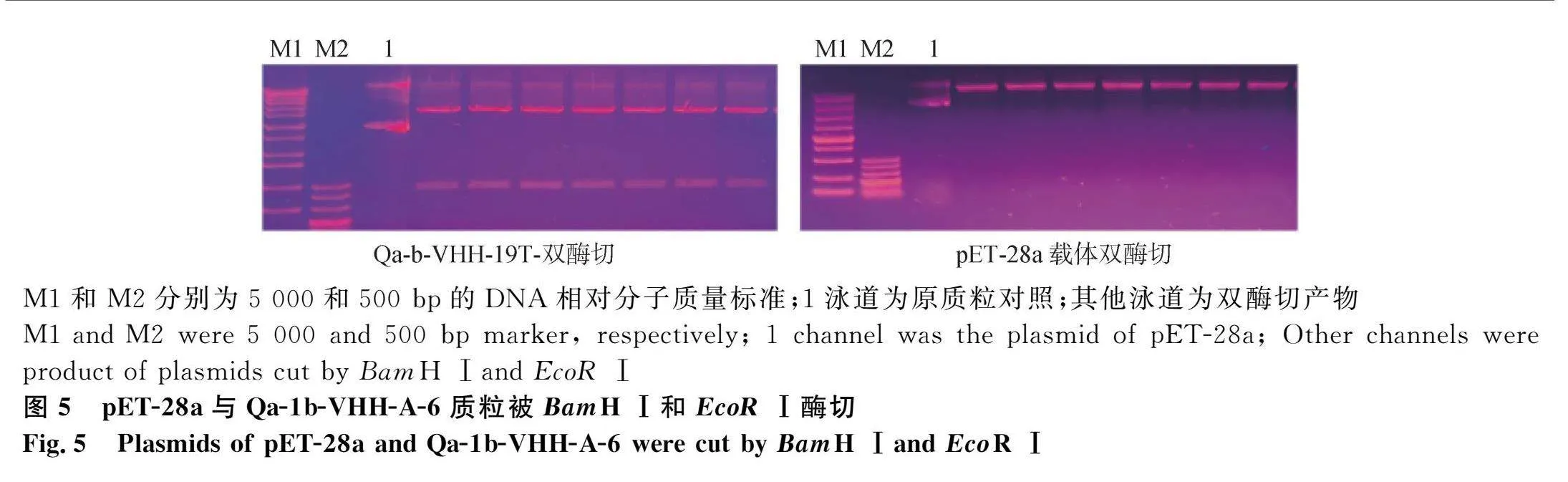
将pET28a与Qa-1b-VHH-A-6双酶切后(图5),用T4连接酶16 ℃过夜连接,转化到BL21感受态细胞中,测序正确后,即为构建的pET28a-Qa-1b-VHH重组质粒(图6)。在菌液中加入不同浓度的IPTG诱导表达,超声破碎后离心取上清,用Western blot检测,在诱导表达条件16 ℃、110 r·min-1振荡培养20 h,加入IPTG浓度为0.6 mmol·L-1时,上清中的表达量最高(图7)。
用0.6 mmol·L-1浓度IPTG将重组质粒进行大量诱导表达,用不同浓度的咪唑洗脱,使用Western blot检测,在洗脱咪唑浓度为30%时,可洗脱到大小约15 ku且条带较为单一的纳米抗体(图8)。
2.3 Qa-1b纳米抗体的功能
2.3.1 Qa-1b纳米抗体结合力
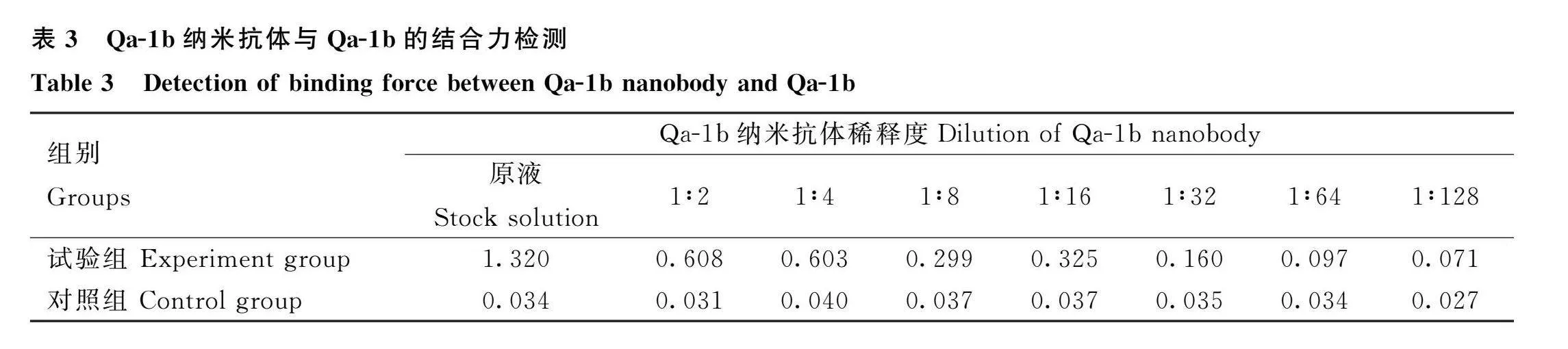
应用间接ELISA方法检测Qa-1b纳米抗体与Qa-1b的结合力,在抗体稀释度为1∶32时抗体仍有结合作用(表3)。
2.3.2 Qa-1b纳米抗体用于检测Qa-1b在黑素瘤和皮肤中的表达
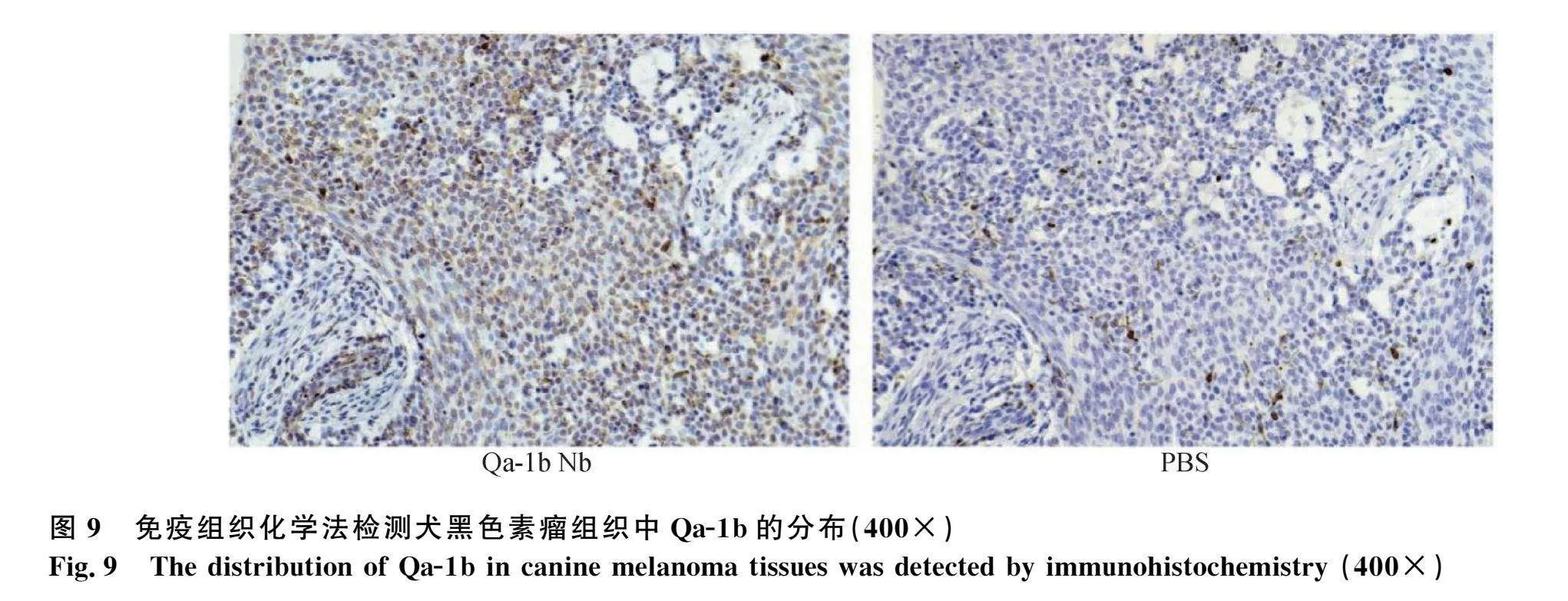
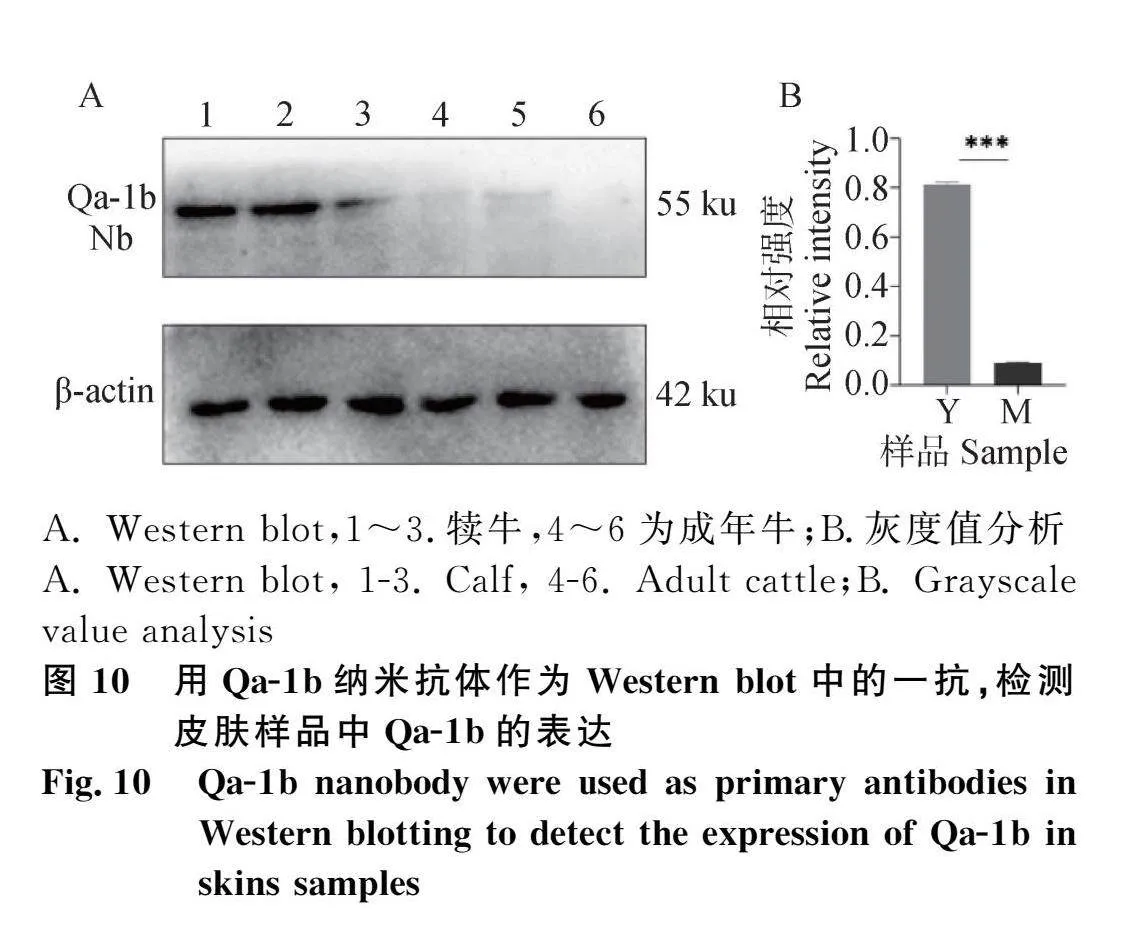
用Qa-1b纳米抗体作为免疫组织化学法一抗,在犬黑色素瘤组织中检测Qa-1b表达分布(图9)。用Qa-1b纳米抗体作为Western blot中的一抗,检测皮肤蛋白中Qa-1b的表达,在犊牛皮肤组织中的检测较为灵敏(图10)。
2.3.3 Qa-1b纳米抗体对B16细胞增殖和迁移的影响
将纯化后的Qa-1b纳米抗体使用脱盐柱脱盐后,应用CCK8试验,检测Qa-1b纳米抗体对B16细胞增殖的抑制作用,结果显示,在加入Qa-1b抗体浓度为120 μg·mL-1时有明显的抑制作用。应用细胞划痕试验,将抗体浓度用去血清培养基稀释至120 μg·mL- 每隔12 h,观察细胞的迁移状态,在培养24 h后,呈现明显的抑制细胞迁移作用(图11A、11B)。
Qa-1b纳米抗体作用于B16后,通过qPCR技术发现MEK1、CDK4、Ras、CyclinD1 mRNA表达量显著下调(P<0.001)(图11C);经Western blot检测,结果发现与细胞增殖相关的蛋白MEK1、CDK4、Ras、CyclinD1表达量显著降低(P<0.01或P<0.001)(图11D、11E)。
3 讨 论
哺乳动物皮肤的免疫微环境在维持组织稳态、防御和修复过程中起重要的作用[19]。在毛囊形态发生完成时,郎格汉斯细胞等免疫反应性淋巴细胞进入毛囊,分布到外根鞘中[20]。本实验我们也发现Qa-1b和NKG2A在毛囊外根鞘中表达,二者存在互作关系,结果提示Qa-1b/NKG2A参与毛囊免疫系统,保证毛囊正常生长。此外,二者在幼龄皮肤中的表达量高于成年皮肤中的表达,一方面与毛囊生长周期有关,另一方面可能与蒙古牛的生长环境相关,毛囊对皮肤具有一定的保护作用。此外,Qa-1b在巨噬细胞和淋巴细胞中均有表达,且与感染或炎症相关的蛋白分子肽结合,能应用到皮肤感染或者炎症免疫反应中,NKG2A受体可通过与HLA-E分子结合,在免疫监视过程中帮助免疫系统识别并清除感染或突变的细胞,维持机体免疫稳态[21]。因此,Qa-1b/NKG2A在皮肤中的作用不仅维持正常的皮肤功能,而且在皮肤病发生过程中通过参与皮肤免疫清除病原体。
在肉牛养殖过程中,皮肤病是最常见的一种疾病,影响牛的生长性能和牛的皮张质量,从而引起经济损失[22]。黑色素瘤是一种哺乳动物常见的皮肤恶性肿瘤,发病率、恶性程度高,易发生转移[23]。黑色素瘤在犬类动物中尤其是纯种犬的发病率较高,常见于口腔、皮肤、眼部和脚趾部[24],除此之外大多数家养动物犬、猫、马以及野生动物和海洋动物也会发生。虽然没有蒙古牛黑素瘤发生的报道,但在乳牛[25]、水牛[26]和黄牛[27]中均有过黑素瘤发生的报道。为了研究Qa-1b在黑素瘤发展过程中的抑制作用,本试验制备Qa-1b纳米抗体后,通过干扰其对黑色素瘤细胞的生长,同时细胞中的Ras、MEK1、CyclinD1、CDK4基因表达量均被下调。
RAS GTP酶可以激活生长因子受体,联系下游信号转导途径,且三种RAS亚型(HRAS、KRAS和NRAS)共同代表了人类恶性肿瘤中最常见的突变癌基因[28-29]。在15%~30%的黑色素瘤样本中鉴定出NRAS突变,并被认为是这些患者最重要的致癌因素[30]。Raf-1可以通过磷酸化激活MEK-1激酶,而MEK-1可以激活ERK即细胞外信号调节激酶,其可以级联控制不同细胞类型的增殖和分化[31-32]。突变的c-Kit可以刺激Ras-Raf-Mek-Erk通路和黑素细胞增殖[33]。本项目组前期的试验结果表明[12],在一种人黑色素瘤A375细胞中敲减HLA-E基因,A375细胞的增殖和迁移均受到抑制,且信号通路上的基因HLA-E、Ras、Raf、CyclinD1、CDK4的蛋白含量和相对mRNA表达量低,同时也证实Qa-1b在小鼠黑色素瘤B16细胞中通过Ras-Raf-MAPK信号通路影响肿瘤生长。本试验结果支持这一观点。
本试验获得的Qa-1b纳米抗体具有一定的结合性,即Qa-1b纳米抗体可以检测到犬黑色素瘤组织和皮肤组织中Qa-1b蛋白的分布,可能是因为CDR3区具有16个氨基酸,与正常人和小鼠的重链可变区CDR3区约含9~12个氨基酸[34]相比,较长的CDR3区弥补了常规抗体有6个重链可变区而纳米抗体仅有3个CDR区所带来的结合能力不足的问题,且较长的CDR3区可形成一个突起的环区,使其可结合一些常规抗体无法结合的位点[35]。因此,该纳米抗体不仅可以应用于与免疫相关的方法进行抗原检测,如ELISA、免疫荧光、免疫组化等技术,而且可用于抑制黑素瘤生长和发展的工具。
4 结 论
本研究验证了Qa-1b/NKG2A在蒙古牛皮肤中表达,参与皮肤免疫。所获的Qa-1b纳米抗体结合性较强,在细胞水平上可靶向抑制Qa-1b通过Ras-Raf-MAPK路径发挥抗肿瘤生长和发展的功能,为增强皮肤免疫和抗黑素瘤发展的抗体药物提供理论依据。
参考文献(References):
[1] 张 霞, 聂 红. Qa-1分子在免疫调节中的研究进展[J]. 现代免疫学, 2010, 30(2):159-163.
ZHANG X, NIE H. Progress on Qa-1 molecules in immune regulation[J]. Current Immunology, 2010, 30(2):159-163. (in Chinese)
[2] 曹朔文, 刘 丹, 施 明. 基于HLA-E功能特点的肿瘤免疫治疗新策略[J]. 中国肿瘤生物治疗杂志, 2022, 29(5):383-390.
CAO S W, LIU D, SHI M. Novel strategies of tumor immunotherapy based on the functional features of HLA-E[J]. Chinese Journal of Cancer Biotherapy, 2022, 29(5):383-390. (in Chinese)
[3] IMANI F, SOLOSKI M J. Heat shock proteins can regulate expression of the Tla region-encoded class Ib molecule Qa-1[J]. Proc Natl Acad Sci U S A, 199 88(23):10475-10479.
[4] VIVIER E, ROMAGN F. Good news, bad news for missing-self recognition by NK cells:autoimmune control but viral evasion[J]. Immunity, 2007, 26(5):549-551.
[5] VIVIER E, RAULET D H, MORETTA A, et al. Innate or adaptive immunity? The example of natural killer cells[J]. Science, 201 331(6013):44-49.
[6] FEREZ M, KNUDSON C J, LEV A, et al. Viral infection modulates Qa-1b in infected and bystander cells to properly direct NK cell killing[J]. J Exp Med, 202 218(5):e20201782.
[7] RAHBARIZADEH F, AHMADVAND D, SHARIFZADEH Z. Nanobody; an old concept and new vehicle for immunotargeting[J]. Immunol Invest, 201 40(3):299-338.
[8] MUYLDERMANS S, ATARHOUCH T, SALDANHA J, et al. Sequence and structure of V H domain from naturally occurring camel heavy chain immunoglobulins lacking light chains[J]. Protein engineering, 1994, 7(9):1129-1135.
[9] VU K B, GHAHROUDI M A, WYNS L, et al. Comparison of llama VH sequences from conventional and heavy chain antibodies[J]. Mol Immunol, 1997, 34(16-17):1121-1131.
[10] OLIVEIRA S, VAN DONGEN G A M S, STIGTER-VAN WALSUM M, et al. Rapid visualization of human tumor xenografts through optical imaging with a near-infrared fluorescent anti-epidermal growth factor receptor nanobody[J]. Mol Imaging, 2012, 11(1):33-46.
[11] ABULROB A, SPRONG H, VAN BERGEN EN HENEGOUWEN P, et al. The blood-brain barrier transmigrating single domain antibody:mechanisms of transport and antigenic epitopes in human brain endothelial cells[J]. J Neurochem, 2005, 95(4):1201-1214.
[12] 郭 湘. Qa-1b对恶性黑色素瘤生长发展作用的机制及其受体NKG2A纳米抗体的制备与应用[D]. 晋中:山西农业大学, 2022.
GUO X. The mechanism of Qa-1b in malignant melanomaand preparation and application of nanobody of its receptor NKG2A[D]. Jinzhong:Shanxi Agricultural University, 2022. (in Chinese)
[13] HSU Y C, LI L S, FUCHS E. Emerging interactions between skin stem cells and their niches[J]. Nat Med, 2014, 20(8):847-856.
[14] OVAERE P, LIPPENS S, VANDENABEELE P, et al. The emerging roles of serine protease cascades in the epidermis[J]. Trends Biochem Sci, 2009, 34(9):453-463.
[15] 王 峰, 田春英, 荣威恒. 蒙古牛改良与肉牛育种规划[J]. 畜牧与饲料科学, 2004, 25(6):62-63.
WANG F, TIAN C Y, RONG W H. Mongolian cattle improvement and beef cattle breeding program[J]. Animal Husbandry and Feed Science, 2004, 25(6):62-63. (in Chinese)
[16] 张文兰, 王静瑜, 王筱珊, 等. 阿拉善蒙古牛不同部位肉品质特性研究[J]. 当代畜牧, 2023(8):39-41.
ZHANG W L, WANG J Y, WANG X S, et al. Study on the meat quality characteristics of different parts of Alxa Mongolian cattle[J]. Contemporary Animal Husbandry, 2023(8):39-41. (in Chinese)
[17] 齐 昱, 邢燕平, 潘 静, 等. 基于转录组数据的蒙古牛皮肤组织抗寒相关信号通路及候选基因的筛选[J]. 畜牧兽医学报, 2017, 48(12):2301-2313.
QI Y, XING Y P, PAN J, et al. Screening of cold tolerance-related signaling pathways and candidate genes in Mongolia cattle skin tissues based on transcriptome data[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12):2301-2313. (in Chinese)
[18] 贾 琼, 金聪俐, 胡世雄, 等. 丝裂原活化蛋白激酶15纳米抗体的制备及其在B16-F10黑素瘤细胞生长过程中的抑制作用[J]. 中国生物化学与分子生物学报, 2024, 40(1):72-80.
JIA Q, JIN C L, HU S X, et al. Preparation of MAPK15 nanobody and its inhibitory effect on the growth of B16-F10 melanoma cells[J]. Chinese Journal of Biochemistry and Molecular Biology, 2024, 40(1):72-80. (in Chinese)
[19] NGUYEN A V, SOULIKA A M. The dynamics of the skin’s immune system[J]. Int J Mol Sci, 2019, 20(8):1811.
[20] 付国强. 小鼠毛囊免疫系统的产生及周期性改变[J]. 国外医学皮肤性病学分册, 1999, 25(3):185.
FU G Q. Production and periodic changes of the immune system[J]. International Journal of Dermatology and Venereology, 1999, 25(3):185. (in Chinese)
[21] R LLE A, J GER D, MOMBURG F. HLA-E peptide repertoire and dimorphism-centerpieces in the adaptive NK cell puzzle?[J]. Front Immunol, 2018, 9:2410.
[22] 张 亮, 陈美凯, 刘小锋, 等. 牛几种常见皮肤病的防治措施[J]. 甘肃畜牧兽医, 2022, 52(2):16-19.
ZHANG L, CHEN M K, LIU X F, et al. Prevention and treatment measures for several common skin diseases in cattle[J]. Gansu Animal Husbandry and Veterinary Medicine, 2022, 52(2):16-19. (in Chinese)
[23] 李 玮, 胡佳丽, 王 凯, 等. 黑色素瘤免疫治疗的研究现状与展望[J]. 中国临床药理学与治疗学, 202 26(9):1053-1064.
LI W, HU J L, WANG K, et al. Research progress and prospect of immunotherapy in the treatment of melanoma[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 202 26(9):1053-1064. (in Chinese)
[24] HERNANDEZ B, ADISSU H, WEI B R, et al. Naturally occurring canine melanoma as a predictive comparative oncology model for human mucosal and other triple wild-type melanomas[J]. Int J Mol Sci, 2018, 19(2):394.
[25] 郑保纹, 徐福南, 钱存忠. 乳牛皮肤恶性黑色素瘤形态学的观察[J]. 中国兽医科技, 1988(8):13-14.
ZHENG B W, XU F N, QIAN C Z. Morphology of malignant melanoma in dairy bovine skin[J]. Chinese Journal of Veterinary Science and Technology, 1988(8):13-14. (in Chinese)
[26] 袁荣茂, 景积友. 水牛恶性黑色素瘤病例报告[J]. 甘肃畜牧兽医, 1986(3):30.
YUAN R M, JING J Y. Case report of malignant melanoma in water buffalo[J]. Gansu Animal Husbandry and Veterinary Medicine, 1986(3):30. (in Chinese)
[27] 孙钟琴, 江多轩, 郭宗英. 黄牛恶性黑色素瘤一例[J]. 中国兽医杂志, 1983(11):36-37.
SUN Z Q, JIANG D X, GUO Z Y. A case of malignant melanoma in scalpers[J]. Chinese Journal of Veterinary Medicine, 1983(11):36-37. (in Chinese)
[28] FURGE K A, KIEWLICH D, LE P, et al. Suppression of Ras-mediated tumorigenicity and metastasis through inhibition of the Met receptor tyrosine kinase[J]. Proc Natl Acad Sci U S A, 200 98(19):10722-10727.
[29] SULLIVAN R J, FLAHERTY K. MAP kinase signaling and inhibition in melanoma[J]. Oncogene, 2013, 32(19):2373-2379.
[30] VAKIANI E, SOLIT D B. KRAS and BRAF: drug targets and predictive biomarkers[J]. J Pathol, 201 223(2):219-229.
[31] FERRELL J E JR. MAP kinases in mitogenesis and development[J]. Curr Top Dev Biol, 1996, 33:1-60.
[32] MORRISON D K, CUTLER R E. The complexity of Raf-1 regulation[J]. Curr Opin Cell Biol, 1997, 9(2):174-179.
[33] MONSEL G, ORTONNE N, BAGOT M, et al. c-Kit mutants require hypoxia-inducible factor 1α to transform melanocytes[J]. Oncogene, 2010, 29(2):227-236.
[34] 于吉军, 杨 光, 周婷婷, 等. 骆驼来源单域抗体的研究进展[J]. 国际药学研究杂志, 2017, 44(1):18-23.
YU J J, YANG G, ZHOU T T, et al. Single domain antibodies from camel: research advances[J]. Journal of International Pharmaceutical Research, 2017, 44(1):18-23. (in Chinese)
[35] MARQUARDT A, MUYLDERMANS S, PRZYBYLSKI M. A synthetic camel anti-lysozyme peptide antibody (peptibody) with flexible loop structure identified by high-resolution affinity mass spectrometry[J]. Chemistry, 2010, 12(7):1915-1923.
(编辑 白永平)
