表儿茶素没食子酸酯对MAC-T和小鼠乳腺炎症与细胞焦亡及NF-κB通路和NLRP3炎性小体的抑制效应
2025-01-27王浩磊刘梦燕龙泉李曼曼吕祥林涛蒋曹德
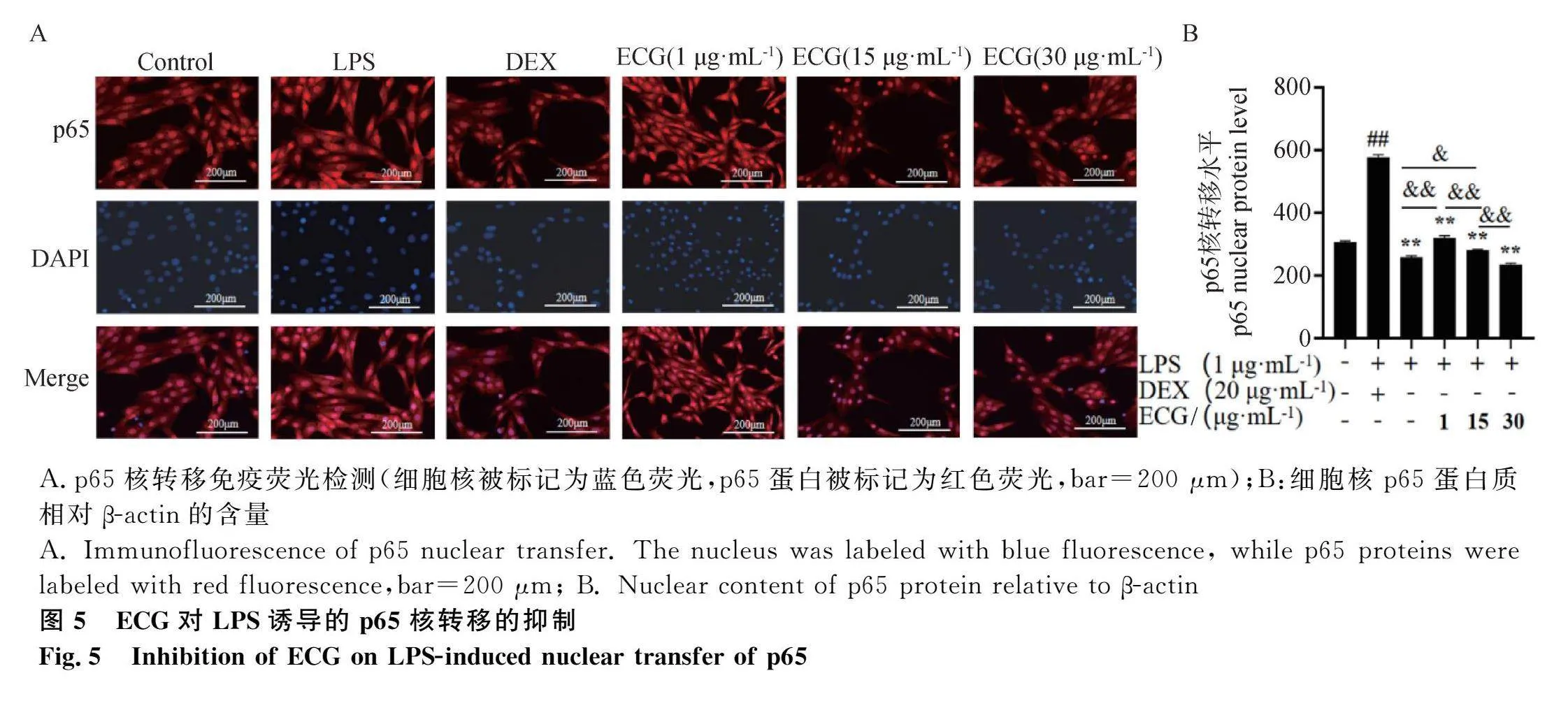



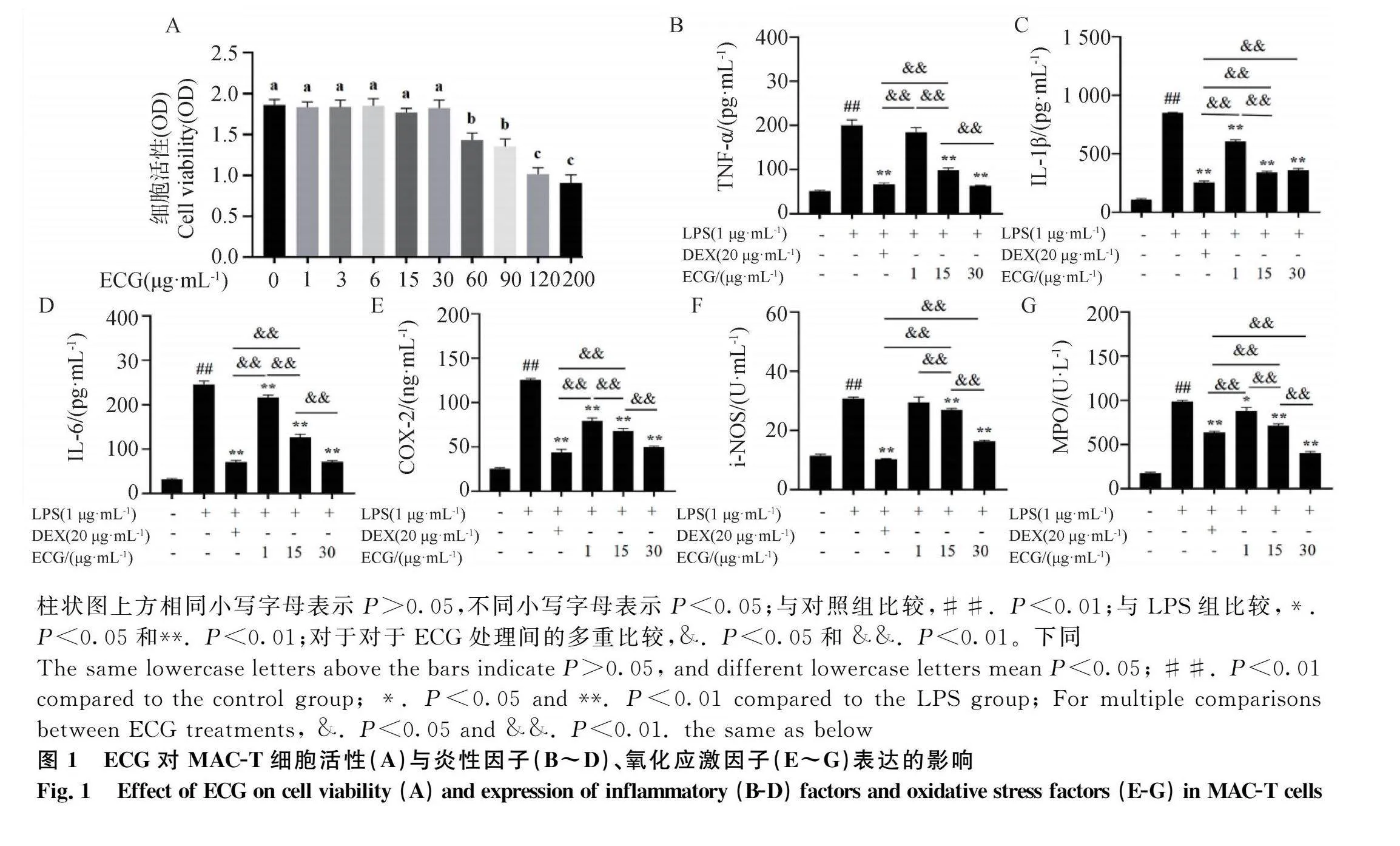
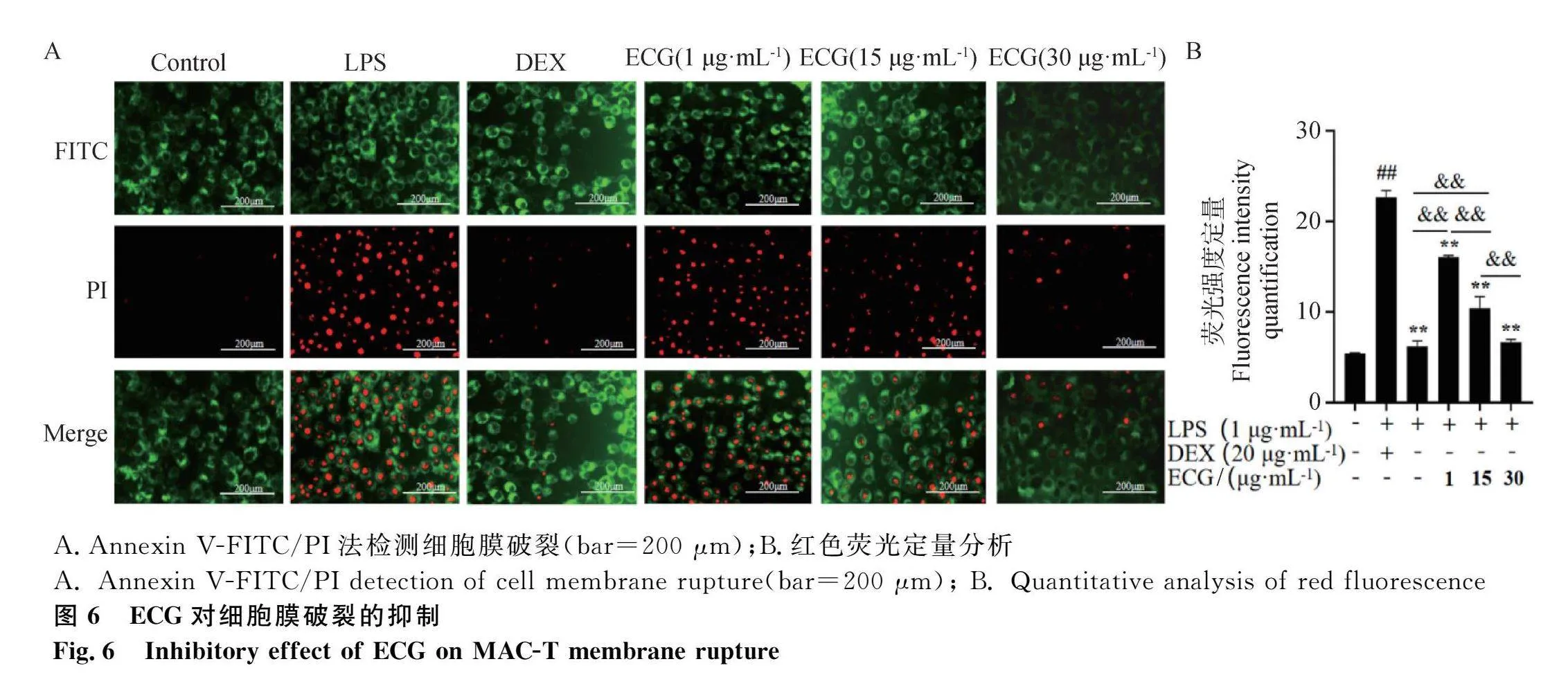


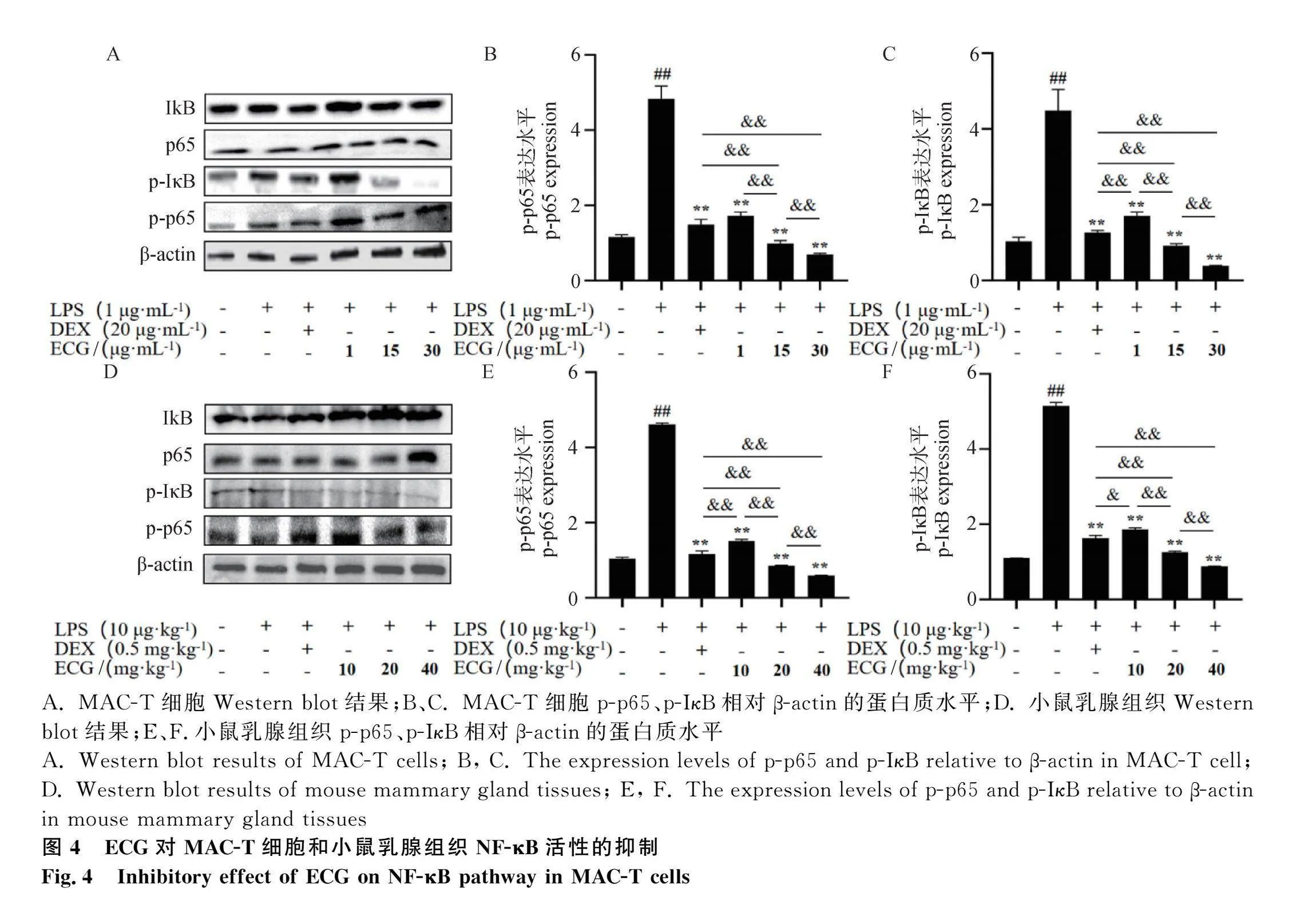
摘 要: 本研究旨在探究表儿茶素没食子酸酯(epicatechin gallate, ECG)对牛乳腺上皮细胞NF-κB(nuclear factor kappa B)炎性通路和NOD样受体3(NOD-like receptor protein 3, NLRP3)炎症小体的抑制作用。利用脂多糖(lipopolysaccharide, LPS)处理牛乳腺上皮细胞系(MAC-T)和小鼠乳腺;采用CCK-8法筛选ECG处理MAC-T细胞的最佳浓度,ELISA法检测促炎因子、氧化应激指示因子以及焦亡指示因子的表达水平;苏木精-伊红染色和Annexin V-FITC/PI法检测小鼠乳腺组织炎性变化和细胞膜破裂情况;Western blot检测NF-κB、NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)、caspase-1和Gasdermin NH 3 端(GSDMD-N)的表达水平;免疫荧光检测p65核转移情况。结果发现:1)ECG在10、20、40 mg·kg-1浓度下均可减轻LPS诱导的乳腺炎症和炎性细胞浸润;2)ECG在体内和体外均可显著且剂量依赖性地降低LPS诱导的促炎因子(IL-1β、IL-6、TNF-α)和氧化应激指示因子(COX-2、iNOS、MPO)表达水平(Plt;0.05);3)ECG剂量依赖性地降低了LPS诱导的细胞死亡率以及ROS、IL-18和LDH焦亡指示因子表达水平(Plt;0.05);4)ECG极显著地抑制LPS诱导的NLRP3、ASC、GSDMD-N、caspase-1、磷酸化p65的表达与核转移(Plt;0.05)。综上表明,ECG抑制MAC-T细胞和小鼠乳腺炎症与细胞焦亡以及NF-κB通路和NLRP3炎性小体。本研究为利用ECG替代抗生素防治牛乳腺炎提供了新的数据。
关键词: 表儿茶素没食子酸酯;NF-κB;乳腺炎;NLRP3炎性小体;焦亡
中图分类号: S857.26"""" 文献标志码:A"""" 文章编号: 0366-6964(2025)01-0430-12
收稿日期:2024-01-24
基金项目:国家自然科学基金(32171673)
作者简介:王浩磊(1999-),男,上海人,硕士生,主要从事动物营养与动物炎症治疗研究,E-mail: yipianche@qq.com;刘梦燕(1998-),女,山西汾阳人,硕士生,主要从事动物分子遗传育种研究,E-mail: 798163059@qq.com。王浩磊和刘梦燕为同等贡献作者
*通信作者:蒋曹德,主要从事动植物分子遗传育种与饲料生物技术与加工利用研究,E-mail: jcdpjx@swu.edu.cn;林 涛,主要从事动物营养与动物炎症治疗研究,E-mail: 727826660@qq.com
Inhibition of Epicatechin Gallate on Inflammation and Pyroptosis as Well as NF-κB
Pathway and NLRP3 Inflammasome in MAC-T Cells and Mouse Mammary Glands
WANG" Haolei LIU" Mengyan LONG" Quan LI" Manman L Xiang LIN" Tao 为制约奶牛健康和乳品产业发展的关键因素[1]。乳腺炎主要由微生物感染引起,但是环境因素、人为因素以及牛自身的遗传因素等也是其诱因[1]。引起乳腺炎的主要的病原菌包括金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)和链球菌(Streptococcus)等,其中大肠杆菌是导致急性临床乳腺炎最常见的病原菌,它的细胞外膜主要致病成分脂多糖(lipopolysaccharide, LPS)通过激活核因子κB(nuclear factor kappa B, NF-κB)信号通路和NOD样受体3(NOD-like receptor protein 3, NLRP3)炎性小体诱发乳腺组织炎性反应和焦亡[2]。因此,LPS被广泛应用于多种动物的炎症模型的建立[3-5]。
焦亡为依赖于caspase-1和促炎调节的细胞程序性坏死,又称细胞炎性死亡[6]。在LPS诱导的焦亡信号通路中,LPS被Toll样受体4(TLR4)二聚体识别,导致NF-κB的活化与NLRP3(NOD-like receptor protein 3)炎性小体的组装[2],进而通过caspase-1、Gasdermin NH 3端 (GSDMD-N)的作用形成细胞膜穿孔,释放乳酸脱氢酶(lactic dehydrogenase, LDH)和IL-1β、IL-18等促炎细胞因子促进炎性疾病的发生[7-9]。因此,NF-κB和NLRP3炎症小体在LPS诱导的炎性反应和细胞焦亡中起关键作用。
表儿茶素没食子酸酯(epicatechin gallate, ECG)是一种重要的类黄酮物质,广泛存在于茶、葡萄、可可和红酒中[10-11]。众多研究已证实ECG在抗炎、抗氧化、抗肿瘤和抗凋亡等方面具有显著作用[12-16],因此它被用于龋齿、牙周病和动脉粥样硬化的治疗研究[17-18]。在作用机制方面,研究发现ECG通过阻断p65的磷酸化来抑制NF-κB的激活,减少NLRP3炎症小体的形成和IL-1β与TNF-α的释放,从而缓解小鼠在缺氧环境下的神经炎症[13]。同时,ECG抑制丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路,减轻炎症和细胞凋亡[14]。最近的研究也表明,ECG抑制NF-κB和MAPK的磷酸化,防止小鼠动脉粥样硬化的恶化[18-19]。然而,目前关于ECG的报道大多局限于小鼠和大鼠模型的抗炎和抗凋亡特性,ECG在乳腺炎性反应和焦亡方面的作用有待阐明。
本研究通过LPS刺激MAC-T细胞和小鼠乳腺,探讨了ECG对乳腺炎症与焦亡的抑制作用及其分子机制,为利用ECG替代抗生素防治乳腺炎奠定基础。
1 材料与方法
1.1 细胞培养和处理
DMEM培养基(Gibco,苏州)中加入100 U·mL-1青霉素、10%胎牛血清和100 μg·mL-1链霉素(Solarbio,北京)。根据需要选择96孔板或者6孔板,将MAC-T细胞(BNCC,河北廊坊)接种于上述培养基,并在37℃、5% CO 2(Forma Series 3 WJ,Thermo)的培养箱中培养至对数生长期。采用1 μg·mL-1 LPS[3-4]和1、15或30 μg·mL-1 ECG处理MAC-T细胞(ECG的处理浓度根据下述细胞活性检测确定),并继续培养24 h。每个处理重复5次,用LPS单独处理的细胞和LPS+20 μg·mL-1 地塞米松(dexamethasone,DEX,一种广泛用于治疗炎症性疾病的类固醇药物)处理的细胞分别作为ECG处理阴性和阳性对照。
1.2 细胞活性检测(CCK8)
将重悬的MAC-T细胞接种到96孔板中,每孔100 μL的细胞悬液。待细胞长到90%(2×106细胞·孔-1),将配制好的ECG原液用不含FBS的DMEM培养基稀释至0、1、3、6、15、30、60、90、120和200 μg·mL-1处理细胞,并在处理孔周围加入100 μL PBS 缓冲液,每个处理5个重复。处理24 h后在每孔加入10 μL CCK-8溶液(Solarbio,北京),培养箱孵育2 h后用酶标仪测定450 nm处的光密度值(OD)。
1.3 动物体内试验
从恩彼生物技术有限公司(重庆)购买6~8周龄的BALB/c小鼠(18只,♀36只),母鼠每笼2只,公鼠每笼1只,自由采食,在光照/黑暗各12 h的条件下饲养7 d。随机选取2只母鼠和1只公鼠共同饲养在一个笼子里,进行配种。产后7 d,将成活并泌乳的30只母鼠随机分为6组,每组5只:空白对照组、LPS组(10 μg·kg-1)、LPS+ECG(10、20和40 mg·kg-1)组[20],以及LPS+DEX(0.5 mg·kg-1)组,其中LPS组、LPS+DEX组分别作为ECG处理阴性和阳性对照。注射前将母鼠和子鼠分离2 h后,LPS+DEX和LPS+ECG组进行腹腔注射,空白组和 LPS 组腹腔注射等量生理盐水。按照前期的方法[4],1 h后用2%戊巴比妥钠(50 mg·kg-1)麻醉小鼠,将LPS注射到雌鼠的第四对乳头的乳腺导管中。24 h后当乳腺出现红肿充血时眼球采血5 mL,注入含有0.1 mL肝素钠(10 mg·mL-1 盐水溶液)的10 mL离心管中,4 ℃,3 000×g离心30 min,收集血清。颈部脱臼法处死小鼠,取出乳房组织,其中一部分置于4%多聚甲醛固定液中,另一部分储存于-80℃备用。
1.4 酶联免疫吸附试验(ELISA)
细胞在6孔板中培养并按“1.1”方法处理,小鼠按“1.3”方法处理。根据 ELISA试剂盒说明书(博诺恒生物科技有限公司,重庆)测定细胞上清和小鼠血清中炎性因子(TNF-α、IL-1β、IL-6)和氧化应激指示因子(COX-2、iNOS)的含量。
1.5 Western blot
将“1.1”和“1.3”中处理过的细胞和小鼠组织研磨,使用细胞总蛋白提取试剂盒(Solarbio,北京)提取总蛋白,用BCA蛋白定量试剂盒(Solarbio,北京)进行定量。Western blot按照Ma等[3]的方法,每个试验3次重复。所用的一抗包括p65(bs-23217R)、p-p65(bs-0982R)、IκB(bs-1287R0)、p-IκB(bs-2513R)、NLRP3(19771-1-AP)、caspase-1(22915-1-AP)、ASC(10500-1-AP)、GSDMD-N(20770-1-AP)、β-actin(bsm-33036M)(Proteintech,湖北武汉),一抗稀释比例均为1∶1 000;二抗为 Goat Anti-rabbit IgG/HRP(BS13278;Bioss,北京),稀释比1∶5 000。胶条使用化学发光ECL-Western blot检测试剂(Bioground,重庆)进行可视化,并使用Image Lab(版本5.2. Bio-Rad)进行定量。
1.6 免疫荧光
细胞和小鼠处理如“1.1”和“1.3”,按照前期的方法进行GSDMD、NLRP3和p65核转移免疫荧光检测[3-4]。简而言之,处理过的MAC-T细胞相继用乙醇孵育10 min,2%的Triton X-100(Beyotime, 重庆)孵育5 min,5%的BSA Block Buffer(Beyotime, 重庆)孵育1 h;分别利用GSDMD、NLRP3以及磷酸化p65(p-p65)的抗体孵育,再用兔抗山羊IgG/Cy3抗体(Bioss, 北京)孵育;使用DAPI对核进行染色,在荧光倒置显微镜(Leica, Wetzlar, GER)下观察。
1.7 Annexin V-FITC/PI分析
将“1.1”处理的MAC-T细胞接种于24孔板,待其生长到90%时,用PBS洗涤3次。按照Annexin V-FITC/PI检测试剂盒(翌圣生物科技,上海)说明书在每个培养孔加入10 μL Annexin V-FITC和20 μL PI Staining Solution,避光、室温反应10~15 min。再加入400 μL 1×Binding Buffer,混匀后放置于冰上,1 h内利用荧光倒置显微镜(Leica, Wetzlar, GER)进行拍照,并使用Image Lab(版本5.2. Bio-Rad)进行定量。
1.8 苏木精-伊红(HE)染色
HE染色由武汉赛维尔生物科技有限公司完成,即将“1.3”方法处理的小鼠R4乳腺组织固定在4%(体积比)的甲醛中,经过脱水、透明化、蜡浸和石蜡包埋后切成5 μm厚的切片。切片进行二甲苯脱蜡(共3缸,5 min·缸-1);过无水、90%、80%、70%的乙醇(各1缸,均3 min·缸-1),蒸馏水再清洗3 min;依次进行苏木精染色10 min、伊红染色5 min,经80%、90%和无水乙醇脱水及二甲苯透明化处理后,在生物显微镜(Leica, Wetzlar, GER)下观察组织损伤。
1.9 髓过氧化物酶、活性氧和乳酸脱氢酶检测
收集“1.1”方法处理的细胞上清和“1.4”方法处理的小鼠血清,按照MPO、ROS检测试剂盒和LDH活性检测试剂盒(Solarbio, 北京)说明书,使用Multiskan GO(Thermo, 美国)分别于460、525和450 nm波长处测定MPO(myeloperoxidase)和LDH活性以及ROS(reactive oxygen species)的含量,每次检测重复3次。
1.10 统计分析
使用SPSS26.0软件进行单因素方差分析,并进行Duncan多重比较。统计显著性设定为Plt;0.05 或 Plt;0.01。
2 结 果
2.1 ECG在MAC-T细胞与小鼠乳腺中的抗炎作用
首先,利用不同浓度的ECG处理MAC-T细胞筛选最佳的处理浓度。CCK-8检测表明,ECG在1、3、6、15和30 μg·mL-1浓度下对MAC-T细胞活性无影响;当ECG浓度在60 μg·mL-1以上时显著降低了细胞活性(Plt;0.0 图1A)。因此,在后续研究中采用的ECG浓度梯度为1、15和30 μg·mL-1。进一步采用ELISA检测不同浓度ECG处理下MAC-T细胞促炎细胞因子和氧化应激细胞因子的表达变化(图1B~G)。与对照组相比,受LPS诱导的MAC-T细胞中IL-1β、IL-6、TNF-α、COX-2和iNOS的蛋白水平以及MPO活性极显著增加(Plt;0.01);但是,ECG处理后上述细胞因子的表达和MPO活性呈剂量依赖性且极显著降低(Plt;0.01),其中30 μg·mL-1 ECG处理组的MPO活性极显著低于DEX处理组(Plt;0.01)。
其次,为了证实ECG体外抗炎效果,分析了ECG对小鼠乳腺炎症的抑制作用。图2A显示,对照组小鼠乳腺组织正常,LPS组小鼠乳腺组织肿胀、充血明显。HE染色显示LPS刺激引起腺泡腔充血性水肿,白细胞浸润;然而,DEX和ECG处理明显减轻了LPS诱导的乳腺组织病理变化(图2A、2B)。MPO检测也证实,ECG处理可极显著降低LPS诱导的炎症细胞浸润(Plt;0.0 图3A)。进一步分析了ECG对小鼠乳腺组织中促炎细胞因子和氧化应激细胞因子表达的影响。与对照组相比,LPS诱导的MAC-T细胞中IL-1β、IL-6、TNF-α、COX-2和iNOS的蛋白水平极显著增加(Plt;0.01);但是,ECG处理后这些细胞因子的表达呈剂量依赖性而且极显著降低(Plt;0.01),其中40 μg·kg-1 ECG处理组的MPO活性和IL-1β、COX-2的表达极显著低于DEX处理组(Plt;0.0 图3B~F)。
2.2 ECG对NF-κB炎性通路的调控
采用Western blot检测NF-κB两个关键亚基(p65和IκB)的蛋白和磷酸化水平。在MAC-T细胞(图4A~C),p65和IκB的蛋白水平在不同处理之间没有显著差异(Pgt;0.05);LPS处理的细胞中p-p65和p-IκB 蛋白水平较对照组极显著增加(Plt;0.01);在ECG(1、15 和 30 μg·mL-1)处理的细胞中,p-p65和p-IκB蛋白水平极显著下降(Plt;0.01)。同样,ECG(10、20、40 mg·mL-1)极显著降低小鼠乳腺组织中p-p65和p-IκB蛋白水平(Plt;0.0 图4D~F)。在15和30 μg·mL-1 ECG处理组的MAC-T细胞和20、40 mg·mL-1 ECG处理的乳腺组织中,p-p65和p-IκB蛋白水平极显著低于DEX处理组(Plt;0.01)。
采用免疫荧光分析了MAC-T细胞中p65的核移位(图5A)。结果表明,LPS增强了细胞核p65的荧光信号,而ECG减弱了细胞核p65的信号。MAC-T细胞核p65含量分析也显示,LPS处理导致核中p65水平极显著高于对照组(Plt;0.01),ECG剂量依赖性地降低了细胞核p65含量(Plt;0.0 图5B)。
2.3 ECG对MAC-T细胞和小鼠乳腺焦亡的抑制效应
采用Annexin V-FITC/PI方法检测各处理组细胞膜破裂情况。与空白对照组相比,LPS组被PI标记的红色细胞数目增多;但是ECG处理组的红色细胞数目较LPS组明显降低(图6A)。荧光定量分析也表明,ECG各处理组细胞破裂程度均较LPS组极显著地降低(Plt;0.01),且具有剂量依赖性(图6B)。
其次,通过检测细胞焦亡特异指标ROS、LDH和IL-18的表达水平,以进一步证明ECG对LPS诱导的MAC-T细胞焦亡的抑制作用。与空白对照组相比,LPS组MAC-T细胞和小鼠乳腺ROS荧光强度、LDH活性和IL-18水平极显著增强(Plt;0.0 图7);但是,ECG处理剂量依赖性而且极显著降低了ROS、LDH和IL-18的水平(Plt;0.01)。
2.4 ECG对LPS诱导的NLRP3炎性小体的影响
采用Western blot检测NLRP3炎性小体相关蛋白的表达水平。与空白对照组相比,LPS 组MAC-T细胞中NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)、caspase-1和GSDMD-N的蛋白水平极显著提高(Plt;0.0 图8);与 LPS处理相比,ECG剂量依赖性地降低上述蛋白的表达水平(Plt;0.01),而且30 μg·mL-1 ECG处理组细胞中caspase-1、ASC和GSDMD-N表达量极显著低于DEX处理组(Plt;0.01)。同样,ECG处理剂量依赖性地降低了小鼠乳腺组织中LPS诱导的上述蛋白的表达水平,且caspase-1、ASC和GSDMD-N表达量极显著低于DEX处理组(Plt;0.0 图9)。
3 讨 论
作者和其他前期研究报道,1 μg·mL-1 LPS通过NF-κB和MAPK通路触发MAC-T细胞的炎性反应[3-4],并且通过NLRP3焦亡小体抑制细胞焦亡反应[7]。另一方面,DEX是一种广泛用于治疗各种急性和慢性炎症性疾病的药物,该药物对LPS诱导的炎症反应的抑制作用已在小鼠等动物模型中得到广泛的证实[3,21]。本研究发现,ECG在≤30 μg·mL-1的浓度下对MAC-T细胞活性没有影响,表明对细胞无毒性(图1A)。基于上述这些数据,并且Esmaeelpanah等[22]发现10、20和30 mg·kg-1ECG对丙烯酰胺引起的大鼠神经毒性具有抑制效应,本研究利用LPS刺激MAC-T细胞和小鼠乳腺,并且设计空白对照组、LPS组、LPS + DEX组和LPS + ECG组。通过比较LPS组与空白对照组以揭示LPS诱导的炎性反应,再通过LPS + ECG组与LPS + DEX组、LPS组的比较反映ECG的效应。
很多研究报道炎性因子在乳腺炎发生过程中起着关键作用[3-5]。ECG为儿茶素多酚成分之一,儿茶素多酚还包括表儿茶素(epicatechin, EC)、表没食子儿茶素(epigallocatechin, EGC)和表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)[23]。儿茶素的结构为黄烷-3-醇,由两个苯环(A环和B环)通过一个二氢吡喃杂环(C环)相连而成,形成C 6-C 3-C 6的结构通式;ECG、EC、EGC和EGCG结构的差异在于羟基数量不同和C环的4’连接的官能团不同,由于它们结构的相似性,均显示出抗癌、抗炎、抗氧化等方面的重要活性[23]。特别地,EC和EGCG能够显著降低LPS诱导的RAW264.7细胞、MAC-T细胞和大鼠模型中IL-1β、IL-6和TNF-α的表达[3,24-26]。小鼠上的研究进一步揭示了ECG具有抗动脉粥样硬化的作用[12,18]。本研究进一步揭示ECG能有效地抑制MAC-T细胞和小鼠乳腺组织中LPS诱导的炎性因子的表达(图1~3),这与Chen等[13]的研究结果一致,表明ECG具有抑制乳腺炎症的作用。
氧化应激通过激活NF-κB促进炎性因子的表达,从而诱导炎症的发生[11]。前期研究报道绿茶儿茶素能够降低肥胖、血压、低密度脂蛋白胆固醇以及心脑血管疾病风险[11],其中EGCG降低缺氧BV2细胞中COX-2、iNOS和MPO的表达[27]。COX-2由组织损伤部位促炎细胞因子(如IL-1和IL-6)刺激释放的诱导酶,它催化花生四烯酸产生前列腺素E2来刺激疼痛和炎症的发生[28]。iNOS为一氧化氮合酶,被炎性等刺激激活并催化NO的生成,从而促进细胞死亡[29]。MPO由巨噬细胞和中性粒细胞产生,为氧化应激反应关键的介导因子;MPO活性与中性粒细胞的数量成正比,是中性粒细胞浸润和促炎因子表达的衡量指标[30]。因此,这些氧化应激指示因子被认为是治疗炎症性疾病和癌症的重要靶点[29-30]。本研究发现ECG在体内、体外均能抑制LPS诱导的COX-2、iNOS和MPO的活性(图1和3),进一步暗示ECG在牛乳腺炎的治疗中具有抗氧化和抗炎作用。
细胞焦亡分为经典细胞焦亡通路和非经典细胞焦亡通路[31-33]。相关研究已证明LPS刺激细胞后,由caspase-1、GSDMD和NLRP3炎症小体介导感染细胞发生非经典细胞焦亡[31-32]。然而,细胞的过度或不当焦亡导致组织损伤[33]。本研究的体内、体外证据表明ECG对LPS诱导的焦亡与NLRP3炎性小体及其相关蛋白水平的的抑制作用(图6~9)。虽然目前还没有文献报道ECG在细胞焦亡调控中的作用,但是前期的研究也表明,EC和EGCG在小鼠肺炎组织、小鼠骨髓来源的巨噬细胞和慢性阻塞性肺病患者中阻止NLRP3炎症小体和caspase-1的激活[34-36];ECG能够减轻大鼠的炎症和凋亡[14],这些研究报道进一步证实了ECG的抗焦亡作用。
NF-κB是各种生物细胞中广泛存在的转录因子,是LPS诱导炎症发生的经典信号传导通路[37-38]。NF-κB在未受到刺激的静息状态下与IκB结合而失活;当LPS等外部刺激出现时,会导致IκB的磷酸化和随后的泛素化降解,释放p65进入到细胞核启动NLRP3、IL-1β和IL-18等靶基因的转录[37-38]。本研究体内和体外结果表明,ECG降低了LPS诱导的p-IκBα和p-p65蛋白水平与细胞核含量(图4、5)。前期的研究进一步报道ECG抑制ROS、p-IκB、p-p65和TLR4水平[13,18];EC能够降低p-IκB和p-p65水平[3]。这些证据充分证明ECG对NF-κB信号通路的抑制作用。
4 结 论
本研究揭示了ECG可有效减轻LPS诱导的MAC-T细胞和小鼠乳腺炎症;ECG抑制了MAC-T细胞和小鼠乳腺组织中LPS诱导的炎性和细胞焦亡反应,并且抑制NF-κB通路以及NLRP3炎症小体及其相关蛋白的表达。今后将进一步研究ECG在抗牛乳腺炎更深层次的分子机制以及在奶牛乳腺炎防治中的应用。
参考文献(References):
[1] HU H H, FANG Z, MU T, et al. Application of metabolomics in diagnosis of cow mastitis:a review[J]. Front Vet Sci, 202 8:747519.
[2] YU S, LIU X, YU D, et al. Morin protects LPS-induced mastitis via inhibiting NLRP3 inflammasome and NF-κB signaling pathways[J]. Inflammation, 2020, 43(4):1293-1303.
[3] MA X, LI M M, LU G C, et al. Anti-inflammation of epicatechin mediated by TMEM35A and TMPO in bovine mammary epithelial cell line cells and mouse mammary gland[J]. J Dairy Sci, 202 104(12):12925-12938.
[4] LI M M, LU G C, MA X, et al. Anti-inflammation of isoliquiritigenin via the inhibition of NF-κB and MAPK in LPS-stimulated MAC-T cells[J]. BMC Vet Res, 2022, 18(1):320.
[5] LI L, WEI X F, YANG Z Y, et al. Alleviative effect of poly-β-hydroxybutyrate on lipopolysaccharide-induced oxidative stress, inflammation and cell apoptosis in Cyprinus carpio[J]. Int J Biol Macromol, 2023, 253:126784.
[6] MIAO E A, LEAF I A, TREUTING P M, et al. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria[J]. Nat Immunol, 2010, 11(12):1136-1142.
[7] JIANG A M, ZHANG Y, ZHANG X, et al. Morin alleviates LPS-induced mastitis by inhibiting the PI3K/AKT, MAPK, NF-κB and NLRP3 signaling pathway and protecting the integrity of blood-milk barrier[J]. Int Immunopharmacol, 2020, 78:105972.
[8] RUSSO H M, RATHKEY J, BOYD-TRESSLER A, et al. Active caspase-1 induces plasma membrane pores that precede pyroptotic lysis and are blocked by lanthanides[J]. J Immunol, 2016, 197(4):1353-1367.
[9] YE Z, LI L Z, LI Y Z, et al. Tou Nong powder obstructs ulcerative colitis through the regulation of NF-κB/NLRP3/Caspase-1/GSDMD inflammasome pyroptotic pathway[J]. J Ethnopharmacol, 2023, 317:116846.
[10] SAMPATH C, RASHID M R, SANG S M, et al. Green tea epigallocatechin 3-gallate alleviates hyperglycemia and reduces advanced glycation end products via nrf2 pathway in mice with high fat diet-induced obesity[J]. Biomed Pharmacother, 2017, 87:73-81.
[11] PREZ-TORRES I, CASTREJ N-TLLEZ V, SOTO M E, et al. Oxidative stress, plant natural antioxidants, and obesity[J]. Int J Mol Sci., 202 22(4):1786.
[12] AL-SAYED E, ABDEL-DAIM M M. Analgesic and anti-inflammatory activities of epicatechin gallate from Bauhinia hookeri[J]. Drug Dev Res, 2018, 79(4):157-164.
[13] CHEN G J, CHENG K, NIU Y, et al. (-)-Epicatechin gallate prevents inflammatory response in hypoxia-activated microglia and cerebral edema by inhibiting NF-κB signaling[J]. Arch Biochem Biophys, 2022, 729:109393.
[14] MALIK S, SUCHAL K, BHATIA J., et al. Molecular mechanisms underlying attenuation of cisplatin-induced acute kidney injury by epicatechin gallate[J]. Lab Invest, 2016, 96(8):853-861.
[15] STADLBAUER S, STEINBORN C, KLEMD A, et al. Impact of green tea catechin ECG and its synthesized fluorinated analogue on prostate cancer cells and stimulated immunocompetent cells[J]. Planta Med, 2018, 84(11):813-819.
[16] ZHU M, FEI X Y, GONG D M, et al. Effects of processing conditions and simulated digestion in vitro on the antioxidant activity, inhibition of xanthine oxidase and bioaccessibility of epicatechin gallate[J]. Foods, 2023, 12(14):2807.
[17] EZHIL I, LAKSHMI T. Antibacterial efficacy of epicatechin and rutin from Acacia catechu leaf extract against Enterococcus faecalis and Streptococcus mutans-an in vitro study[J]. J Adv Pharm Educ Res, 2017, 7(1):22-24.
[18] YU J J, LI W F, XIAO X, et al. (-)-Epicatechin gallate blocks the development of atherosclerosis by regulating oxidative stress in vivo and in vitro[J]. Food Funct, 202 12(18):8715-8727.
[19] LI W F, YU J J, XIAO X, et al. The inhibitory effect of (-)-epicatechin gallate on the proliferation and migration of vascular smooth muscle cells weakens and stabilizes atherosclerosis[J]. Eur J Pharmacol, 202 891:173761.
[20] SADEK K, SALEH E, AYOUB M. Selective, reliable blood and milk bio-markers for diagnosing clinical and subclinical bovine mastitis[J]. Trop Anim Health Prod, 2017, 49(2):431-437.
[21] AL-HARBI N O, IMAM F, AL-HARBI M M, et al. Dexamethasone attenuates LPS-induced acute lung injury through inhibition of NF-κB, COX-2, and pro-inflammatory mediators[J]. Immunol Invest, 2016, 45(4):349-369.
[22] ESMAEELPANAH E, RAZAVI B M, HASANI F V, et al. Evaluation of epigallocatechin gallate and epicatechin gallate effects on acrylamide-induced neurotoxicity in rats and cytotoxicity in PC 12 cells[J]. Drug Chem Toxicol, 2018, 41(4):441-448.
[23] MUSIAL C, KUBAN-JANKOWSKA A, GORSKA-PONIKOWSKA M. Beneficial properties of green tea catechins[J]. Int J Mol Sci, 2020, 21(5):1744.
[24] ZHONG Y, CHIOU Y S, PAN M H, et al. Anti-inflammatory activity of lipophilic epigallocatechin gallate (EGCG) derivatives in LPS-stimulated murine macrophages[J]. Food Chem, 2012, 134(2):742-748.
[25] PRINCE P D, FISCHERMAN L, TOBLLI J E, et al. LPS-induced renal inflammation is prevented by (-)-epicatechin in rats[J]. Redox Biol, 2017, 11:342-349.
[26] YANG D J, LIU S C, CHEN Y C, et al. Three pathways assess anti-inflammatory response of epicatechin with lipopolysaccharide-mediated macrophage RAW264. 7 Cells[J]. J Food Biochem, 2015, 39(3):334-343.
[27] KIM S R, SEONG K J, KIM W J, et al. Epigallocatechin gallate protects against hypoxia-induced inflammation in microglia via NF-κB suppression and Nrf-2/HO-1 activation[J]. Int J Mol Sci, 2022, 23(7):4004.
[28] LEE J A, HA S, CHO E, et al. Resveratrol as a bioenhancer to improve anti-inflammatory activities of apigenin[J]. Nutrients, 2015, 7(11):9650-9661.
[29] NICHOLAS C, BATRA S, VARGO M A, et al. Apigenin blocks lipopolysaccharide-induced lethality in vivo and proinflammatory cytokines expression by inactivating NF-κB through the suppression of p65 phosphorylation[J]. J Immunol, 2007, 179(10):7121-7127.
[30] ZHANG Z M, LI L, HUANG G X, et al. Embelia Laeta aqueous extract suppresses acute inflammation via decreasing COX-2/iNOS expression and inhibiting NF-κB pathway[J]. J Ethnopharmacol, 202 281:114575.
[31] YE J Z, ZENG B, ZHONG M Y, et al. Scutellarin inhibits caspase-11 activation and pyroptosis in macrophages via regulating PKA signaling[J]. Acta Pharm Sin B, 202 11(1):112-126.
[32] WU Q R, YANG H, ZHANG H D, et al. IP3R2-mediated Ca2+ release promotes LPS-induced cardiomyocyte pyroptosis via the activation of NLRP3/Caspase-1/GSDMD pathway[J]. Cell Death Discov, 2024, 10(1):91.
[33] CHURCHILL M J, MITCHELL P S, RAUCH I. Epithelial pyroptosis in host defense[J]. J Mol Biol, 2022, 434(4):167278.
[34] SUHAIL M, REHAN M, TARIQUE M, et al. Targeting a transcription factor NF-κB by green tea catechins using in silico and in vitro studies in pancreatic cancer[J]. Front Nutr, 2023, 9:1078642.
[35] TIAN X, XUE Y S, XIE G G, et al. (-)-Epicatechin ameliorates cigarette smoke-induced lung inflammation via inhibiting ROS/NLRP3 inflammasome pathway in rats with COPD[J]. Toxicol Appl Pharmacol, 202 429:115674.
[36] ZHANG C, LI X, HU X, et al. Epigallocatechin-3-gallate prevents inflammation and diabetes-induced glucose tolerance through inhibition of NLRP3 inflammasome activation[J]. Int Immunopharmacol, 202 93:107412.
[37] ZHANG Q, LENARDO M J, BALTIMORE D. 30 years of NF-κB:a blossoming of relevance to human pathobiology[J]. Cell, 2017, 168(1-2):37-57.
[38] TANIGUCHI K, KARIN M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nat Rev Immunol, 2018, 18(5):309-324.
(编辑 白永平)
