植物雌激素大豆黄酮对小鼠乳腺上皮细胞乳成分合成和细胞增殖的影响及机制
2025-01-27黄心河李浩楠周潇徐佳婧张源淑韩正康

摘 要: 本试验旨在研究植物雌激素大豆黄酮(daidzein, DZ)对小鼠乳腺上皮细胞EpH4-Ev乳糖、乳蛋白、乳脂肪合成及细胞增殖的影响,探讨相关的调节作用。首先用不同浓度DZ(0~1 000 μmol·L-1)处理EpH4-Ev细胞6、12、24、48 h,通过检测细胞活力确定DZ作用浓度及时间;试验分为对照组(0 μmol·L-1 DZ处理)、低浓度组(10 μmol·L-1 DZ处理)、中浓度组(20 μmol·L-1 DZ处理)、高浓度组(40 μmol·L-1 DZ处理),并以生理剂量的雌二醇(E2)作为阳性对照,37 ℃、5%CO 2培养12 h后,进行如下试验:1)测定细胞及分泌上清中甘油三酯(TG)、葡萄糖(GLU)含量及脂滴染色变化;2)检测细胞增殖与凋亡相关蛋白、乳成分合成相关蛋白的表达变化;3)检测PI3K/AKT-mTOR信号通路关键蛋白的磷酸化水平;4)流式细胞技术分析细胞凋亡率与细胞周期分布情况。结果显示:1)与对照组相比,2.5~80.0 μmol·L-1 "DZ处理后,细胞活力极显著提高(Plt;0.01),其中20 μmol·L-1 DZ处理提高效果最为显著,结合实验室前期结果,选择DZ作用的低、中和高浓度分别为10、20和40 μmol·L- 作用时间为12 h。2)与对照组相比,中浓度及高浓度组DZ及E2处理后极显著提高了EpH4-Ev细胞及分泌上清中TG和GLU的含量,促进了脂滴的合成(P<0.01)。3)与对照组相比,不同浓度DZ处理后葡萄糖转运载体1(GLUT1)和β-酪蛋白(β-casein)的表达均极显著升高(P<0.01);同时DZ及E2处理后均提高脂肪酸合成酶(FASN)、胆固醇调节元件结合蛋白1(SREBP1)、过氧化物酶体增殖物激活受体γ(PPAR-γ)、乙酰辅酶A羧化酶(ACC)的表达。4)与对照组相比,不同浓度DZ及E2处理后均增加了G2/M期和S期的细胞占比,上调了增殖细胞核抗原(PCNA)、细胞周期蛋白D1、D3、抗凋亡蛋白Bcl-2的表达量,同时中浓度DZ组极显著增加了Bcl-2/Bax比值(P<0.01),细胞凋亡率降低。5)三个浓度DZ及E2处理后均上调了PI3K/AKT-mTOR信号通路中p-PI3K、p-mTOR、p-AKT的磷酸化水平。结果表明:DZ处理可促进乳腺上皮细胞的增殖及乳成分的合成。其机制与上调细胞增殖蛋白的表达、降低细胞凋亡率,激活PI3K/AKT-mTOR通路有关。
关键词: 植物雌激素;大豆黄酮;小鼠乳腺上皮细胞;乳成分合成;乳腺上皮细胞的增殖
中图分类号: S857.26"""" 文献标志码:A"""" 文章编号: 0366-6964(2025)01-0417-13
收稿日期:2024-02-22
基金项目:国家自然科学基金(31972640)
作者简介:黄心河(1999-),女,浙江常山人,硕士,主要从事动物机能生物化学研究,E-mail: 2021107033@stu.njau.edu.cn
*通信作者:张源淑,主要从事动物机能生物化学研究,E-mail: zhangyuanshu@njau.edu.cn
Effects and Mechanism on the Synthesis of Milk Components and Cell Proliferation in Mouse
Mammary Epithelial Cells by Phytoestrogen Daidzein
HUANG" Xinhe, LI" Haonan, ZHOU" Xiao, XU" Jiajing, ZHANG" Yuanshu*, HAN" Zhengkang
(Key Laboratory of Animal Physiology and Biochemistry of Ministry of Agriculture and
Rural Affairs, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: "This study was to detect the effects of Daidzein (DZ) on the synthesis of lactose, milk protein, milk fat and cell proliferation of mouse mammary epithelial cells EpH4-Ev to investigate the associated regulatory roles. EpH4-Ev cells were treated with different concentrations of DZ (0 to 1 000 μmol·L-1) for 6, 12, 24, 48 h and the concentration of DZ and time were determined by detecting cell viability; they were divided into a control group (0 μmol·L-1 DZ treatment), a low-concentration group (10 μmol·L-1 DZ treatment), a medium-concentration group (20 μmol·L-1 DZ treatment), and a high-concentration group (40 μmol·L-1 DZ treatment), and physiological dose of estradiol (E2) was used as a positive control, and the cells were incubated for 12 h at 37 ℃ and 5% CO 2 as follows experiments were performed: 1) Determination of triglyceride (TG) and glucose (GLU) content in cells and supernatants; 2) Cell proliferation and apoptosis-related proteins, milk component synthesis-related proteins and PI3K/AKT-mTOR signaling pathways were detected, and milk lipid synthesis was probed by combining with lipid droplet staining. The apoptosis rate and cell cycle distribution were analyzed by flow cytometry. The results showed that: 1) Compared with the control group, between 2.5-80.0 μmol·L-1 DZ treatments could significantly improve the cell viability of EpH4-Ev cells (Plt;0.01), and 20 μmol·L-1 DZ treatment had the most significant improvement effect. Combined with the results of the pre-laboratory period, the low, medium and high concentrations of DZ action were selected to be 10, 20, and 40 μmol·L-1. 2) Compared with the control group, medium and high concentration of DZ and E2 treatments significantly increased the content of TG and GLU in EpH4-Ev and supernatants and promoted the synthesis of lipid droplets (Plt;0.01). 3) Compared with the control group, the expression of glucose transporter carrier 1 (GLUT1) and β-casein were both highly significantly elevated after treatment with different concentrations of DZ (Plt;0.01); meanwhile, both DZ and E2 treatments increased the expression of fatty acid synthetase (FASN), cholesterol regulatory element-binding protein 1 (SREBP1), peroxisome proliferator-activated receptor γ(PPAR-γ), and acetyl coenzyme A carboxylase (ACC) expression. 4) Compared with the control group, the proportion of cells in G2/M phase and S phase, the expression of proliferating cell nuclear antigen (PCNA), cell cycle proteins D1 and D3 (CyclinD1 and D3), and anti-apoptotic protein Bcl-2 were increased after treatment with different concentrations of DZ and E2, and the medium concentration of DZ group highly significantly increased the Bcl-2/Bax ratio (Plt;0.01) and decreased the apoptosis rate. 5) Compared with the control group, three concentrations of DZ and E2 treatment increased the phosphorylation levels of p-PI3K, p-mTOR, p-AKT and promoted the activation of the PI3K/AKT-mTOR signaling pathway. These results suggested that DZ can promote the proliferation of mammary epithelial cells and the synthesis of milk components. The mechanism is related to the up-regulation of the expression of cell proliferation proteins, the reduction of apoptosis rate, and the activation of PI3K/AKT-mTOR pathway.
Key words: phytoestrogen; daidzein; mouse mammary epithelial cells; milk component synthesis; mammary epithelial cell proliferation
*Corresponding author:" ZHANG Yuanshu, E-mail: zhangyuanshu@njau.edu.cn
乳腺是哺乳动物乳汁合成和分泌的场所,乳汁作为哺乳动物初生后代的主要营养来源,为后代的生长发育提供营养。乳腺上皮细胞(mammary epithelial cells, MECs)发挥分泌功能,使乳腺产生乳汁,其数量及分泌活性是影响乳腺泌乳量的重要因素之一。另外,乳腺上皮细胞的增殖和凋亡与泌乳和乳腺发育密切相关对乳汁生产至关重要[1]。乳汁的主要成分为乳糖、乳脂和乳蛋白[2]。乳糖是主要的能量来源,是影响乳产量高低的决定因素。乳脂含量是衡量乳品质的重要指标之一,其在乳汁能量分配方面也发挥着核心作用。乳蛋白包含机体大部分的必需氨基酸,同样是衡量乳品质量的重要指标。乳成分和泌乳量作为衡量乳用动物生产性能和乳品质量的重要指标,直接影响着乳用动物的养殖经济效益。乳腺是乳用动物泌乳的唯一场所,它的健康发育直接关系母畜后期泌乳的乳品质。对乳腺的泌乳及乳成分进行研究具有十分重要的意义。
有研究指出,雌激素可以通过刺激垂体前叶合成并释放PRL,共同调控乳成分的合成[3]。Chu等[4]研究发现,17-β-雌二醇(17-β-estradiol, E2)通过调节脂质合成酶促进乳腺上皮细胞的脂质合成。Burgos等[5]研究发现,在奶牛乳腺上皮细胞培养基中添加催乳素(PRL)、雌激素(E)、胰岛素和氢化可的松等能够提高乳蛋白的合成量。Tucker等[6]研究发现,一定量的雌激素可以刺激泌乳,而过量的雌激素会抑制泌乳。但是,雌激素在体内易残留且有毒害作用,易导致乳腺发育不全,寻找雌激素的替代品是一个新的思路和方向。
植物雌激素是在各种植物来源中发现的类雌激素化合物,其中的大豆黄酮(daidzein, DZ)属于异黄酮类植物雌激素,其结构与E2相似。有研究发现,其可以与雌激素受体相互作用,在体内发挥雌激素或抗雌激素活性[7]。另有研究表明,DZ可与多种激素协同作用促进乳腺泌乳及酪蛋白的合成[8]。谢娜娜等[9]及本实验室前期研究均发现DZ可促进乳腺上皮细胞的增殖和乳腺发育[10],显示了DZ在调控乳腺发育方面的开发潜力。但至目前,关于DZ对乳成分合成的影响及机理方面的研究较少,所得的结果尚不一致。本试验拟以DZ处理小鼠乳腺上皮细胞EpH4-Ev,研究DZ对EpH4-Ev乳成分合成及细胞增殖的影响,并通过PI3K/AKT-mTOR信号通路初步探讨其作用机制,旨在为DZ调控乳成分合成提供理论数据资料,同时为进一步在乳用动物和奶业生产中植物雌激素大豆黄酮的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆黄酮(daidzein, DZ)由南京农业大学韩正康教授赠送(纯度≥98%);Cell Counting Kit-8(CCK8)试剂盒购自上海陶术生化科技有限公司;细胞裂解液RIPA、蛋白酶抑制剂PMSF均购自南京碧云天生物技术有限公司;甘油三酯(TG)、葡萄糖(GLU)检测试剂盒均购自南京建成科技有限公司;小鼠乳腺上皮细胞专用培养基购自武汉普诺赛生命科技有限公司;细胞凋亡及细胞周期检测试剂盒均购自上海翌圣生物科技公司;尼罗红(Nile Red)染料购自MCE公司等。
细胞周期蛋白CyclinD1、CyclinD3、β-tubulin抗体均购自南京巴傲得生物科技有限公司;乙酰辅酶A羧化酶(ACC)、Bax、Bcl-2、mTOR、p-mTOR抗体均购自Cell Signaling Technology公司;葡萄糖转运载体1(GLUT1)、增殖细胞核抗原(PCNA)抗体均购自武汉三鹰公司;PI3K、p-PI3K、AKT、p-AKT、过氧化物酶体增殖物激活受体γ(PPAR-γ)、β-酪蛋白(β-casein)抗体均购自Immunoway公司;脂肪酸合成酶(FAS)抗体购自武汉赛维尔生物科技公司;胆固醇调节元件结合蛋白1(SREBP1)抗体、羊抗兔IgG购自武汉爱博泰克生物科技有限公司。ECL显色液、细胞凋亡与细胞周期试剂盒均购自翌圣生物科技公司等。
1.2 仪器与设备
POWER-PAC 300 电泳仪(BIO-RAD,美国)、POWER-PACHC 转印仪(BIO-RAD,美国)、Tanon-3900 全自动化学发光图像分析系统(上海 Tanon 科技有限公司,中国)、Tecan Spark 多功能酶标仪(Tecan,瑞士);EVOS M7000 倒置荧光显微镜(Thermo Fisher Scientific 公司,美国)、BECKMAN-CytoFLEX流式细胞仪(BECKMAN,美国)等。
1.3 细胞及培养
小鼠乳腺上皮细胞(EpH4-Ev)来自于实验室存种。常规法培养,使用专用培养基,37 ℃、5%CO 2条件下传代培养。所有细胞处理前均用未加胎牛血清的不完全培养基饥饿处理4 h。
1.4 试验分组及细胞处理
1.4.1 CCK-8法检测不同浓度DZ对乳腺上皮细胞活力的影响
参照谢娜娜等[9]的方法,采用CCK-8法检测乳腺上皮细胞活力。当96孔细胞培养板细胞长至80%左右,分别加入终浓度为0、2.5、5、10、20、40、80、160、1 000 μmol·L-1的DZ处理细胞6、12、24、48 h,更换基础培养基。每孔加入10 μL CCK-8试剂并置于细胞培养箱中继续培养1 h,在酶标仪上测定各孔450 nm波长下的吸光度(OD)值,按以下公式计算:
细胞活力=(样品孔吸光度-空白孔吸光度)÷(对照孔吸光度-空白孔吸光度)。
1.4.2 试验分组
正常消化细胞制成悬液,均匀接种于6孔细胞培养板中,待细胞长至80%左右,根据CCK-8试验确定的作用条件,如表1进行分组与处理,37℃、5%CO 2培养箱中培养12 h。阳性对照组以E2处理,每组均设3个重复。
1.5 指标测定
1.5.1 细胞甘油三酯和葡萄糖含量的测定
6孔板细胞处理12 h后终止培养,收集细胞上清后,使用裂解液刮下细胞并超声破碎。按甘油三酯和葡萄糖试剂盒说明书操作,分别在500及505 nm波长处测定OD值,按照说明书分别计算细胞上清及细胞内甘油三酯和葡萄糖的含量。
1.5.2 脂滴观察与含量的测定
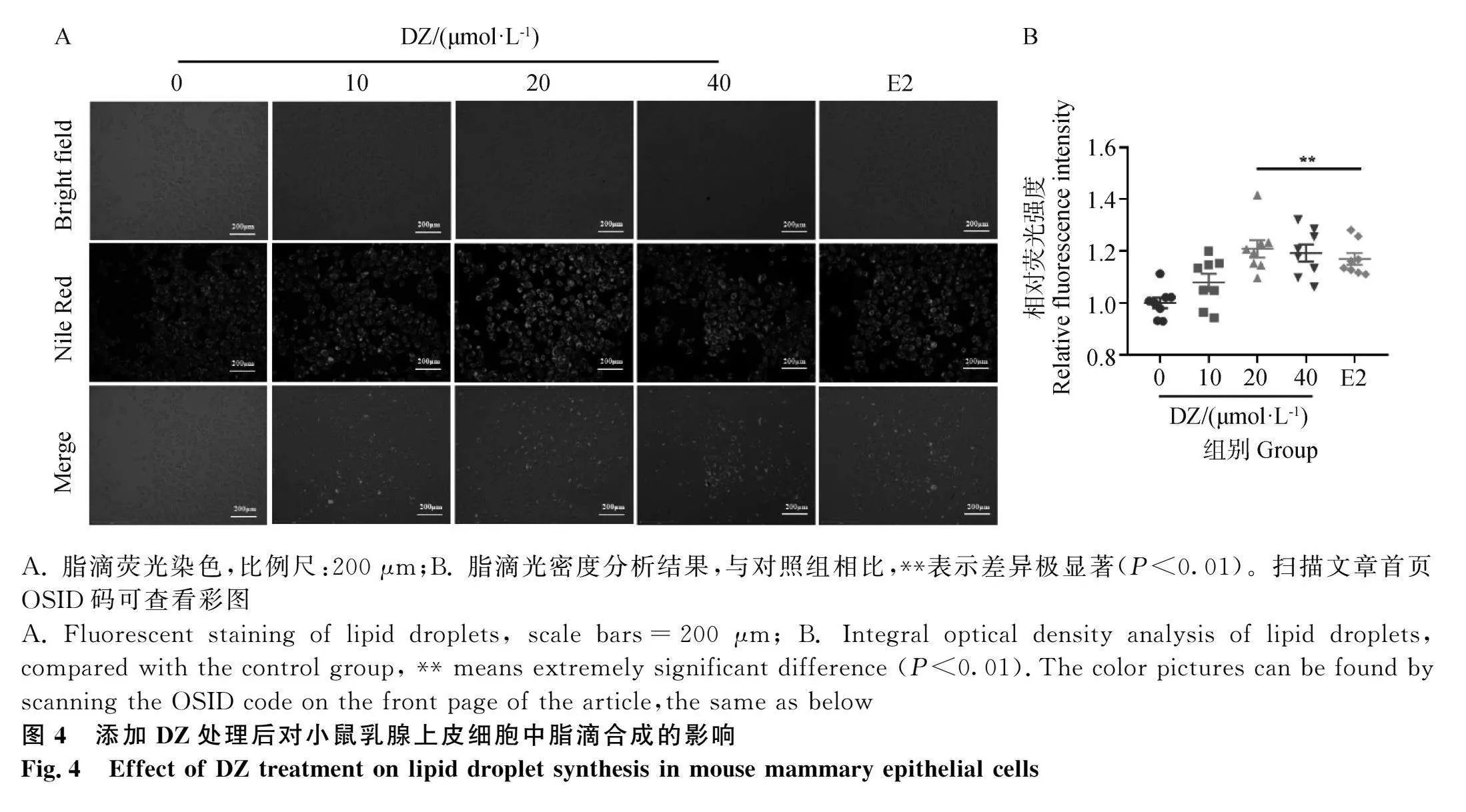
免疫荧光法检测。具体取长至80%左右的细胞正常消化,制成细胞悬液,均匀铺至96孔细胞培养板,待细胞长至70%左右,高、中、低三个浓度DZ处理12 h,每个浓度6个重复孔,处理结束后,每孔加入10 μL的尼罗红染料,37℃,孵育10 min。孵育结束后,用PBS洗涤,之后荧光显微镜下观察脂滴含量并结合Image J分析。
1.5.3 细胞增殖与凋亡、乳成分合成及PI3K/AKT-mTOR信号通路相关蛋白表达及磷酸化水平检测
采用Western blot法测定。具体操作如下:6孔板细胞处理12 h后终止培养,加入预冷的蛋白裂解液,并用细胞刮刀刮取细胞。4 ℃ 12 000 g离心10 min,收集细胞上清,BCA法测定蛋白浓度,统一浓度后加入蛋白上样缓冲液,100 ℃变性10 min制样。每孔上样10 μL,进行SDS-PAGE,然后湿转法将目的蛋白转移至PVDF膜。5%脱脂奶粉封闭2 h后,加入一抗CyclinD1、CyclinD3、ACC、mTOR、p-mTOR、β-casein、GLUT1、PCNA、FASN、SREBP1、PPAR-γ、Bax、Bcl-2、PI3K、p-PI3K、AKT、p-AKT(皆为1∶1 000稀释)及β-tubulin(1∶10 000稀释),抗体与蛋白条带在4 ℃孵育过夜。次日TBST漂洗,加入辣根过氧化物酶标记的1∶10 000羊抗兔IgG二抗,室温孵育2 h。洗涤后加入ECL发光液,全自动化学发光分析仪中检测,Image J软件分析各条带灰度值。以β-tubulin为内参比较并计算各目的条带相对灰度值。
1.5.4 流式细胞术检测DZ对乳腺细胞凋亡的影响
参照Kumar和Chauhan[11]的方法,流式细胞仪检测各处理细胞中凋亡水平的变化。具体步骤如下:细胞消化后,4℃ 300 g离心5 min,收集细胞;用预冷的PBS洗涤细胞两次,离心后收集细胞,用缓冲液重悬细胞。之后在每管细胞中加入染色工作液,室温避光孵育15 min,再次用缓冲液重悬细胞后上机检测。使用流式细胞仪和FlowJo_V10.0软件检测并分析细胞凋亡率和坏死率。
1.5.5 流式细胞术检测细胞周期分布情况
细胞处理结束后,消化并收集细胞,用预冷PBS洗涤细胞两次;弃去PBS,加入70%的预冷乙醇,4 ℃固定过夜;次日离心收集细胞,用PBS洗涤细胞后,加入PBS重悬细胞。之后加入2 μL的RNase A,37℃水浴30 min;再加入50 μL的碘化丙啶(PI)染色液,室温避光孵育20 min后上机检测,采用Modfit 5.0软件分析细胞周期分布。
1.6 数据统计与分析
数据均采用IBM SPSS 21.0软件进行方差分析(ANOVA),GraphPad Prism 8.0软件作图,试验结果均以“平均值±标准误(x-±s x-)”表示,Plt;0.05 表示差异显著,Plt;0.01 表示差异极显著。
2 结 果
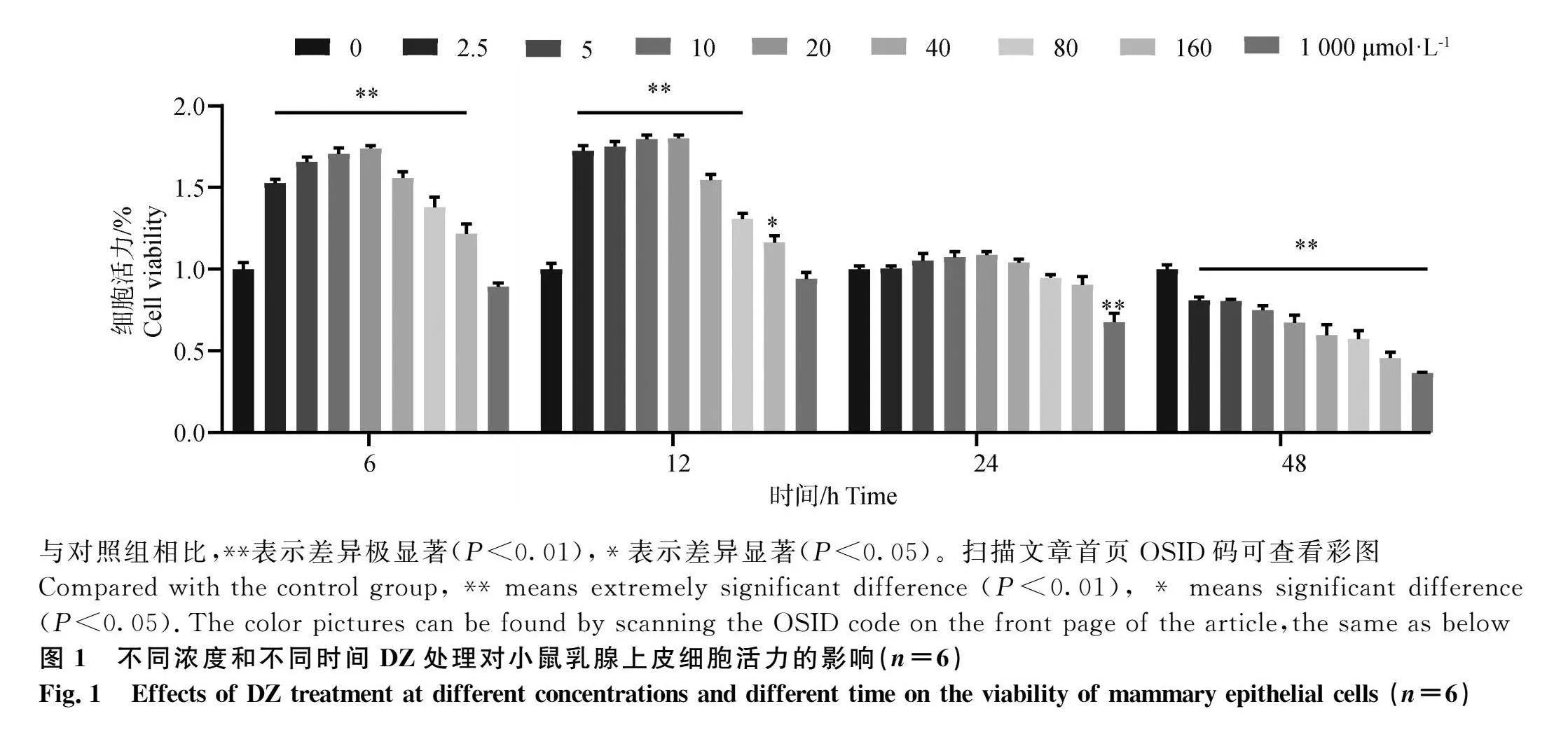
2.1 DZ对小鼠乳腺上皮细胞活力的影响
结果如图1 所示,与对照组相比,2.5~160 μmol·L-1的DZ处理EpH4-Ev细胞6、12、24 h均未引起细胞活力的显著下降,表明此条件DZ对小鼠EpH4-Ev细胞的无毒副作用;同时在2.5~80 μmol·L-1不同浓度DZ处理后,细胞活力均极显著提高(Plt;0.01),而处理48 h各浓度DZ处理均极显著降低了细胞活力(Plt;0.01)。综合实验室前期结果,本试验选择10、20及40 μmol·L-1 DZ浓度分别作为低、中、高浓度用于后续试验,处理时间选择12 h。
2.2 DZ处理对小鼠乳腺上皮细胞甘油三酯含量的影响
结果如图2所示,与对照组相比,DZ及E2处理后,EpH4-Ev分泌上清(图2A)及细胞(图2B)中的甘油三酯含量均有升高,中浓度和高浓度组极显著升高(P<0.01),且均高于E2处理组。
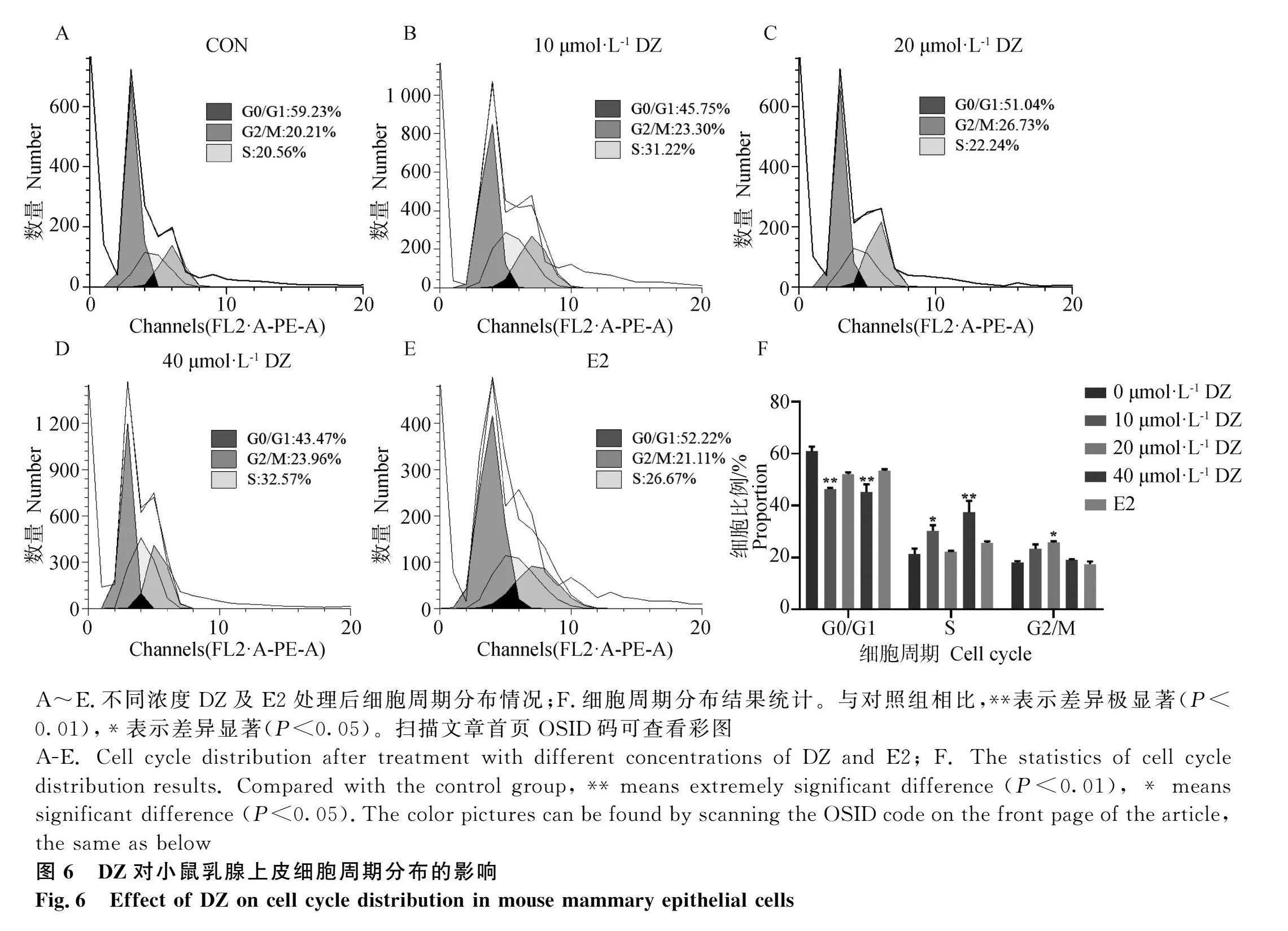
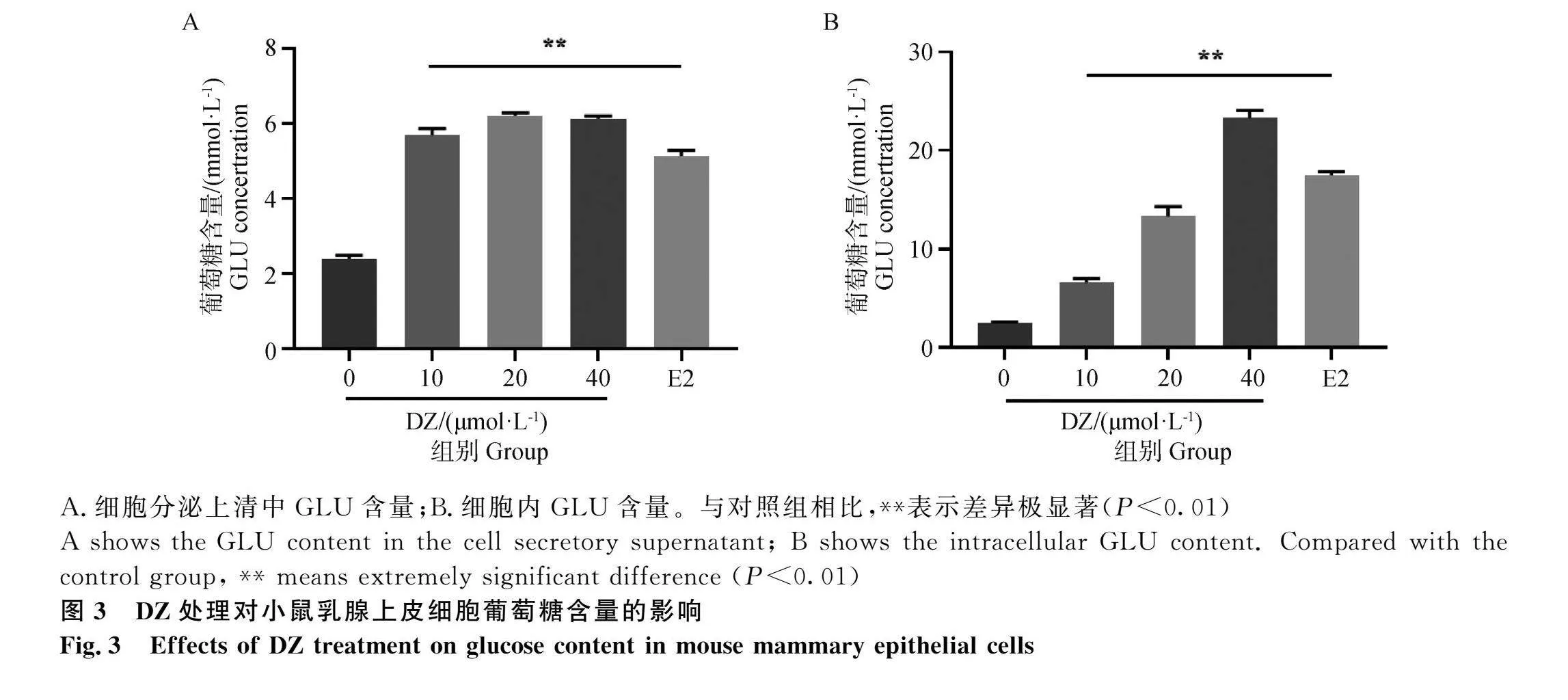
2.3 DZ处理对小鼠乳腺上皮细胞葡萄糖含量的影响
结果如图3所示,与对照组相比,DZ及E2处理后各组细胞分泌上清及细胞中葡萄糖含量均极显著升高(P<0.01),且随着DZ浓度提高,细胞中葡萄糖含量呈剂量依赖性升高。
2.4 DZ处理对小鼠乳腺上皮细胞脂滴合成的影响
结果如图4所示,根据所拍摄的荧光图,每组分别选取10个200倍放大的视野,利用Image J软件计算每个视野中脂滴的数量,最后结果以统计图的形式表示。乳脂可以脂滴的形式贮存起来,成份包括甘油三酯和胆固醇酯等。细胞脂滴染色情况结合脂滴光密度分析结果显示,与对照组相比,DZ及E2处理后小鼠乳腺上皮细胞中脂滴亮度明显提高且含量升高,中、高浓度DZ组脂滴含量极显著升高(P<0.01)。
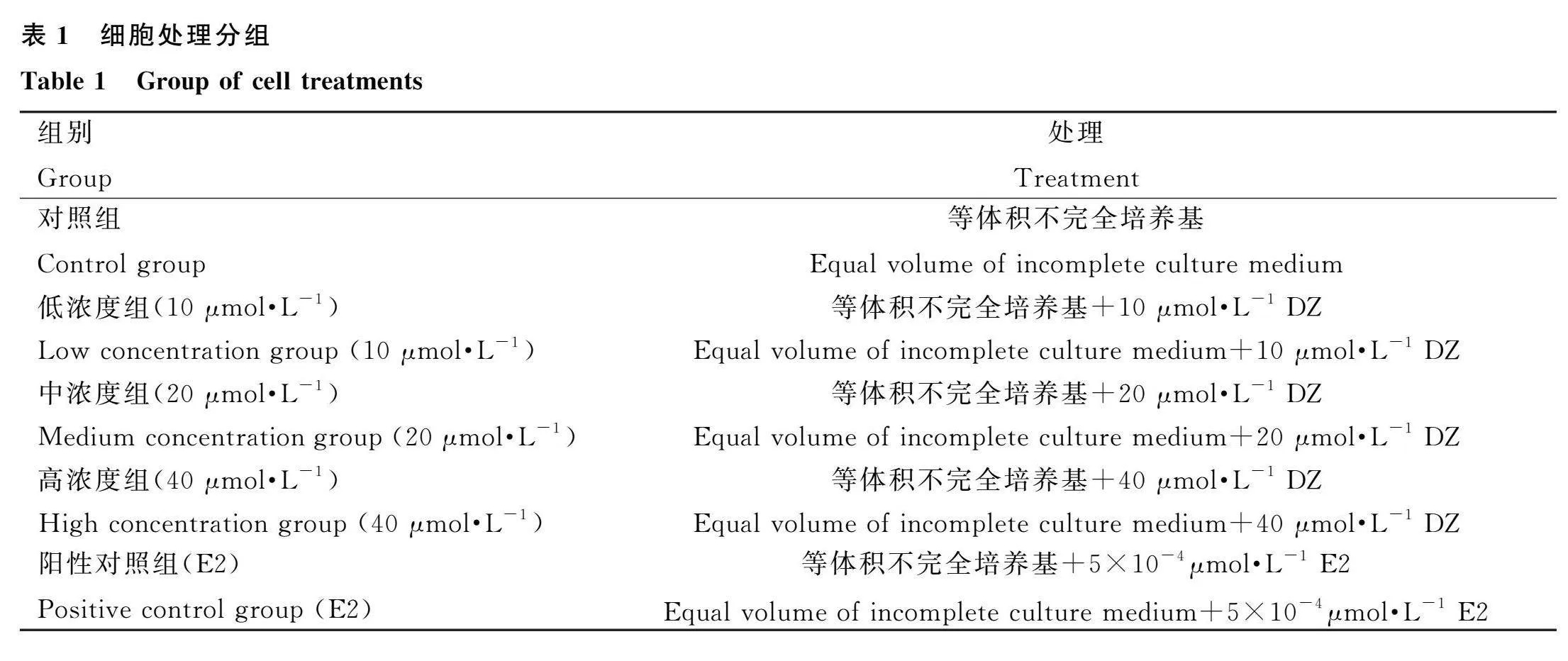
2.5 DZ处理对小鼠乳腺上皮细胞乳成分合成相关蛋白表达的影响
结果如图5A所示。葡萄糖转运载体1作为小鼠乳腺中主要的葡萄糖转运载体,能促进葡萄糖转运入胞,进而合成乳糖。与对照组相比,DZ及E2处理后GLUT1的表达均极显著升高(P<0.01),且随着DZ浓度的升高,其表达呈剂量依赖性提高。
β-酪蛋白作为乳蛋白中含量最多的一种蛋白,其表达情况反映了乳蛋白的合成情况。与对照组相比,DZ及E2处理后β-casein表达均极显著升高(P<0.01),且中浓度组最为显著,随DZ浓度的进一步升高,其表达开始降低(图5B)。
乳脂合成相关蛋白FASN、ACC、SREBP1、PPAR-γ的表达结果见图5C~F,DZ及E2处理后均提高了以上蛋白的表达,中浓度组极显著提高了FASN、SREBP1、PPAR-γ的表达(P<0.01),高浓度组极显著提高了FASN、ACC、SREBP1的表达(P<0.01)。
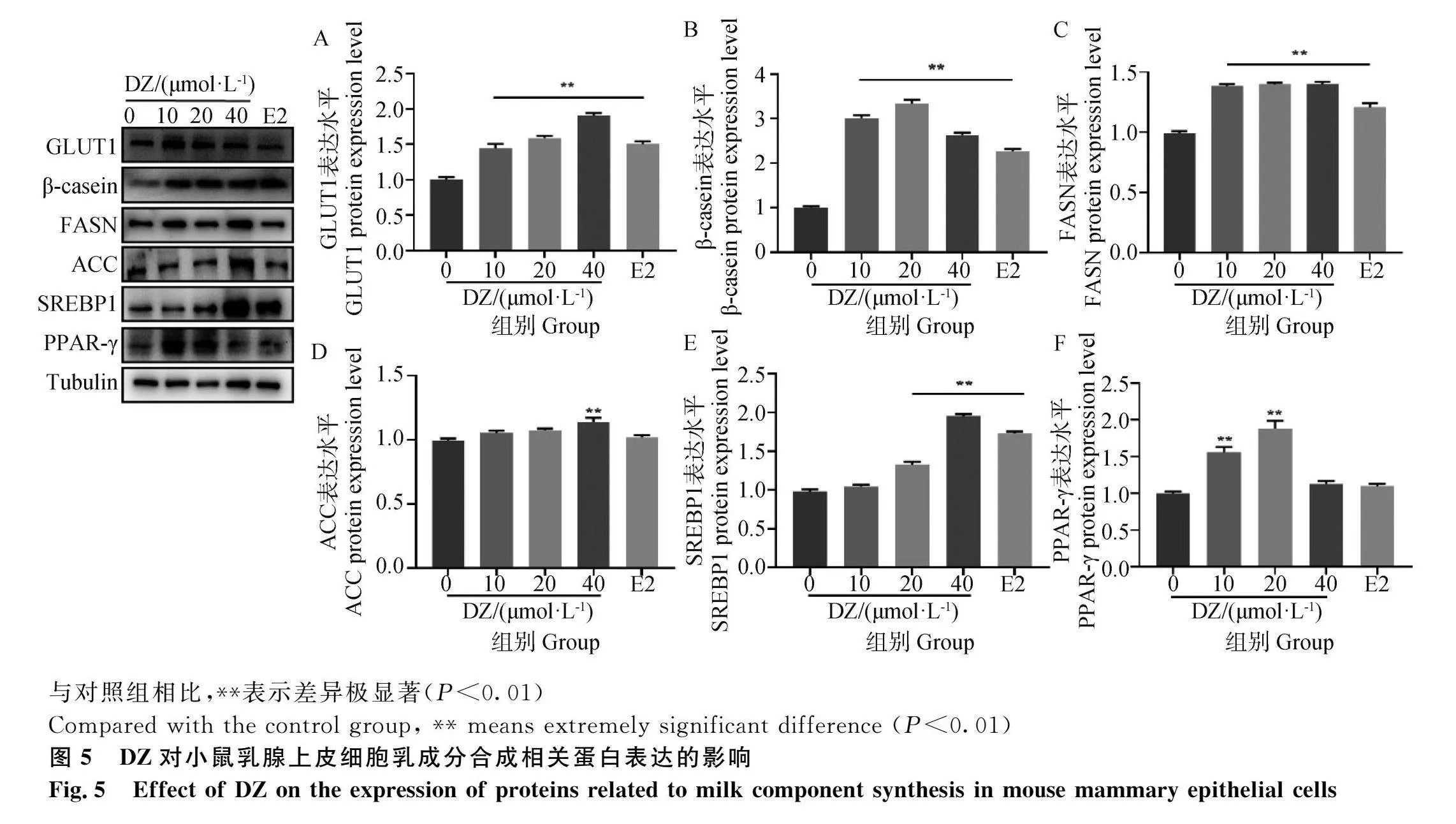
2.6 DZ处理对小鼠乳腺上皮细胞周期分布的影响
DZ处理对乳腺上皮细胞周期分布的变化结果如图6所示。与对照组相比,各浓度DZ处理组及E2均降低了G0/G1期细胞占比,增加了S期和G2/M期细胞比例。其中低浓度及高浓度组均极显著降低了G0/G1期细胞占比(Plt;0.01),极显著增加S期比例(Plt;0.01);中浓度组显著增加G2/M期细胞占比(Plt;0.05)。E2组与中浓度组具有相同趋势,但对G2/M期细胞比例的增加未达到显著水平(Pgt;0.05)。
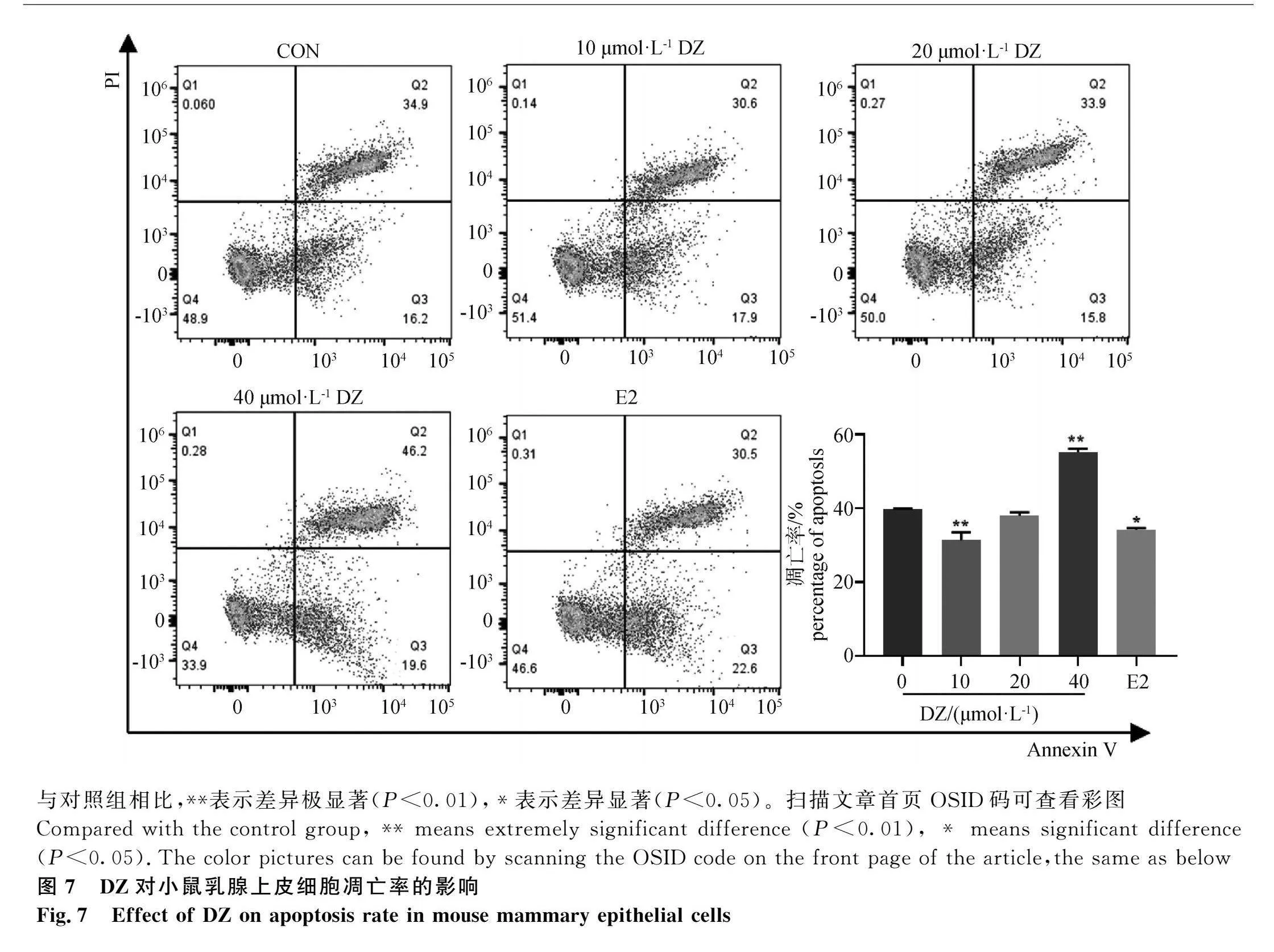
2.7 DZ处理对小鼠乳腺上皮细胞凋亡率的影响
DZ处理对乳腺上皮细胞凋亡率的变化结果如图7所示。Q1区(Annexin V-FITC)-/ PI+ 此区域为坏死细胞;Q2区(Annexin V-FITC)+/PI+ 此区域为晚期凋亡细胞;Q3区(Annexin V-FITC)+/PI- 此区域为早期凋亡细胞;Q4区(Annexin V-FITC)-/PI- 此区域为活细胞。Q2区与Q3区所占百分比表示细胞凋亡水平的变化。
与对照组相比,低浓度组DZ与E2组极显著或显著降低了细胞凋亡率(P<0.01或 P<0.05),中浓度组降低了凋亡率但差异不显著(P>0.05),而高浓度组极显著提高了细胞的凋亡率(P<0.01),促进细胞的凋亡。
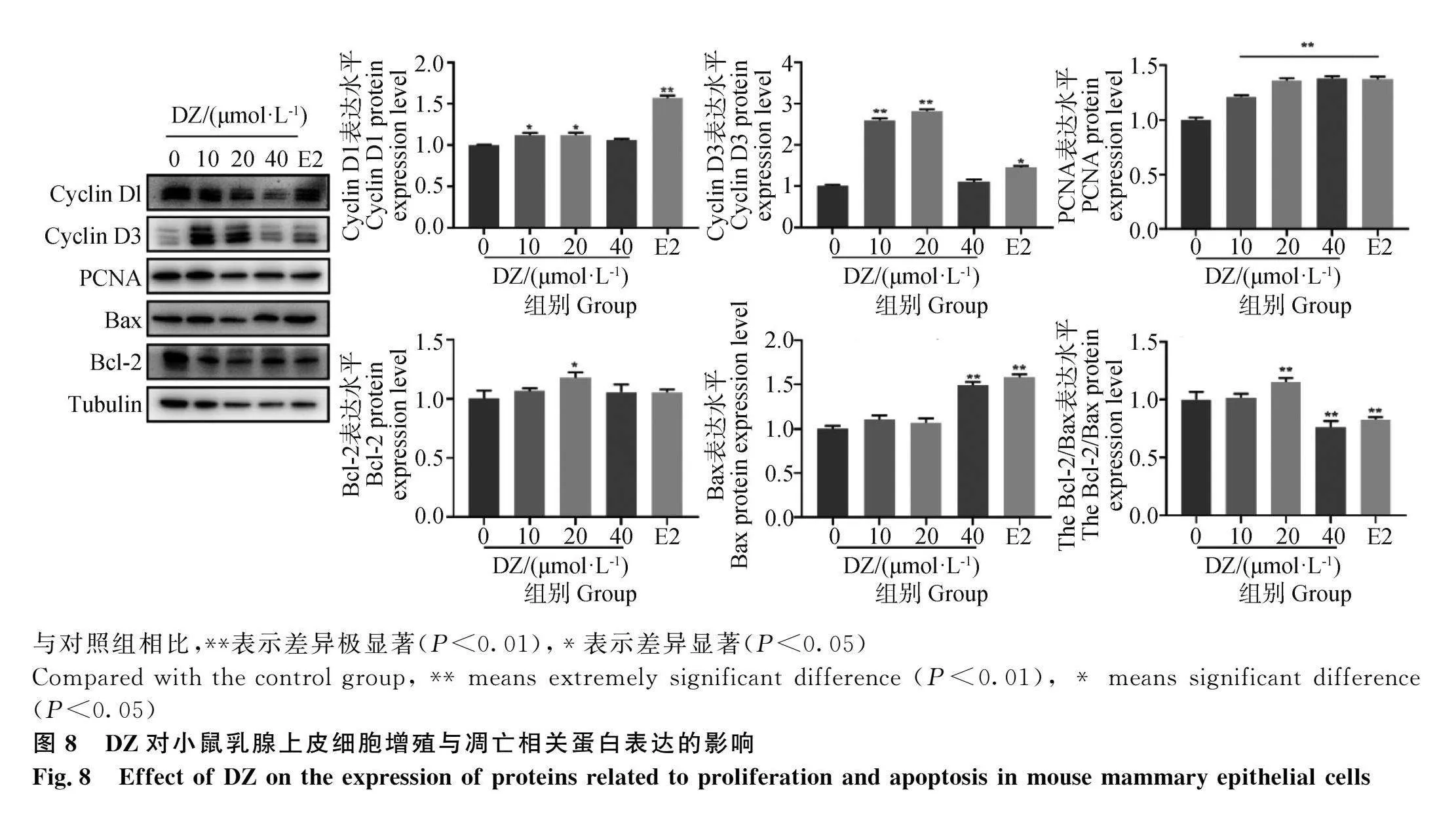
2.8 DZ处理对小鼠乳腺上皮细胞增殖与凋亡相关蛋白表达的影响
结果如图8所示,与对照组相比,DZ及E2处理后均提高了增殖相关蛋白的表达,其中不同浓度DZ及E2处理后均极显著提高了PCNA蛋白的表达(P<0.01);低浓度与中浓度组DZ及E2处理显著或极显著提高了细胞周期蛋白D1、D3的表达(P<0.05或P<0.01),高浓度组DZ处理后同样上调了两者的表达,但差异不显著(P>0.05)。
与对照组相比,DZ及E2处理后均提高了抗凋亡蛋白Bcl-2的表达,中浓度组DZ显著上调(P<0.05);高浓度组DZ与E2处理后极显著提高了凋亡蛋白Bax的表达(P<0.01);中浓度组极显著增加了Bcl-2/Bax比值(P<0.01),高浓度组及E2组极显著降低了Bcl-2/Bax比值(P<0.01)。
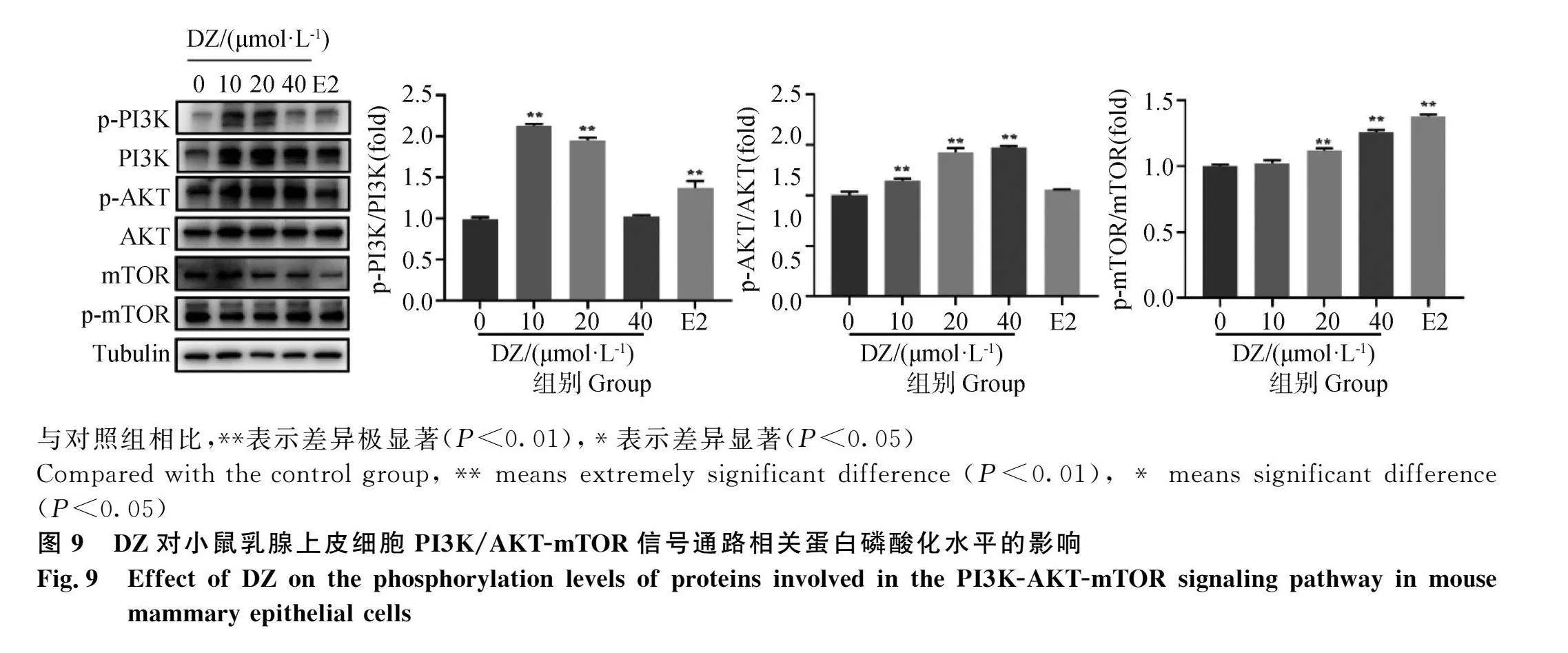
2.9 DZ处理对小鼠乳腺上皮细胞PI3K/AKT-mTOR信号通路相关蛋白磷酸化水平的影响
结果如图9所示,与对照组相比,三个浓度DZ处理均极显著增加了p-AKT的磷酸化水平(P<0.01),不同浓度DZ及E2处理后同样增加了p-PI3K和p-mTOR蛋白磷酸化水平,其中低浓度、中浓度组及E2处理组极显著促进了p-PI3K蛋白的磷酸化(P<0.01);中、高浓度组及E2处理组极显著促进了p-mTOR蛋白的磷酸化(P<0.01)。以上结果表明,中浓度组DZ极显著激活了PI3K-AKT-mTOR信号通路。
3 讨 论
3.1 DZ对小鼠乳腺上皮细胞增殖与凋亡的影响
细胞增殖是生物体生长、发育、繁殖和遗传的基础。乳腺发育过程中,细胞增殖与分化对乳腺组织的生长和泌乳均发挥了重要调控作用。乳腺上皮细胞的数量与泌乳量密切相关,促进乳腺上皮细胞的增殖可以增加泌乳量[2]。细胞周期蛋白D1、D3(Cyclin D1、D3)和增殖细胞核抗原(PCNA)作为细胞增殖标志物,在调控细胞增殖中发挥重要作用[12]。Cyclin D是有丝分裂的重要传感器,可通过与细胞周期蛋白依赖性蛋白激酶CDK4或CDK6结合,控制G1、G1/S期的转换,从而启动DNA复制[13]。其中Cyclin D1、Cyclin D3是Cyclin D的两个重要亚型,是调节细胞周期G1-S期进程的关键周期蛋白。细胞增殖抗原PCNA是一种在DNA损伤和修复中起主要作用的核蛋白。
有研究发现PCNA在S期表达显著增加,可作为DNA聚合酶δ的辅助蛋白,促进DNA复制[14]。另有研究发现雌激素E2在哺乳动物乳腺发育过程中具有重要作用,可调节导管形态发生,促进乳腺上皮细胞增殖[15]。DZ作为植物雌激素,具有相似的促进细胞增殖作用。刘春龙等[10]发现,DZ在一定浓度范围内显著促进奶牛乳腺上皮细胞增殖。异黄酮类植物雌激素可通过影响细胞周期相关蛋白信号通路来影响乳腺的发育[16]。研究发现DZ可通过上调Cyclin D1蛋白的表达并增加G2/M期细胞占比从而促进乳腺上皮细胞的增殖[9,17]。本研究结果发现,DZ处理后提高了小鼠乳腺上皮细胞中Cyclin D1、D3、PCNA蛋白的表达量,同时提高了G2/M期和S期细胞的占比,促进乳腺上皮细胞的增殖,与以往研究结果一致,提示着DZ处理可促进小鼠乳腺上皮细胞增殖。
细胞的增殖和凋亡是一个动态平衡的过程。Bcl-2相关蛋白是影响细胞凋亡的细胞内信号介导者,抗凋亡Bcl-2基因缺乏会加速细胞凋亡,促凋亡Bax基因缺失会延缓乳腺的退化[18]。在细胞内Bcl-2和Bax蛋白之间是相互拮抗的,细胞凋亡由Bcl-2/Bax比率的变化调节[19]。因此,通常用Bcl-2/Bax比值来检测细胞凋亡效应。Kumar和Chauhan[11]研究发现,DZ可通过介导细胞凋亡的内在途径影响Bax/Bcl-2蛋白的表达。本研究结果显示,中浓度DZ处理后显著上调了抗凋亡蛋白Bcl-2的表达,降低了凋亡蛋白Bax的表达,极显著增加了Bcl-2/Bax比值。同时经过流式细胞术检测 Annexin V 凋亡细胞所占百分比,发现中浓度的DZ可降低乳腺上皮细胞的凋亡率,促进细胞存活。综上结果表明,中浓度DZ 可有效抑制乳腺上皮细胞凋亡,促进乳腺上皮细胞增殖。
3.2 DZ对小鼠乳腺上皮细胞乳成分合成的影响
乳汁作为哺乳动物初生幼仔的主要营养来源,可以为幼仔提供必要的营养和具有生物活性的化合物,促进幼仔的生长发育,并增强机体免疫力[20]。各种哺乳动物乳汁中都包含蛋白质、脂肪、乳糖、无机盐和维生素等[2]。乳汁中的蛋白质主要为酪蛋白(casein),占比高达80%,包括αS、β、γ和κ等不同表型[21]。其中β-casein是乳中主要的酪蛋白,可通过检测酪蛋白的表达量来判断乳腺细胞的乳蛋白合成能力[2] 。Tsugami等[22]研究发现异黄酮及其代谢物可以促进乳腺上皮细胞表达和分泌酪蛋白。本研究结果显示不同浓度DZ处理后均极显著提高了小鼠乳腺上皮细胞中β-casein蛋白的表达,其中以中浓度DZ影响效果最为显著。
乳糖作为乳汁中重要的组成成分,是控制乳汁体积的关键,Shahbazkia等[23]研究发现乳糖合成水平与泌乳量、乳蛋白以及总固形物产量正相关。乳糖的生物合成主要在乳腺上皮细胞中的高尔基体内进行,以葡萄糖作为乳糖合成的主要前体物,能够为乳糖提供80%~85%的碳源[24]。由于乳腺内缺少葡萄糖-6-磷酸酶,不能通过糖异生合成葡萄糖,乳腺内所需的葡萄糖主要从细胞外摄取。GLUT1是小鼠乳腺中主要的葡萄糖转运载体,当GLUT1表达下调时,会导致用于合成乳糖的葡萄糖利用率降低[25]。本研究发现DZ处理后极显著提高了小鼠乳腺上皮细胞中及细胞分泌的葡萄糖的含量,同时极显著提高了GLUT1蛋白的表达,提示:DZ对乳腺上皮细胞转运及利用葡萄糖具有促进作用,从而促进乳糖的合成。
脂类为乳中重要营养成分之一,其主要成分为甘油三酯(triglyceride, TG),在乳脂中质量百分比约占98%。甘油和葡萄糖代谢途径中产生的脂肪酸合成甘油三酯,随后在内质网中形成脂滴,在脂质包裹下释放入腺泡腔中,乳脂主要以与膜结合的小球形式存在[2]。甘油三酯在很大程度上决定了乳脂的合成量,因此常用作乳脂含量的指标。在乳脂合成和分泌过程中,涉及许多基因的表达调控,其中PPAR γ和SREBP1是乳脂合成相关基因网络中关键的转录调控因子。研究表明,激活的SREBP1可通过结合脂肪酸合成酶ACC、FAS等基因的应答元件,从而激活脂肪生成基因的转录以及乳腺上皮细胞中脂肪酸从头合成和三酰基甘油积累,促进乳脂合成[26-27] 。PPAR γ作为乳脂合成的正调节因子,在乳成分合成过程中,能增加乳腺上皮细胞内TG的含量[28],同时通过调节乳腺中生脂相关基因的表达及SREBP1的表达继而促进乳脂的合成[29-30]。本研究结果发现,DZ处理后显著提高了乳腺上皮细胞内及细胞分泌的甘油三酯的含量及脂滴含量,同时上调了乳脂合成相关蛋白ACC、FASN、SREBP1、PPAR-γ的表达,提示DZ具有促进乳脂合成的作用,且这种作用与PPAR γ和SREBP1的激活有关。
3.3 DZ对PI3K/AKT-mTOR信号通路的影响
PI3K/AKT-mTOR信号通路参与细胞存活、生长增殖和组织器官的形成等多种生命进程。AKT被PI3K激活并发生磷酸化后,可作用于mTOR信号转导调节细胞生长;同时通过激活并磷酸化CDK的抑制剂p21和p27,进而影响细胞增殖。此外AKT是细胞存活的主要调节因子,通过直接抑制促凋亡蛋白(如Bad)或抑制转录因子(如FoxO1)产生促凋亡的信号实现调节[31]。研究发现过表达 AKT可促进乳腺癌细胞的增殖[32]。在乳腺上皮细胞中该信号通路主要调节乳腺上皮细胞的增殖与生长[33],此外研究发现该通路可调控乳蛋白合成相关基因的表达,同时参与乳脂合成的调控过程,提高乳脂合成信号通路的转导[34]。此外,该信号通路还涉及到乳糖合成相关基因的表达调控。研究发现SIRT7可调控奶牛乳腺上皮细胞中乳蛋白、乳脂和乳糖合成的关键基因表达,而这些调控作用可能与PI3K/AKT-mTOR信号通路有关[28]。Yu等[17]研究发现DZ可通过NFκB1激活来增强mTOR-CyclinD1-SREBP-1c信号通路,从而促进乳汁合成和奶牛乳腺上皮细胞的增殖。谢娜娜等[9]研究发现,DZ可通过激活PI3K-GSK3β-AKT信号通路来促进牛乳腺上皮细胞的增殖。另有研究表明,DZ可通过激活PI3K/AKT信号通路促进细胞增殖[35]。目前关于DZ、PI3K/AKT-mTOR信号通路及乳成分合成三者之间的研究较少,多集中于DZ与该通路在乳腺癌的防治研究中。本研究结果发现,不同浓度DZ及E2处理后均增加p-PI3K、p-AKT、p-mTOR蛋白磷酸化水平,激活PI3K-AKT-mTOR 信号通路,其中以中浓度(20 μmol·L-1)DZ效果最为显著;同时DZ处理后乳脂乳糖乳蛋白等乳成分的合成均在增加,猜测DZ可能是通过激活PI3K/AKT-mTOR通路来促进乳成分合成。
4 结 论
植物雌激素DZ可通过激活PI3K/AKT-mTOR信号通路促进小鼠EpH4-Ev乳腺上皮细胞的增殖、乳蛋白及乳脂的合成,可促进葡萄糖转运入胞及利用,共同促进乳成分合成。以20 μmol·L-1 DZ浓度时,效果较好。
参考文献(References):
[1] BOUTINAUD M, HERVE L, QUESNEL H, et al. Review:the cellular mechanisms underlying mammary tissue plasticity during lactation in ruminants[J]. Animal, 2019, 13(Suppl 1):s52-s64.
[2] 李庆章. 乳腺发育与泌乳生物学[M]. 北京:科学出版社, 2009.
LI Q Z. Development and lactation biology of mammary gland[M]. Beijing: Science Press, 2009. (in Chinese)
[3] SCULLY K M, GLEIBERMAN A S, LINDZEY J, et al. Role of estrogen receptor-α in the anterior pituitary gland[J]. Mol Endocrinol, 1997, 11(6):674-681.
[4] CHU M Q, ZHAO Y, YU S, et al. MicroRNA-221 may be involved in lipid metabolism in mammary epithelial cells[J]. Int J Biochem Cell Biol, 2018, 97:118-127.
[5] BURGOS S A, DAI M, CANT J P. Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J]. J Dairy Sci, 2010, 93(1):153-161.
[6] TUCKER H A. Hormones, mammary growth, and lactation:a 41-year perspective[J]. J Dairy Sci, 2000, 83(4):874-884.
[7] ALSHEHRI M M, SHARIFI-RAD J, HERRERA-BRAVO J, et al. Therapeutic potential of isoflavones with an emphasis on daidzein[J]. Oxid Med Cell Longev, 202 2021:6331630.
[8] TSUGAMI Y, SUZUKI N, SUZUKI T, et al. Regulatory effects of soy isoflavones and their metabolites in milk production via different ways in mice[J]. J Agric Food Chem, 2020, 68(21):5847-5853.
[9] 谢娜娜, 闫书平, 张崇昊, 等. 植物雌激素大豆黄酮对牛乳腺上皮细胞增殖及细胞周期的影响[J]. 动物营养学报, 2022, 34(4):2645-2653.
XIE N N, YAN S P, ZHANG C H, et al. Effects of phytoestrogen daidzein on proliferation and cell cycle of bovine mammary epithelial cells[J]. Chinese Journal of Animal Nutrition, 2022, 34(4):2645-2653. (in Chinese)
[10] 刘春龙, 李忠秋, 张 帆, 等. 大豆黄酮和染料木素对体外培养奶牛乳腺上皮细胞增殖及抗氧化水平的影响[J]. 畜牧兽医学报, 2008, 39(11):1517-1522.
LIU C L, LI Z Q, ZHANG F, et al. Effect of daidzein and genistein on proliferation and antioxidation of mammary epithelial cell of dairy cow in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(11):1517-1522. (in Chinese)
[11] KUMAR V, CHAUHAN S S. Daidzein induces intrinsic pathway of apoptosis along with ER α/β ratio alteration and ROS production[J]. Asian Pac J Cancer Prev, 202 22(2):603-610.
[12] LI W, LONG X Y, LI F, et al. Lysine stimulates the development of the murine mammary gland at puberty via PI3K/AKT/mTOR signalling axis[J]. J Anim Physiol Anim Nutr (Berl), 2022, 106(6):1420-1430.
[13] SHERR C J. Surprising regulation of cell cycle entry[J]. Science, 2019, 366(6471):1315-1316.
[14] FAN L, BI T H, WANG L X, et al. DNA-damage tolerance through PCNA ubiquitination and sumoylation[J]. Biochem J, 2020, 477(14):2655-2677.
[15] 王雯竞, 吴 霄, 臧旭鹏, 等. 哺乳动物乳腺发育调控机制的研究进展[J]. 畜牧与兽医, 2022, 54(1):137-143.
WANG W J, WU X, ZANG X P, et al. Progress in research on the regulation mechanism of mammary gland development in mammals[J]. Animal Husbandry amp; Veterinary Medicine, 2022, 54(1):137-143. (in Chinese)
[16] GUO J L, WANG Q L, ZHANG Y, et al. Functional daidzein enhances the anticancer effect of topotecan and reverses BCRP-mediated drug resistance in breast cancer[J]. Pharmacol Res, 2019, 147:104387.
[17] YU M M, QI H, GAO X J. Daidzein promotes milk synthesis and proliferation of mammary epithelial cells via the estrogen receptor α-dependent NFκB1 activation[J]. Anim Biotechnol, 2022, 33(1):43-52.
[18] METCALFE A D, GILMORE A, KLINOWSKA T, et al. Developmental regulation of Bcl-2 family protein expression in the involuting mammary gland[J]. J Cell Sci, 1999, 112(Pt 11):1771-1783.
[19] ZHU C, WANG L L, ZHU J R, et al. OGR1 negatively regulates β-casein and triglyceride synthesis and cell proliferation via the PI3K/AKT/mTOR signaling pathway in goat mammary epithelial cells[J]. Anim Biotechnol, 202 32(5):627-636.
[20] 任发政. 乳的营养与健康[J]. 中国食品学报, 2020, 20(7):1-9.
REN F Z. Advances in milk nutrition and human health[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):1-9. (in Chinese)
[21] G B T K, BORATYN'SKI J. Potential of casein as a carrier for biologically active agents[J]. Top Curr Chem (Cham), 2017, 375(4):71.
[22] TSUGAMI Y, MATSUNAGA K, SUZUKI T, et al. Isoflavones and their metabolites influence the milk component synthesis ability of mammary epithelial cells through prolactin/STAT5 signaling[J]. Mol Nutr Food Res, 2017, 61(10):1700156.
[23] SHAHBAZKIA H R, AMINLARI M, TAVASOLI A, et al. Associations among milk production traits and glycosylated haemoglobin in dairy cattle; importance of lactose synthesis potential[J]. Vet Res Commun, 2010, 34(1):1-9.
[24] SUNEHAG A L, LOUIE K, BIER J L, et al. Hexoneogenesis in the human breast during lactation[J]. J Clin Endocrinol Metab, 2002, 87(1):297-301.
[25] BEN CHEDLY H, LACASSE P, MARNET P G, et al. Use of milk epithelial cells to study regulation of cell activity and apoptosis during once-daily milking in goats[J]. Animal, 201 5(4):572-579.
[26] LI N, ZHAO F, WEI C J, et al. Function of SREBP1 in the milk fat synthesis of dairy cow mammary epithelial cells[J]. Int J Mol Sci, 2014, 15(9):16998-17013.
[27] ZHANG M, ZHANG S Q, HUI Q, et al. β-Hydroxybutyrate facilitates fatty acids synthesis mediated by sterol regulatory element-binding protein1 in bovine mammary epithelial cells[J]. Cell Physiol Biochem, 2015, 37(6):2115-2124.
[28] 陈坤琳, 钱 勇, 蒋临正, 等. SIRT7对奶牛乳腺上皮细胞乳蛋白、乳脂和乳糖合成关键基因表达的调控[J]. 南京农业大学学报, 2019, 42(5):917-923.
CHEN K L, QIAN Y, JIANG L Z, et al. Effects of SIRT7 on the expression of key genes involved in lactoprotein, milk fat and lactosesynthesis in dairy cow mammary epithelial cells[J]. Journal of Nanjing Agricultural University, 2019, 42(5):917-923. (in Chinese)
[29] LIU L L, LIN Y, LIU L X, et al. Regulation of peroxisome proliferator-activated receptor gamma on milk fat synthesis in dairy cow mammary epithelial cells[J]. In Vitro Cell Dev Biol Anim, 2016, 52(10):1044-1059.
[30] MU T, HU H H, MA Y F, et al. Regulation of key genes for milk fat synthesis in ruminants[J]. Front Nutr, 202 8:765147.
[31] ERSAHIN T, TUNCBAG N, CETIN-ATALAY R. The PI3K/AKT/mTOR interactive pathway[J]. Mol BioSyst, 2015, 11(7):1946-1954.
[32] HINZ N, JCKER M. Distinct functions of AKT isoforms in breast cancer:a comprehensive review[J]. Cell Commun Signal, 2019, 17(1):154.
[33] PONNUSAMY A, SINHA S, HYDE G D, et al. FTI-277 inhibits smooth muscle cell calcification by up-regulating PI3K/Akt signaling and inhibiting apoptosis[J]. PLoS One, 2018, 13(4):e0196232.
[34] YU M M, WANG Y, WANG Z, et al. Taurine promotes milk synthesis via the GPR87-PI3K-SETD1A signaling in BMECs[J]. J Agric Food Chem, 2019, 67(7):1927-1936.
[35] JIN X, SUN J, YU B, et al. Daidzein stimulates osteogenesis facilitating proliferation, differentiation, and antiapoptosis in human osteoblast-like MG-63 cells via estrogen receptor-dependent MEK/ERK and PI3K/Akt activation[J]. Nutr Res, 2017, 42:20-30.
(编辑 白永平)
