氟通过自噬和铁死亡途径诱发肉鸡小肠氧化损伤
2025-01-27王艺侯露露方菲高林英谢淑敏王雨





摘 要: 随着人类工业、农业的不断发展,越来越多的氟化物通过饮水、药物、农药和杀菌剂进入生产生活和环境中,会对生活在相应地区的动物产生不利影响。为了探讨氟中毒导致肉鸡小肠损伤的相关作用,本研究通过氟化物饮食暴露建立动物试验模型进行后续验证。试验按照饲料中氟化钠暴露剂量水平分为对照组C(0 mg·kg-1)、低剂量氟组L(500 mg·kg-1)、中剂量氟组M(1 000 mg·kg-1)和高剂量氟组H(2 000 mg·kg-1),分别处理肉鸡6周,分析氟化物暴露对肉鸡小肠的影响。结果显示:随着氟化钠暴露浓度的增加,Nrf2增加(Plt;0.001),Keap1减少(Plt;0.001),HO-1减少(Plt;0.001),NQO1在高浓度组降低(Plt;0.01),Nrf2/HO-1通路被激活,但其下游抗氧化酶减少,提示发生了氧化应激;p-AKT和p-mTOR蛋白表达量显著升高(Plt;0.001),最后恢复正常甚至减少(Plt;0.05),而PI3K显著降低(Plt;0.001),提示PI3K/Akt/mTOR通路磷酸化被抑制;Beclin-1显著增加(Plt;0.001),ATG12变化不显著,LC3蛋白表达量显著高于对照组(Plt;0.05),提示自噬体加速形成和自噬流活化,p62蛋白与自噬底物蛋白结合,含量减少(Plt;0.001),表明自噬通路未受阻。同时FTH1降低(Plt;0.01),NCOA4升高(Plt;0.01),储铁蛋白降解释放出二价铁离子;ASCL4和ALOX12蛋白表达量升高(Plt;0.01),促进脂质过氧化过程;SLC7A11和GPX4蛋白表达量显著降低(Plt;0.001),细胞清除脂质过氧化物能力降低,易发生铁死亡。综上,氟化钠会干扰Nrf2-Keap1抗氧化途径,导致氧化应激,也会激活自噬,最终导致肉鸡小肠发生铁死亡。
关键词: 氟化钠;鸡;小肠;氧化应激;细胞自噬;铁死亡
中图分类号: S856.9"""" 文献标志码:A"""" 文章编号: 0366-6964(2025)01-0442-13
收稿日期:2024-02-19
基金项目:东北林业大学大学生创新训练计划项目国家级(202310225077);黑龙江省博士后科学基金项目(LBH-Z23057)
作者简介:王 艺(2001-),女,山东烟台人,本科,主要从事动物中毒病病理学研究,E-mail: wangyi@nefu.edu.cn
*通信作者:王 雨,主要从事野生动物疫病监测、动物中毒病病理学、食品安全和公共卫生学研究,E-mail: wangyu2013@nefu.edu.cn
Fluoride Induced Small Intestine Oxidative Damage in Broilers via Autophagy and Ferroptosis
WANG" Yi, HOU" Lulu, FANG" Fei, GAO" Linying, XIE" Shumin, WANG Yu*
(College of Wildlife and Protected Area, Northeast Forestry University, Harbin 150040," China)
Abstract: "With the continuous development of industrial and agriculture, more and more fluoride enters the production, life and environment through drinking water, medicines, pesticides and fungicides, which may have adverse effects on animals living in the area. In order to explore the related effects of fluoride poisoning on small intestinal injury in broilers, we established an animal experimental model through fluoride diet exposure for subsequent verification. Broilers were divided into control group C (0 mg·kg-1), low-dose fluoride group L (500 mg·kg-1), medium dose fluoride group M (1 000 mg·kg-1) and high-dose fluoride group H (2 000 mg·kg-1) according to the exposure dose level of sodium fluoride in feed. The effects of fluoride exposure on small intestine of broilers were analyzed. With the increase of sodium fluoride exposure concentration, Nrf2 increased (Plt;0.001), Keap1 decreased (Plt;0.001), HO-1 decreased (Plt;0.001), and NQO1 decreased in the high concentration group (Plt;0.01). The Nrf2/HO-1 pathway was activated, but its downstream antioxidant enzymes decreased, suggesting the oxidative stress may occur; the protein expression of p-AKT and p-mTOR increased significantly (Plt;0.001), and finally returned to normal or even decreased (Plt;0.05), while PI3K decreased significantly (Plt;0.001), suggesting that the phosphorylation of PI3K/Akt/mTOR pathway was inhibited; Beclin-1 was significantly increased (Plt;0.001), ATG12 was not significantly changed, and LC3 protein was significantly higher than the C group (Plt;0.05), indicating the autophagosomes formation and autophagy flow were accelerated, p62 protein combined with autophagy substrate protein (Plt;0.001), and the content decreased, indicating the authay pathway was not blocked. At the same time, FTH1 decreased (Plt;0.01), NCOA4 increased (Plt;0.01), and ferrous ions were released from the degradation of ferritin; ASCL4 and ALOX12 protein increased (Plt;0.01), which promoted the lipid peroxidation process; SLC7A11 and GPX4 protein significantly decreased (Plt;0.001), and the ability of scavenging lipid peroxide was reduced, which was prone to ferroptosis. Sodium fluoride interfered with the Nrf2 antioxidant pathway, leading to oxidative stress, also activate autophagy and ultimately lead to ferroptosis in the small intestine of broilers.
Key words: sodium fluoride; chicken; small intestine; oxidative stress; autophagy; ferroptosis
*Corresponding author:" WANG Yu, E-mail: wangyu2013@nefu.edu.cn
氟是周期表中最活泼的元素之一,属于卤族元素,在自然界中以氟化物的形式存在,如氟化钙和氟化钠。同时,作为一种生物必需的微量元素,氟在骨骼钙化和牙釉质形成的方面发挥了重要作用,一些地区将氟化物添加到饮用水中,以减少龋齿的发生。随着人类工业、农业的不断发展,越来越多的氟化物通过饮水、药物、农药和杀菌剂进入到环境和人类的生活区,被污染的水和粗饲料都被认为是导致氟中毒的主要因素[1]。对东北高氟地区的居民的饮水检测发现氟含量明显超标,有病人表现出氟斑牙和氟骨症临床症状,并伴有腰腿疼痛[2]。氟中毒的靶器官是骨骼和牙齿,正常摄入量的氟(小于1 mg·L-1)能够促进骨骼和牙齿正常发育,但长期过量摄入氟(大于1.5 mg·L-1)可能出现氟斑牙、氟骨症等氟中毒现象[3]。在氟化物高度污染的地区中,每天摄入少量有毒物质会对动物产生负面影响。研究发现,地方性氟中毒引起绵羊的慢性毒性,涉及骨骼、消化道、肝、肾、神经和生殖器官等[4-6]。同样的,生活在氟化物污染地区的动物,如牛、骆驼、驴和马等,在不同程度上均受到氟化物毒性影响[7]。
氟毒性的研究一直备受关注,其对畜牧业的影响也是。肉鸡是满足人类需求的肉类食品的重要来源,是畜牧业的重要组成部分,针对氟所致肉鸡毒性作用的研究逐渐增加。研究发现,高氟日粮暴露引起肉鸡贫血,损伤红细胞的膜完整性、运输氧气和二氧化碳的能力以及免疫黏附功能[8]。血液学指标是动物生理、病理和营养状况的良好标志,血液学参数的变化有可能用于阐明氟对肉鸡的毒性影响。胃肠道是经口毒物最早接触的器官,也是体内最大的免疫器官,其稳态有重要意义。研究发现,高浓度氟暴露会引起肠道菌群的紊乱,增加有害细菌[9]。日粮氟暴露后肉鸡小肠中IgA+细胞的数量和免疫球蛋白的含量下降,这最终可能影响肠道中的黏膜、体液免疫功能[10]。氟中毒能够通过调节B淋巴细胞瘤-2(B-cell lymphoma- Bcl-2)家族蛋白激活肉鸡盲肠扁桃体淋巴线粒体细胞凋亡途径[11]。小肠是动物重要的消化吸收器官,它在禽类养殖中决定了饲料转化率。氟的暴露也会抑制小肠的发育,可能损害肠道的正常功能[12]。同时,高浓度氟暴露会引起肉鸡小肠氧化应激,减少紧密连接蛋白的表达,导致十二指肠和空肠的肠黏膜通透性增加,最终降低了肉鸡的生长性能[13]。然而,氟对肉鸡小肠的毒性作用的研究很少,它的作用机制仍不清楚。
氧化应激是氟重要毒性作用之一。过量摄入氟导致卵巢颗粒细胞发生氧化应激,导致线粒体功能障碍[14]。氟暴露也会引起肉鸡小肠氧化应激,抑制NF-E2相关因子2(nuclear factor E2-related factor" Nrf2)途径,导致线粒体途径细胞凋亡[15]。Nrf2信号通路是经典的抗氧化防御途径。在正常生理情况下,Nrf2主要与它的胞质接头蛋白(Kelch-like ECH-associated protein "Keap1)结合在一起,以非活性形式存在于细胞质中。氧化应激刺激下Nrf2与Keap1解偶联,Nrf2活化进入细胞核,与Maf蛋白结合形成异质二聚体,二聚体与抗氧化原件结合,调控抗氧化酶活性,发挥抗氧化功能[16]。而氟的肠毒性与氧化应激之间的关系仍然未知。
细胞自噬是细胞通过分解和回收自身衰老损伤细胞器,来维持细胞内各种物质代谢的平衡,其中最常见的是大自噬[17]。正常情况下,雷帕霉素(mechanistic target of rapamycin,mTOR)磷酸化UNC-51样激酶1(Unc-51 like autophagy activating kinase "ULK1)复合体,抑制下游反应。当胞内外的刺激因子激活ULK1复合体时,解除抑制作用,自噬启动。ULK1复合体与Bcl-2同源结构域蛋白Beclin-1协同作用于自噬相关蛋白招募到前自噬体结构,自噬体逐渐延伸和成熟,在自噬体标志物微管相关蛋白轻链3(microtubule-associated proteins lightchain 3,LC3)作用下开始吞噬损伤细胞器、大分子等。成熟自噬体与溶酶体发生融合,形成自噬溶酶体,酸性水解酶降解产生的小分子,如氨基酸,被转运到细胞质,再次用于蛋白质的合成[17]。研究发现,氟暴露激活IL-17信号通路诱导小鼠肝脏凋亡和自噬,最终导致肝功能受损[18];也可能在大鼠神经系统中通过抑制溶酶体的生物发生,损害自噬降解途径[19]。氟对肉鸡小肠的毒性作用与自噬的关系尚不清楚。铁蛋白自噬属于蛋白质介导自噬中的一种,核受体共激活因子4 (nuclear receptor coactivator 4,NCOA4)与铁蛋白重链1(ferritin heavy chain "FTH1)介导铁蛋白进入自噬体,发生降解、释放二价铁离子,其堆积诱发铁死亡[20]。铁死亡是一种铁依赖性细胞程序性死亡,它的显著特征是二价铁离子堆积、脂质活性氧沉积及谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)大量失活[21-23]。研究发现,高氟暴露下诱导小鼠成骨细胞和睾丸间质细胞的铁死亡[24-25]。而氟中毒所致肉鸡小肠的毒性作用与铁死亡之间关系仍需继续探究。
目前氟中毒对肉鸡小肠毒性的相关机制研究较少,而氟中毒与铁死亡、细胞自噬存在密切联系。基于此,本研究通过相关指标的检测探究氟中毒致肉鸡小肠内氧化应激、细胞自噬和铁死亡之间的关系,旨在挖掘其中相关作用机制,也为氟的肠毒性研究提供基础数据。
1 材料与方法
1.1 添加剂和试剂
氟化钠购自上海市奉贤奉城试剂厂。4%多聚甲醛溶液、聚丙烯酰胺和曝光液购自美国biosharp公司。TRIzol购自美国Invitrogen公司。cDNA反转录试剂盒购自翌圣生物科技股份有限公司。HiScript II Q RT Super Mix试剂盒购自南京诺唯赞生物科技有限公司。SYBR green荧光定量染料购自瑞士Roche公司。十二烷基硫酸钠购自北京博奥拓达科技有限公司。BCA蛋白定量试剂盒和RIPA裂解液(强)购自北京碧云天生物技术有限公司。四甲基乙二胺(TEMED)购自赛默飞世尔科技(中国)公司。PVDF膜购自美国GE公司。
1.2 氟化钠暴露的肉鸡和样品采集
120只1日龄肉鸡购自中国威威有限公司,经过1周的适应后,随机分为4组(每组30只):对照组(C)的饲料氟化钠水平为0 mg·kg- 低氟组(L)为500 mg·kg- 中氟组(M)为1 000 mg·kg- 高氟组(H)为2 000 mg·kg- 饲喂6周,空腹1 d后,用乙醚麻醉处死试验肉鸡,收集小肠组织储存并用于后续试验。暴露剂量中“mg·kg-1”指的是每千克饲料中包含氟化钠的质量。L组暴露剂量的选择参考GB 13078—2017饲料卫生标准,肉用仔鸡、育雏鸡、育成鸡配方饲料中氟元素的国家标准限量小于250 mg·kg- M和H组在L组的暴露剂量上增加暴露剂量。试验期间,肉鸡均在标准环境下饲养,温度保持在22~25 ℃,湿度保持在55%~60%,12 h光照和黑暗循环,并且通风良好,饲料和饮用水供应充足。
1.3 肉鸡小肠的组织形态的光学观察
用4%多聚甲醛溶液固定肉鸡小肠组织,静置24 h,流水冲洗后进行脱水、透明和包埋处理。石蜡块在切片机上切成1 μm厚的切片,使用苏木精和伊红(Hamp;E)染色后在光学显微镜下观察。
1.4 肉鸡小肠的超微结构的电镜观察
2.5%戊二醛和1%四氧化锇中固定肉鸡小肠组织,2 h后用乙醇和丙酮对肉鸡小肠进行梯度脱水,然后包埋在树脂中,染色使用4%乙酸铀酰和0.5%柠檬酸铅。
通过透射电子显微镜观察样品。
1.5 实时定量聚合酶链反应(qRT-PCR)
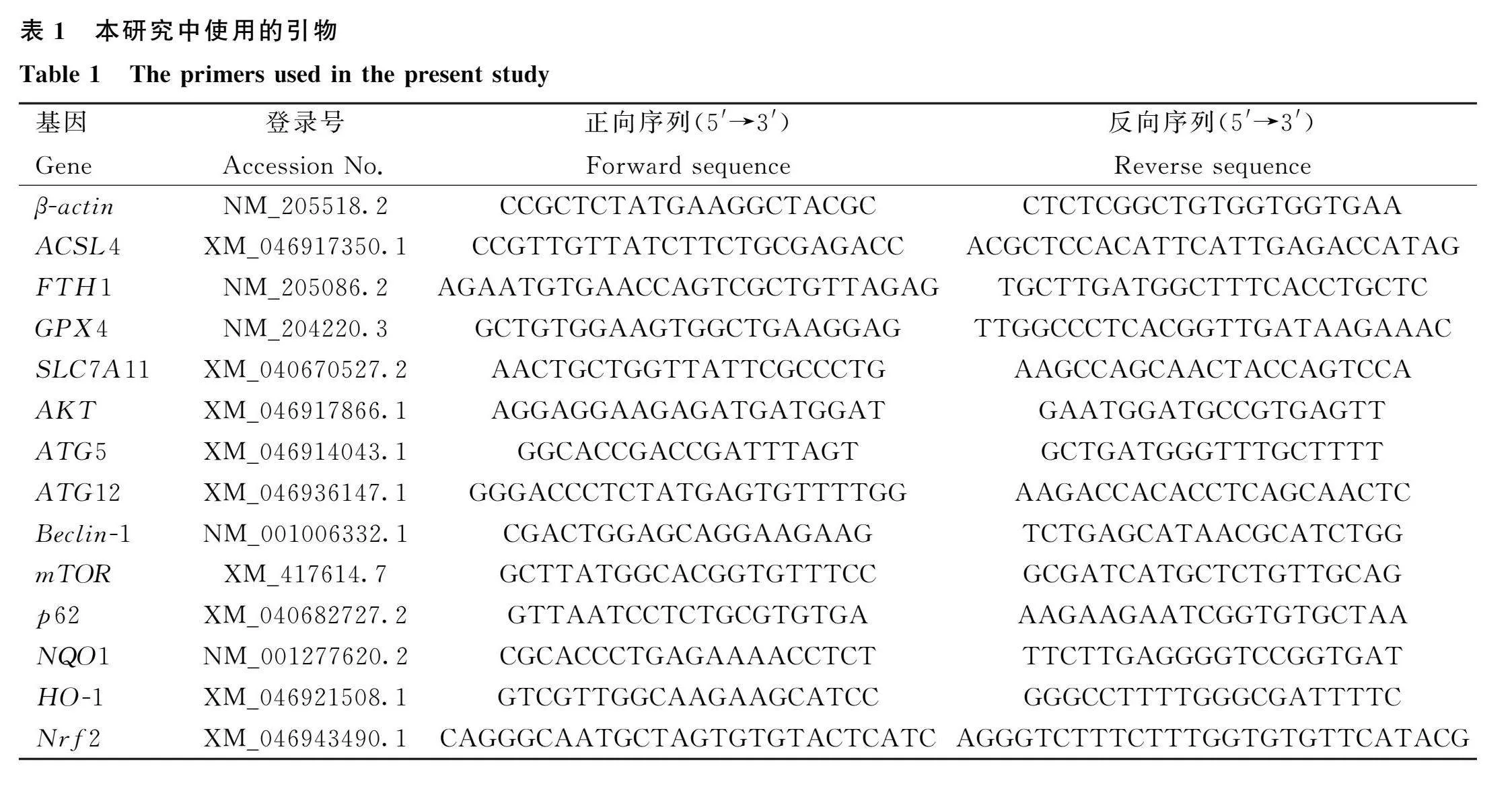
通过TRIzol方法从液氮冷冻肉鸡小肠组织中提取总RNA,并用于后续试验。通过Bio Spectrometer Basic分光光度计(Eppendorf, 德国)测量A 260 nm/A 280 nm的比例,以获得RNA的浓度和纯度。然后,使用逆转录试剂盒将RNA逆转录为cDNA。qRT-PCR在仪器ABI-7500(Applied Biosystems,美国)上使用HiScript II Q RT Super Mix试剂盒进行。每个反应的体积为10 μL。在National Coalition Building Institute查找基因序列,并使用Primer Premier 5.0软件(Premier,加拿大)设计引物。反应条件:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环。用2-△△Ct方法制备熔解曲线。引物序列如表1所示。
1.6 Western blot检测
将小肠组织放入RIPA裂解缓冲液提取组织和细胞蛋白,总蛋白浓度通过BCA法测定。蛋白质通过12% SDS-聚丙烯酰胺凝胶电泳分离。样品通过SDS-聚丙烯酰胺凝胶电泳进行解析后转移到PVDF膜上,5%脱脂牛奶封闭1 h后,4 ℃条件下一抗孵育过夜和使用偶联辣根过氧化物酶的二抗孵育膜,加曝光液检测特异性反应产物。抗体信息表如表2所示。
1.7 数据统计及分析
所有试验数据结果均以“平均值±平均值标准误差(SEM)”展示。本研究数据统计分析和制作图表使用SPSS 20.0.0.0分析软件和GraphPad 8.0.1软件。试验统计数据进行单因素方差分析(ANOVA),使用Tukey HSD 多重比较4组试验之间的显著性差异水平。所有试验均以95%的置信度进行分析,Plt;0.05为差异具统计学意义(其中*.Plt;0.05,**.Plt;0.0 ***.Plt;0.00 ns代表差异不显著Pgt;0.05)。
2 结 果
2.1 氟化钠对肉鸡小肠肠绒毛形态结构的影响
如图1所示,通过HE染色观察小肠显微结构的变化。C组中肠黏膜微绒毛结构正常,呈细长圆柱形,向肠腔内延伸,排列整齐。红色箭头指示L和M组中肠黏膜微绒毛数量,长度、形态、隐窝深度与C组类似,而高浓度氟处理后,肠黏膜微绒毛稀疏,短小畸形和隐窝深度显著变浅。
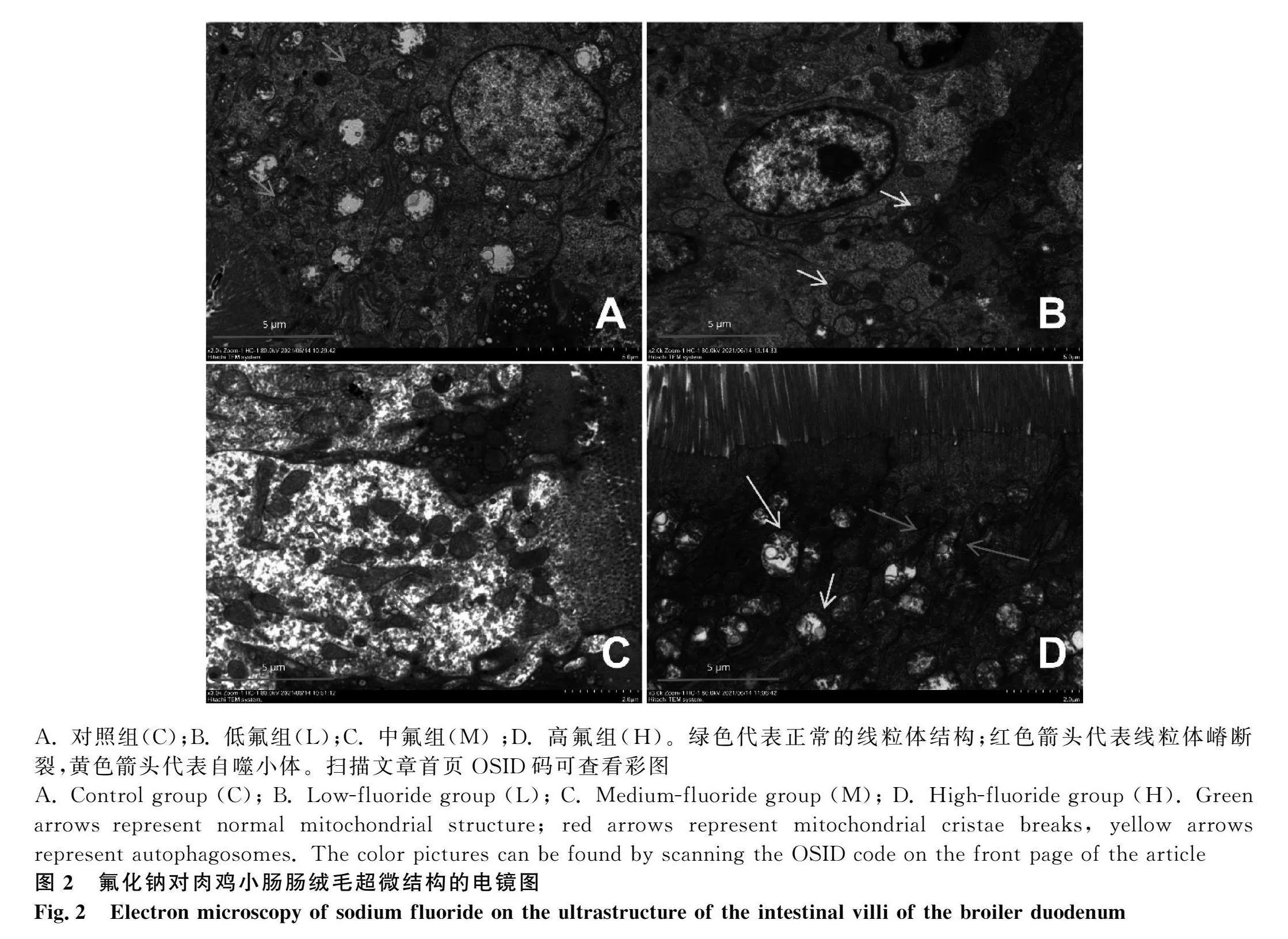
2.2 氟化钠对肉鸡小肠肠上皮细胞超微结构的影响
如图2结果显示,C组线粒体形态正常,未发现线粒体嵴断裂和自噬体。L组出现自噬小体,M组线粒体肿胀、部分线粒体嵴断裂,H组线粒体肿胀、部分线粒体嵴断裂,并出现大量自噬体。
2.3 氟化钠对肉鸡小肠抗氧化途径相关指标的影响
如图3 A所示,与C组相比,氟化钠暴露使血红素加氧酶1(heme oxygenase "HO-1)的mRNA水平仅在L和M组显著性增加(Plt;0.001),醌NADH脱氢酶1(recombinant NADH dehydrogenase quinone "NQO1)和Nrf2变化均不显著。与L组相比,HO-1的mRNA水平仅H组显著性减少(Plt;0.001),NQO1和Nrf2变化均不显著。图3A中mRNA水平变化综合分析,通过氟化钠暴露引起鸡小肠内抗氧化途径相关指标转录水平变化推测抗氧化酶的减少是因为氧化应激的消耗。
如图3 C所示,与C组相比,Nrf2的蛋白表达水平显著性增加(Plt;0.001),Keap1显著减少(Plt;0.001),并且呈剂量依赖性,NQO1和HO-1在L组显著增加(Plt;0.01),M和H组显著减少(Plt;0.01)。与L组相比,Nrf2的蛋白表达水平仅M组显著增加(Plt;0.001)。Keap1、NQO1和HO-1在M和H组显著减少(Plt;0.01或者Plt;0.001)。由图3A和C中mRNA和蛋白指标的变化发现,存在趋势不同现象,这是因为mRNA和蛋白分别代表转录和翻译两个层次,它们发生的时间和位点存在时空间隔,同时在转录后,又会有转录后加工、转录产物的降解、翻译和翻译后加工及修饰好几个层面。所以从转录水平和翻译水平并不完全一致。这些结果提示氟化钠暴露引起鸡小肠内抗氧化途径蛋白水平变化,Nrf2途径虽然被激活,但其下游的抗氧化酶却减少,指向氧化应激。
2.4 氟化钠对肉鸡小肠自噬指标的影响
如图4 A所示,与C组相比,氟化钠暴露使磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)的蛋白表达水平显著性减少(Plt;0.001),具有剂量依赖性,磷酸化丝氨酸/苏氨酸蛋白激酶B(phospho-protein kinase B,p-AKT)仅L组显著性增加(Plt;0.001),H组显著性减少(Plt;0.05);LC3仅M和H组显著增加(Plt;0.05或者Plt;0.01),p-mTOR仅L组显著性增加(Plt;0.001),Beclin1显著增加(Plt;0.001),ATG12变化不显著,p62显著减少(Plt;0.001)。与L组相比PI3K、p-AKT和p-mTOR在M和H组蛋白均显著性减少(Plt;0.001),Beclin1、LC3和p62在M和H组蛋白均显著性增加(Plt;0.05,Plt;0.01或者Plt;0.001)。氟化物钠暴露引起鸡小肠内自噬相关指标蛋白水平变化,诱导细胞自噬。
图4 C所示,与C组相比,氟化钠暴露组AKT和ATG5的mRNA水平仅L组显著性减少(Plt;0.05或者Plt;0.001),ATG12仅L组显著性减少(Plt;0.01),Beclin-1变化不显著,p62显著增加(Plt;0.001)。与 L组相比AKT和ATG5的mRNA水平在M和H组显著性增加(Plt;0.01或者Plt;0.001),ATG12在M和H组显著性增加(Plt;0.01),Beclin-1和p62变化不显著,mTOR在M和H组显著性减少(Plt;0.01)。氟化钠暴露引起鸡小肠内自噬相关指标转录水平变化,诱导细胞自噬。
2.5 氟化钠对肉鸡小肠铁死亡指标的影响
如图5 A所示,与C组相比,氟化钠暴露组花生四烯酸-12-脂加氧酶(arachidonate-12-lipoxygenase,ALOX12)和NCOA4的蛋白水平显著升高(Plt;0.001),GPX4和FTH1显著降低(Plt;0.01或者Plt;0.001),且呈剂量依赖性。溶质载体家族7成员11(solute carrier family 7 member 1 SLC7A11)在M和H组显著性减少(Plt;0.001)。与L组相比,ALOX12和NCOA4在M和H组显著性增加(Plt;0.05,Plt;0.01或者Plt;0.001),GPX4、SLC7A11和FTH1显著性减少(Plt;0.001)。氟化钠暴露诱导肉鸡小肠发生铁死亡。
如图5 C所示,与C组相比,氟化钠暴露后Achaete-Scute 复合体同源物 4(achaete-scute complex homolog 4,ASCL4)的mRNA水平显著增加(Plt;0.001),FTH1则显著减少(Plt;0.05或者Plt;0.001),并且呈剂量依赖性。SLC7A11仅在L组显著增加(Plt;0.001),GPX4仅M和H组显著性减少(Plt;0.01或者Plt;0.001)。与L组相比,ASCL4的mRNA水平在M和H组显著性增加(Plt;0.01或Plt;0.001),FTH1、GPX4和SLC7A11在M和H组显著性减少(Plt;0.05,Plt;0.01或者Plt;0.001)。本研究发现氟化钠暴露引起鸡小肠内铁死亡途径相关指标转录水平变化,诱导铁死亡。
3 讨 论
氟中毒是一个重大的公共卫生问题,长期摄入过量的氟会对生物组织和器官造成负面影响。值得注意的是,氟中毒主要影响牙齿和骨骼等硬组织,但随着研究的深入发现它也会影响非骨骼器官。本研究中,氟暴露后肉鸡小肠发生组织病理学损伤,变化包括肠黏膜微绒毛稀疏,短小畸形和隐窝深度显著变浅等;超微结构检测发现线粒体肿胀、部分线粒体嵴断裂,并出现自噬体。
氟在食品和饮用水中广泛存在,过量摄入能诱导组织细胞产生大量活性氧,发生氧化应激反应,其中涉及Nrf2途径的激活[26-27]。Nrf2途径是典型的抗氧化防御机制,在发生氧化应激时,它能调节下游的解毒酶HO-1和NQO1的表达,发挥生物内在的抗氧化作用[28]。高浓度氟暴露于人神经母细胞瘤时也有类似的研究发现,此时活性氧积聚,同时Nrf2途径被抑制[29]。本研究中,Nrf2途径有短暂地激活,其下游HO-1和NQO1随氟化钠暴露浓度增加先增加后减少,这提示氟化钠暴露后肉鸡小肠发生氧化应激,激活Nrf2抗氧化途径,但随着暴露浓度增加,小肠内氧化应激程度超过了调控范围,抗氧化途径被抑制,细胞命运可能由存活导向死亡。结果中Nrf2途径的变化与先前的研究基本类似。这提示氟暴露诱导氧化应激,Nrf2的变化与氟的暴露浓度有关。
PI3K-AKT-mTOR是一条自噬经典信号通路,其中mTOR是负调控自噬的中枢检查点,mTOR的抑制刺激自噬[30]。氟诱导小鼠间质细胞发生自噬,主要是通过抑制途径和激活实现的[31]。本研究中氟暴露的小肠中对PI3K-AKT-mTOR途径相关蛋白和mRNA水平的检查发现AKT和mTOR的磷酸发生抑制,这提示自噬被激活,这与先前研究类似。Beclin-1高剂量表达能够促进细胞自噬。LC3也在自噬过程中发挥关键作用,包括LC3I、LC3II两种分子形态。在自噬发生时,LC3会被剪切成LC3-I型,然后LC3-I型被磷脂酰乙醇胺修饰成LC3-II型,促使自噬体形成和扩张过程[32]。研究表明,LC3-II的量与自噬体的数量呈正相关[33-34]。氟化钠暴露于肉鸡后小肠自噬相关指标Beclin-1、LC3和ATG5显著增加,这些都指向自噬的发生。p62是一种自噬底物递送蛋白,研究发现,将p62敲除并不影响会自噬体的形成,但会使自噬底物蛋白的募集和降解过程受抑制[35]。氟化钠暴露后p62蛋白表达量显著低于对照组,分析发现是由于自噬流活化,p62与自噬底物蛋白结合后,进入自噬体,经历一系列反应后在自噬溶酶体中被降解,所以当自噬流活化时p62蛋白减少[36]。由上述结果可知,氟暴露会引起肉鸡心脏中自噬的活化。
氧化应激和自噬与铁死亡有关。研究发现,氟诱导的自噬与铁死亡之间的串扰依赖于线粒体活性氧通路[37]。铁死亡途径的一部分依赖自噬,受铁蛋白自噬调控,而铁死亡的相关蛋白也参与自噬的调节[38]。研究表明,当细胞自噬受抑制时,镉暴露导致的脂质过氧化和细胞中游离铁水平降低,也即当细胞自噬受抑制时细胞铁死亡也会受抑制[39]。铁蛋白自噬与铁死亡联系紧密,铁蛋白的自噬降解会释放大量的游离铁,进而促进铁死亡[40]。NCOA4与 FTH1相互作用是介导铁蛋白自噬降解的关键蛋白。通过下调NCOA4基因表达或抑制自噬,可以有效地抑制铁死亡的发生[41-42]。FTH1既可以结合存储铁离子,又可以与NCOA4结合,分解和释放游离铁。解毒酶HO-1也可以通过催化血红素降解为胆绿素,产生Fe2+的积累激活铁死亡途径[43-44]。本试验氟化钠暴露的肉鸡小肠NCOA4蛋白表达量显著升高,FTH1显著降低,发生铁自噬,游离铁离子含量升高,诱导铁死亡的发生。
铁死亡途径最核心的变化是脂质过氧化,这就涉及到ASCL4和ALOX12涉及的多不饱和脂肪酸的氧化和SLC7A11和GPX4途径涉及的抵御脂质过氧化反应。不饱和脂肪酸会在ASCL4和溶血卵磷脂酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)的作用下与磷脂酰乙醇胺结合形成多不饱和脂肪酸的磷脂,后者易受ALOX12介导的自由基引发的氧化的影响,诱发铁死亡[45]。本研究中氟暴露组肉鸡小肠中ASCL4和ALOX12蛋白表达量升高,脂质过氧化物含量升高。胱氨酸经嵌于细胞膜表面的SLC7A11和SLC3A2二聚体进入细胞,然后被氧化成半胱氨酸,最后经谷氨酸-半胱氨酸连接酶和GSH合成酶催化合成GSH。GPX4利用GSH能够将脂质过氧化的过氧键(L-OOH)转变为羟基(L-OH),失去其过氧化物的活性,这是清除脂质过氧化的主要途径[46]。本研究中氟暴露后SLC7A11、GPX4蛋白表达量显著降低,细胞清除脂质过氧化物能力降低,易发生铁死亡。综上数据,在本研究中,氟化钠暴露通过铁代谢、脂质代谢和GSH代谢三条途径的作用导致了肉鸡小肠组织发生铁死亡。
4 结 论
本研究发现氟中毒导致肉鸡小肠组织病理学损伤,初步确定了氟毒性作用的相关途径:即通过氧化应激和自噬途径诱导铁死亡。本研究结果为研究环境中氟化物造成的家禽小肠毒性和损害提供了理论依据,也为评价氟对家禽毒理损伤的机理及其对人体健康的影响提供了重要的参考。
参考文献(References):
[1] ZUO H, CHEN L, KONG M, et al. Toxic effects of fluoride on organisms[J]. Life Sci, 2018, 198:18-24.
[2] 邵奎东, 张海涛. 吉林省地方性氟中毒“十三五”防治进展及今后对策探讨[J]. 中国地方病防治, 2023, 38(1):1-7.
ZHAO K D, ZHANG H T. Progress in prevention and control of endemic fluorosis in Jilin Province during the 13th Five Year Plan period and future countermeasures[J]. Chinese Journal of Control of Endemic Diseases, 2023, 38(1):1-7. (in Chinese)
[3] 吕 纬. 四方针铁矿及其铝氧化物复合体对氟离子的吸附性能与机理[D]. 呼和浩特:内蒙古大学, 2021.
LV W. Adsorption performance and mechanisms of fluoride on the akaganeite and its aluminum oxide complex[D]. Hohhot:Inner Mongolia University, 2021. (in Chinese)
[4] OTTAPPILAKKIL H, BABU S, BALASUBRAMANIAN S, et al. Fluoride induced neurobehavioral impairments in experimental animals:a brief review[J]. Biol Trace Elem Res, 2023, 201(3):1214-1236.
[5] RAHIM A, ESSAMADI A, EL AMIRI B. A comprehensive review on endemic and experimental fluorosis in sheep:Its diverse effects and prevention[J]. Toxicology, 2022, 465:153025.
[6] EFE U, DEDE S, YKSEK V, et al. Apoptotic and oxidative mechanisms in liver and kidney tissues of sheep with fluorosis[J]. Biol Trace Elem Res, 202 199(1):136-141.
[7] CHOUBISA S L, CHOUBISA D. Status of industrial fluoride pollution and its diverse adverse health effects in man and domestic animals in India[J]. Environ Sci Pollut Res, 2016, 23(8):7244-7254.
[8] DENG Y B, CUI H M, PENG X, et al. Effects of high dietary fluorine on erythrocytes and erythrocyte immune adherence function in broiler chickens[J]. Biol Trace Elem Res, 2013, 155(2):247-252.
[9] CHEN G J, HU P C, XU Z C, et al. The beneficial or detrimental fluoride to gut microbiota depends on its dosages[J]. Ecotoxicol Environ Saf, 202 209:111732.
[10] LUO Q, CUI H M, PENG X, et al. Intestinal IgA+ cell numbers as well as IgA, IgG, and IgM contents correlate with mucosal humoral immunity of broilers during supplementation with high fluorine in the diets[J]. Biol Trace Elem Res, 2013, 154(1):62-72.
[11] LIU J, CUI H M, PENG X, et al. Dietary high fluorine induces apoptosis and alters Bcl-2, Bax, and caspase-3 protein expression in the cecal tonsil lymphocytes of broilers[J]. Biol Trace Elem Res, 2013, 152(1):25-30.
[12] LUO Q, CUI H M, PENG X, et al. Suppressive effects of dietary high fluorine on the intestinal development in broilers[J]. Biol Trace Elem Res, 2013, 156(1-3):153-165.
[13] CHEN S Y, XUE Y J, SHEN Y T, et al. Effects of different selenium sources on duodenum and jejunum tight junction network and growth performance of broilers in a model of fluorine-induced chronic oxidative stress[J]. Poult Sci, 2022, 101(3):101664.
[14] ZHAO W P, WANG H W, LIU J, et al. Mitochondrial respiratory chain complex abnormal expressions and fusion disorder are involved in fluoride-induced mitochondrial dysfunction in ovarian granulosa cells[J]. Chemosphere, 2019, 215:619-625.
[15] JU H, CHEN S Y, XUE Y J, et al. The role of Nrf2 pathway in alleviating fluorine-induced apoptosis by different selenium sources in the chicken duodenum and jejunum[J]. Ecotoxicol Environ Saf, 202 224:112708.
[16] 胡流芳, 王 迎, 任汝静, 等. Keap1-Nrf2/ARE信号通路的抗氧化应激作用及其调控机制[J]. 国际药学研究杂志, 2016, 43(1):146-152, 166.
HU L F, WANG Y, REN R J, et al. Anti-oxidative stress actions and regulation mechanisms of Keap1-Nrf2/ARE signal pathway[J]. Journal of International Pharmaceutical Research, 2016, 43(1):146-152, 166. (in Chinese)
[17] SUN Y, ZHENG Y F, WANG C X, et al. Glutathione depletion induces ferroptosis, autophagy, and premature cell senescence in retinal pigment epithelial cells[J]. Cell Death Dis, 2018, 9(7):753.
[18] ZHAO Y F, LI Y Y, WANG J M, et al. Fluoride induces apoptosis and autophagy through the IL-17 signaling pathway in mice hepatocytes[J]. Arch Toxicol, 2018, 92(11):3277-3289.
[19] TANG H Y, HOU H Q, SONG L, et al. The role of mTORC1/TFEB axis mediated lysosomal biogenesis and autophagy impairment in fluoride neurotoxicity and the intervention effects of resveratrol[J]. J Hazard Mater, 2024, 467:133634.
[20] JIANG J Z, RUAN Y B, LIU X H, et al. Ferritinophagy is critical for deoxynivalenol-induced liver injury in mice[J]. J Agric Food Chem, 2024, 72(12):6660-6671.
[21] DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5):1060-1072.
[22] 岑 怡, 王甜甜, 高兴杰, 等. 铁死亡调控机制及其在肠道疾病中的研究进展[J]. 生命的化学, 2022, 42(11):2071-2078.
CEN Y, WANG T T, GAO X J, et al. Regulatory mechanism and research progress of ferroptosis in intestinal diseases[J]. Chemistry of Life, 2022, 42(11):2071-2078. (in Chinese)
[23] 王 浩, 肖金龙, 沈 珏, 等. 细胞死亡的新方式——铁死亡与铜死亡[J]. 畜牧兽医学报, 2024, 55(2):461-470.
WANG H, XIAO J L, SHEN J, et al. New ways of cell death—ferroptosis and cuproptosis[J]. Acta Veterinaria et Zootechnica Sinica, 2024, 55(2):461-470. (in Chinese)
[24] LI X, YANG J, SHI E B, et al. Riboflavin alleviates fluoride-induced ferroptosis by IL-17A-independent system Xc-/GPX4 pathway and iron metabolism in testicular Leydig cells[J]. Environ Pollut, 2024, 344:123332.
[25] ZHANG Y, FANG Y M, ZHAO S, et al. Fluoride resistance capacity in mammalian cells involves global gene expression changes associate with ferroptosis[J]. Chem Biol Interact, 2023, 381:110555.
[26] SONG C, HEPING H F, SHEN Y S, et al. AMPK/p38/Nrf2 activation as a protective feedback to restrain oxidative stress and inflammation in microglia stimulated with sodium fluoride[J]. Chemosphere, 2020, 244:125495.
[27] 毕 翻, 万 珑, 温建霞, 等. 氟对仔鼠生长发育、学习记忆及血清氧化应激水平的影响[J]. 中华地方病学杂志, 2020, 39(4):243-247.
BI F, WAN L, WEN J X, et al. Effects of fluoride on growth and development, learning and memory, and oxidative stress in serum of offspring rat[J]. Chinese Journal of Endemiology, 2020, 39(4):243-247. (in Chinese)
[28] 辛 涛, 许 娟, 刘红岗. Nrf2/HO-1通路在Erastin诱导的非小细胞肺癌A549细胞铁死亡中的作用[J]. 山西医科大学学报, 2023, 54(7):879-884.
XIN T, XU J, LIU H G. Role of Nrf2/HO-1 pathway in Erastin-induced ferroptosis in non-small cell lung cancer A549 cells[J]. Journal of Shanxi Medical University, 2023, 54(7):879-884. (in Chinese)
[29] TANG Z, LAI C C, LUO J, et al. Mangiferin prevents the impairment of mitochondrial dynamics and an increase in oxidative stress caused by excessive fluoride in SH-SY5Y cells[J]. J Biochem Mol Toxicol, 202 35(4):e22705.
[30] XU Z R, HAN X, OU D M, et al. Targeting PI3K/AKT/mTOR-mediated autophagy for tumor therapy[J]. Appl Microbiol Biotechnol, 2020, 104(2):575-587.
[31] ZHANG J H, ZHU Y C, SHI Y, et al. Fluoride-induced autophagy via the regulation of phosphorylation of mammalian targets of rapamycin in mice leydig cells[J]. J Agric Food Chem, 2017, 65(40):8966-8976.
[32] 孔志伟, 姚婷婷. 自噬相关基因Beclin1和LC3与子宫内膜异位症的研究进展[J]. 医学综述, 2019, 25(21):4166-4173.
KONG Z W, YAO T T. Research on endometriosis and autophagy associated gene beclin1 and LC3[J]. Medical Recapitulate, 2019, 25(21):4166-4173. (in Chinese)
[33] MIZUSHIMA N. Methods for monitoring autophagy[J]. Int J Biochem Cell Biol, 2004, 36(12):2491-2502.
[34] KABEYA Y, MIZUSHIMA N, UENO T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21):5720-5728.
[35] 刘世玉, 冯学召, 古丽妮尕尔·司马义, 等. p62敲除对细胞自噬的影响及其对泛素化修饰蛋白募集的作用[J]. 新疆医科大学学报, 2023, 46(9):1119-1123, 1131.
LIU S Y, FENG X Z, GULINIGAER S, et al. Effect of p62 knockout on cellular autophagy and its role in recruitment of ubiquitination-modified proteins[J]. Journal of Xinjiang Medical University, 2023, 46(9):1119-1123, 1131. (in Chinese)
[36] 吕晓希, 胡卓伟. 自噬流的检测方法[J]. 药学学报, 2016, 51(1):45-51.
LV X X, HU Z W. New methods to detect autophagic flux[J]. Acta Pharmaceutica Sinica, 2016, 51(1):45-51. (in Chinese)
[37] XU W J, HU Z Y, ZHANG J J, et al. Cross-talk between autophagy and ferroptosis contributes to the liver injury induced by fluoride via the mtROS-dependent pathway[J]. Ecotoxicol Environ Saf, 2023, 250:114490.
[38] 李 昕, 李 平, 熊秋宏. 自噬和铁死亡的相互联系[J]. 中国细胞生物学学报, 202 43(1):144-151.
LI X, LI P, XIONG Q H. The crosstalk between autophagy and ferroptosis[J]. Chinese Journal of Cell Biology, 202 43(1):144-151. (in Chinese)
[39] 李 敏, 杨 前, 刘亚轩, 等. 镉通过诱导自噬促进肾小管上皮细胞铁死亡的研究[J]. 陆军军医大学学报, 2022, 44(17):1705-1711.
LI M, YANG Q, LIU Y X, et al. Cadmium promotes ferroptosis in renal tubular epithelial cells by inducing autophagy[J]. Journal of Army Medical University, 2022, 44(17):1705-1711. (in Chinese)
[40] MANCIAS J D, WANG X X, GYGI S P, et al. Quantitative proteomics identifies NCOA4 as the cargo receptor mediating ferritinophagy[J]. Nature, 2014, 509(7498):105-109.
[41] HOU W, XIE Y C, SONG X X, et al. Autophagy promotes ferroptosis by degradation of ferritin[J]. Autophagy, 2016, 12(8):1425-1428.
[42] GAO M F, MONIAN P, PAN Q H, et al. Ferroptosis is an autophagic cell death process[J]. Cell Res, 2016, 26(9):1021-1032.
[43] SONG X H, LONG D X. Nrf2 and ferroptosis:a new research direction for neurodegenerative diseases[J]. Front Neurosci, 2020, 14:267.
[44] 刘 恒, 段晓峰. 铁自噬及相关基因NCOA4、FTH1在口腔鳞癌中的研究进展[J]. 中国口腔颌面外科杂志, 2023, 21(1):87-91.
LIU H, DUAN X F. Research progress of ferritinophagy and related genes FTH1 and NCOA4 in oral squamous cell carcinoma[J]. China Journal of Oral and Maxillofacial Surgery, 2023, 21(1):87-91. (in Chinese)
[45] DING K Y, LIU C B, LI L, et al. Acyl-CoA synthase ACSL4: an essential target in ferroptosis and fatty acid metabolism[J]. Chin Med J (Engl), 2023, 136(21):2521-2537.
[46] CHU B, KON N, CHEN D L, et al. ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway[J]. Nat Cell Biol, 2019, 21(5):579-591.
(编辑 白永平)
