基于转录组和蛋白质组分析筛选五龙鹅产蛋相关候选基因
2025-01-27鲁秀张名爱孔敏张晶王秉翰侯中一滕兴怡姜雅静凡文磊王宝维



摘 要: 旨在通过转录组和蛋白组联合分析来挖掘五龙鹅产蛋量相关候选基因,为其产蛋性能遗传机制研究提供理论基础。本研究选取200只体重相近的36周龄健康五龙鹅种鹅,记录其36~54周龄产蛋情况。在产蛋后期(54周龄)时,根据产蛋水平,将产蛋量最高的30只鹅定为高产组,产蛋量最低的30只鹅定为低产组,从高产组(H)和低产组(L)鹅中各采集3个卵巢组织,提取RNA和蛋白质,通过转录组测序(RNA-Seq)和4D-DIA蛋白组定量分析筛选差异表达基因(differentially expressed genes,DEGs)和差异表达蛋白(differentially expressed proteins,DEPs)。之后对筛选的差异基因和蛋白进行RT-qPCR验证、功能富集分析和蛋白互作(PPI)网络的构建与分析,筛选鹅产蛋性能相关的候选基因。结果:共鉴定到450个DEGs和333个DEPs,其中,AFAP1、INHA、FNDC1、INHBB在基因和蛋白水平上表达出相同的差异趋势。富集分析显示,DEGs和DEPs显著富集到364个GO条目和75个KEGG通路,涉及生殖结构发育(gland development)、性别分化(sex differentiation)、性激素活性(hormone activity)、TGF-β通路(TGF-β signaling pathway)、卵母细胞减数分裂(oocyte meiosis)、GnRH信号通路(GnRH signaling pathway)、孕激素介导的卵母细胞成熟(progesterone-mediated oocyte maturation)等多个与产蛋相关的通路和关键生物过程。选取9个潜在候选基因,对高产组和低产组(包含转录组测序样品)各8个卵巢组织进行RT-qPCR验证,表达趋势与测序结果一致。基于上述研究结果,本研究最终筛选到6个与五龙鹅产蛋性能密切相关的候选基因(PTTG1、LRP2、TNFSF10、INHA、INHBB、FST),丰富了五龙鹅产蛋性能的相关分子机制。
关键词: 五龙鹅;转录组;蛋白组;产蛋量;候选基因
中图分类号:S835.3""""" 文献标志码:A""""" 文章编号: 0366-6964(2025)01-0232-14
收稿日期:2024-07-22
基金项目:国家重点研发计划(2023YFD1300300);国家水禽产业技术体系(CARS-43-11);山东省重点研发计划(2021CXGC010805);农业农村部政府购买服务:鹅高繁性状精准评价和分子鉴定(19230551)
作者简介:鲁 秀(1997-),女,山东新泰人,硕士生,主要从事动物遗传与育种研究,E-mail: luxiu911@163.com
*通信作者:凡文磊,主要从事动物遗传与育种方向的研究,E-mail: fanwenlei@qau.edu.cn;王宝维,主要从事动物营养与保健方向的研究,E-mail: wangbw1959@qq.com
Screening for Candidate Genes Related to Egg Production in Wulong Geese Based on Transcriptome
and Proteome Analyses
LU" Xiu ZHANG" Ming’ai 2022年商品鹅出栏量达到4.68亿只,肉鹅产值高达526.73亿元[1]。然而,在鹅产业快速发展的同时,正在面临着繁殖性能差的卡脖子问题[2]。因此,深入挖掘影响鹅产蛋量的关键基因,对鹅产蛋性状分子标记辅助育种与鹅产业的可持续发展具有重要意义。
家禽产蛋量受卵巢和卵泡发育水平的影响,而生长因子、激素以及卵泡闭锁等多个因素均能通过调控卵泡发育水平影响家禽的繁殖性能。利用基因组学技术对扬州鹅、四川白鹅的基因进行测序,发现了大量与产蛋相关的SNPs位点,以及GnRH和GnIH等基因[3],证实这些基因在性腺轴中起关键作用,揭示了与产蛋量之间的关联性。通过转录组学技术对山麻鸭[4]、浙东白鹅[5]等产蛋性状进行研究,筛选出了INHA、GDF9、FST[6]、BMP、EGR[7]等基因,这些基因在卵泡发育和闭锁过程中发挥重要作用,对于维持繁殖功能的稳定具有重要意义。黄宣等[8]采用蛋白组学技术对高低产鸡卵巢进行深度分析后发现,CYP11A1、HSD3B1等蛋白可能与类固醇激素合成过程有关,对卵泡的发育和排卵过程具有重要作用。尽管,目前对家禽产蛋调控机制已经有了一定程度的了解,但仍存在很多问题有待阐明,如具体影响产蛋量的基因和通路,高产和低产鹅在卵巢表达上有何差异等。
豁眼鹅(五龙鹅)是我国产蛋性能最优秀的地方鹅品种之一,年产蛋量可达100枚左右。但是在生产中发现,同一群体中的不同个体,在产蛋水平上存在较大差异,群体内变异较大[9]。因此,本研究通过在同一五龙鹅群体中筛选高产和低产个体,对其卵巢组织进行转录组和蛋白组联合分析,旨在筛选影响五龙鹅产蛋量的关键候选基因,为后续利用分子标记辅助育种培育鹅高繁配套系奠定基础。
1 材料与方法
1.1 试验动物及样本采集
选择200只36周龄体重相近、健康的五龙鹅母鹅为研究对象,试验群体饲养于青岛农业大学优质水禽研究所育种基地,饲养模式为单笼饲养。在36~54周龄期间记录全部产蛋量,根据产蛋水平分为高产组和低产组,其中产蛋量最高的30只鹅定为高产组,产蛋量最低的30只鹅定为低产组。在产蛋后期(54周龄)屠宰,屠宰前12 h内禁食、自由饮水。屠宰后,采集卵巢组织(去除等级卵泡),用RNase-free水冲洗干净,吸干表面水分,迅速放入液氮速冻,置于-80 ℃保存备用。每组随机选取3个卵巢组织,即3个高产组(H)样品和3个低产组(L)样品,送至武汉迈特维尔生物科技有限公司,将卵巢样匀浆后取部分样品进行RNA和蛋白质提取,用于后续转录组测序与蛋白质测序。
1.2 转录组测序数据处理
采用Trizol法提取总RNA,利用Qsep400生物分析仪精确检测RNA完整性,质检合格后,用带有Oligo(dT)的磁珠富集mRNA,随后用fragmentation buffer将RNA打断成短片段,以此为模板,用六碱基随机引物和逆转录酶合成cDNA第一链,并以第一链cDNA为模板进行第二链cDNA的合成。最后用PCR法富集cDNA,构建鹅卵巢cDNA文库。构建完成后,使用高通量核酸蛋白分析系统对文库的insert size进行检测,完成文库质检。采用Illumina平台测序,使用fastp 0.23.2对原始数据进行处理;利用Hisat2 2.2.1将样本clean reads与鹅参考基因组进行序列比对。建库及测序过程均由武汉迈特维尔生物科技有限公司完成。
1.3 蛋白组测序数据处理
取匀浆后的样品,加入含有1 mmol·L-1 PMSF(苯甲基磺酰氟)和2 mmol·L-1 EDTA(乙二胺四乙酸)以及8 mol·L-1尿素的混合裂解缓冲液中孵育5 min,充分裂解,离心取上清。通过BCA法测定总蛋白浓度后,根据浓度取等量蛋白溶液,用8 mol·L-1尿素将体积补全至200 μL,经10 mmol·L-1 DTT(二硫苏糖醇)还原、50 mmol·L-1 IAM(碘乙酰胺)烷基化处理后,用预冷丙酮沉淀蛋白。离心后,将蛋白沉淀风干并重悬于碳酸氢铵溶液和胰蛋白酶(Promega)中,37℃消化过夜。消化产物经C 18柱料脱盐,真空离心浓缩,并溶解于1 mL·L-1甲酸中。此后,使用NanoElute高效液相色谱仪和timsTOF Pro2质谱仪进行分析;使用DIA-NN软件以Library free方法搜库,进行质谱解析,完成蛋白定量。
1.4 DEGs、DEPs筛选及功能富集分析
使用String Tie进行新基因预测,使用Feature Counts计算基因在样本中的表达量。使用DESeq2对基因表达量数据进行标准化处理和差异分析,差异表达基因(differentially expressed genes,DEGs)筛选的标准为P<0.05且log 2FC≥1.0。利用t检验对两组样本间蛋白表达量进行组间差异显著性的检验,差异表达蛋白(differentially expressed proteins,DEPs)筛选的标准为P<0.05且FC≥1.2或FC≤0.83。合并DEGs和DEPs,并通过在线网站DAVID进行GO功能富集和KEGG信号通路分析。
1.5 荧光定量PCR验证
在筛选出的与产蛋相关候选基因中随机选择出9个DEGs(LRP2、TNFSF10、A2M、SNRPA1、PTTG1、BMP5、FST、PRLHR、INHBB),以GAPDH作为内参基因,并且在高产组和低产组的卵巢组织中进行RT-qPCR验证。利用NCBI Primer-BLAST (https:∥www.ncbi.nlm.nih.gov/tools/primer-blast/)在线工具设计引物,引物由青岛蔚来生物科技有限公司合成。荧光定量PCR试剂盒采购自湖南艾科瑞生物工程有限公司,荧光定量PCR反应体系如下:上、下游引物(表1)各0.4 μL,cDNA模板2 μL,酶Mix 10 μL,ddH 2O 7.2 μL;反应程序为:95℃预变性30 s;95℃变性5 s,60℃退火延伸30 s,40个循环。采用2-ΔΔCt方法计算基因的相对mRNA表达量,并通过t检验进行统计分析。
1.6 DEGs、DEPs蛋白互作网络构建及可视化
利用在线数据库STRING对与产蛋相关的候选基因和候选蛋白进行检索,并结合Cytoscape软件构建蛋白互作网络,利用Cyto Hubba插件统计网络中节点(degree)和节点的中介中心性(between centrality),探究互作网络的结构特征,并进行可视化与分析,进一步筛选产蛋相关的关键候选基因。
2 结 果
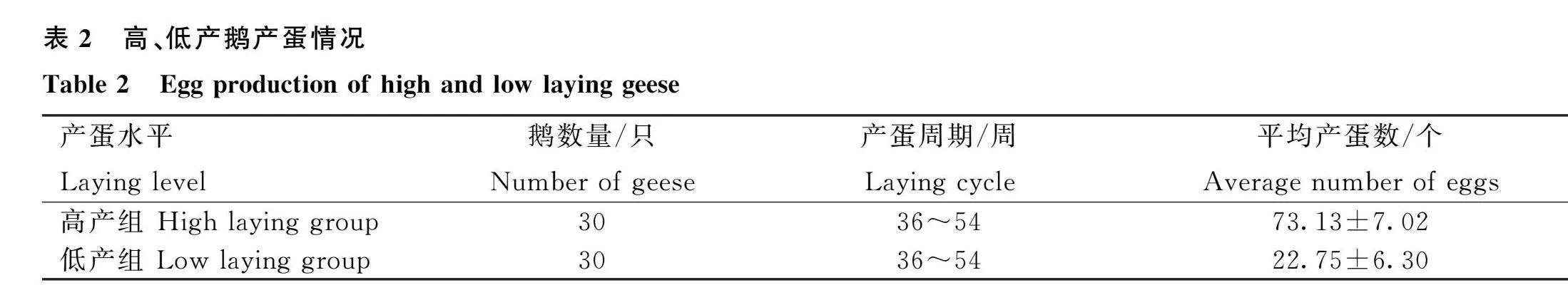
2.1 高、低产鹅产蛋情况
在36~54周龄的产蛋周期内,将200只鹅根据产蛋量进行排序,排名前30的鹅划分为高产组,排名后30的鹅划分为低产组,其中高产组平均产蛋量为73个,低产组平均产蛋量为22个(表2)。
2.2 DEGs和DEPs筛选
经过对原始转录组测序数据质控,平均每个样品获得4.37×107条clean reads,平均注释效率为90.94%,最终获得23 324个基因的mRNA表达量。利用DESeq2包进行基因表达量差异分析,成功鉴定出450个DEGs,其中有146个基因高产组表达量显著高于低产组,304个基因高产组表达量显著低于低产组(图1A)。
样本蛋白的质谱分析结果经过定量后获得8 266个基因的蛋白表达量数据。对两组样本的蛋白表达量进行t检验,共筛选到333个DEPs,其中156个蛋白的表达量高产组显著高于低产组,177个蛋白的表达量高产组显著低于低产组(图1B)。
此外,在DEGs和DEPs联合分析中,特别关注到同时在基因和蛋白层面均表现出差异表达的交集基因(图1C),经过仔细比对,共得到8个基因AFAP1、MSC、CFAP206、MRPL51、INHA、FNDC1、INHBB和CNGB1(表3)。值得注意的是,其中AFAP1、INHA、FNDC1、INHBB这4个基因的mRNA和蛋白表达趋势完全一致,为后续的研究提供了重要线索。
2.3 DEGs、DEPs的功能富集分析
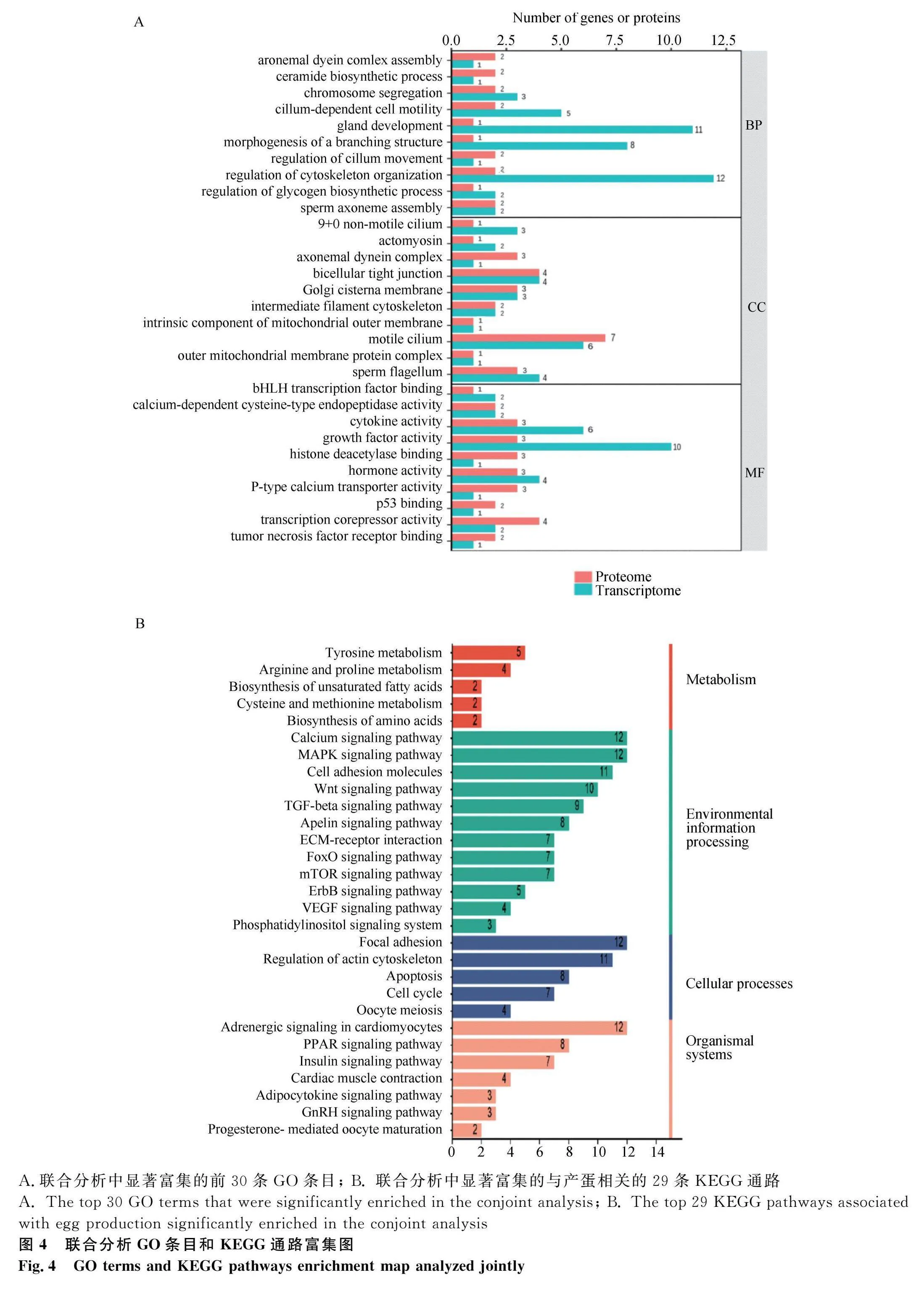
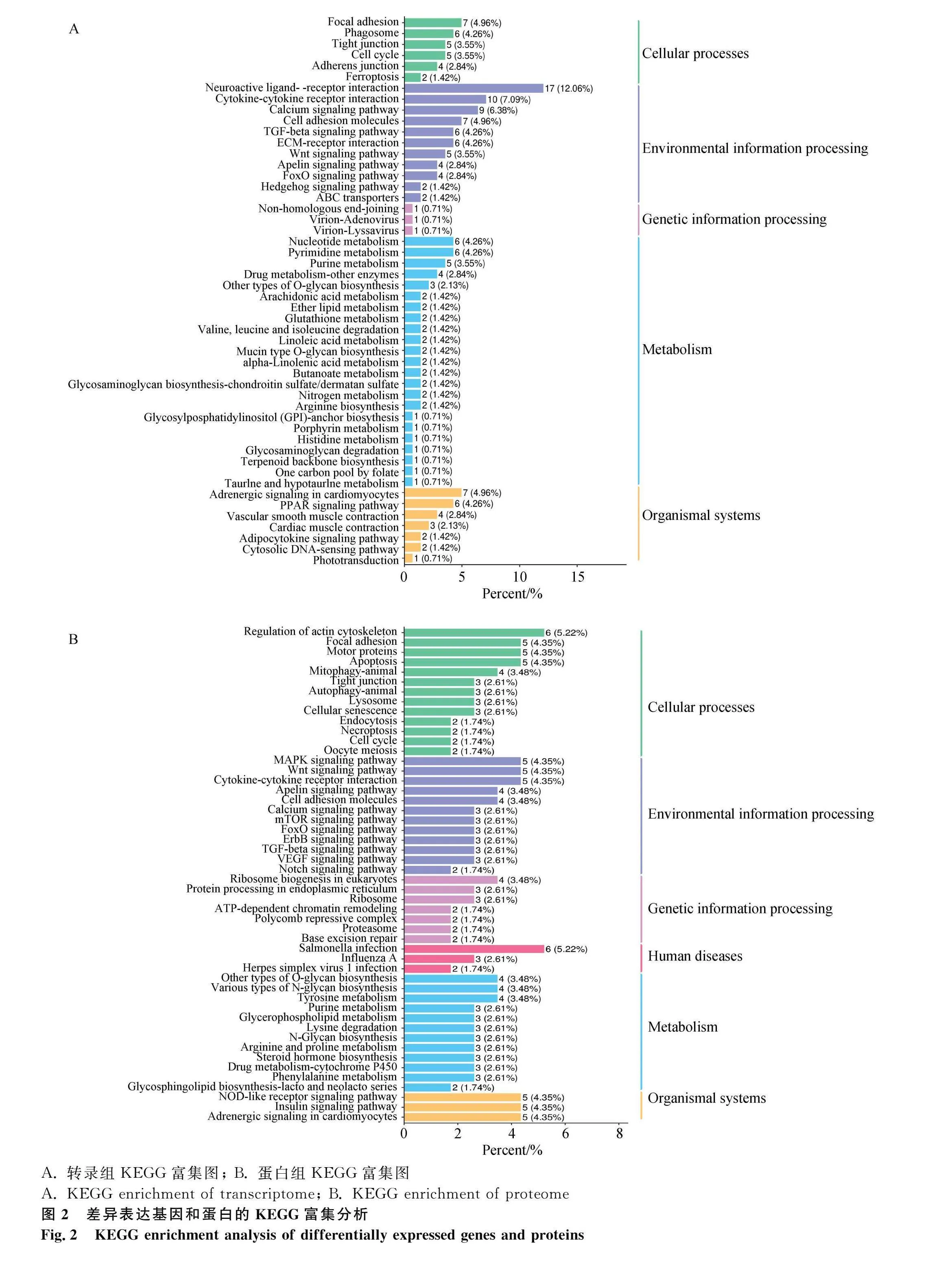
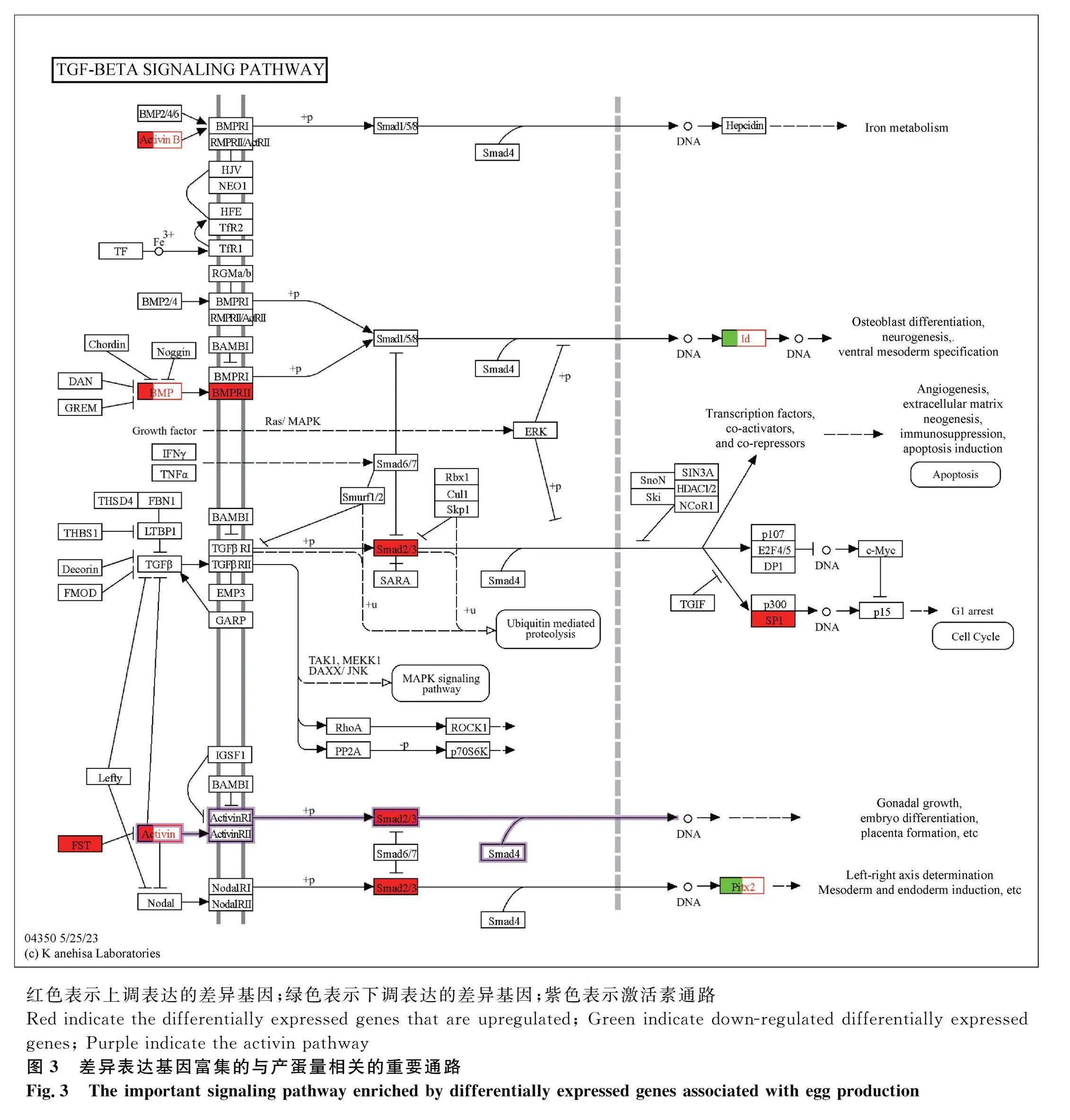
对DEGs进行KEGG富集分析,共富集到108条通路,发现DEGs主要富集于代谢途径(metabolic pathways)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、TGF-β信号通路(TGF-β signaling pathway)等通路,其中与卵泡发育相关的通路有TGF-β信号通路(TGF-β signaling pathway)、卵母细胞减数分裂(oocyte meiosis)、孕激素介导的卵母细胞成熟(progesterone-mediated oocyte maturation)、GnRH信号通路(GnRH signaling pathway)等。根据显著性通路进一步筛选到INHBB、BMP5、PTTG1等与调控产蛋性状相关的DEGs(图2A)。其中,TGF-β信号通路的分支,激活素通路可能是调控产蛋的关键通路。在激活素信号通路中,FST通过作用于抑制素(INHA、INHBB)阻碍激活素与受体相结合,使SMAD2/3磷酸化增强,从而促进性腺生长以及胚胎分化(图3)。对DEPs进行KEGG富集分析,共富集到101个相关的信号转导过程,排名前50的信号通路(图2B)显示,DEPs主要富集于肌动蛋白细胞骨架(regulation of actin cytoskeleton)、MAPK信号通路(MAPK signaling pathway)、胰岛素信号通路(insulin signaling pathway)、TGF-β信号等通路(TGF-β signaling pathway)等。
将DEGs和DEPs进行共同富集,分析结果显示,共有364个显著的GO条目(209个生物学过程,61个细胞组分,94个分子功能)和75个显著的KEGG通路(图4)。其中,GO条目主要涉及生殖结构发育(gland development)、性别分化(sex differentiation)、性激素活性(hormone activity)等,KEGG通路主要富集到TGF-β信号通路(TGF-β signaling pathway)、卵母细胞减数分裂(oocyte meiosis)、GnRH信号通路(GnRH signaling pathway)、孕激素介导的卵母细胞成熟(progesterone-mediated oocyte maturation)等,它们与产蛋性能高度相关,这些相关条目和通路主要涉及INHBB、FST、BMP5、PITX2、PTTG1、PRKCA、INHA、INSR、PPP3CB、PPP2R5D、EGR1、AKT3和MSC等基因。
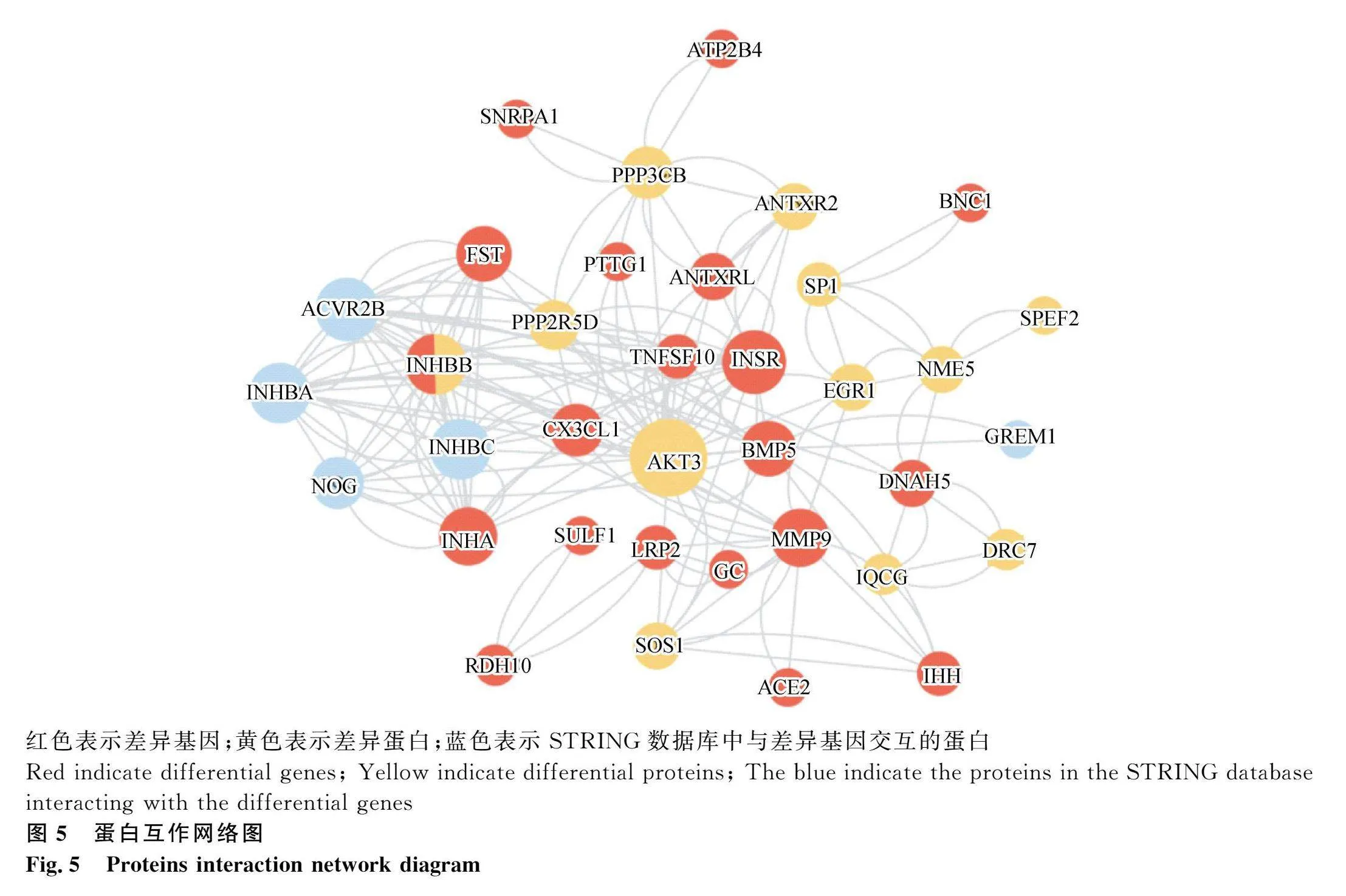
2.4 蛋白互作网络分析
基于GO和KEGG的分析结果,将筛出的产蛋性能相关的候选基因和交集基因,利用在线数据库STRING构建蛋白互作网络(图5),结果共匹配到38个编码蛋白,富集到36个节点。经过对网络中节点数和节点中心性的评估与分析,发现AKT3位于网络节点中心,周围与INSR、INHBB、INHA等多个蛋白节点连接,从而揭示其在产蛋过程的核心枢纽地位。综合以上分析,最终确定了AKT3、INSR、INHBB、FST、BMP5、INHA、PPP2R5D、PTTG1、LRP2、TNFSF10、EGR1这11个基因为产蛋性能相关的核心基因,极有可能与产蛋量之间存在显著且重要的关联。
2.5 荧光定量PCR验证
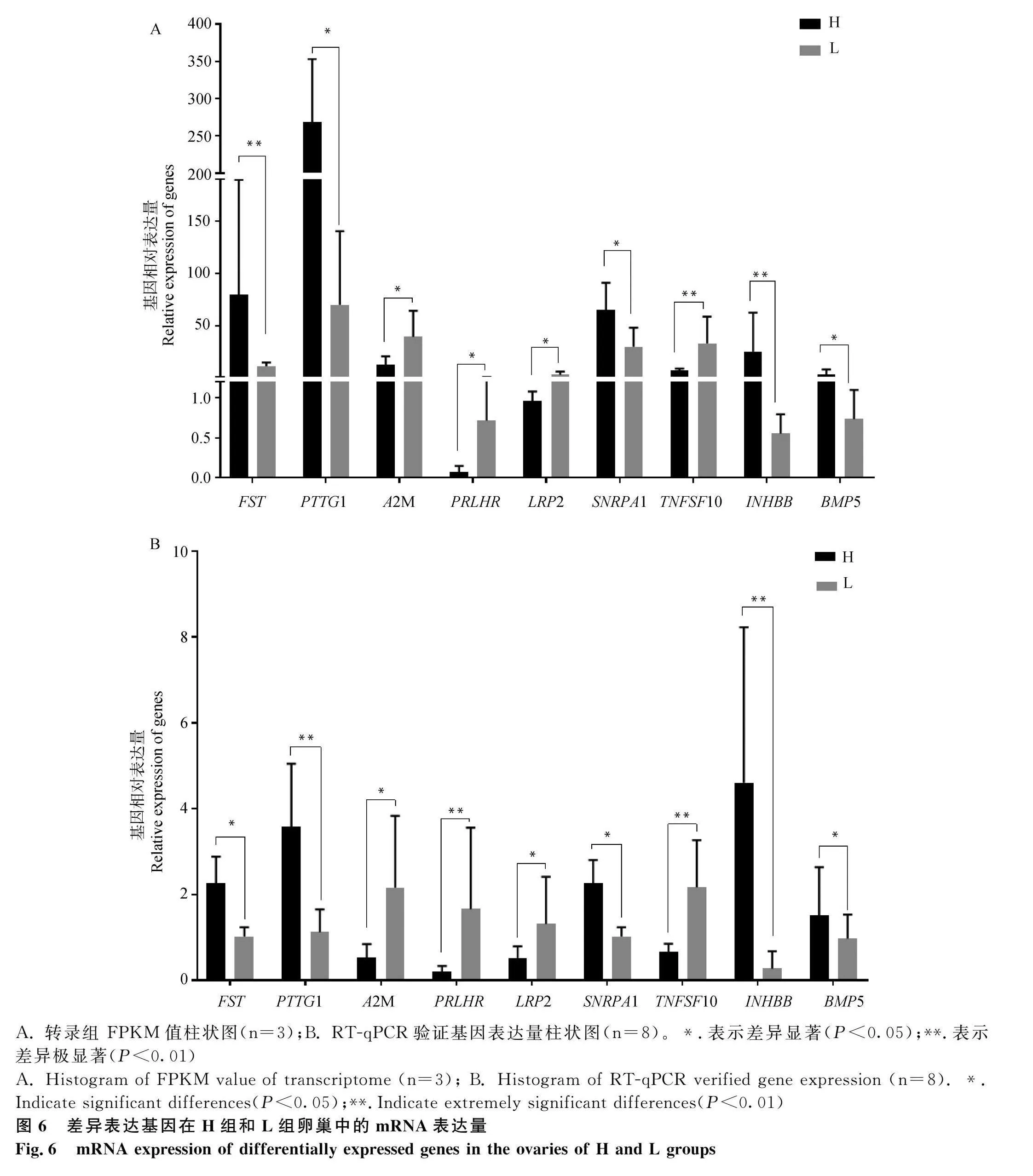
在产蛋相关的潜在候选基因中,由于转录组测序中,AFAP1、INHA、FNDC1基因的FPKM值和原始reads数值较低,可能对验证结果的精确性构成不利影响,因此,在GO注释和KEGG分析结果等的综合考虑下,决定选择9个DEGs对高产组和低产组的卵巢组织样本(每组8个,且包含转录组测序的样品)进行RT-qPCR验证,以L组为对照做均一化处理,结果表明,9个基因的表达量变化趋势与转录组测序结果相同,并且表达水平在高低产五龙鹅卵巢组织中均呈现显著差异,其中PTTG1、PRLHR、TNFSF10、INHBB基因表现出极显著差异(P<0.01)(图6)。
3 讨 论
家禽产蛋量与卵泡发育密切相关,卵泡发育包括原始卵泡、生长卵泡、成熟卵泡三个阶段的发育,其中涉及生长因子、激素、血管生成和肌肉组织等相关基因的交互作用。为解析影响产蛋量的分子机制,本研究利用高、低产蛋水平的五龙鹅进行转录组和蛋白组联合分析,筛选与产蛋量相关的候选基因,为后续利用分子标记辅助育种培育鹅高繁配套系奠定基础。
在本研究中,通过对五龙鹅高产组和低产组转录组和蛋白组差异比较,发现DEGs主要富集在细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、钙离子信号通路(calcium signaling pathway)、MAPK信号通路(MAPK signaling pathway)、TGF-β信号(TGF-β signaling pathway)、黏着斑(focal adhesion)等通路。有研究发现,王莹等[10-11]在鸡卵巢颗粒细胞转录组调控研究中,也显著富集到GnRH信号通路(GnRH signaling pathway)、钙离子信号通路(calcium signaling pathway)、细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、TGF-β信号通路(TGF-β signaling pathway)、MAPK信号通路(MAPK signaling pathway)、VEGF信号通路(VEGF signaling pathway)等通路。两者在通路富集结果种类中有相同之处,进一步强调了这些通路的在卵巢发育中的重要性。其中,细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)通路可能在促进鸡卵泡颗粒细胞增殖起关键作用,而且参与输卵管的收缩和蛋壳的形成,影响蛋的排出和蛋壳的质量[12-13]。刘建高[14]通过蛋白组学技术在蛋鸭卵泡发育调控研究中发现,钙离子信号通路(calcium signaling pathway)可能通过影响卵泡颗粒细胞的凋亡和能量代谢来调控卵泡的发育和排卵;并且通过影响输卵管上皮细胞的钙吸收和分泌功能来确保蛋壳的正常形成。MAPK信号通路(MAPK signaling pathway)的激活可以促进颗粒细胞分泌FSH(促卵泡激素)和LH(促黄体生成素)受体等多种生长因子和激素,促进卵泡的生长发育;并且通过调控卵泡壁细胞的收缩和卵泡液的分泌,确保卵泡正常破裂释放卵母细胞,完成排卵[15]。综上研究表明,这些通路在卵泡发育、蛋壳形成以及排卵等过程中具有重要作用。
卵泡发育是一个复杂的过程,在这个过程中细胞凋亡起着重要的调控作用,卵泡中的颗粒细胞和卵母细胞之间的相互作用以及卵泡微环境的变化均会影响卵泡的发育和成熟[16-17]。TNFSF10作为一种促凋亡因子,属于肿瘤坏死因子(TNF)配体家族的成员,通过诱导细胞凋亡来清除异常或受损细胞,减少炎症因子的来源,从而间接调控炎症反应[18]。已有研究发现,炎症因子如肿瘤坏死因子(tumor necrosis factor,TNF)[19]、白细胞介素(interleukin,IL)等通过影响HPO轴(下丘脑-垂体-卵巢轴)的神经内分泌活动来调控卵泡的发育和排卵。本研究发现,TNFSF10在五龙鹅卵巢的表达量高产组显著低于低产组,提示该基因可能在五龙鹅卵泡颗粒细胞凋亡过程中发挥重要作用,进而对卵泡的发育产生影响。因此推测,低产组鹅体内可能存在炎症反应,进而影响其卵泡发育质量,导致产蛋量降低。
卵母细胞减数分裂是卵母细胞发育成熟的最后一个阶段,是受精、胚胎着床前不可或缺的先决条件,PTTG1、PPP2R5D、PPP3CB这3个基因均在此过程中发挥重要作用。PTTG1在猪胚胎发生过程中参与卵母细胞成熟和合子基因组激活的过程[20],并且在马和驴等动物的GV期和MⅡ期的卵母细胞中也发现PTTG1都有高丰度表达[21]。与之相似,本研究也发现了PTTG1在高产组鹅卵巢中高丰度表达。由此推测,该基因可能通过促进卵母细胞的成熟发育,进而影响五龙鹅的产蛋水平。此外,PPP2R5D、PPP3CB这两个基因是磷蛋白磷酸酶(PPP)家族重要成员。有研究证实,PPP3CB参与调控猪青春期卵母细胞减数分裂过程[22],而且,当PPP2R5D亚基中的丝氨酸-丙氨酸发生突变时,会抑制小鼠卵泡的正常去磷酸化[23],从而影响正常的卵母细胞减数分裂过程,提示该基因可能通过干预卵泡生长发育影响五龙鹅产蛋水平。
产蛋量与蛋重之间存在一定的关系,但这种关系受多种因素的影响。多项研究证实,蛋重与产蛋量之间存在较强的负相关[24]。Yi等[25]也在蛋清形成的膨大部发现,LRP2是影响蛋重的重要基因。LRP2作为一种多功能内吞受体[26],通过内吞作用有效摄取与其载体蛋白相结合的重要维生素和激素,包括维生素D结合蛋白[27]、视黄醇结合蛋白[28]和性激素结合球蛋白[29-30]等,这些物质的摄取对卵巢的发育具有重要作用。当维生素D摄取不足时,会影响抗缪勒管激素的分泌,这是一种由卵巢颗粒细胞分泌的激素,对卵巢的储备功能和排卵过程有重要影响[31-33]。此外,维生素D的缺乏还可能导致生殖系统微血管功能异常,影响子宫内膜的营养供应和修复过程,从而影响卵巢的正常功能[34]。因此,LRP2作为母胎脂质转运途径的胚胎脂蛋白受体,介导脂蛋白摄取到卵黄囊中,对卵泡的发育具有重要意义。在本研究中,低产组LRP2表达量显著高于高产组,这种高表达促进了营养物质向卵泡的有效输送,确保了卵泡发育过程中获得充足的营养支持。因此,这种营养分配的差异可能是导致低产鹅的种蛋较重、产蛋量较低的重要因素之一。
通过蛋白互作网络分析得知,INHBB、INHA、FST(卵泡抑素)这3个基因相互之间有着密切的关联,有研究证实其在影响产蛋性状中起重要作用。在雌性动物卵巢发育过程中,抑制素、激活素和卵泡抑素都是重要的调节因子,这三者组成的抑制素-激活素-卵泡抑素系统在动物的各个生殖阶段都发挥着重要的调控作用[35]。有研究证实,在激活素信号通路中,FST作用于抑制素,从而阻止激活素与其受体的结合[36],导致SMAD2/3磷酸化增强,这进一步促进了性腺的生长和胚胎的分化(图3)[37-38]。本研究中,这3个基因在高产组的mRNA表达水平高于低产组,当敲除INHBB时,会影响颗粒细胞的生长和凋亡[39-40],而过表达时,其会和FSH相互作用影响类固醇激素下调,导致卵泡发育受阻[41]。当然,在正常情况下,一定水平的INHBB会适当的抑制FSH分泌。由此推断,在产蛋过程中,这3个基因通过促进性腺生长发育和调控生殖激素平衡,从而促进产蛋量增加。
4 结 论
本研究通过转录组和蛋白组进行联合分析,最终筛选到6个与产蛋性能相关的候选基因(PTTG1、LRP2、TNFSF10、INHA、INHBB、FST),为五龙鹅产蛋性能的分子育种和产蛋性能调控机制的阐明提供参考。
参考文献(References):
[1] 侯水生,刘灵芝.2022年水禽产业现状、未来发展趋势与建议[J].中国畜牧杂志,2023,59(3):274-280.
HOU S S,LIU L Z.Current status,future development trends,and suggestions for the waterbird industry in 2022[J].Chinese Journal of Animal Science,2023,59(3):274-280.(in Chinese)
[2] 杨景晁,李显耀,王宝维,等.山东省水禽产业的发展基础及“十四五”高质量发展策略[J].家畜生态学报,2023,44(6):92-96.
YANG J C,LI X Y,WANG B W,et al.Development foundation of Shandong waterfowl industry and its 14th five-year high quality development strategy[J].Acta Ecologae Animalis Domastici,2023,44(6):92-96.(in Chinese)
[3] 胡彦竞科.四川白鹅GnRH、GnIH基因克隆、多态性及其与产蛋量的关联性研究[D].重庆:西南大学,2017.
HU Y J K.Cloning,polymorphism of GnRH and GnIH genes and their association with egg production in Sichuan white goose[D].Chongqing:Southwest University,2017.(in Chinese)
[4] CHANG Y G,GUO R B,ZENG T,et al.Analysis of transcriptomic differences in the ovaries of high- and low-laying ducks[J].Genes (Basel),2024,15(2):181.
[5] WANG Y,WANG S,ZANG Z,et al.Molecular and transcriptomic analysis of the ovary during laying and brooding stages in Zhedong white geese (Anser cygnoides domesticus)[J].Br Poult Sci,2024,65(5):631-644.
[6] 陈 静,吴薛蓓,苗冬枝,等.产蛋间隔前期鸽卵泡转录组比较分析揭示卵泡发育相关基因[J].畜牧兽医学报,2024,55(8):3503-3515.
CHEN J,WU X B,MIAO D Z,et al.Comparative analysis of transcriptome of pigeon follicles at early stage of laying interval reveals genes related to follicular development[J].Acta Veterinaria et Zootechnica Sinica,2024,55(8):3503-3515.(in Chinese)
[7] 袁素珍.EGR1调控的颗粒细胞凋亡在卵巢衰老中的作用及其机制研究[D].武汉:华中科技大学,2017.
YUAN S Z.The role of EGR1-regulated granulosa cell apoptosis in ovarian aging and its mechanism[D].Wuhan:Huazhong University of Science and Technology,2017.(in Chinese)
[8] 黄 宣,尹兆正,徐春晖,等.基于TMT技术的不同产蛋性能母鸡卵巢蛋白组学研究[J].中国畜牧杂志,2024,60(5):139-146.
HUANG X,YIN Z Z,XU C H,et al.Ovarian proteomics of hens with different laying performance based on TMT technology[J].Chinese Journal of Animal Science,2024,60(5):139-146.(in Chinese)
[9] 孙金艳,彭福刚,赵秀华,等.种鹅繁殖性能的影响因素[J].黑龙江动物繁殖,2020,28(5):41-43.
SUN J Y,PENG F G,ZHAO X H,et al.Factors affecting reproductive performance of breeding geese[J].Heilongjiang Journal of Animal Reproduction,2020,28(5):41-43.(in Chinese)
[10] 王 莹,李婉晴,贺文庆,等.红光对京海黄鸡卵巢转录组模式调控分析[J].中国畜牧杂志,2023,59(12):205-211.
WANG Y,LI W Q,HE W Q,et al.Analysis of red light on the regulation of transcriptome pattern in the ovary of Jinghai yellow chicken[J].Chinese Journal of Animal Science,2023,59(12):205-211.(in Chinese)
[11] 冉明霞.miR-202-5p调控鹅颗粒细胞增殖凋亡、脂质沉积和类固醇激素合成的机制研究[D].成都:四川农业大学,2023.
RAN M X.Research on the mechanism of miR-202-5p regulating the proliferation,apoptosis,lipid deposition and steroid hormone synthesis of goose follicular granulosa cells[D].Chengdu:Sichuan Agricultural University,2023.(in Chinese)
[12] 韩昆鹏.高、低产蛋量京海黄鸡卵巢组织转录组学分析[D].扬州:扬州大学,2016.
HAN K P.Transcriptomics analysis of ovaries of high and low egg production Jinghai yellow chicken[D].Yangzhou:Yangzhou University,2016.(in Chinese)
[13] LIU Z P,CHAO J R,XU P T,et al.Lonicera flos and Cnicus japonicus extracts improved egg quality partly by modulating antioxidant status,inflammatory-related cytokines and shell matrix protein expression of oviduct in laying hens[J].Poult Sci,2023,102(4):102561.
[14] 刘建高.钙相关信号参与蛋鸭卵泡发育调控的作用及机制研究[D].长沙:湖南农业大学,2021.
LIU J G.Functions of calcium signalling in mediating follicular development in laying ducks and its mechanism[D].Changsha:Hunan Agricultural University,2021.(in Chinese)
[15] MATHIEN S,TESNI RE C,MELOCHE S.Regulation of mitogen-activated protein kinase signaling pathways by the ubiquitin-proteasome system and its pharmacological potential[J].Pharmacol Rev,202 73(4):263-296.
[16] LIN F,FU Y H,HAN J,et al.Changes in the expression of FoxO1 and death ligand genes during follicular atresia in porcine ovary[J].Genet Mol Res,2014,13(3):6638-6645.
[17] KULUS M,KRANC W,SUJKA-KORDOWSKA P,et al.The processes of cellular growth,aging,and programmed cell death are involved in lifespan of ovarian granulosa cells during short-term IVC-Study based on animal model[J].Theriogenology,2020,148:76-88.
[18] 侯增鑫.尼罗罗非鱼TNFSF10(TRAIL)免疫功能初步研究[D].广州:中山大学,2017.
HOU Z X.Primary study on immune function of TNFSF10(TRAIL)in Tilapia,Oreochromis niloticus[D].Guangzhou:Sun Yat-Sen University,2017.(in Chinese)
[19] 钟 佩.生殖道微生物及血清代谢物对胚胎移植后妊娠结局的影响及机制探究[D].合肥:安徽医科大学,2023.
ZHONG P.The impact and mechanism of reproductive tract microbiota and serum metabolites on pregnancy outcomes after embryo transfer[D].Hefei:Anhui Medical University,2023.(in Chinese)
[20] XIE B K,QIN Z X,LIU S,et al.Cloning of porcine pituitary tumor transforming gene 1 and its expression in porcine oocytes and embryos[J].PLoS One,2016,11(4):e0153189.
[21] 严嘉耕.比较转录组揭示影响马和驴卵母细胞体外成熟基因的初步研究[D].南宁:广西大学,2023.
YAN J G.Comparative transcriptome reveals a preliminary study of genes influencing invitro maturation of horse and donkey oocytes[D].Nanning:Guangxi University,2023.(in Chinese)
[22] LI Q N,PAN X C,LI N,et al.Identification of circular RNAs in hypothalamus of gilts during the onset of puberty[J].Genes (Basel),202 12(1):84.
[23] EGBERT J R,SILBERN I,ULIASZ T F,et al.Phosphatases modified by LH signaling in ovarian follicles:testing their role in regulating the NPR2 guanylyl cyclase[J].Biol Reprod,2024,110(1):102-115.
[24] 严西萍.鸭产蛋量和蛋重关键基因的筛选及其调控机制研究[D].成都:四川农业大学,2023.
YAN X P.Screening the candidate genes and regulatorypathways associated with the trait of egg-production and egg weight in ducks[D].Chengdu:Sichuan Agricultural University,2023.(in Chinese)
[25] YI G Q,SHEN M M,YUAN J W,et al.Genome-wide association study dissects genetic architecture underlying longitudinal egg weights in chickens[J].BMC Genomics,2015,16(1):746.
[26] FARIDI R,YOUSAF R,GU S J,et al.Variants of LRP2,encoding a multifunctional cell-surface endocytic receptor,associated with hearing loss and retinal dystrophy[J].Clin Genet,2023,103(6):699-703.
[27] TOI N,INABA M,ISHIMURA E,et al.Significance of urinary C-megalin excretion in vitamin D metabolism in pre-dialysis CKD patients[J].Sci Rep,2019,9(1):2207.
[28] CHARLTON J R,HARER M W,SWAN C,et al.Immature megalin expression in the preterm neonatal kidney is associated with urinary loss of vitamin carrier proteins[J].Pediatr Res,2019,85(3):405-411.
[29] MARKO H L,HORNIG N C,BETZ R C,et al.Genomic variants reducing expression of two endocytic receptors in 46,XY differences of sex development[J].Hum Mutat,2022,43(3):420-433.
[30] GARCIA J,KRIEGER K D,LOITZ C,et al.Regulation of prostate androgens by Megalin and 25-hydroxyvitamin D status:Mechanism for high prostate androgens in African American Men[J].Cancer Res Commun,2023,3(3):371-382.
[31] SIMPSON S,PAL L.Vitamin D and infertility[J].Curr Opin Obstet Gynecol,2023,35(4):300-305.
[32] NELSON S M,DAVIS S R,KALANTARIDOU S,et al.Anti-Müllerian hormone for the diagnosis and prediction of menopause:a systematic review[J].Hum Reprod Update,2023,29(3):327-346.
[33] MORIDI I,CHEN A,TAL O,et al.The association between vitamin D and Anti-Müllerian Hormone:A systematic review and meta-analysis[J].Nutrients,2020,12(6):1567.
[34] V RB R "S,TAK CS I,TU′′U′′ L,et al.Effects of vitamin D on fertility,pregnancy and polycystic ovary syndrome-a review[J].Nutrients,2022,14(8):1649.
[35] SEACHRIST D D,KERI R A.The activin social network:Activin,inhibin,and follistatin in breast development and cancer[J].Endocrinology,2019,160(5):1097-1110.
[36] THOMPSON T B,LERCH T F,COOK R W,et al.The structure of the follistatin:Activin complex reveals antagonism of both type I and type II receptor binding[J].Dev Cell,2005,9(4):535-543.
[37] 付献欧.鹅胚性腺形态结构发育特征及MAPK、TGF-β/Smad信号通路的表达调控研究[D].长春:吉林农业大学,2023.
FU X O.Morphological structural and developmental characteristics of goose embryonic gonads and the MAPK and TGF-β/Smad expression and regulation of the signaling pathway[D].Changchun:Jilin Agricultural University,2023.(in Chinese)
[38] 郭泽媛,杜张胜,张雅琦,等.Smad7介导TGF-β信号通路对绵羊卵泡颗粒细胞增殖的影响[J].中国农业科学,2023,56(13):2597-2608.
GUO Z Y,DU Z S,ZHANG Y Q,et al.Effects of Smad7-mediated TGF-β signaling pathway on proliferation of sheep granulosa cells[J].Scientia Agricultura Sinica,2023,56(13):2597-2608.(in Chinese)
[39] 李芝丰,孙 伟,储明星.TGF-β通路相关基因在绵羊性腺轴组织的表达分析[J].东北农业大学学报,202 52(2):43-49.
LI Z F,SUN W,CHU M X.Expression analysis of TGF-β pathway related genes in gonadal axis-associated tissues[J].Journal of Northeast Agricultural University,202 52(2):43-49.(in Chinese)
[40] M’BAYE M,HUA G H,KHAN H A,et al.RNAi-mediated knockdown of INHBB increases apoptosis and inhibits steroidogenesis in mouse granulosa cells[J].J Reprod Dev,2015,61(5):391-397.
[41] 张智慧,高鸿霞,王国庆,等.VEGF对小鼠卵巢类固醇合成相关基因表达的影响及其机制[J].解放军医学杂志,2024,49(6):679-685.
ZHANG Z H,GAO H X,WANG G Q,et al.Effect of VEGF on the expression of genes related to ovarian steroid synthesis in mice and its mechanism[J].Medical Journal of Chinese People’s Liberation Army,2024,49(6):679-685.(in Chinese)
(编辑 郭云雁)
