多花黄精多糖提取条件优化及其抗氧化能力评价
2025-01-26李翔梁忠厚张先贺灵芝陈娟鹃阮晓玲曾智彭艳
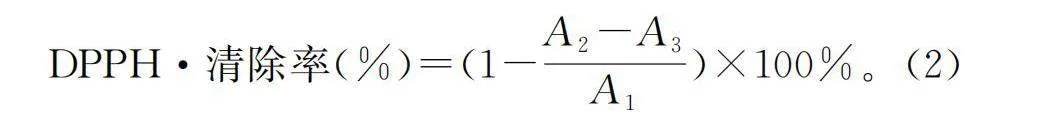

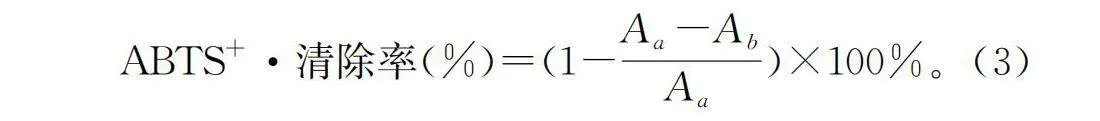
摘要:以多花黄精为主要原料,采用超声波提取法提取多花黄精多糖,选择微波功率、固液比、微波时间为单因素进行分析,采用正交实验优化多花黄精多糖提取条件;利用铁离子还原能力、DPPH·清除能力、ABTS+·清除能力综合分析多花黄精多糖的体外抗氧化能力。研究结果显示,当微波功率为350 W、固液比为1∶20、微波时间为10 min时,多花黄精多糖的提取率为8.85%,效果最优。在此条件下提取多花黄精多糖,进行抗氧化能力评价,其铁离子还原能力为(59.35±0.73)μmol FE/g dw;DPPH·清除能力为(63.24±2.31)%;ABTS+·清除能力为(47.58±1.49)%。总体可达到多花黄精多糖含量为3 mg/mL的水平。研究结果表明,在最优条件下提取多花黄精多糖提取率高,适合作为多花黄精深加工食品开发手段。
关键词:多花黄精多糖;提取;抗氧化能力
中图分类号:TS241 文献标志码:A 文章编号:1000-9973(2025)01-0222-05
Optimization of Extraction Conditions of Polysaccharides from Polygonatum cyrtonema and Evaluation of Their Antioxidant Capacity
LI Xiang1, LIANG Zhong-hou1, ZHANG Xian-wen2, HE Ling-zhi1, CHEN Juan-juan1, RUAN Xiao-ling1, ZENG Zhi-wen1*,PENG Yan1
(1.School of Medicine and Technology, Hunan Polytechnic of Environment and Biology, Hengyang 421005, China; 2.College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410125, China)
Abstract: With Polygonatum cyrtonema as the main raw material, the Polygonatum cyrtonema polysaccharides are extracted by ultrasonic extraction method.Microwave power, solid-liquid ratio and microwave time are selected as the single factors for analysis, and the orthogonal experiment is used to optimize the extraction conditions of Polygonatum cyrtonema polysaccharides. The in vitro antioxidant capacity of Polygonatum cyrtonema polysaccharides is comprehensively analyzed by iron ion reducing power, DPPH· scavenging ability and ABTS+· scavenging ability. The results show that when the microwave power is 350 W, the solid-liquid ratio is 1∶20, and the microwave time is 10 min, the extraction rate of Polygonatum cyrtonema polysaccharides is 8.85%, and the effect is the best. Under these conditions, Polygonatum cyrtonema polysaccharides are extracted and the antioxidant capacity is evaluated. The iron ion reducing power is (59.35±0.73)μmol FE/g dw; DPPH· scavenging ability is (63.24±2.31)%; ABTS+· scavenging ability is (47.58±1.49)%. Overall, it could reach the level of Polygonatum cyrtonema polysaccharide content of 3 mg/mL. The research results show that the extraction rate of Polygonatum cyrtonema polysaccharides extracted under the optimal conditions is high, and it is suitable as a means of developing deep processed foods of Polygonatum cyrtonema.
Key words: Polygonatum cyrtonema polysaccharides; extraction; antioxidant capacity
收稿日期:2024-07-29
基金项目:湖南省教育厅科学研究项目(20B196);湖南自然科学基金科教联合项目(2023JJ60205,2022JJ60048);衡阳市科技局指导性项目(衡科发[2021]51号-36);湖南环境生物职业技术学院青年科技人才培优计划项目(PY2021-08)
作者简介:李翔(1986—),女,湖南衡阳人,副教授,硕士,研究方向:天然产物开发。
*通信作者:曾智文(1984—),男,湖南衡阳人,副教授,硕士,研究方向:天然产物开发。
多花黄精(Polygonatum cyrtonema),又名姜型黄精,为百合科黄精属草本植物,主要分布在湖南、安徽、浙江等地。多花黄精的根状茎呈圆柱形,叶片轮生,花朵多为伞形或伞房状花序。它不仅可以作为药用植物,而且能作为食材和观赏植物[1]。2002—2023年,国家卫生健康委员会食品安全标准与监测评估司多次发布的《按照传统既是食品又是中药材的物质目录管理规定》中,黄精一直位列其中,表明其作为食品和药品的作用一直广为认可[2]。
从药食同源的角度来看,多花黄精既是一种药物,又是一种食物。其味甘、性平,具有补气养阴、健脾、润肺、益肾等功效,常用于治疗脾胃虚弱、肺虚咳嗽、消渴等症状[3]。同时,黄精也是一种营养丰富的食材,含有多种氨基酸、维生素和微量元素,具有增强免疫力、抗衰老、降血糖等作用,因此深受人们喜爱[4]。
目前已有较多文献报道发现,多花黄精含有黄精多糖、皂苷、黄酮、酚类、氨基酸等多种生物活性成分[5]。其中多糖为多花黄精最主要的功效成分之一,也是《中国药典》规定评价黄精质量的重要指标之一[6]。多花黄精多糖含量随着生长期的延长呈下降趋势,同时在多花黄精不同部位其含量也有所差异[7]。目前多花黄精主要以直接食用为主,其深度开发如研制食品添加剂、保健食品尚属空白。本文通过优化多花黄精多糖的提取方法,提高多花黄精多糖提取率,以期为多花黄精深加工食品的开发提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
多花黄精整株植株:采于林下药用植物应用技术湖南省工程研究中心;葡萄糖标准品、无水乙醇、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二胺盐(ABTS)、L-抗坏血酸、1,1-二苯基-2-三硝基苯肼(DPPH):均为分析纯,均购自湖南省至美生物医药有限公司。
1.2 仪器与设备
KE-490紫外可见光光度计 上海培德仪器设备厂;UGW-06大容量离心机 武汉三鹰生物技术有限公司;WIR954型高速粉碎机、IGQ-45T旋转蒸发仪 湖南弘林科学仪器有限公司。
1.3 实验方法
1.3.1 多花黄精多糖的提取
参考李兆君等[8]的方法并略作修改。称取多花黄精根状茎10 g,切成1 cm×1 cm×1 cm的块,利用高速粉碎机完全粉碎。全部转移至锥形瓶中后,加入15 mL蒸馏水搅拌均匀。微波炉内设置功率350 W、微波8 min后取出,降至室温。全部转移至离心管中,3 500 r/min离心15 min,取上清液转入旋转蒸发仪,浓缩至原体积的1/3后,加入2倍体积的无水乙醇溶液,于10℃下避光浸提4 h。浸提溶液以3 500 r/min离心15 min后,去除上清。用无水乙醇洗涤,45℃真空干燥10 h。
1.3.2 多花黄精多糖含量测定
采用蒽酮-硫酸法测定多花黄精多糖含量[9]。以葡萄糖浓度为横坐标、吸光度为纵坐标绘制标准曲线,其拟合方程:y=5.792x+0.185,R2=0.099 54,其葡萄糖浓度在0~0.1 mg/mL范围内线性关系良好。以公式(1)计算多花黄精多糖提取率:
W=m1×V1×f/m2×V2×104。(1)
式中:W为多花黄精多糖提取率(%);m1为多花黄精多糖测定液中糖含量(mg);V1为定容体积(mL);m2为多花黄精质量(mg);V2为待测液体积(mL);f为3.17(定值,为葡萄糖换算成多糖的比值)。
1.3.3 单因素分析
分别调整微波功率为250,300,350,400,450 W;固液比(多花黄精质量与浸提水溶液体积比)为1∶5、1∶10、1∶15、1∶20、1∶25;微波时间为6,8,10,12,14 min,测定多花黄精多糖的提取率。
1.3.4 正交实验设计
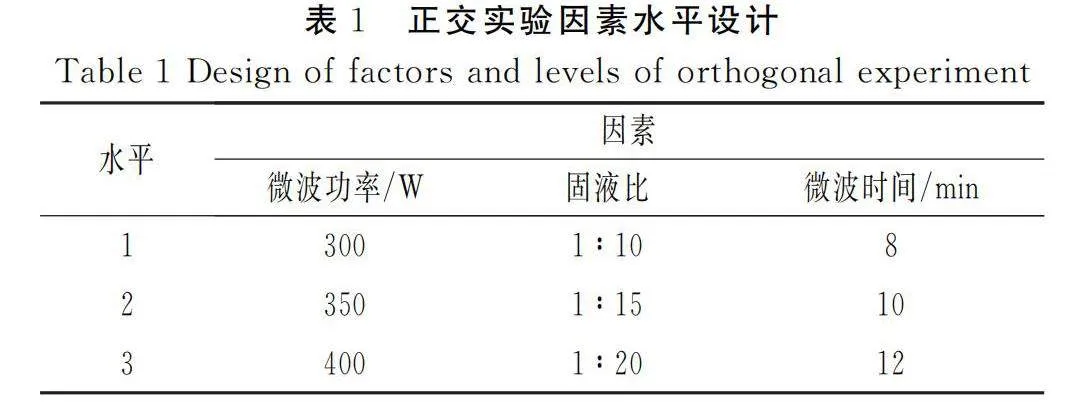
根据多花黄精多糖提取过程,以微波功率、固液比和微波时间设置三因素三水平正交实验,见表1。
1.3.5 最佳提取条件下多花黄精多糖抗氧化能力评价
1.3.5.1 铁离子还原能力
参考唐双庆等[10]的方法并略作修改。配制FRAP工作液,预热37℃备用。配制0, 0.2, 0.4, 0.6, 0.8, 1.0 mmol/L的FeSO4·7H2O,取500μL不同浓度的FeSO4·7H2O溶液,加入1.5 mL FRAP工作液、0.3 mL超纯水,避光反应5 min后,于594 nm处检测吸光度值,绘制标准曲线。然后取500μL多花黄精多糖样品液进行同样反应。所得多花黄精多糖铁离子还原能力以每克多花黄精干重所含硫酸亚铁物质的量表示(μmol FE/g dw)。
1.3.5.2 DPPH·清除能力
参考白周亚等[11]的方法并略作修改。配制0.05 mg/mL DPPH溶液,以A1为1 mL DPPH溶液+1 mL双蒸水;A2为1 mL 样品液+1 mL DPPH溶液;A3为1 mL 样品液+1 mL 无水乙醇,在不同试管中加入对应溶液,漩涡混匀1 min后避光保存15 min。于515 nm处检测吸光度值。以公式(2)计算样品的DPPH·清除率:
DPPH·清除率(%)=(1-A2-A3/A1)×100%。(2)
1.3.5.3 ABTS+·清除能力
参考Moghadam等[12]方法并略作修改。配制ABTS+·储备液:将50 mL 6 mmol/L ABTS溶液和50 mL 3 mmol/L过硫酸钾溶液混合后,避光反应14 h,测定ABTS+·储备液于725 nm处的吸光度值,为0.701。配制0,0.2,0.4,0.6,0.8,1.0 mmol/L Trolox标准溶液。以不同浓度Trolox标准溶液200μL+1 mL ABTS+·储备液反应所测吸光度值绘制标准曲线。以Aa为200μL甲醇+1 mL ABTS+·储备液,以Ab为200μL样品+1 mL ABTS+·储备液,漩涡混匀1 min后避光保存15 min,检测725 nm处的吸光度值,以公式(3)计算样品的ABTS+·清除率:
ABTS+·清除率(%)=(1-Aa-Ab/Aa)×100%。(3)
1.3.6 数据分析
利用Excel 2010进行数据整理,SPSS 20.0进行统计分析。
2 结果与分析
2.1 单因素对多花黄精多糖提取率的影响
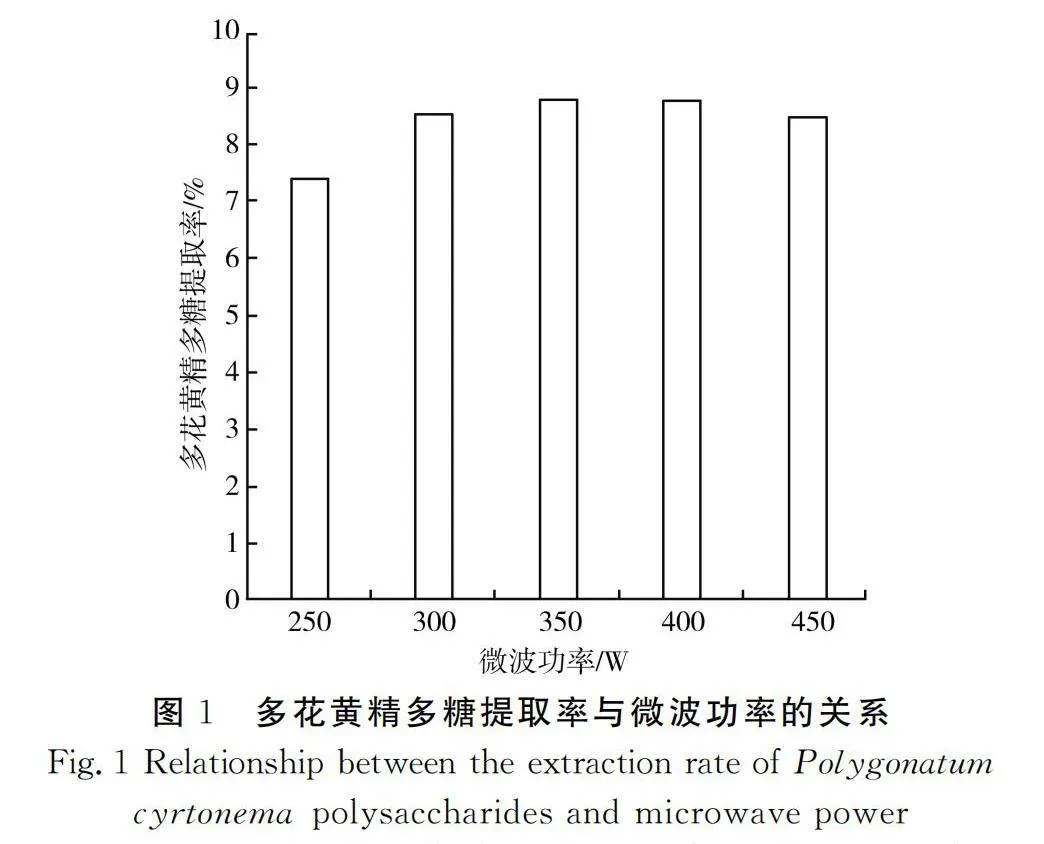
由图1可知多花黄精多糖提取率随着微波功率增加的变化。由于多糖一般存在于细胞内,其析出需要细胞破碎,因此,细胞破碎越完全,越有助于多糖析出[13]。随着微波功率升高,多花黄精多糖提取率上升,这可能是由于微波有助于细胞破碎,但当其高于350 W后又出现下降,可能是由于细胞内容物全部析出,干扰多糖的提取率。因此,在350 W微波功率下,多花黄精多糖的提取率最高,为8.81%。
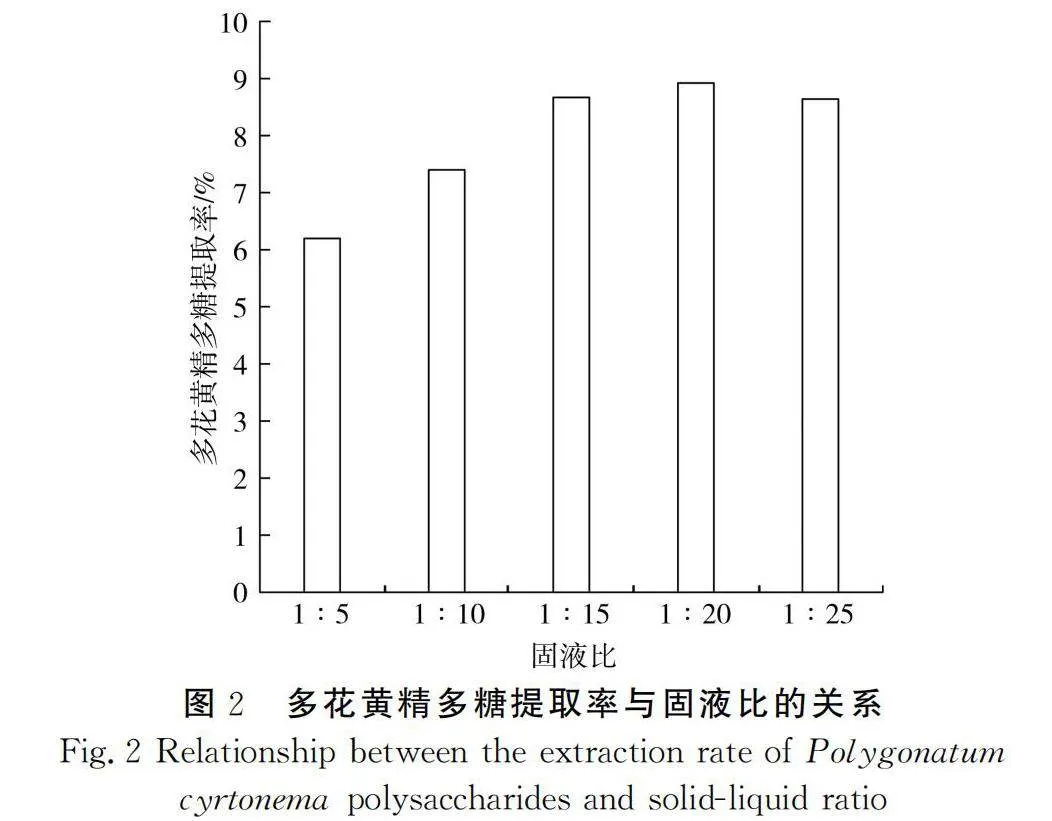
由图2可知,多花黄精多糖提取率随着固液比的增加而增大,在固液比为1∶20条件下其多糖提取率最高,为8.98%,然后呈现下降趋势,故多花黄精多糖提取率在固液比为1∶20时最高。
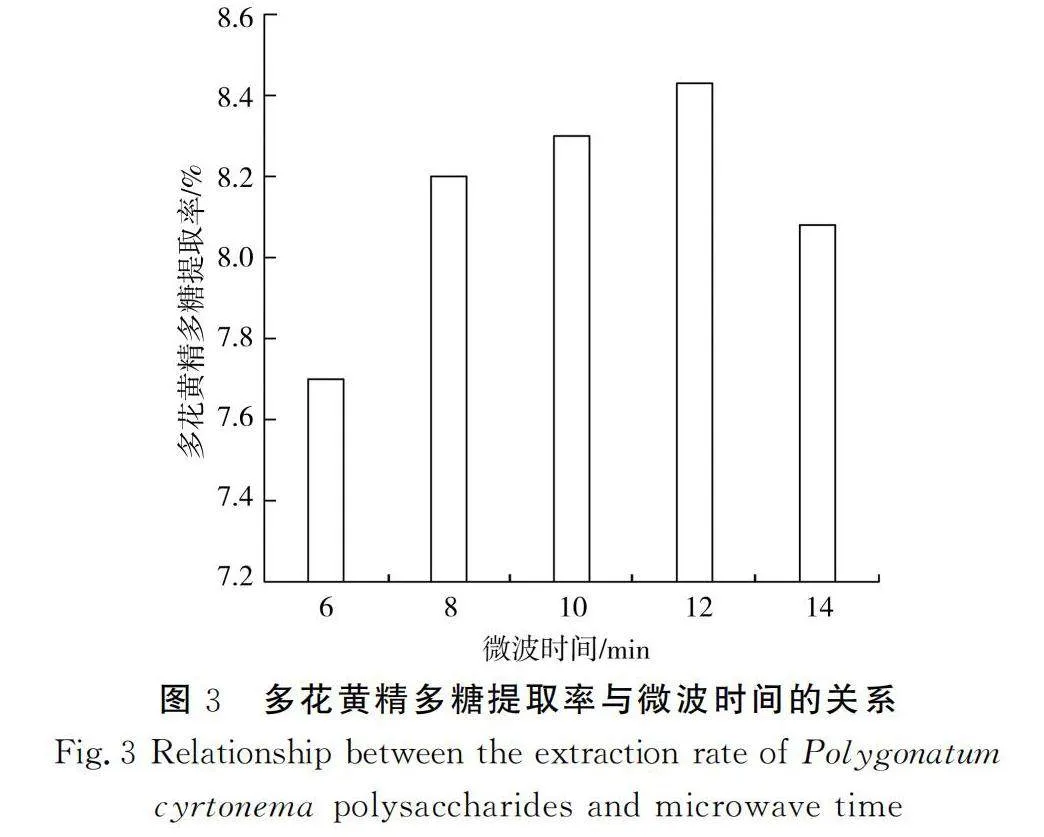
由图3可知,多花黄精多糖提取率随着微波时间的增加呈现先上升后下降的趋势。当微波时间为12 min时,其提取率最高,达到8.41%,然后下降,可能是微波时间过长导致多糖结构出现损伤,故选择12 min为最佳微波时间。
2.2 多花黄精多糖提取率正交实验
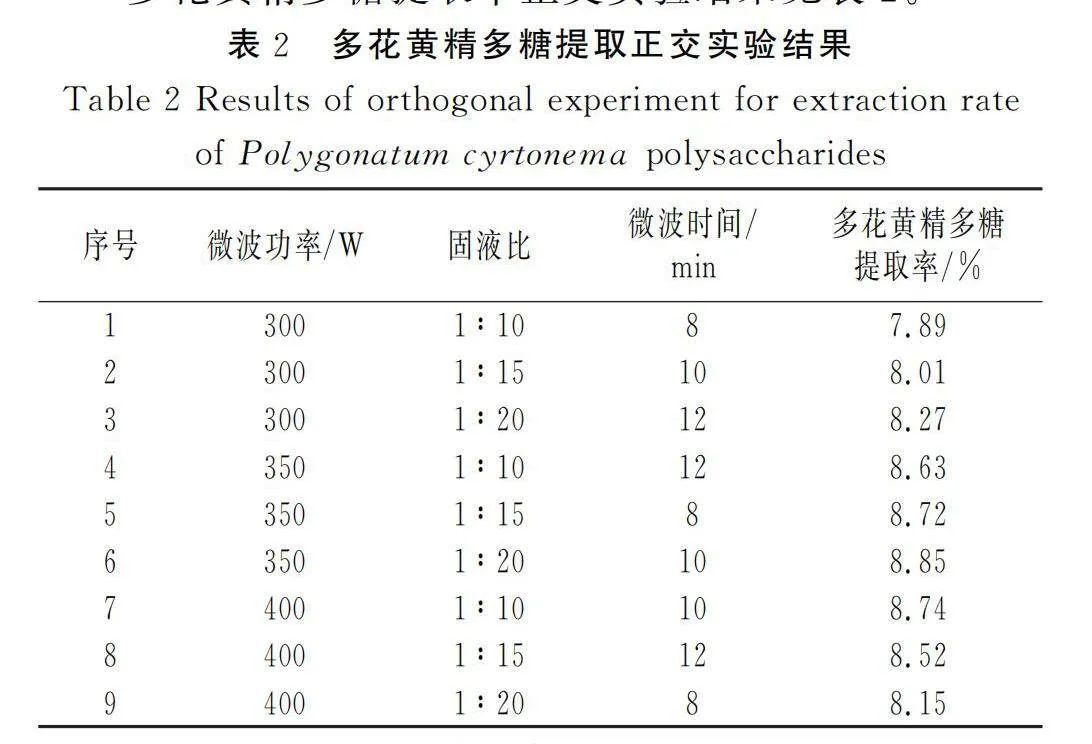
多花黄精多糖提取率正交实验结果见表2。
由表2可知,在微波功率为350 W、固液比为1∶20、微波时间为10 min时,多花黄精多糖提取率为8.85%,在9种组合方式中最佳。
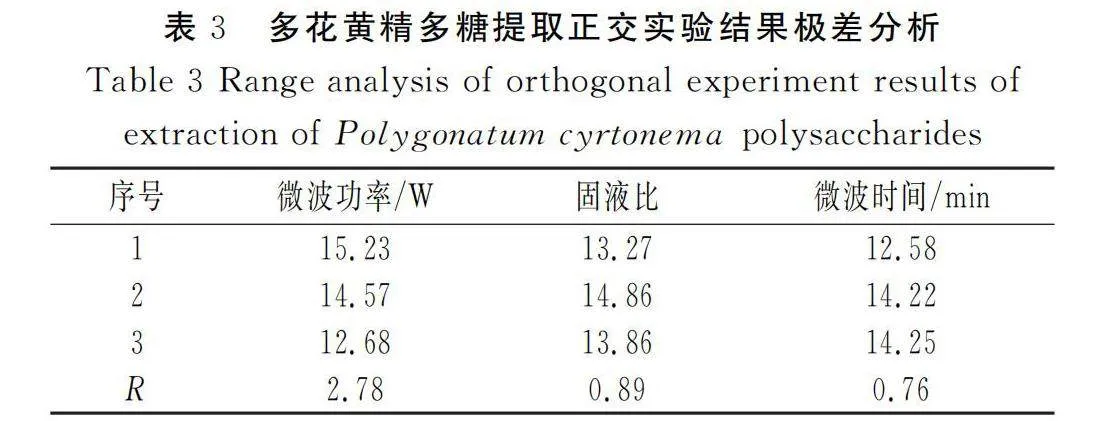
由表3可知,微波功率、固液比和微波时间3个因素中,微波功率对多花黄精多糖提取率的影响最大,其次是固液比、微波时间。3个因素的影响排序为微波功率gt;固液比gt;微波时间。同时可以得到微波功率条件1、固液比条件2和微波时间条件3为最佳组合,即当微波功率为300 W、固液比为1∶15、微波时间为12 min时提取效果最佳。
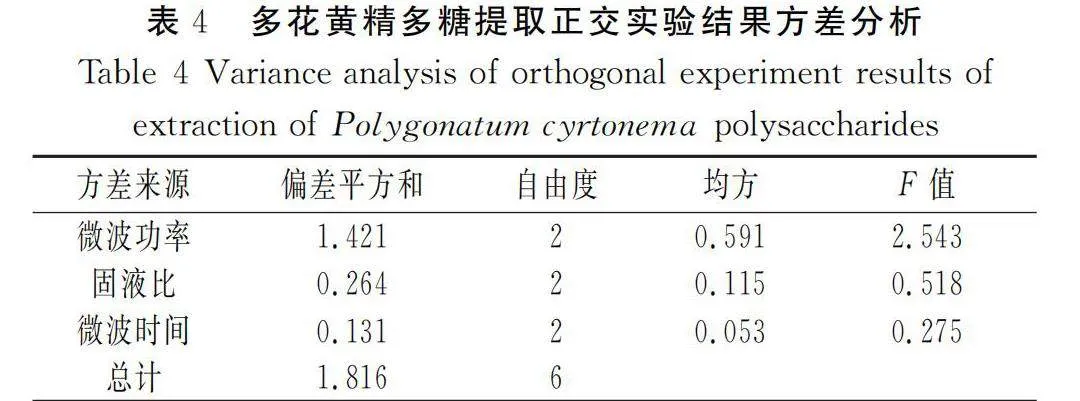
由表4可知,微波功率、固液比和微波时间3个因素的偏差平方和、均方、自由度和F值均出现微波功率gt;固液比gt;微波时间的情况,呈现出与极差分析相同的情况,表明极差分析结果真实可信。
2.3 多花黄精多糖提取正交实验结果验证
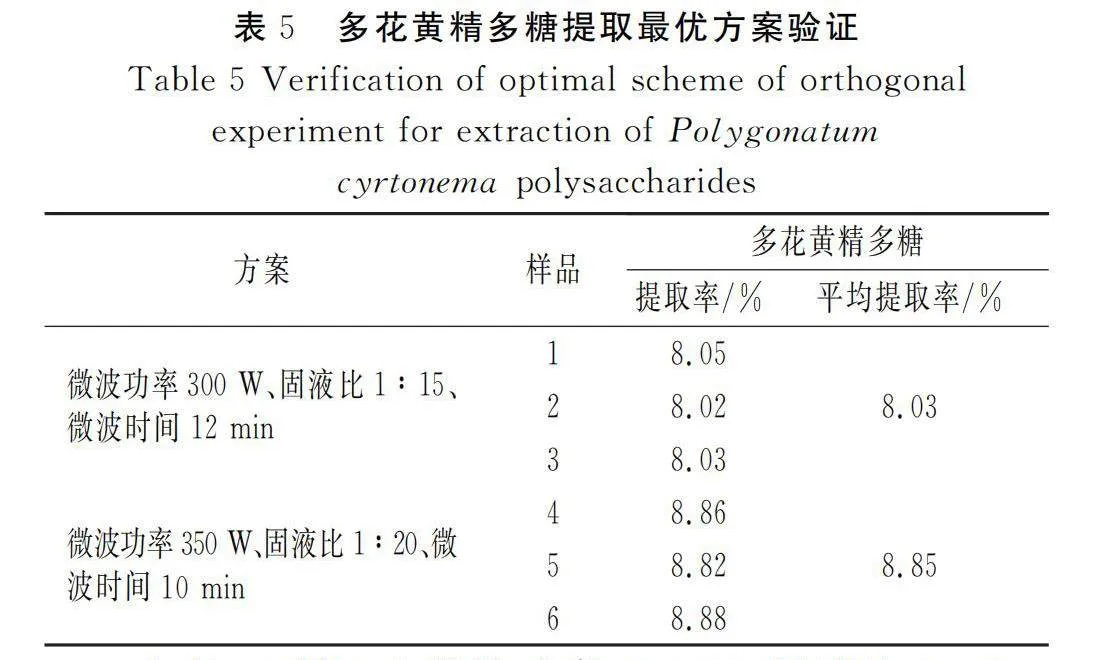
称取10 g多花黄精根状茎切块后,加入15 mL蒸馏水,在极差分析最佳提取条件(微波功率300 W、固液比1∶15、微波时间12 min)及正交实验最佳提取条件(微波功率350 W、固液比1∶20、微波时间10 min)下进行提取,各重复3次取平均值,所得结果见表5。
由表5可知,在微波功率350 W、固液比1∶20、微波时间10 min的提取条件下,平均提取率可达到8.85%,高于极差分析最优结果。因此,此条件为多花黄精多糖最佳提取方案。
2.4 多花黄精多糖抗氧化能力分析
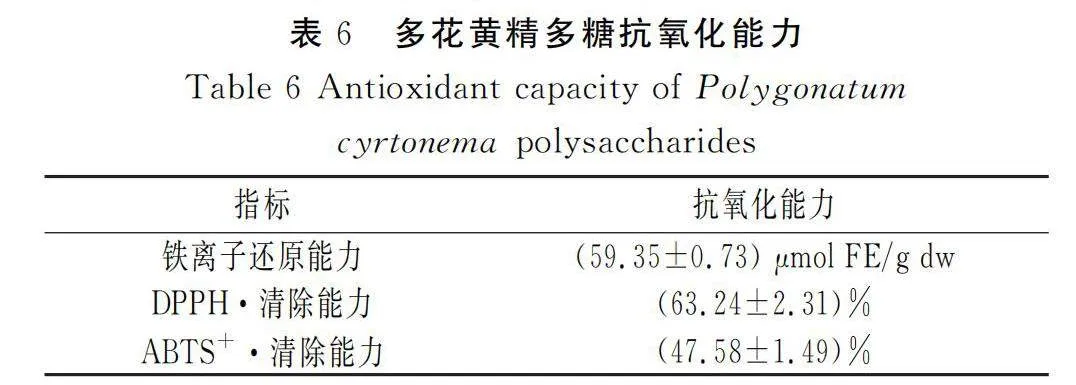
铁氰化钾中的三价铁在还原物质的还原作用下可反应产生亚铁氰化钾,与游离的三价铁离子结合后,溶液颜色呈蓝色,在680~700 nm处吸光度值最高。不同物质进行反应后吸光度值越高,则该物质的还原能力越强[14]。由表6可知,多花黄精多糖的铁离子还原能力为(59.35±0.73)μmol FE/g dw。
醇溶液中DPPH·乙醇溶液稳定,呈紫色。当DPPH·存在于还原物质环境中会发生反应,变为无色物质。在DPPH·乙醇溶液中添加还原物质,测定其在515 nm处的吸光度值,吸光度值越低,清除率越高,则还原能力越强[15]。程亚楠[16]对江西铜鼓、安徽九华山、湖南怀化、江西安福等地5种多花黄精多糖的DPPH·清除能力研究中发现,此5种多花黄精多糖的DPPH·清除能力为31.01%~68.20%,其中江西铜鼓的多花黄精多糖的DPPH·清除能力最高。在本实验中,多花黄精多糖的DPPH·清除能力为(63.24±2.31)%(见表6),略低于江西铜鼓产多花黄精,这可能是产地不同、提取方法不同导致的。
ABTS在过硫酸钾作用下会被氧化,产生的ABTS+·为蓝绿色,在725 nm处吸光度值最大。当加入还原物质后反应体系颜色变浅,从而可以判断其加入物质的还原能力[17]。李旭鸿等[18]研究多花黄精多糖、鸡头黄精多糖和滇黄精多糖的ABTS+·清除能力发现,多花黄精多糖的ABTS+·清除率在质量浓度为1~5 mg/mL范围内,随着质量浓度的上升,ABTS+·清除能力上升。本研究发现,多花黄精多糖的ABTS+·清除能力为(47.58±1.49)%,约为多花黄精多糖含量3 mg/mL的水平。
3 讨论与结论
本研究利用微波法进行多花黄精多糖提取,设置微波功率、固液比、微波时间3个因素进行单因素实验,确定单因素条件范围;再利用正交实验对多花黄精多糖提取工艺进行优化;随后利用优化后提取条件所提取的多糖进行抗氧化活性分析。结果发现,在微波功率、固液比、微波时间3个因素中,微波功率对多花黄精多糖提取率的影响最大;其次是固液比和微波时间。通过正交实验、正交实验极差分析和方差分析后,获得最佳提取条件为微波功率350 W、固液比1∶20、微波时间10 min,此时多花黄精多糖的平均提取率为8.85%,提取效果较理想。随后利用此方法对所提取的多花黄精多糖进行了抗氧化能力分析,多花黄精多糖的铁离子还原能力为(59.35±0.73)μmol FE/g dw;DPPH·清除能力为(63.24±2.31)%;ABTS+·清除能力为(47.58±1.49)%。总体可达到多花黄精多糖含量为3 mg/mL的水平。
本研究通过微波法提取多花黄精多糖,进行提取条件优化,使多花黄精多糖提取率有效提高;同时以此方法所提取的多花黄精多糖的抗氧化活性水平能够达到3 mg/mL纯多糖的抗氧化活性水平,表现出良好的抗氧化能力。目前多花黄精的市场需求极大,除直接食用外,通过本研究还可利用微波提取手段高效获得多花黄精多糖产品,为进一步开发多花黄精深加工食品奠定了理论基础。
参考文献:
[1]陈晔,孙晓生.黄精的药理研究进展[J].中药新药与临床药理,2010,21(3):328-330.
[2]刘清华,高汉云,陈桂芬,等.多花黄精中总黄酮提取工艺优化及可视化分析[J].中国中医药信息杂志,2019,26(8):89-93.
[3]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2020:248.
[4]涂明锋,叶文峰,彭靖,等.不同产地多花黄精化学成分含量比较分析[J].安徽农业科学,2020,48(8):198-200.
[5]腾欢欢,王仁中,吴德玲,等.多花黄精炮制前后不同极性部位抗氧化与降血糖活性研究[J].食品与发酵工业,2022,48(8):70-75.
[6]兰茂.滇南本草[M].昆明:云南人民出版社,2017:63.
[7]DONG S Q, WANG X F, LI W H, et al. Phytochemical constituents and chemotaxonomic study of Polygonatum prattii Baker[J].Biochemical Systematics and Ecology,2021,97:104278.
[8]李兆君,丁润梅.黑果枸杞和宁夏枸杞多糖含量比较研究[J].石油化工应用,2020,39(7):102-104.
[9]何晓梅,朱富成,张珍林,等.不同年生栽培白及各成分含量及对ABTS+·的清除作用[J].枣庄学院学报,2020,37(5):83-89.
[10]唐双庆,屈雅宁,刘琴,等.干酪乳杆菌发酵8种食用豆提取物抗氧化活性研究[J].中国酿造,2022,41(10):119-124.
[11]白周亚,阚丽娇,李昌,等.不同豇豆中酚类含量与抗氧化活性[J].食品科学,2017,38(15):153-157.
[12]MOGHADAM M, SALAMI M, MOHAMMADIAN M, et al. Development of antioxidant edible films based on mung bean protein enriched with pomegranate peel[J].Food Hydrocolloids,2020,104:105735.
[13]许飞利,王丹凤,刘志博.微波法提取黑果枸杞多糖工艺条件优化[J].商洛学院学报,2023,37(6):69-74.
[14]何晓梅,陈存武,乔德亮,等.芝麻素的超声辅助提取技术及生物活性研究[J].中国油脂,2015,40(5):65-69.
[15]李学玲,李剑美,李倩,等.龙血树叶总黄酮提取工艺的正交实验法优化及体外抗氧化性研究[J].华西药学杂志,2020,35(6):617-620.
[16]程亚楠.多花黄精多糖提取纯化、结构表征及其体外益生活性研究[D].南昌:南昌大学,2023.
[17]鲁曼霞,杨阳,李小军,等.细柱五加叶水提物降糖和抗氧化作用研究[J].时珍国医国药,2020,31(11):2597-2599.
[18]李旭鸿,冯源源,黄月,等.3种黄精多糖含量及抗氧化活性的差异分析[J].食品工业,2023,44(4):171-175.
