亚磷酸脱氢酶表达对大肠杆菌琥珀酸发酵的影响
2025-01-26刘利陈炜琪邹诗瑶王金华高娃王永泽




摘要:琥珀酸在食品中有广泛的用途,但琥珀酸发酵往往受制于还原力不平衡的问题。相比于其他常用于平衡还原力的酶,亚磷酸脱氢酶催化产物为磷酸盐,对后续琥珀酸的分离纯化影响较小。文章克隆了来源于施氏假单胞菌的亚磷酸脱氢酶(编码基因为ptxD),比较ptxD在载体和基因组上表达对琥珀酸发酵的影响,同时研究了亚磷酸盐添加量对发酵的影响。结果表明,在ptxD表达条件下,亚磷酸盐在5~15 mmol/L范围内添加并未表现出对细胞生长的抑制性,且在10 mmol/L时展现出较高的糖耗速率和琥珀酸得率。基因组上表达ptxD的工程菌 WS105(WS100,iclR::pJ23119-ptxd)能积累79.38 g/L琥珀酸,较载体上表达ptxD的工程菌WS104(WS100/puc19-pJ23119-ptxd)提升了4.87%,较出发菌株WS100提升了13.81%。WS105副产物乙酸含量显著下降,浓度为2.76 g/L,较WS100、WS104分别降低了42.38%、29.41%,表明亚磷酸脱氢酶的表达能有效促进琥珀酸产量的提高。
关键词:琥珀酸;亚磷酸脱氢酶;还原力平衡
中图分类号:TS201.25 文献标志码:A 文章编号:1000-9973(2025)01-0210-06
Effect of Phosphite Dehydrogenase Expression on Succinic Acid Fermentation in Escherichia coli
LIU Li1, CHEN Wei-qi1, ZOU Shi-yao1, WANG Jin-hua1,2,3, GAO Wa1,2,3, WANG Yong-ze1,2,3*
(1.School of Bioengineering and Food Science, Hubei University of Technology, Wuhan 430068, China;2.Key Laboratory of Fermentation Engineering, Ministry of Education, Hubei University of Technology, Wuhan 430068, China; 3.Collaborative Innovation Center of Industrial Fermentation Co-constructed by Ministry of Education and Hubei Province, Hubei University of Technology, Wuhan 430068, China)
Abstract: Succinic acid has a wide range of uses in food, but succinic acid fermentation is often limited by the problem of unbalanced reducing power. Compared with other enzymes commonly used for balancing reducing power, the catalytic product of phosphite dehydrogenase is phosphate, which has little effect on the subsequent separation and purification of succinic acid. In this paper, a phosphite dehydrogenase (encoding gene is ptxD) from Pseudomonas schszei is cloned, the effects of ptxD expression in vectors and genomes on succinic acid fermentation are compared, and the effect of phosphite addition amount on fermentation is also studied. The results show that under the condition of ptxD expression, the addition of phosphite within the range of 5~15 mmol/L does not exhibit any inhibitory effect on cell growth, and at 10 mmol/L, it exhibits a higher sugar consumption rate and succinic acid yield. The engineering strain WS105 (WS100, iclR::pJ23119-ptxd) expressing ptxD on the genome can accumulate 79.38 g/L succinic acid, which is 4.87% higher than the engineering strain WS104 (WS100/puc19-pJ23119-ptxd) expressing ptxD on the vector, and 13.81% higher than that of the starting strain WS100. The content of acetic acid, a by-product of WS105, significantly decreases and the concentration is 2.76 g/L, which is 42.38% and 29.41% lower than WS100 and WS104 respectively, indicating that the expression of phosphite dehydrogenase can effectively promote the increase of succinic acid production.
Key words: succinic acid; phosphite dehydrogenase; reducing power balance
收稿日期:2024-07-21
基金项目:国家自然科学基金青年项目(31501677);企业合作项目(2021433)
作者简介:刘利(1993—),女,硕士,研究方向:生物医药。
*通信作者:王永泽(1976—),男,副教授,博士,研究方向:微生物代谢与发酵。
琥珀酸又名丁二酸,是一种重要的C4平台化合物,可广泛应用于食品、医药和化工等领域。在食品行业中,琥珀酸常被制成琥珀酸二钠,能强化食品的鲜味,添加在啤酒、醋、酱油等产品中能发挥重要的增强风味作用[1-3],同时还可降低食品的加工成本[4]。此外,琥珀酸衍生物辛烯基琥珀酸酯可用作乳化增稠剂,增加色拉油调味品的稳定性[5]。在医药行业,琥珀酸与代谢性心血管疾病及稳态失衡有关,还能调节肠道炎症反应和机体免疫功能[6-7]。
目前琥珀酸主要由发酵法合成,相对于其他有机酸发酵,影响琥珀酸合成的关键因素是胞内还原力平衡。实现还原力平衡常用的脱氢酶有醇脱氢酶(ADH)、甲酸脱氢酶(FDH)、葡萄糖脱氢酶(GDH)和葡萄糖-6-磷酸脱氢酶(G6PDH)等[8],这些酶平衡还原力时往往存在需要额外添加碳源及产生毒副产物的问题。如醇脱氢酶(ADH)作用需要额外添加乙醇,添加量高时会对微生物产生毒害作用,所产生的乙醛也易使酶失活[9]。葡萄糖脱氢酶(GDH)催化时需要添加葡萄糖,所产生的葡萄糖酸也会对后续分离产生影响[10]。甲酸脱氢酶(FDH)可将甲酸转化成二氧化碳,增加NADH供给[11-12],采用该酶催化时后续分离容易,但所生成的CO2仍然会导致催化环境的酸化,所添加的甲酸底物对很多微生物具有一定毒性[13-14]。
亚磷酸脱氢酶(编码基因为ptxD)是一种NAD+依赖的酶,可以将亚磷酸盐(Pt)转化成磷酸盐(Pi),同时可将NAD+还原成NADH [15]。亚磷酸盐价格便宜,再生过程中亚磷酸缓冲液很容易转化成磷酸缓冲液,对酶的活性几乎没有影响,且亚磷酸脱氢酶催化时pH值范围更广[15],此外,没有亚磷酸脱氢酶的微生物无法产生磷酸盐,因此ptxD的表达还能防止发酵培养过程中杂菌的污染,ptxD已被引入至裂殖酵母、酿酒酵母[16]和枯草芽孢杆菌[17]中来对抗微生物污染。对于大肠杆菌而言,目前研究主要集中于将其作为宿主,用于ptxD基因的克隆和酶学性质上的研究[18-19],目前仍缺乏ptxD作为一个还原力平衡因子在大肠杆菌上的应用。
本研究以高产琥珀酸的大肠杆菌E.coli WS100为出发菌株,通过ptxD的表达来补充强化琥珀酸发酵所需要的还原力。一方面,克隆来源于施氏假单胞菌的亚磷酸脱氢酶(编码基因为ptxD),并比较载体及基因组上表达ptxD这两种方式对琥珀酸发酵的影响;另一方面,研究亚磷酸盐浓度对细胞生长和琥珀酸产量的影响。通过内部因子即ptxD基因的表达和环境因子亚磷酸盐浓度的探究,共同促进还原力的平衡和琥珀酸发酵产量,为大肠杆菌还原力平衡探索出一条切实可行的路线。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
DNA Marker、PCR Master Mix:Fermentas公司;氨苄青霉素、卡那霉素:Zhejiang Mersco Industry amp; Trade Co., Ltd.;L-阿拉伯糖:Sigma-Aldrich公司;蛋白胨、酵母粉、葡萄糖(分析纯)、NaCl和琼脂:国药集团化学试剂有限公司;PCR引物合成:生工生物工程(上海)股份有限公司。
1.1.2 培养基
LB液体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 5 g/L。
LB固体培养基:在LB液体培养基中加2%的琼脂。
摇瓶种子培养基:NBS培养基[20],葡萄糖20 g/L。
摇瓶发酵培养基:NBS培养基,将其中磷酸盐替换成不同物质的量浓度的亚磷酸二钠盐(0,5,10,15 mmol/L),葡萄糖 40 g/L,MgCO3 40 g/L,少许玻璃珠。
上罐种子培养基:NBS培养基,酵母粉2 g/L,葡萄糖40 g/L,MgCO3 25 g/L。
上罐发酵培养基:NBS培养基,酵母粉10 g/L,葡萄糖 100 g/L。当菌株中有ptxD基因时,将NBS培养基中磷酸盐替换成10 mmol/L亚磷酸二钠盐。
1.1.3 菌株与质粒
大肠杆菌(Escherichia coli)WS100(ΔldhA、ΔadhE、ΔpflB、ΔpoxB、ΔackA)[21]。pKD4、pET28a、pUC19由本实验室保存。
1.1.4 引物
1.2 方法
1.2.1 ptxD基因的克隆及其在大肠杆菌BL21(DE3)中的表达
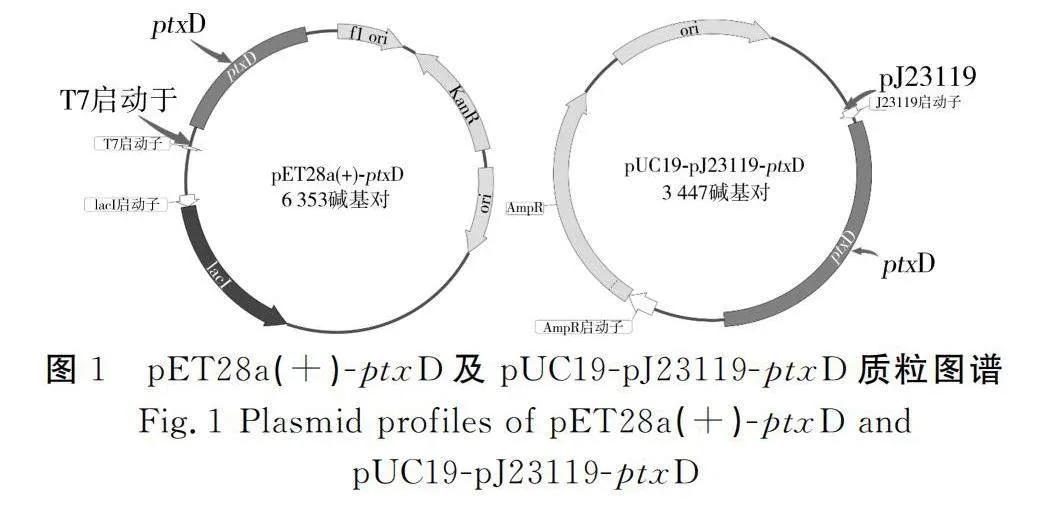
pET28a(+)-ptxD质粒构建:设计引物Pet-1和Pet-2通过反向PCR方式将pET28a线性化;以施氏假单胞菌作为模版,采用引物pp1和pp2扩增得到亚磷酸脱氢酶ptxD核酸序列,将ptxD序列和线性化的pET28a载体混合,使用T5 外切酶进行处理[22],处理产物化转到大肠杆菌DH5α,涂布后用菌落PCR方式,利用验证引物Verify-Pet1和Verify-Pet2筛选质粒,所筛得质粒测序成功后,将其命名为pET28a(+)-ptxD。
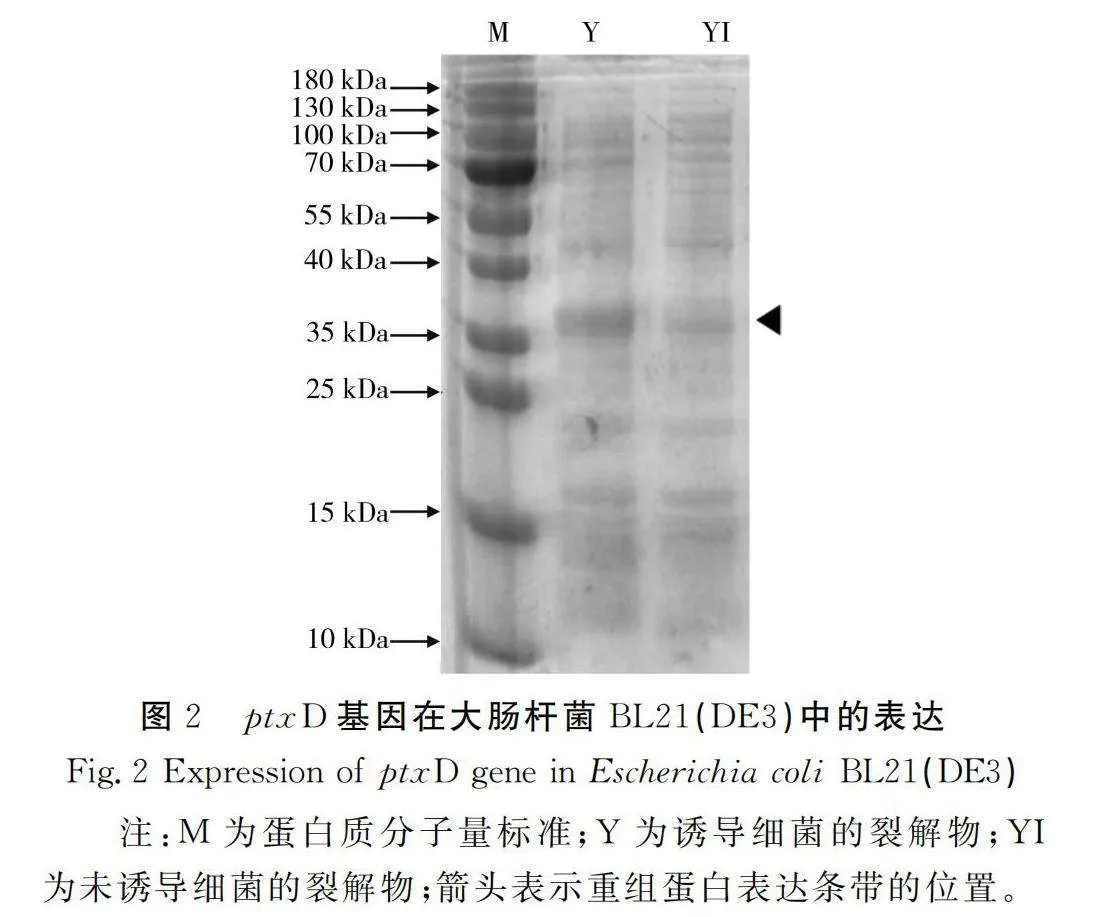
重组蛋白ptxD诱导表达:将重组质粒pET28a(+)-ptxD转化到大肠杆菌BL21(DE3)中,诱导表达及蛋白电泳方法参照文献[23]的方法。
1.2.2 ptxD基因在pUC19载体及基因组上的表达
pUC19-pJ23119-ptxD质粒构建:设计引物 puc-f1 和 puc-f2通过反向PCR方式将pUC19线性化;以施氏假单胞菌为模板,设计引物ptxD-1和ptxD-2,PCR扩增ptxD基因的同时,使ptxD基因带上pJ23119启动子。将ptxD序列和线性化的pUC19载体混合,使用T5 外切酶进行处理[22],处理产物化转到DH5α,涂布后用菌落PCR方式,利用验证引物Verify-ptxD1和Verify-ptxD2筛选质粒,筛得质粒测序成功后命名为pUC19-pJ23119-ptxD。在质粒pUC19-pJ23119-ptxD转化到E.coli WS100 中,得到菌株E.coli WS104。
重组工程菌WS105构建:以pKD4为模板,采用引物kk1和kk2扩增FRT-Kan-FRT。以pUC19-pJ23119-ptxD为模板,采用引物pp1和pp2扩增pJ23119-ptxD片段。采用融合PCR方法将FRT-Kan-FRT和pJ23119-ptxD融合:两片段以摩尔比1∶1混合,10个循环后,取出反应管加入引物CS-1和CS-2进一步扩增得到PCR产物,即为同源重组打靶片段。RED同源重组具体方法参考文献[21],利用引物Verify-iclr1和Verify-iclr2进行菌落PCR阳性重组子,再送至生工生物工程(上海)股份有限公司武汉分公司测序,验证重组子的正确性,测序无误后将该阳性克隆子继续进行抗性基因消除,将最终得到的菌株命名为E.coli WS105。
1.2.3 亚磷酸盐浓度对ptxD基因表达的影响
将3株菌株WS100、WS104、WS105分别在LB固体培养基上进行划线培养,在平板上挑选单菌落接种至50 mL LB液体培养基中,于37℃、200 r/min培养8~12 h。将培养好的菌株以1%的接种量接种至250 mL的种子培养基中,于37 ℃、200 r/min培养8~12 h,种子液以25%接种量接种至200 mL的摇瓶发酵培养基中,于37℃、200 r/min恒温振荡培养48 h,所有发酵设置3个平行。
1.2.4 ptxD基因表达对琥珀酸发酵的影响
将WS100、WS104、WS105大肠杆菌单菌落分别活化数代后接入种子培养基中,于200 r/min、37 ℃条件下摇瓶培养。当种子菌体浓度(OD600 nm )达到15左右时,按10%的接种量接入带有自动调节系统的7 L发酵罐中。发酵罐条件:3 L上罐发酵培养基中于37℃、转速300 r/min不通气发酵。初始糖含量100 g/L,当葡萄糖含量低于1%时,自动流加75%葡萄糖,控制发酵液葡萄糖浓度为1%。以4 mol/L NaOH和2.4 mol/L NaHCO3的混合液作为中和剂,通过自动流加方式控制pH值在6.8左右。定时对发酵液取样,检测生物量(OD600 nm)、有机酸含量[21]。
1.2.5 发酵产物分析
生物量(OD600 nm):采用可见分光光度计测量,波长选定600 nm。
葡萄糖含量测定:所取发酵液样品在10 000 r/min离心10 min,去除细胞残留,收集上清液,用超纯水稀释一定倍数,使用SBA-40D生物传感仪进行葡萄糖含量测定。
有机酸含量测定:发酵液按体积比1∶1加入6%的硫酸溶液进行处理,处理液漩涡振荡5 min后,以10 000 r/min离心10 min。离心后的上清液用流动相稀释后,用0.22μm滤膜过滤备用,使用高效液相色谱仪测量发酵液中的有机酸含量。分析条件:色谱柱Xtimate Sugar-H;流动相5 mmol/L H2SO4溶液;流速0.5 mL/min;柱温45℃;检测器PDA;检测波长210 nm;进样量10μL。
有机酸产量(g/L)=有机酸含量(g/L)×(取样时发酵液体积(L)/发酵液初始体积(L))。
2 结果与分析
2.1 pET28a(+)-ptxD、pUC19-pJ23119-ptxD质粒的构建
pET28a(+)-ptxD、pUC19-pJ23119-ptxD质粒的构建示意图见图1,其中pUC19-pJ23119-ptxD质粒采用pJ23119强组成性启动子,同时采用ptxD原有的核糖体结合位点。
2.2 重组蛋白ptxD诱导表达结果
诱导后的条带分子量与蛋白的理论分子量(36.6 kDa)相一致,表明ptxD克隆成功且能在载体pET28a上有效表达。
2.3 亚磷酸盐浓度对ptxD基因表达的影响
大部分能促进辅因子平衡的酶往往需要添加底物,如使用甲酸脱氢酶时往往添加了甲酸,但甲酸在低浓度下仍能抑制细胞生长[24],因此使用酶法平衡还原力时还需考虑底物添加浓度对细胞生长的影响,在产量和细胞生长方面做一些平衡。本文考虑了不同浓度的亚磷酸盐添加对琥珀酸发酵和细胞生长的影响。结果显示,没有ptxD基因的出发菌株WS100在含5~15 mmol/L亚磷酸盐的摇瓶发酵培养基中发酵效果较差(见表2),随着亚磷酸盐浓度的增加,生物量从14.08±1.04降低至1.77±0.11,琥珀酸和乙酸未检出;而ptxD基因在载体和基因组上表达的工程菌WS104、WS105在所研究的亚磷酸盐浓度范围内,相对于各自未添加亚磷酸盐的对照,生物量大多变化不显著,甚至部分有少量提高,在10 mmol/L时,展现出较高的糖耗速率和琥珀酸得率。表达ptxD条件下,亚磷酸盐在5~15 mmol/L范围内并未表现出对细胞生长的抑制性,可能与ptxD基因在大肠杆菌工程菌中得以有效表达相关,大肠杆菌将亚磷酸盐快速转化成磷酸盐,在降低亚磷酸盐对大肠杆菌生长抑制的同时,也平衡了还原力,促进了琥珀酸产量的提高。
2.4 ptxD分别在载体和基因组表达上发酵结果对比
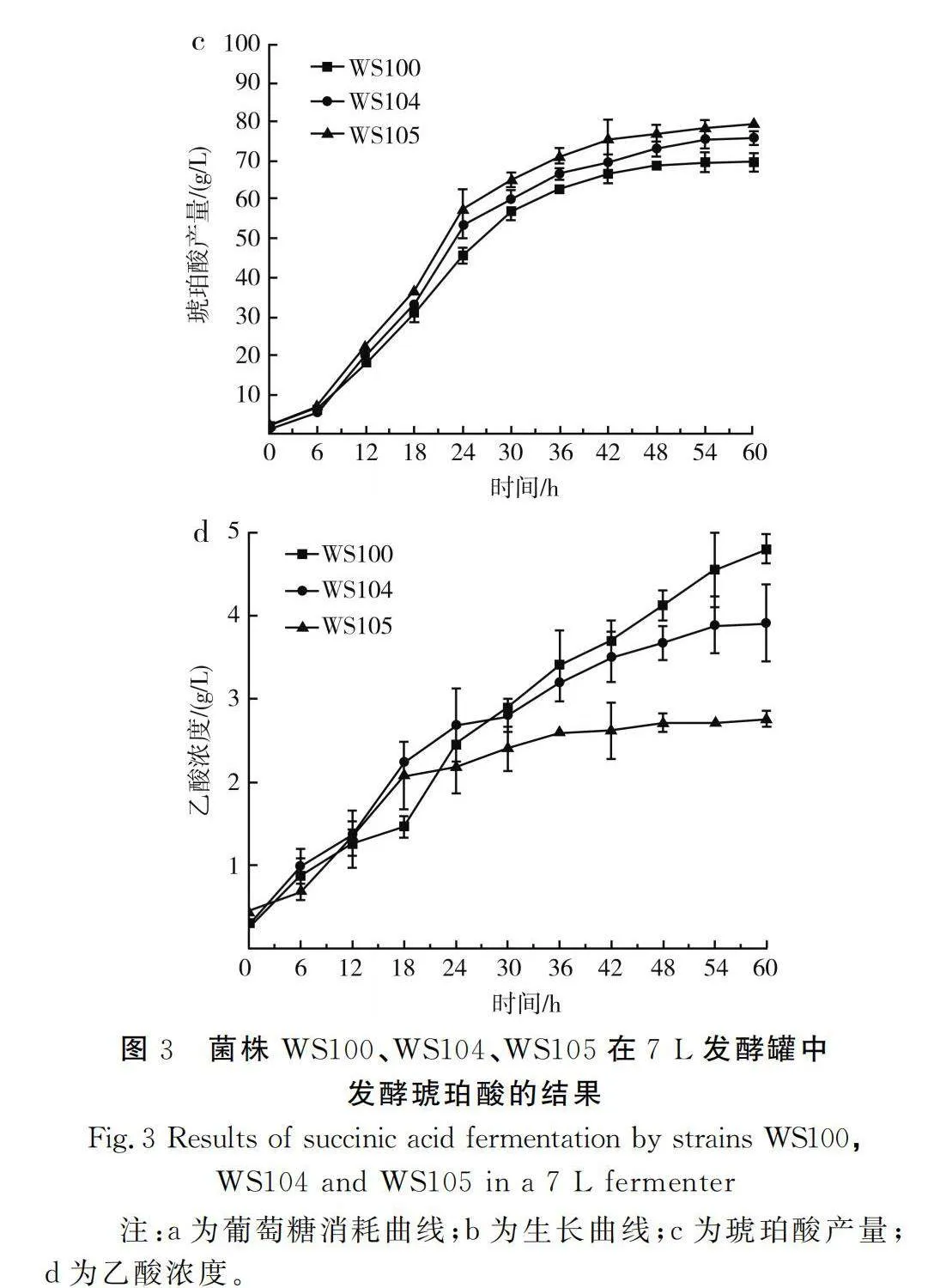
由图3可知,WS100、WS104、WS105均在发酵30 h时OD600 nm值达到最大,分别为19.6,20.1,21.6。与WS100相比,WS105和WS104菌体生长更明显,表明ptxD表达后有利于菌体生长。
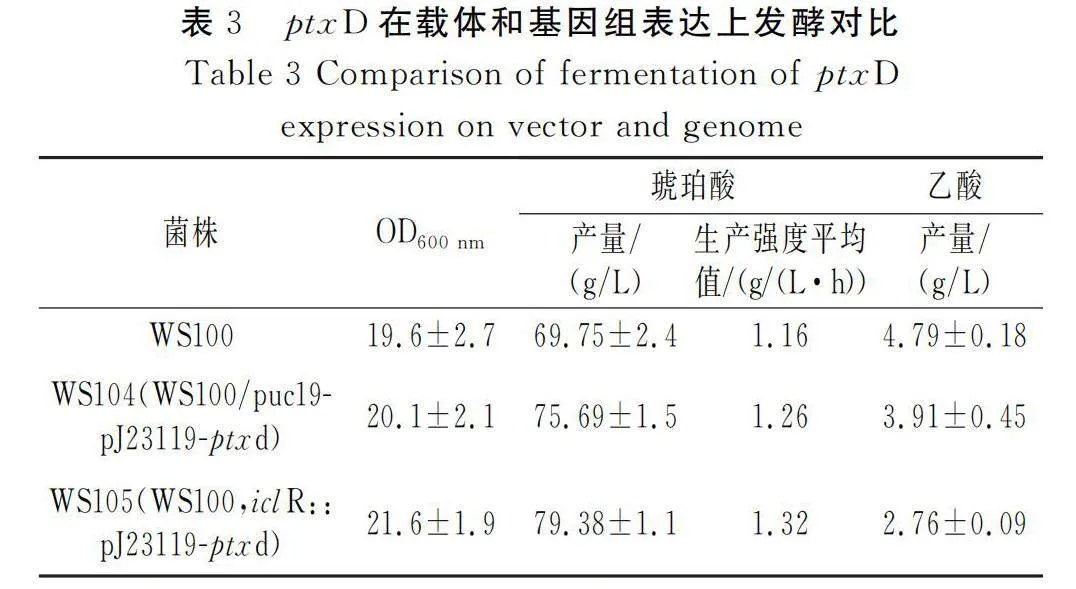
由表3可知,基因组上表达ptxD的工程菌WS105(WS100,iclR::pJ23119-ptxd)能积累79.38 g/L琥珀酸,较载体上表达ptxD的工程菌WS104(WS100/puc19- pJ23119-ptxd)提升了4.87%,较出发菌株WS100提升了13.81%。WS105副产物乙酸含量显著下降,浓度为2.76 g/L,较WS100、WS104分别降低了42.38%、29.41%。
相比于WS104,WS105虽然ptxD拷贝数较少,但生物量较高,发酵效果更好,表明pJ23119这种强启动子能在基因低拷贝的情况下满足基因表达的需要,WS104不仅基因拷贝数高,而且配上强启动子往往会对微生物生长带来一定负荷而影响发酵[25],且发酵过程中还需要添加一定抗生素来维持相关质粒存在,也进一步增加了成本和操作的复杂性。
3 结论
本研究探究了亚磷酸脱氢酶对大肠杆菌琥珀酸发酵的影响,成功克隆了来自施氏假单胞菌的ptxD至载体pET28a(+)上,并在BL21(DE3)中诱导表达,鉴定分子量为36.6 kDa。进一步将ptxD基因在pUC19载体和基因组上表达,并评价了亚磷酸盐浓度对ptxD基因表达的影响。结果表明,没有ptxD基因的出发菌株WS100在含5~15 mmol/L亚磷酸盐的摇瓶发酵培养基中发酵效果较差,随着亚磷酸盐浓度的增加,生物量从14.08±1.04降低至1.77±0.11,琥珀酸和乙酸未检出;而ptxD基因在载体和基因组上表达的工程菌WS104、WS105在所研究的亚磷酸盐浓度范围内表现出较好的生长和发酵结果。基因组上表达ptxD的工程菌WS105(WS100,iclR::pJ23119-ptxd)能积累79.38 g/L琥珀酸,较载体上表达ptxD的工程菌WS104(WS100/puc19-pJ23119-ptxd)提升了4.87%,较出发菌株WS100提升了13.81%。WS105的副产物乙酸含量显著下降,浓度为2.76 g/L,较WS100、WS104分别降低了42.38%、29.41%,表明亚磷酸盐的表达特别是在基因组上表达能有效促进琥珀酸产量的提高。
参考文献:
[1]向阳,李崎.啤酒中的琥珀酸[J].啤酒科技,2005(7):17-20.
[2]李国权,陆震鸣,余永建,等.镇江香醋有机酸风味特征的分析[J].中国调味品,2013,38(11):63-65.
[3]于江,于贞.琥珀酸高产菌株ASQ-1酱油发酵性能的初步研究[J].中国调味品,2019,44(11):37-39.
[4]李永歌,刘立新.琥珀酸二钠在食品中的应用[J].中国调味品,2013,38(3):109-111.
[5]李春波,邵斌.维生素E及其琥珀酸酯和琥珀酸钙在保健食品中的应用[J].中国药科大学学报,2003(2):94-96.
[6]贺喆,危当恒,唐惠芳.琥珀酸与代谢性疾病的研究进展[J].中国动脉硬化杂志,2022,30(5):454-460.
[7]张宁,苟妍,张力莉,等.琥珀酸对肉质性状及免疫反应影响的研究进展[J].动物营养学报,2022,34(12):7595-7601.
[8]吕陈秋,姜忠义,王姣.烟酰型辅酶NAD(P)+和NAD(P)H再生的研究进展[J].有机化学,2004,24(11):1366-1379.
[9]CHENAULT H K, WHITESIDES G M. Regeneration of nicotinamide cofactors for use in organic synthesis[J].Applied Biochemistry and Biotechnology,1987,14(2):147-197.
[10]WONG C, WHITESIDES G M. Enzyme-catalyzed organic synthesis: NAD(P)H cofactor regeneration by using glucose-6-phosphate and the glucose-5-phosphate dehydrogenase from Leuconostoc mesenteroides[J].Journal of the American Chemical Society,1981,103(16):4890-4899.
[11]LITSANOV B, BROCKER M, BOTT M. Toward homosuccinate fermentation: metabolic engineering of Corynebacterium glutamicum for anaerobic production of succinate from glucose and formate[J].Applied Environmental Microbiology,2012,78(9):3325-3337.
[12]BALZER G J, THAKKER C, BENNETT G N, et al. Metabolic engineering of Escherichia coli to minimize byproduct formate and improving succinate productivity through increasing NADH availability by heterologous expression of NAD(+)-dependent formate dehydrogenase[J].Metabolic Engineering,2013,20:1-8.
[13]NEUHAUSER W, STEININGER M, HALTRICH D, et al. A pH-controlled fed-batch process can overcome inhibition by formate in NADH-dependent enzymatic reductions using formate dehydrogenase-catalyzed coenzyme regeneration[J]. Biotechnology and Bioengineering,1998,60(3):277-282.
[14]KRAGL U, KRUSE W, HUMMEL W, et al. Enzyme engineering aspects of biocatalysis: cofactor regeneration as example[J]. Biotechnology and Bioengineering,1996,52(2):309-319.
[15]RELYEA H A, DONK V D, WILFRED A.Mechanism and applications of phosphite dehydrogenase[J].Bioorganic Chemistry,2005,33(3):171-189.
[16]KANDA K, ISHIDA T, HIROTA R, et al. Application of a phosphite dehydrogenase gene as a novel dominant selection marker for yeasts[J].Journal of Biotechnology,2014,182-183(1):68-73.
[17]GUO Z W, OU X Y, LIANG S, et al. Recruiting a phosphite dehydrogenase/formamidase-driven antimicrobial contamination system in Bacillus subtilis for nonsterilized fermentation of acetoin[J].ACS Synthetic Biology,2020,9(9):2537-2545.
[18]袁航,罗著,杨玉梅,等.土壤假单胞菌亚磷酸盐脱氢酶的基因克隆和原核表达及其酶活分析[J].生物技术通报,2018,34(8):130-137.
[19]杜怡青.Pseudomonas sp. M亚磷酸脱氢酶基因的克隆表达和酶性质的研究[D].杭州:浙江大学,2010.
[20]CAUSEY T B, ZHOU S, SHANMUGAM K T, et al. Engineering the metabolism of Escherichia coli W3110 for the conversion of sugar to redox-neutral and oxidized products: homoacetate production[J].Applied Biological Sciences,2003,100(3):825-832.
[21]赵锦芳,华渤文,王永泽,等.高产琥珀酸重组大肠杆菌的构建及厌氧发酵[J].食品与发酵工业,2013,39(1):6-10.
[22]GIBSON D G, YOUNG L, CHUANG R Y, et al. Enzymatic assembly of DNA molecules up to several hundred kilobases[J].Nature Methods,2009,6(5):343-345.
[23]唐梅,蔡松,付声亮,等. UdhA和博伊丁假丝酵母xylI基因共表达对木糖醇发酵的影响[J].安徽农业科学,2022,50(1):106-109.
[24]WARNECKE T, GILL R T. Organic acid toxicity, tolerance, and production in Escherichia coli biorefining applications[J].Microbial Cell Factories,2005,4(1):25.
[25]ROUCHES M V, XU Y, CORTES L B G, et al. A plasmid system with tunable copy number[J].Nature Communications,2022,13(1):3908.
