淹水胁迫对秋华柳内生细菌抗氧化能力的影响
2017-03-09蒋维皮玉东孔玉珊秦王阁阁
蒋维++皮玉东++孔玉珊++秦王阁阁++刘士平++薛艳红

摘要:以三峡河岸带植物秋华柳(Salix variegata)为研究对象,分离了其在淹水胁迫前后不同部位的内生细菌,在测定其总抗氧化能力的基础上,对部分具高抗氧化能力的内生细菌进行了生物学鉴定。结果共分离获得105株内生细菌,其中淹水前共分离54株,淹水后共分离51株。分析表明秋华柳内生细菌的多样性程度较高,无明显组织偏爱性,而且其丰富度和多样性不会显著受淹水胁迫影响。抗氧化试验结果表明,72 h是测定秋华柳内生细菌总抗氧化能力的最佳时间,淹水胁迫后的内生细菌抗氧化能力强,根部的内生细菌抗氧化能力强。筛选出2株具强抗氧化能力的内生细菌sar3和sar4,其发酵液的抗氧化值达到40 U/mL, 生物学鉴定结果显示,这2株菌都是耐寒短杆菌(Brevibacterium frigoritolerans)。
关键词:淹水胁迫;秋华柳(Salix variegata);内生细菌;抗氧化能力
中图分类号:Q945.78;Q949.733 文献标识码:A 文章编号:0439-8114(2017)01-0083-06
DOI:10.14088/j.cnki.issn0439-8114.2017.01.021
The Effects of Flooding Stress on Antioxidant Capacity of
Endophytic Bacteria from Salix variegata
JIANG Wei, PI Yu-dong, KONG Yu-shan, QIN Wang-ge-ge, LIU Shi-ping, XUE Yan-hong
(College of Life Science and Pharmacy, Three Gorges University, Yichang 443002, Hubei, China)
Abstract: This experiment focused on the Salix variegata plants living in three gorges riparian zone. We isolated the endophytic bacteria from various tissues before and after flooding stress, and performed biological assay based on the total antioxidant capacity analysis. Totally, 105 endophytic bacteria were acquired, involving 54 before flooding and 51 after flooding. These bacteria showed high biodiversity and no obvious tissue preference. Furthermore, bacteria diversity and abundance would be almost unaffected by flooding. According to the antioxidant results, 72 hours maybe the best time to determine the activity. After flooding the total antioxidant capacity of the endophytic bacteria was much higher, and so did the bacteria from roots. sar3 and sar4 were screened for the potent antioxidant capacity, since the maximal value got nearly to 40 U/mL. Biological discern indicated that both be Brevibacterium frigoritolerans.
Key words: flooding stress; Salix variegata; endophytic bacteria; antioxidant capacity
秋华柳(Salix variegata)是一种杨柳科柳属多年生植物,主要分布在中国云、贵、川、藏及长江中上游的溪流与河谷的岸坡地上,是三峡库区消落带的一种优势灌木[1]。由于其根系非常发达,可长时间忍受淹水胁迫,故秋华柳对水土保持有重要作用,是一种优良的护堤、护岸树种,也是库区消落带植被恢复与重建的主要物种之一[2]。大部分植物在水淹条件下由于供氧量减少,被迫进行不完全氧化,将会导致OH-、O2-等氧化自由基的积累,从而引起膜脂发生过氧化,致使生长发育受阻[3]。可是秋华柳在长江流域每年要承受4~6个月的淹水胁迫,长期的低氧环境使其进化出极强的抗氧化能力[1,2]。
近年来研究表明,许多高等植物的内生菌可帮助宿主应对各种生物和非生物胁迫环境,如病虫害、干旱、高温、低营养和高盐胁迫等[4,5]。特别是处于特殊生境下的植物,其体内的内生菌在协助寄主度过胁迫期中发挥着重要作用,如从海洋植物红树林中分离的内生菌,可提高植物对盐碱的抵抗能力[6];从沙漠地区麻黄中分离的内生菌Chaetomium chiversii,可显著提高拟南芥对高温和干旱的耐受能力[7]。此外,内生菌还可提高宿主植物对氧化胁迫的抵抗能力,增强对逆境的适应性[8,9]。Huang等[8]从29种传统中草药中分离出了292种不同形态类型的内生真菌,65%以上的内生真菌表现出很强的抗氧化作用。本实验室从同是三峡河岸带植物的疏花水柏枝(Myricaria laxiflora)中分離到163株内生真菌,大多数都显示出较强的抗氧化能力[9]。
为了探讨秋华柳的内生细菌是否也具有抗氧化能力,在秋华柳水淹胁迫前后共分离了105株内生细菌,在分析其分布规律后,利用总抗氧化试剂盒分析了其在胞外的抗氧化能力,并将一些代表性菌株进行了生物学鉴定,研究结果一方面为探究内生细菌协助秋华柳抗氧化胁迫的机理奠定基础,另一方面对新型抗氧化剂的筛选与研发有一定的积极意义。
1 材料与方法
1.1 材料
秋华柳采集自湖北宜昌胭脂坝;LB培养基:蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂15 g,加水至1 000 mL,调pH至7.2~7.4;次氯酸钠溶液(天津市天力化学试剂有限公司);液氮(宜昌蓝天气体有限公司);总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所);细菌Ezup柱式基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司);引物 F8和R1492(生工生物工程(上海)股份有限公司);dNTP、10×PCR buffer、ExTaq酶、PCR產物回收试剂盒(宝生物工程(大连)有限公司);T-AOC试剂盒(南京建成生工生物科技有限公司)。
洁净工作台(苏净集团苏州安泰空气技术有限公司)、PH-030A型培养箱(上海一恒科学仪器有限公司)、MyCycler PCR仪(美国BIO-RAD公司)、GDS-8000凝胶成像系统(美国UVP公司)、DYCP-31DN型水平电泳仪(北京市六一仪器厂)、UV752N紫外可见分光光度计(海佑科仪器仪表有限公司)、CH-AS恒温振荡器(国华电器有限公司)。
1.2 秋华柳内生细菌的分离
2014年5月和10月,在长江湖北宜昌段的胭脂坝,分别对淹水前(5月)和淹水后(10月)健康秋华柳植株的根、茎、叶取样,共取15株样品,每株间隔30 m以上。将样品用洗洁精和清水洗净后短时在4 ℃冰箱保存。
取淹水胁迫前后秋华柳植株的叶、根、茎各组织,切成0.5 cm×0.5 cm大小的块,先用75%乙醇漂洗60 s,然后用无菌水冲洗5次,再用3%的次氯酸钠漂洗60 s,最后再用无菌水冲洗5次。将最后一次漂洗材料用过的无菌水涂布于LB平板上,37 ℃培养2 d,观察有无菌落生长,确保所分离的内生细菌不是来自于样品表面[10]。
经表面消毒后的组织块接种于固体LB培养基中,每个平皿接种4个组织块,5次重复,37 ℃静置培养。培养1~2 d后,挑取植物组织周围的菌落转接入LB斜面上,经纯化后即得内生细菌。根据培养基上长出的菌落形态、大小、颜色等特征挑取不同的单菌落,再利用平板划线法进行纯化,得到的单菌落用甘油于-86 ℃保存。
将纯化的菌株接种到培养皿,37 ℃培养1~2 d后,观察菌落大小、颜色、边缘、质地、渗出物等指标,并进行革兰氏染色和显微形态观察。
1.3 菌株发酵液的总抗氧化性测定
将菌株用LB液体培养基活化,然后将发酵菌悬液先用纱布过滤,滤液10 000 r/min离心10 min,将所获得的上清液按照T-AOC总抗氧化试剂盒介绍的方法反应后在520 nm处测定吸光值,3次重复[9];以空白培养基作对照。
总抗氧化活力计算公式:
T-AOC(U/mL)=■
式中,ODU为测定管吸光度值,ODC为对照管吸光度值,N为反应体系稀释倍数(反应液总体积/取样量),n为样本测试前稀释倍数。
为确定菌株的最佳抗氧化时间,随机选取秋华柳淹水前后来自根、茎、叶不同部位的4株菌,每24 h测定一次总抗氧化能力。
1.4 内生细菌的生物学鉴定
依据《伯杰氏细菌鉴定手册》(第八版)[11]和《常见细菌系统鉴定手册》[12]进行生理生化指标的检测。将形态学观察、生理生化指标与16S rDNA测序同时进行。将内生细菌活化培养后,按照细菌基因组DNA试剂盒介绍的方法提取总DNA,然后以总DNA为模板,以F8:5′-AGAGTTTGATCCTGGCTCAG-3′和R1492:5′-GGTTACCTTGTTACGACTT-3′为引物扩增其16S rDNA序列[13]。反应体系共20 μL:模板DNA 1.0 μL,正向引物(20 pmol/L) 1.0 μL,反向引物(20 pmol/L)1.0 μL,dNTP mixture 2.0 μL,Taq DNA聚合酶0.2 μL,10×Buffer 2 μL,ddH2O 12.8 μL。PCR 扩增条件:94 ℃ 3 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 2 min,30 个循环;72 ℃ 10 min;4 ℃保存[13]。
将扩增获得的DNA片段用PCR纯化试剂盒回收,委托生工生物工程(上海)股份有限公司进行双向测序,重复2次,然后在GenBank中进行Blast比对分析,用MAGE 5.0软件做系统进化树。
2 结果与分析
2.1 秋华柳淹水前后不同部位内生细菌的分布
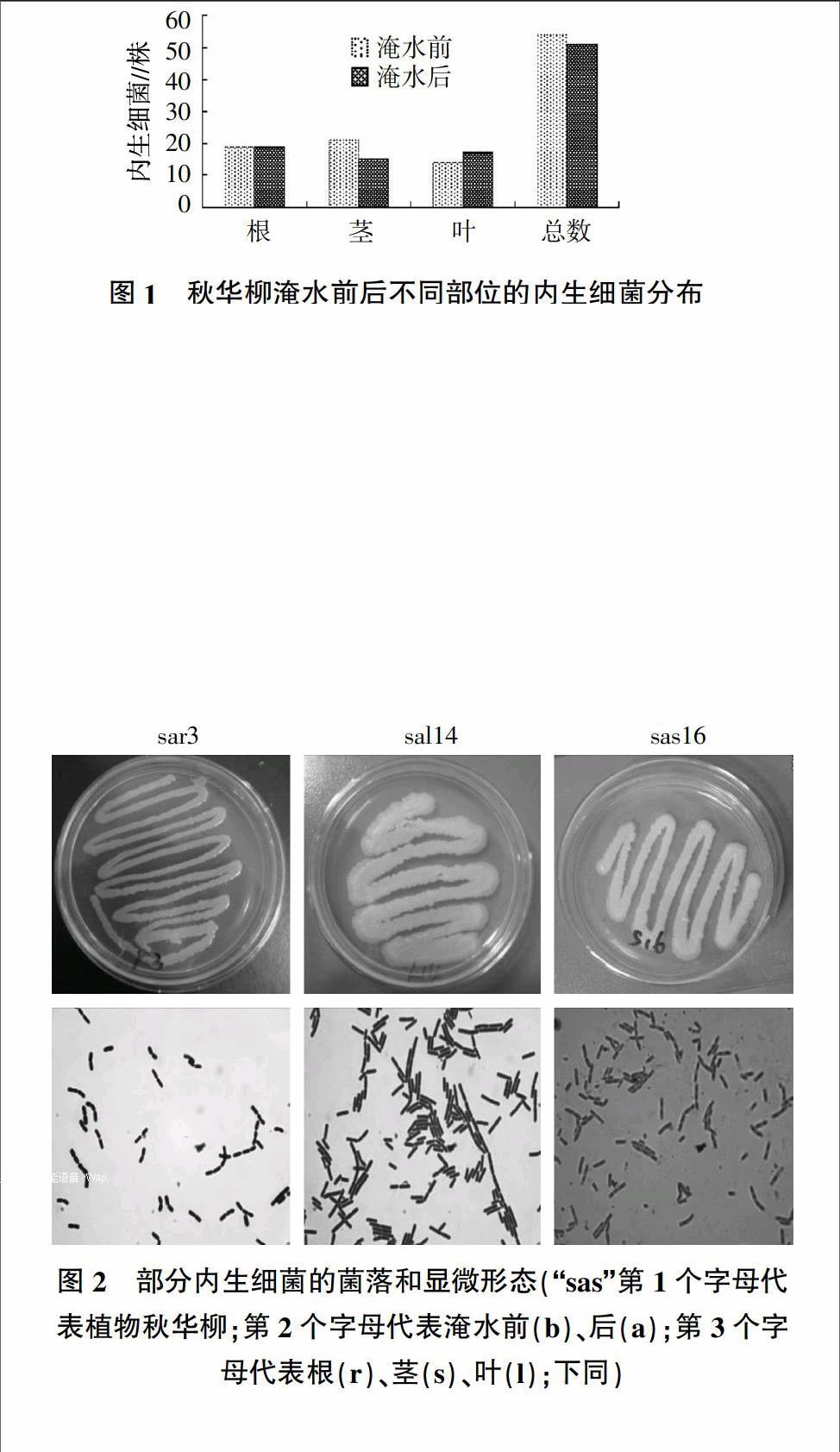
经过平板划线法对秋华柳淹水前后不同部位的内生细菌分离、纯化后,共获得105株内生细菌(图1)。淹水前共分离得到54株,其中19株来自于根,21株来自于茎,14株从叶中分离获得。在淹水后的秋华柳中共分离得到51株内生细菌,其中根19株,茎15株,叶17株。结果表明秋华柳在淹水前后内生细菌的总量变化不大,说明淹水胁迫对秋华柳内生细菌的数量影响不明显。此外,秋华柳根、茎、叶各个器官中都含有内生细菌,分布比较均匀,说明秋华柳的内生细菌对组织的偏爱性不强。
2.2 淹水前后内生细菌的形态特征
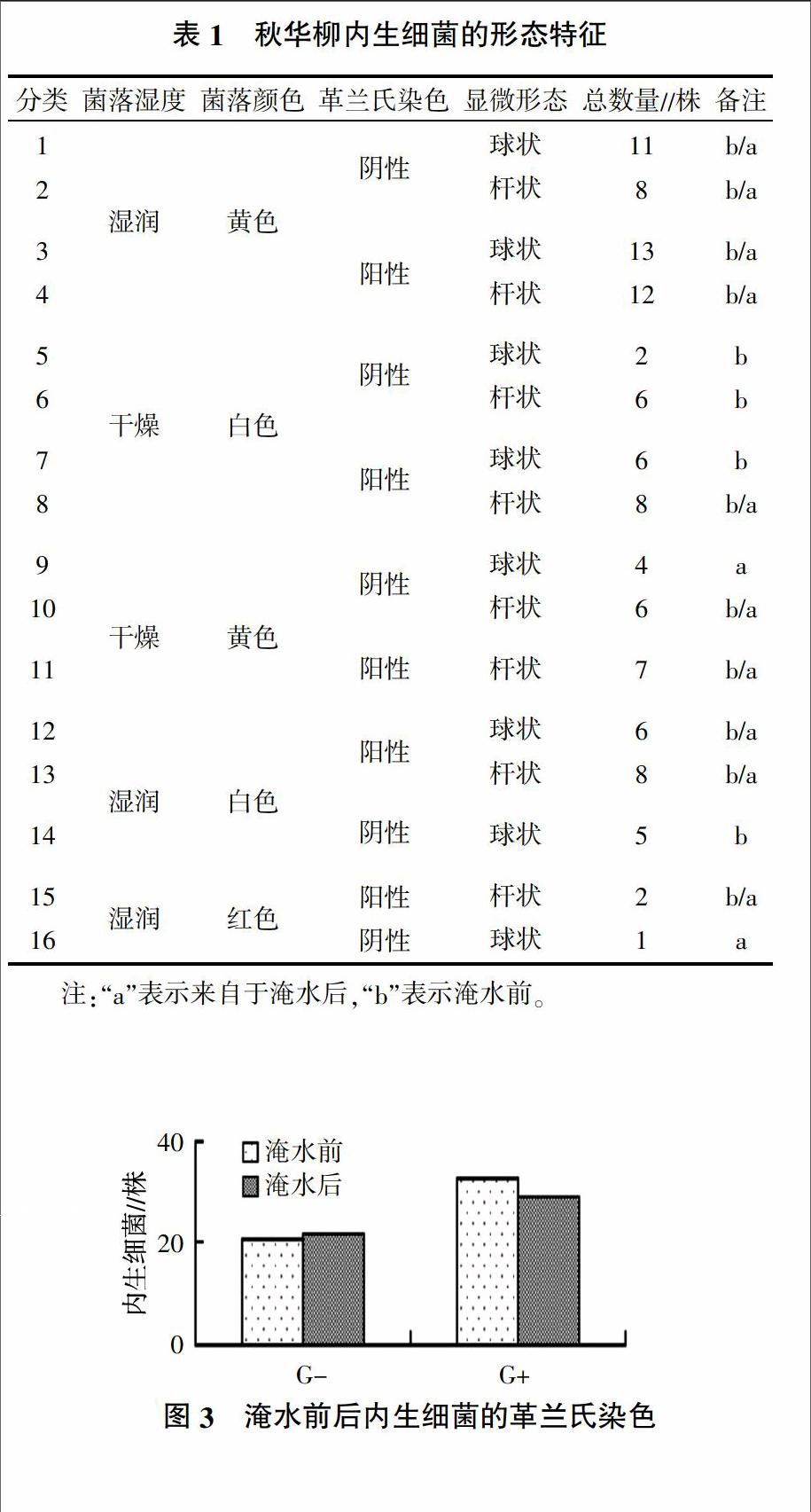
根据细菌分类指导手册[11,12],按照菌落湿度、菌落颜色、革兰氏染色和显微形态等指标(图2),可将淹水前后秋华柳分离的105株内生细菌划归为16类(表1),初步表明秋华柳内生细菌的多样性程度较高。
从表1可以看出,秋华柳的内生细菌主要集中在菌落表面湿润呈黄色的这一类中,有44株,占总数的41.90%;其次是菌落表面干燥呈白色的一类,有22株,占总数的20.95%。说明这两类细菌在秋华柳组织内为优势菌株,对其内生环境有很强的适应性。淹水前的秋华柳分离得到14类内生细菌,淹水后得到12类,说明大多数种类的内生细菌在淹水前后都存在,而且从整个数量来说也变化不大,表明淹水胁迫对秋华柳内生细菌的多样性和丰富性的影响可能不大。
不管是淹水胁迫前还是淹水胁迫后,秋华柳内生细菌中革兰氏阳性菌都比革兰氏阴性菌多(图3)。淹水前革兰氏阳性菌33株,革兰氏阴性菌21株;淹水后革兰氏阳性菌29株,革兰氏阴性菌22株。革兰氏阳性菌可能比革兰氏阴性菌对淹水胁迫敏感一些,因为淹水后革兰氏阴性菌的数量几乎没有变化,而阳性菌减少了4株,但是淹水胁迫本身不会很大程度上改变革兰氏阳性菌或阴性菌的分布。
2.3 淹水前后内生细菌的抗氧化能力分析
为了测定内生细菌的总抗氧化能力大小,先随机挑选了4株菌sbr2、sbr3、sbl3和sas5,根據不同发酵时间发酵液的抗氧化能力来判断其最佳发酵时间(图4)。结果表明,不同内生细菌的最佳抗氧化时间略有不同,但大致的最佳抗氧化时间表现出了一致性。72 h前总抗氧化性值随时间而增大,72 h后总抗氧化性值随时间变化而减小,故确定72 h为测定菌株的最佳抗氧化性时间。
将淹水前后秋华柳不同部位共105株内生细菌,培养72 h后测定其发酵液的抗氧化能力(表2)。从表2可以看出,不同内生细菌的抗氧化能力差异很大,但是都明显高于对照(2.34 U/mL)。最高值来自淹水胁迫后根部筛选的1株菌,达到41.90 U/mL,远比文献[10]报道的要高,说明秋华柳中的内生细菌具有极强的抗氧化活力。
淹水前细菌的平均抗氧化性值为5.66 U/mL,淹水后细菌的平均抗氧化性值为6.34 U/mL(图5)。而且不管是根、茎还是叶,淹水后秋华柳内生细菌的抗氧化能力明显高于淹水前,说明淹水胁迫将会影响秋华柳内生细菌的抗氧化活性,诱导高抗氧化活性内生细菌的出现。这一结果也表明秋华柳可能通过高抗氧化活性内生细菌来应对长时间的淹水胁迫。
高抗氧化活性的细菌具有明显的组织偏爱性。不管是在淹水前还是在淹水后,高抗氧化活性的内生细菌都主要出现在秋华柳的根部,茎部内生细菌的抗氧化能力次之,叶部最小,说明根部内生细菌对秋华柳抗氧化活性的影响最大。
2.4 部分典型内生细菌的生物学鉴定
将2株高抗氧化活性的内生细菌进行生物学鉴定。形态观察表明,sar3和sar4均可在LB固体培养基上迅速生长,sar3菌落呈淡黄色,菌落大小适中,边缘整齐,表面细湿光滑,细菌杆状,革兰氏染色为阳性。sar4也呈淡黄色,边缘呈暗红色,菌落大而呈圆形,边缘呈锯齿状,表面干燥且不光滑,细菌杆状,革兰氏染色亦为阳性。其生理生化指标见表3。
3 小结
试验从三峡河岸带植物秋华柳的根、茎和叶中共分离出105株内生细菌,其中淹水前共分离得到54株,淹水后共分离得到51株。根据形态观察,内生细菌的多样性程度较高,共可分为16类,且对组织的偏爱性不强。秋华柳内生细菌的数量和类型对淹水胁迫并不敏感,说明淹水胁迫不会显著影响秋华柳内生细菌的丰富度和多样性。
72 h是测定秋华柳内生细菌总抗氧化能力的最佳时间。淹水胁迫后的内生细菌比淹水前具有更强的抗氧化能力,根部的内生细菌较其他部位具有更强的抗氧化能力。
结合形态观察、生理生化指标分析和16S rDNA测序分析,对2株抗氧化能力最强的内生细菌进行了生物学鉴定,结果显示它们都是耐寒短杆菌,是一类潜在的抗氧化剂资源。
参考文献:
[1] 陈芳清,郭成圆,王传华,等.水淹对秋华柳幼苗生理生态特征的影响[J].应用生态学报,2008,19(6):1229-1233.
[2] 罗芳丽,曾 波,陈 婷,等.三峡库区岸生植物秋华柳对水淹的光合和生长响应[J].植物生态学报,2007,31(5):910-918.
[3] 张 阳,李瑞莲,张德胜,等.涝渍对植物影响研究进展[J].作物研究,2011,25(2):420-424.
[4] 王莉衡.植物内生菌的研究进展[J].化学与生物工程,2011,28(3):5-7.
[5] JI X,LU G,GAI Y,et al.Colonization of Morus alba L. by the plant-growth-promoting and antagonistic bacterium Burkholderia cepacia strain Lu10-1[J].BMC Microbiology,2010,20(10):243-249.
[6] WEYENS N,VAN DER LELIE D,TAGHAVI S,et al.Phytoremediation:Plant-endophyte partnerships take the challenge[J].Current Opinion in Biotechnology,2009,20(2):248-254.
[7] MCLELLAN C A,TURBYVILLE T J,WIJERATNE E M,et al. A rhizosphere fungus enhances Arabidopsis thermotolerance through production of an HSP90 inhibitor[J].Plant Physiology, 2007,145(1):174-182.
[8] HUANG W Y,CAI Y Z,XING J,et al.A potential antioxidant resource:Endophytic fungi from medicinal plants[J].Economic Botany,2007,61(1):14-30.
[9] ZENG W,QIN W,TIAN W,et al.Antioxidant activity in vitro of endophytic fungi from Myricaria laxiflora,a riparian plant with strong tolerance ability of flooding[J].Journal of Pure and Applied Microbiology,2015,9(1):87-95.
[10] XIONG D S. Kudzu isolation of endophytic bacteria and preliminary study of antioxidant activity of the fermentation product[J].Chemical Industry Times,2012,26(1):27-29.
[11] BUEHANAN R E,GIBBONS N E.伯杰氏细菌鉴定手册[M].第八版.北京:科学出版社,1984.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[13] 张 洁,万 芬,李玉权,等.半夏内生细菌的分离与鉴定[J].贵州农业科学,2014,42(3):95-97.
