磷脂酶CG2在溃疡性结肠炎小鼠模型中的表达
2025-01-25陆雪珂杨燕娄运伟常廷民


[摘要] 目的: 探讨磷脂酶CG2(phospholipase C Gamma 2,PLCG2)在溃疡性结肠炎(ulcerative colitis,UC)小鼠模型中的表达及意义。方法: 选择8~12周龄C57BL/6野生型(WT)雄性小鼠10只,其中5只分离不同肠段,另5只分离肠上皮细胞及固有层淋巴细胞,分别提取各个肠段和细胞总RNA,采用逆转录PCR(RT-PCR)和实时荧光定量PCR(qRT-PCR)检测 PLCG2 "mRNA表达。另选择8~12周龄WT雄性小鼠15只,随机分成3组,分别为对照组、急性发病期组和恢复期组,每组5只;急性发病期组和恢复期组用含2.5%葡聚糖硫酸钠饮用水饲养5 d,随后改为常规饮用水饲养,对照组予以常规饮用水饲养,在UC发展的不同阶段处理小鼠并提取其结肠固有层淋巴细胞;另选择8~12周龄WT雄性小鼠15只,以同样方式造模,提取小鼠结肠上皮细胞;RT-PCR和qRT-PCR检测结肠固有层淋巴细胞和肠上皮细胞中 PLCG2 "mRNA表达。结果: "PLCG2 "mRNA在WT小鼠结肠中表达与十二指肠、空肠、回肠、盲肠相比无明显差异( P gt;0.05)。 PLCG2 "mRNA在WT小鼠结肠固有层淋巴细胞中表达明显高于肠上皮细胞( P < 0.05)。在小鼠结肠固有层淋巴细胞中,与对照组相比,急性发病期组(第3天)和恢复期组(第9天) PLCG2 "mRNA相对表达均明显降低( P <0.05);在小鼠肠上皮细胞中, PLCG2 "mRNA在对照组、急性发病期组(第5天)和恢复期组(第9天)中相对表达无明显差异( P >0.05)。结论: "PLCG2 "mRNA在UC小鼠结肠固有层淋巴细胞中呈低表达,其可能在UC的发生发展中起一定作用。
[关键词] 溃疡性结肠炎;磷脂酶CG2(PLCG2);肠上皮细胞;固有层淋巴细胞
[中图分类号] R574.62" [文献标志码] A" [文章编号] 1671-7783(2025)01-0008-05
DOI: 10.13312/j.issn.1671-7783.y240012
[引用格式]陆雪珂, 杨燕, 娄运伟, 等. 磷脂酶CG2在溃疡性结肠炎小鼠模型中的表达[J]. 江苏大学学报(医学版), 2025, 35(1): 8-12, 20.
[基金项目]河南省自然科学基金资助项目(222300420066);河南省高校科技创新人才支持计划资助项目(23HASTIT049)
[作者简介]陆雪珂(1998—),女,硕士研究生;常廷民(通讯作者),主任医师,硕士生导师,E-mail: ctminmail@163.com
Expression of phospholipase C Gamma 2 in the mouse model of ulcerative colitis
LU Xueke1 , YANG Yan1 , LOU Yunwei2 , CHANG Tingmin1
(1. Department of Gastroenterology, the First Affiliated Hospital of Xinxiang Medical College, Xinxiang Henan 453003; 2. School of Medical Technology, Xinxiang Medical College, Xinxiang Henan 453100, China)
[Abstract] Objective: To investigate the expression and significance of phospholipase C Gamma 2 (PLCG2) "in ulcerative colitis (UC) mouse model. Methods: Ten male C57BL/6 wild-type (WT) mice aged 8 to 12 weeks were selected, 5 of which were used to isolate different intestinal segments, and the other 5 were selected to isolate intestinal epithelial cells (IECs) and colonic lamina propria lymphocytes (LPLs), and total RNA of each intestinal segment and cell was extracted, respectively. The expression of "PLCG2 "mRNA was detected by reverse transcription PCR (RT-PCR) and real-time fluorescence quantitative PCR (qRT-PCR). Another 15 WT male mice aged 8 to 12 weeks were randomly divided into 3 groups: control group, acute onset group and convalescent group, with 5 mice in each group. Mice in the acute onset and recovery groups were fed with drinking water containing 2.5% dextran sulfate sodium for 5 days and then fed with conventional drinking water, while those in the control group were fed with conventional drinking water. The mice were treated at different stages of UC development and LPLs were extracted. In addition, 15 WT male mice aged 8 to 12 weeks were selected to establish the model in the same way and then IECs were extracted. "PLCG2 "mRNA expression in LPLs and IECs was detected by RT-PCR and qRT-PCR, respectively. Results: There was no significant difference in the expression of "PLCG2 "mRNA in the colon of WT mice compared with that in the duodenum, jejunum, ileum and cecum ( P gt;0.05). The expression of "PLCG2 "mRNA in LPLs of WT mice was significantly higher than that in IECs ( P lt;0.05). Compared with the control group, the relative expression of "PLCG2 "mRNA in the acute onset group (day 3) and convalescent group (day 9) was significantly decreased in LPLs ( P lt;0.05). There was no significant difference in the relative expression of "PLCG2 "mRNA in IECs among the control group, the acute onset group (day 5) and the convalescent group (day "9) ( P gt;0.05). Conclusion: The expression of "PLCG2 "mRNA is down-regulated in the LPLs of UC mice, which may play a role in the occurrence and development of UC.
[Key words] ulcerative colitis; phospholipase C Gamma 2 (PLCG2); intestinal epithelial cells; lamina propria lymphocytes
溃疡性结肠炎(ulcerative colitis,UC)是一种影响结直肠黏膜的慢性炎症性疾病,其黏膜炎症特点为缓解与复发,典型症状包括腹泻、黏液脓血便和腹痛等,目前UC发病机制尚不明确,可能涉及遗传易感性、上皮屏障缺陷、免疫反应失调和环境因素等[1-2] 。目前临床上治疗UC的主要方法有传统药物及免疫抑制剂治疗、生物制剂治疗等[3] ,但是,均具有一定的不足之处。对可能参与UC发展的基因和遗传位点的识别有助于进一步了解潜在的免疫调节途径[4] 。
磷脂酶C(phospholipase C,PLC)将磷脂酰肌醇-4,5-二磷酸水解为肌醇1,4,5-三磷酸和二酰甘油,有PLCβ、PLCγ、PLCδ、PLCε、PLCη和PLCζ同工型[5] 。磷脂酶CG2(phospholipase C Gamma 2, PLCG2 )基因编码PLCγ2,PLCγ2是磷酸肌醇特异性磷脂酶C家族的成员之一,主要在淋巴和骨髓细胞中表达,在各种免疫和炎症中具有关键调节作用[6-7] 。PLCG2功能障碍与多种疾病有关,如自身炎症和PLCG2相关抗体缺乏和免疫失调(auto-inflammation and PLCG2-related antibody deficiency and immune dysregulation,APLAID)、阿尔茨海默病和慢性淋巴细胞白血病等[8-10] 。全基因组关联研究表明, PLCG2 常见变异与多基因炎症性肠病相关[11] 。研究发现, PLCG2 基因P645L和N798S突变为儿童炎症性肠病的致病性突变[12] 。目前,尚不清楚PLCG2是否参与UC的发生发展,本研究旨在探讨PLCG2在UC小鼠模型中的表达及意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/6野生型(WT)雄性小鼠,8~12周龄,体重22~26 g,40只,购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(浙)2019-0001。小鼠饲养于新乡医学院第一附属医院生命科学技术中心SPF级动物实验室,适应性喂养7 d。本实验获新乡医学院第一附属医院伦理委员会批准(伦理编号:EC-022-236)。
1.1.2 主要试剂与仪器 葡聚糖硫酸钠(dextran sulfate sodium,DSS;相对分子量为36 000~50 000)购自美国MP Biomedicals公司;DNA酶Ⅰ/牛胰腺脱氧核糖核酸酶Ⅰ、胶原酶Ⅷ/溶组织梭菌胶原酶Ⅷ购自德国Sigma公司;Percoll液购买自美国Cytiva公司;Trizol试剂、逆转录试剂盒和逆转录PCR(RT-PCR)试剂盒购自日本TaKaRa公司;实时荧光定量-PCR(qRT-PCR)试剂盒购自南京Vazyme公司; β -肌动蛋白和 PLCG2 引物由生物工程(上海)股份有限公司合成;RT-PCR和qRT-PCR仪购自上海Thermo公司。
1.2 方法
1.2.1 消化液和Percoll液配制 在DMEM高糖溶液中加入5%胎牛血清和1∶100胶原酶Ⅷ,1∶100 DNA酶Ⅰ,配制消化液。Percoll细胞分离液、10×PBS、DMEM高糖溶液分别按体积比1∶9∶15和2∶ 18∶5混合,配制成40% Percoll溶液和80% Percoll溶液。
1.2.2 分离不同肠段 采用颈椎脱臼法处死5只小鼠,分离十二指肠、空肠、回肠、盲肠和结肠并测量其长度;用剪刀纵向剪开结肠,PBS洗3遍。各个肠段分别取3 cm,加入1 mL Trizol研磨,于-80 ℃保存。
1.2.3 分离结肠上皮细胞 采用颈椎脱臼法处死小鼠,分离全结肠,用剪刀纵向剪开结肠,PBS洗3遍;剪成1 cm小块,置于含双抗、胎牛血清的HBSS中,37 ℃缓慢摇动30 min;用100 μm滤器过滤,取滤液备用。再将固体结肠组织放在含EDTA的PBS中37 ℃缓慢摇动30 min;再次用100 μm滤器过滤取滤液;将两次获得的滤液合并,于4 ℃行1 800 r/min离心5 min;弃上清液,取细胞沉淀;经上皮细胞特异性抗体——上皮细胞黏附分子染色,约85%以上细胞都是结肠上皮细胞。于-80 ℃保存。
1.2.4 分离结肠固有层淋巴细胞 将结肠上皮细胞分离后的固体结肠组织用PBS洗2遍,剪碎,置于配制好的消化液中37 ℃缓慢摇动90 min;用100 μm滤 器过滤,取滤液,于4 ℃行1 800 r/min离心5 min获取单细胞;加入40% Percoll溶液混匀,将其沿管壁缓缓加入含2.5 mL 80% Percoll溶液的离心管中,使两种溶液之间界限分明。以2 000 r/min离心20 min,吸取中层白色云雾状单个核细胞层,即固有层淋巴细胞,于-80 ℃保存。
1.2.5 RT-PCR和qRT-PCR检测 PLCG2 "mRNA表达 采用Trizol试剂提取上述组织及细胞中总RNA,按照试剂盒说明书行逆转录,即37 ℃ 15 min;85 ℃ 5 s;4 ℃保存,行RT-PCR,反应体系:10 μL,即3 μL双蒸水,1 μL cDNA,5 μL Premix "Taq 和上、下游引物各0.5 μL;程序:94 ℃ 30 s,55 ℃ 30 s,72 ℃ "30 s,30个循环。
qRT-PCR体系10 μL,即3 μL双蒸水,1 μL cDNA,5 μL ChamQ Universal SYBR qPCR Master Mix以及上、下游引物各0.5 μL;程序:95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;熔解曲线95 ℃ "15 s,60 ℃ 60 s,95 ℃ 15 s。采用2-ΔΔCt 法计算mRNA相对表达量。所用引物序列如下: PLCG2 ,上游引物5′-CCAACTCCTACGCCATCACCTT-3′,下游引物5′-ATAGAGCGCGTGCTTCTCGTAG-3′; β -肌动蛋白,5′-GGCTGTATTCCCCTCCATCG-3′,下游引物5′-CCAGTTGGTAACAATGCCATGT-3′。
1.3 动物模型实验
1.3.1 UC小鼠模型构建 取15只WT雄性小鼠,随机分成3组,分别为对照组、急性发病期组和恢复期组,每组5只;对照组予以常规饮用水,急性发病期组和恢复期组用含2.5% DSS饮用水饲养5 d,然后予以常规饮用水;将小鼠饮用含DSS水当日设为第0天,次日设为第1天,以此类推。每天记录小鼠体重变化及粪便情况,并行疾病活动指数(disease activity index,DAI)评分。
小鼠出现明显体重下降、肉眼血便/隐血阳性以及DAI评分升高,即为急性UC模型构建成功。
1.3.2 DAI评分 根据小鼠大便性状(正常为0分,松散为2分,稀便为4分)、体重下降百分数(不变为0分,1%~5%为1分,6%~10%为2分,11%~15%为3分,大于15%为4分)及隐血/肉眼血便情况(隐血阴性为0分,隐血阳性为2分,肉眼血便为4分)行DAI评分[13] 。
1.3.3 分离固有层淋巴细胞和结肠上皮细胞 采用颈椎脱臼法分别于第3天处死急性发病期组小鼠、第9天处死对照组和恢复期组小鼠,分离其固有层淋巴细胞。另取15只小鼠用相同方式诱导UC模型,采用颈椎脱臼法分别于第5天处死急性发病期组小鼠、第9天处死对照组和恢复期组小鼠,分离其结肠上皮细胞。
1.3.4 RT-PCR和qRT-PCR检测小鼠不同肠段及结肠上皮细胞和结肠固有层淋巴细胞中 PLCG2 "mRNA表达 具体方法同“1.2.5”。
1.4 统计学处理
采用GraphPad Prism 8.0软件进行统计学分析及绘图,符合正态分布的计量资料采用均数±标准差( x±s )表示,两组间比较采用独立样本 t 检验,多组间比较采用单因素方差分析,组间多重比较采用LSD- t 检验, P <0.05为差异有统计学意义。
2 结果
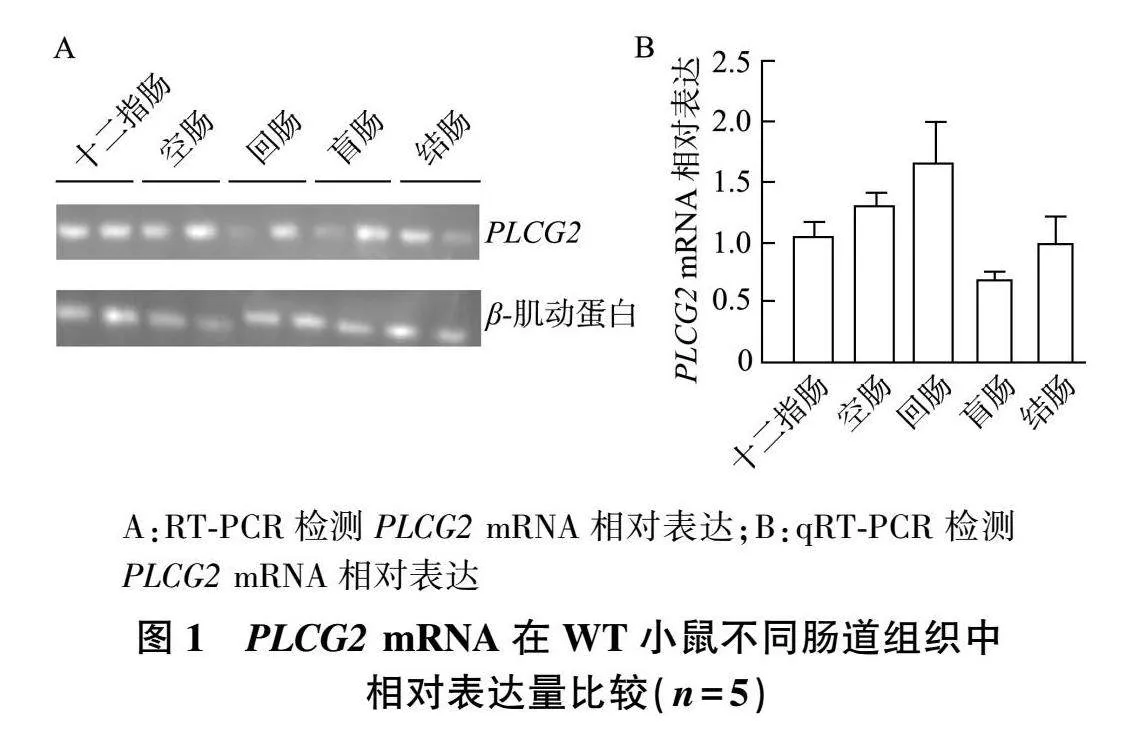
2.1 "PLCG2 "mRNA在WT小鼠不同肠道组织中的表达
RT-PCR结果显示, PLCG2 "mRNA在WT小鼠十二指肠、空肠、回肠、盲肠和结肠中表达未见明显差异(图1A);qRT-PCR结果显示, PLCG2 "mRNA在结肠中表达与其他肠道相比差异无统计学意义( P 均> 0.05,图1B)。
2.2 "PLCG2 "mRNA在WT小鼠结肠固有层淋巴细胞和肠上皮细胞中的表达
RT-PCR结果显示, PLCG2 "mRNA在WT小鼠结肠固有层淋巴细胞中表达高于肠上皮细胞(图2A);qRT-PCR结果显示, PLCG2 "mRNA在WT小鼠结肠固有层淋巴细胞中表达明显高于肠上皮细胞( t =8.408, P <0.001,图2B)。
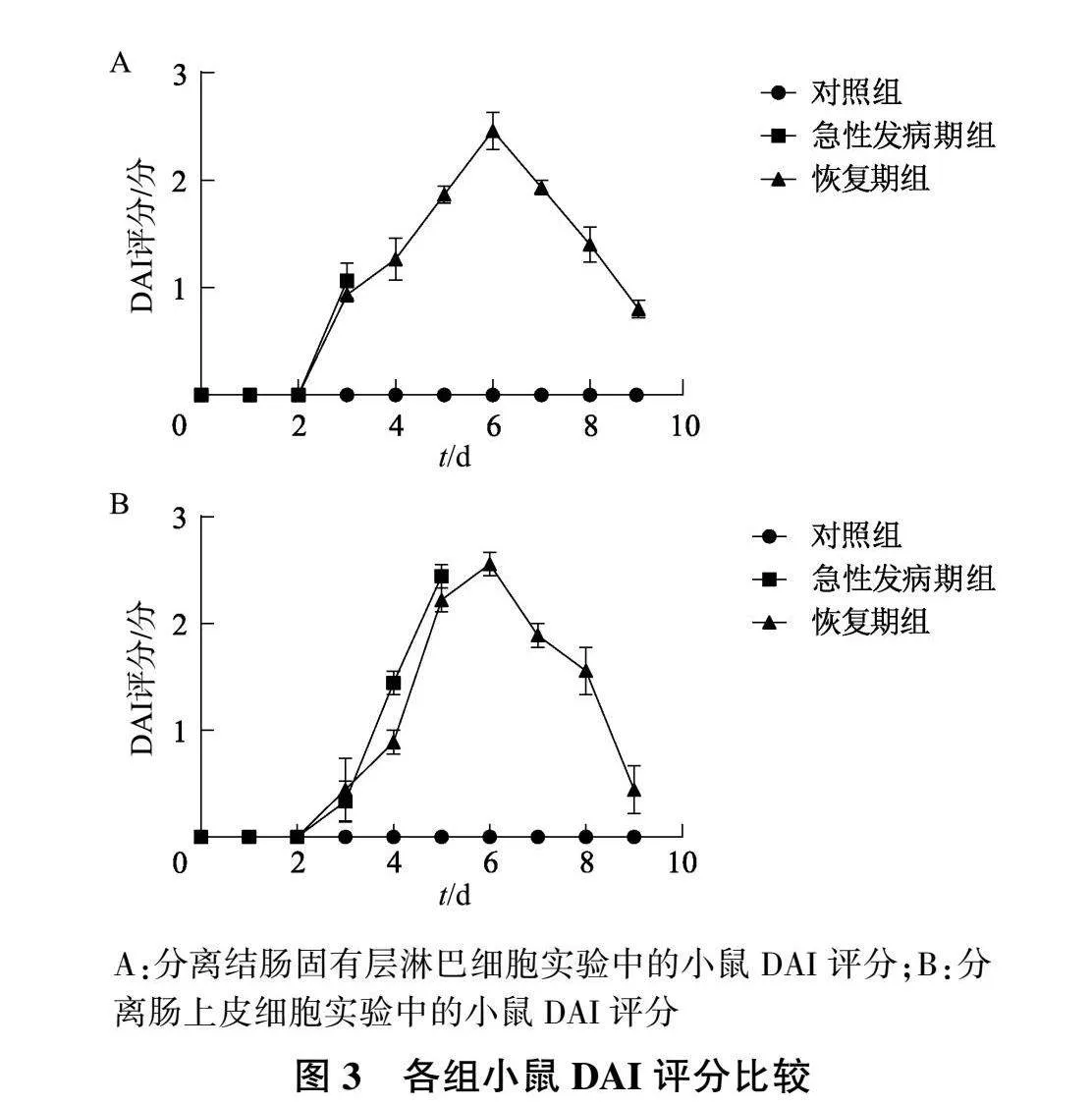
2.3 UC小鼠不同时间点DAI评分比较
在分离结肠固有层淋巴细胞实验中,与对照组相比,急性发病期组小鼠DAI评分第3天升高,恢复期组小鼠DAI评分于第3天开始升高,第6天开始下降(图3A);在分离肠上皮细胞实验中,急性发病期组小鼠DAI评分第3天升高,第5天明显升高;恢复期组小鼠DAI评分于第3天开始升高,第6天开始下降(图3B)。
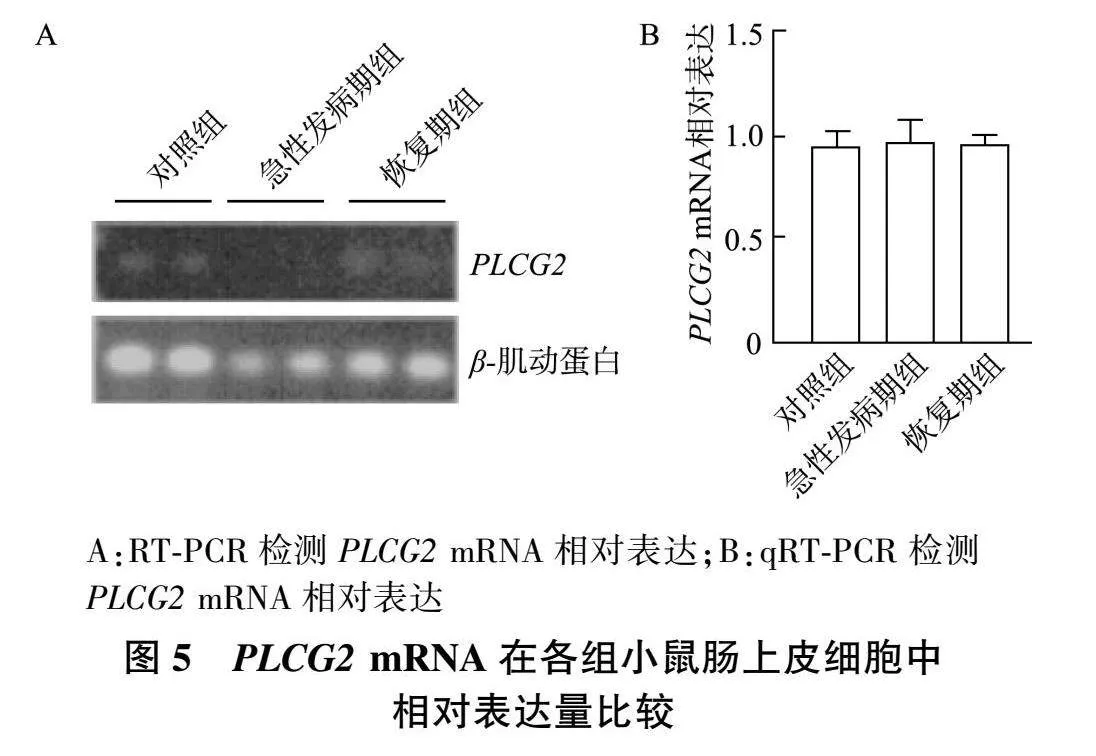
2.4 "PLCG2 "mRNA在UC小鼠结肠固有层淋巴细胞和肠上皮细胞中表达
RT-PCR结果显示(图4A),与对照组相比,急性发病期组结肠固有层淋巴细胞中 PLCG2 "mRNA表达降低,恢复期组表达变化不显著;qRT-PCR结果显示(图4B),与对照组相比,急性发病期组和恢复期组结肠固有层淋巴细胞中 PLCG2 "mRNA相对表达均明显降低( t =0.800,0.630, P 均<0.05),恢复期组 PLCG2 "mRNA相对表达较急性发病期组增加,但差异无统计学意义( P> 0.05)。
在肠上皮细胞中,RT-PCR(图5A)和qRT-PCR(图 5B)结果均显示,与对照组相比,急性发病期组和恢复期组 PLCG2 "mRNA相对表达变化不显著( P gt;0.05)。
3 讨论
PLCG2在单核细胞、巨噬细胞、自然杀伤T细胞、树突状细胞和肥大细胞中表达,可通过多种途径介导先天免疫反应及调节炎症反应[5,14-15] 。肠道固有层淋巴细胞包括B淋巴细胞、T淋巴细胞和巨噬细胞等,主要功能为合成、分泌IgA和IgM,是肠黏膜局部免疫的重要组分[16] 。本研究结果显示, PLCG2 "mRNA在结肠及其他肠段表达无明显差异,这可能与PLCG2主要在免疫细胞中表达相关。肠上皮细胞凋亡发生在UC早期阶段,过度凋亡致上皮防御系统破坏,促进管腔抗原入侵,引发炎症级联反应并加快疾病进展[17] 。本研究结果显示, PLCG2 "mRNA在WT小鼠结肠固有层淋巴细胞中表达高于肠上皮细胞,说明PLCG2主要在肠道免疫细胞中表达,其可能通过影响固有层淋巴细胞进而在急性UC中起一定的调控作用,但其具体作用机制有待进一步研究。
本研究结果显示,在第3天时小鼠出现体重下降、大便性状改变或者血便,DAI评分上升,提示小鼠出现肠道炎症;因此,在第3天处死急性发病期组小鼠获得急性发病期结肠固有层淋巴细胞样本;在第9天时小鼠体重较之前增加,大便成形,血便减少,DAI评分下降,提示肠道炎症恢复;因此,在第9天处死恢复期组小鼠获得恢复期固有层淋巴细胞样本。本研究结果显示,与对照组相比,急性发病期组和恢复期组小鼠结肠固有层淋巴细胞中 PLCG2 "mRNA相对表达均明显降低( P lt;0.05)。PLCG2功能障碍可导致APLAID,在目前已报道的APLAID患者中,胃肠道可作为其累及的器官之一,主要的临床表现包括UC和腹泻、腹痛,此外部分患者可出现免疫缺陷,包括低IgG、低IgM、低IgA、低B淋巴细胞计数和低NK细胞计数[18-19] 。本研究发现 PLCG2 "mRNA在UC小鼠模型急性发病期及恢复期的结肠固有层淋巴细胞中的表达均下降,由此提示PLCG2通过影响结肠固有层淋巴细胞参与UC的发生发展,并且结合APLAID患者的免疫学特征,其可能通过调节B细胞、T细胞和(或)NK细胞功能从而影响UC的发生发展,具体机制有待进一步研究。此外,恢复期组 PLCG2 "mRNA相对表达较急性发病期组升高,但差异不显著( P gt;0.05),由于本实验选取的是小鼠在第3天急性发病过程和第9天恢复过程中 PLCG2 "mRNA表达比较,可能无法完全反应在整个疾病发生发展过程中 PLCG2 "mRNA表达变化,后续可在急性发病期和恢复期各多选取几个时间节点进行比较。
尽管UC确切病因尚不清楚,但已经证实肠道上皮屏障的破坏在UC发病过程中起关键作用[17] 。为了解PLCG2是否通过影响肠上皮细胞进而参与UC的发病,本研究再次用2.5% DSS饮用水饲养小鼠建造UC模型。在DSS诱导第3天时,小鼠体重变化不明显、血便不明显,因此继续诱导,在第5天时,小鼠发病明显,DAI评分明显升高,因此在第5天处死急性发病期组小鼠获得急性发病期结肠上皮细胞样本;同样在第9天处理恢复期组小鼠获得恢复期肠上皮细胞标本;结果显示, PLCG2 "mRNA相对表达量在急性发病期组和恢复期组肠上皮细胞中无明显差异,进一步表明PLCG2可能是通过结肠固有层淋巴细胞而不是肠上皮细胞在急性UC的发生发展中发挥作用。
综上所述, PLCG2 "mRNA在UC小鼠结肠固有层淋巴细胞中表达下调,其可能通过影响结肠固有层淋巴细胞功能等,在UC发生发展中发挥一定作用,具体何种作用还有待进一步研究。此外,本研究仅通过动物模型检测小鼠结肠固有层淋巴细胞和肠上皮细胞中 PLCG2 "mRNA表达,未利用血细胞进行实验,也未利用UC患者结肠样本进行验证,后续有待从蛋白和组织水平以及不同细胞水平探索PLCG2影响UC进程的具体机制。
[参考文献]
[1] Ungaro "R, Mehandru S, Allen PB, et al. Ulcerative colitis[J]. Lancet, 2017, 389(10080): 1756-1770.
[2] 商 梦晗, 张兆美, 焦建新. 溃疡性结肠炎多组学生物标志物的研究进展[J]. 中国临床研究, 2024, 37(3): 455-459.
[3] 陈 香, 许新微, 张朝阳, 等. 白藜芦醇治疗炎症性肠病的研究进展[J]. 江苏大学学报(医学版), 2019, 29(2): 179-184.
[4] Du "L, Ha C. Epidemiology and pathogenesis of ulcerative colitis[J]. Gastroenterol Clin North Am, 2020, 49(4): 643-654.
[5] Bae "YS, Lee HY, Jung YS, et al. Phospholipase Cγ in toll-like receptor-mediated inflammation and innate immunity[J]. Adv Biol Regul, 2017, 63: 92-97.
[6] Szymanski "AM, Ombrello MJ. Using genes to triangulate the pathophysiology of granulomatous autoinflammatory disease: NOD2, PLCG2 and LACC1[J]. Int Immunol, 2018, 30(5): 205-213.
[7] Ombrello "MJ, Remmers EF, Sun G, et al. Cold urticaria, immunodeficiency, and autoimmunity related to PLCG2 deletions[J]. N Engl J Med, 2012, 366(4): 330-338.
[8] Jackson "JT, Mulazzani E, Nutt SL, et al. The role """""of PLCγ2 in immunological disorders, cancer, and neurodegeneration[J]. J Biol Chem, 2021, 297(2): 100905.
[9] Kutukculer "N, Topyildiz E, Berdeli A, et al. Four diseases, PLAID, APLAID, FCAS3 and CVID and one gene (PHOSPHOLIPASE C, GAMMA-2; "PLCG2 ): striking clinical phenotypic overlap and difference[J]. Clin Case Rep, 2021, 9(4): 2023-2031.
[10] Zhou "Q, Lee GS, Brady J, et al. A hypermorphic missense mutation in PLCG2, encoding phospholipase Cγ2, causes a dominantly inherited autoinflammatory disease with immunodeficiency[J]. Am J Hum Genet, 2012, 91(4): 713-720.
[11] De "Lange KM, Moutsianas L, Lee JC, et al. Genome-wide association study implicates immune activation of multiple integrin genes in inflammatory bowel disease[J]. Nat Genet, 2017, 49(2): 256-261.
[12] 杨 惠芳. PLCG2基因P645L和N798S突变在儿童炎症性肠病中的致病机制初探[D]. 汕头: 汕头大学, 2021.
[13] 赵 珊, 王鹏程, 王秋红, 等. 小鼠葡聚糖硫酸钠急性溃疡性结肠炎模型的建立和评价[J]. 辽宁中医药大学学报, 2016, 18(2): 42-45.
[14] Magno "L, Bunney TD, Mead E, et al. TREM2/PLCγ2signalling "in immune cells: function, structural insight, and potential therapeutic modulation[J]. Mol Neurodegener, 2021, 16(1): 22.
[15] Walliser "C, Tron K, Clauss K, et al. Rac-mediated stimulation of phospholipase Cγ2 amplifies B Cell receptor-induced calcium signaling[J]. J Biol Chem, 2015, 290(28): 17056-17072.
[16] 甄 建华, 黄光瑞. 溃疡性结肠炎病因和发病机制的现代医学研究进展[J]. 世界华人消化杂志, 2019, 27(4): "245-251.
[17] Yang "WJ, Han FH, Gu YP, et al. TGR5 agonist inhibits intestinal epithelial cell apoptosis via cAMP/PKA/c-FLIP/JNK signaling pathway and ameliorates dextran sulfate sodium-induced ulcerative colitis[J]. Acta Pharmacol Sin, 2023, 44(8): 1649-1664.
[18] Wu "N, Zhang B, Wang T, et al. Case report: A rare case of autoinflammatory phospholipase Cγ2 (PLCγ2)-associated antibody deficiency and immune dysregulation complicated with gangrenous pyoderma and literature review[J]. Front Immunol, 2021, 12: 667430.
[19] Neves "JF, Doffinger R, Barcena-Morales G, et al. Novel "PLCG2 "mutation in a patient with APLAID and cutis laxa[J] . Front Immunol, 2018, 9: 2863.
[收稿日期] 2024-01-06" [编辑] 刘星星
