脓毒症患者肝损伤风险预测模型的构建和验证
2025-01-25陈闪闪嵇金陵潘胜男王琼李畅姜玉章时汀






[摘要] 目的: 研究脓毒症患者发生脓毒症相关肝损伤(sepsis-associated liver injury,SALI)风险的影响因素,建立并验证预测患者发生SALI风险的模型。方法: 选择2019年1月至2022年1月于南京医科大学附属淮安第一医院重症医学科(ICU)收治的脓毒症患者415例,根据临床诊断结果分为SALI组( n =97)和非SALI组( n =318),收集患者基本信息和临床资料,采用最小绝对收缩和选择算子(LASSO)回归行单因素筛选;然后采用多因素Logistic回归进一步筛选,并以此构建列线图模型;采用bootstrap法对模型进行内部验证以评估列线图性能,包括区分度、准确度和临床适用度。结果: LASSO回归筛选出9个变量;多因素Logistic回归进一步显示总胆红素、丙氨酸氨基转移酶、γ-谷氨酰基转肽酶、机械通气、肾功能衰竭、国际标准化比值和急性呼吸衰竭为SALI的独立危险因素;以此构建的模型行内部验证显示ROC曲线下面积为0.823(95% CI :0.773~0.873);同时模型表现出理想的准确度( P >0.05);决策曲线分析结果显示,该预测模型预测脓毒症患者发生SALI风险在5%~100%阈值范围内产生净收益。结论: 总胆红素、丙氨酸氨基转移酶、γ-谷氨酰基转肽酶、机械通气、肾功能衰竭、国际标准化比值和急性呼吸衰竭是影响脓毒症患者发生SALI的独立危险因素,基于此所建立的列线图模型具有较好的预测价值。
[关键词] 脓毒症;脓毒症相关肝损伤;风险;筛选;预测;列线图
[中图分类号] R631" [文献标志码] A" [文章编号] 1671-7783(2025)01-0062-08
DOI: 10.13312/j.issn.1671-7783.y240009
[引用格式]陈闪闪, 嵇金陵, 潘胜男, 等. 脓毒症患者肝损伤风险预测模型的构建和验证[J]. 江苏大学学报(医学版), 2025, 35(1): 62-69.
[作者简介]陈闪闪(1986—),女,主管检验师,主要从事疾病模型构建等研究;时汀(通讯作者),博士,主治医师,E-mail: shitinggdk@163.com
Construction and validation of liver injury risk prediction model in patients with sepsis
CHEN Shanshan1 , JI Jinling1 , PAN Shengnan1 , WANG Qiong1 , LI Chang1 , JIANG Yuzhang1 , SHI Ting2
(1. Department of Medical Laboratory Center, 2. Department of Hepatobiliary and Pancreatic Surgery, the Affiliated Huai′an "No.1 People′s "Hospital of Nanjing Medical University, Huai′an "Jiangsu 223300, China)
[Abstract] Objective: To investigate the influencing factors of the risk of sepsis-associated liver injury (SALI) "in patients with sepsis, and establish and verify a model for predicting the risk of SALI. Methods: A total of 415 patients with sepsis admitted to the Intensive Care Unit (ICU), the Affiliated Huai′an "No.1 People′s "Hospital of Nanjing Medical University, from January 2019 to January 2022 were enrolled and divided into SALI group ( n =97) and non-SALI group ( n =318), according to clinical diagnosis. Basic information and clinical data of patients were collected. Least absolute shrinkage and selection operator (LASSO) regression was used for univariate screening. Then, multivariate Logistic regression was used to further select the risk factors and construct the model based on the nomogram. The performance of the nomogram, including differentiation, accuracy and clinical utility, was evaluated through internal validation by using bootstrap method. Results: Nine variables were selected by LASSO regression for multivariate analysis. Multivariate Logistic regression further showed that total bilirubin, alanine aminotransferase, γ-glutamyl transpeptidase, mechanical ventilation, renal failure, international normalized ratio, and acute respiratory failure were independent risk factors for SALI. The internal validation of the constructed model showed that the area under the ROC curve was 0.823 (95% CI : 0.773-0.873), and the model demonstrated satisfactory accuracy ( P gt;0.05). Decision curve analysis indicated that the prediction model could generate a net benefit within the threshold range of 5% to 100% for predicting the risk of developing SALI in sepsis patients. Conclusion: Total bilirubin, alanine aminotransferase, γ-glutamyl transpeptidase, mechanical ventilation, renal failure, international normalized ratio, and acute respiratory failure were independent risk factors for SALI in patients with sepsis, and the nomogram model established based on above factors had good predictive value.
[Key words] sepsis; sepsis-associated liver injury; risk; screening; prediction; nomogram
脓毒症是导致ICU患者死亡率升高的重要原因[1] 。国际脓毒症生存委员会将脓毒症定义为一种危及生命的状况,机体对感染的应激反应导致器官功能障碍,通常伴随广泛的炎症和器官衰竭[2] 。
肝脏在机体抗感染中发挥重要作用,这归因于肝窦中丰富的噬菌细胞和多样化的淋巴细胞;肝脏通过肝肠轴和胆酸分泌与肠道菌群一起维护胃肠道的微生物屏障[3-5] 。在脓毒症中,机体炎症反应可破坏肠道屏障的完整性,增加其渗透性,从而导致肠道微生物进入血液循环,通过门静脉达到肝脏,导致进一步的肝脏损伤[6] 。此外,尽管肝脏强大的免疫系统有助于清除微生物,但由于过度炎症反应,可导致肝脏自身损伤[7] 。
脓毒症相关肝损伤(sepsis-associated liver injury,SALI)的发生涉及多种机制,如微循环紊乱、免疫调节失调和全身性炎症反应[8] ;SALI主要表现为胆汁淤积型和(或)肝细胞损害型[9] 。目前文献报道SALI在脓毒症患者中发生率差异较大(12.0%~46.6%)[10-12] ,这可能与患者疾病严重程度不同相关。研究显示,重症脓毒症患者SALI发生率(46.6%)明显高于普通脓毒症患者(12.0%)[11-12] 。SALI不仅发生率高,其病死率也高,达61.5%[13] ,这与多个危险因素有关:首先,脓毒症本身可导致多器官功能障碍;其次,低氧性肝炎会增加额外风险;再者,肝功能受损导致药物毒性增加[2,14-15] 。值得注意的是,早期识别和及时干预可显著改善患者预后[7,16] 。然而,目前尚缺乏针对SALI的特异性预测工具。因此,本研究旨在探讨与SALI相关的危险因素,并利用相关独立危险因素构建和验证预测模型。
1 病例和方法
1.1 研究对象
选择2019年1月至2022年1月于南京医科大学附属淮安第一医院因脓毒症而入院的患者472例,排除57例,最终纳入415例。其中,符合SALI诊断标准的为SALI组,其余为非SALI组。
纳入标准:根据Sepsis 3.0指南诊断为脓毒症者;年龄≥18岁;在ICU停留时间≥48 h;对于在住院期间多次进入ICU者,仅调取第一次医疗记录。排除标准:年龄<18岁;ICU停留时间<48 h;入院24 h内 即诊断为SALI;肝外伤、药物性肝炎、中毒性肝炎、病毒性肝炎(急性或慢性)、肝坏死、肝功能衰竭(急性或慢性)、慢性肝病和肝硬化等原发性肝脏疾病患者;胆管炎和胆囊急性炎症伴胆道梗阻患者;胆管和壶腹部肿瘤患者;自身免疫性肝炎患者;肝脏血管梗死患者。本研究经医院伦理审查委员会批准(批准号:KY-2023-156-01)。由于数据已进行匿名化处理,无需签署知情同意书。
1.2 临床特征与实验室指标收集
收集患者年龄、性别等人口统计学数据;恶性肿瘤、脑血管疾病、慢性肾脏疾病、慢性肺部疾病、慢性心力衰竭、陈旧性心肌梗死、心房颤动、糖尿病(有无并发症)、高脂血症和高血压等慢性并发症[均 根据国际疾病分类(International Classification of Diseases,ICD)-9和ICD-10定义];脓毒性休克、急性器官损伤、感染部位和病原微生物存在情况,入ICU时首次实验室检查结果(入ICU后24 h内进行)以及支持性治疗的执行情况,包括机械通气和血管活性药物等使用情况;患者在ICU期间第一次简化急性生理学评分Ⅱ(simplified acute physiological score Ⅱ,SAPS Ⅱ)和序贯器官衰竭评估(sequential organ failure assessment,SOFA)评分(入ICU后24 h内完成)。
1.3 诊断标准
目前,SALI诊断标准尚未标准化。SALI分为两类:胆汁淤积型和肝细胞损害型;肝细胞损害型表现为患者丙氨酸氨基转移酶水平超过正常范围上限(本 实验室所用丙氨酸氨基转移酶试剂盒参考区间上限为40 U/dL)十倍以上[17] ;胆汁淤积型表现为患者血清总胆红素水平超过2 mg/dL[13,18] 。肝细胞损害和胆汁淤积可单独出现,也可同时出现,只要出现以上一种形式,即可诊断为SALI[19] 。
1.4 特征选择和模型建立
采用多重插补技术对缺失数据进行填补,利用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回归分析筛选预测变量,随后行“Backwald:Wald”多因素Logistic回归分析,制定可区分SALI患者和非SALI患者的预测模型。对预测模型进行具有500次迭代的内部验证[20] ,通过计算曲线下面积(area under the curve,AUC)评估预测模型的区分能力,Delong测试用于比较预测模型和包含在预测模型中的单个变量的区分能力,行Hosmer-Lemeshow检验评估模型的校准性;此外,采用决策曲线分析(decision curve analysis,DCA)以确定模型的临床适用性[21] 。
1.5 统计学分析
应用SPSS 26.0统计软件和R软件4.3.3版本进行统计分析。采用Shapiro-Wilk检验计量数据是否符合正态分布( P gt;0.05表示符合正态分布),符合正态分布以均值±标准差( x±s )表示,非正态分布数据用 P 50 ( P 25 , P 75 )表示,分别采用独立样本 t 检验和非参数Mann-Whitney "U 检验;计数数据用率和百分比表示,采用Pearson χ 2 检验; P lt;0.05为差异有统计学意义。
2 结果
2.1 两组患者基线特征比较
结果显示,与非SALI组相比,SALI组凝血酶原时间、活化部分凝血酶原时间、凝血酶时间明显延长( P 均< 0.05),国际标准化比值和乳酸、氨基末端脑钠肽前体、尿素、天冬氨酸氨基转移酶、γ-谷氨酰转肽酶、乳酸脱氢酶水平明显升高( P 均<0.05),总胆红素≤2 mg/dL、丙氨酸氨基转移酶≤400 IU/L、机械通气、气管插管、心功能不全、感染性休克、凝血功能障碍、急性呼吸衰竭、肾功能衰竭、呼吸心跳骤停和多器官功能障碍占比明显升高( P 均<0.05),而纤维蛋白原和血小板水平,以及恶性肿瘤发生率、腹腔和泌尿系统感染发生率显著降低( P 均<0.05),其余指标比较差异均无统计学意义( P 均>0.05)。见表1。
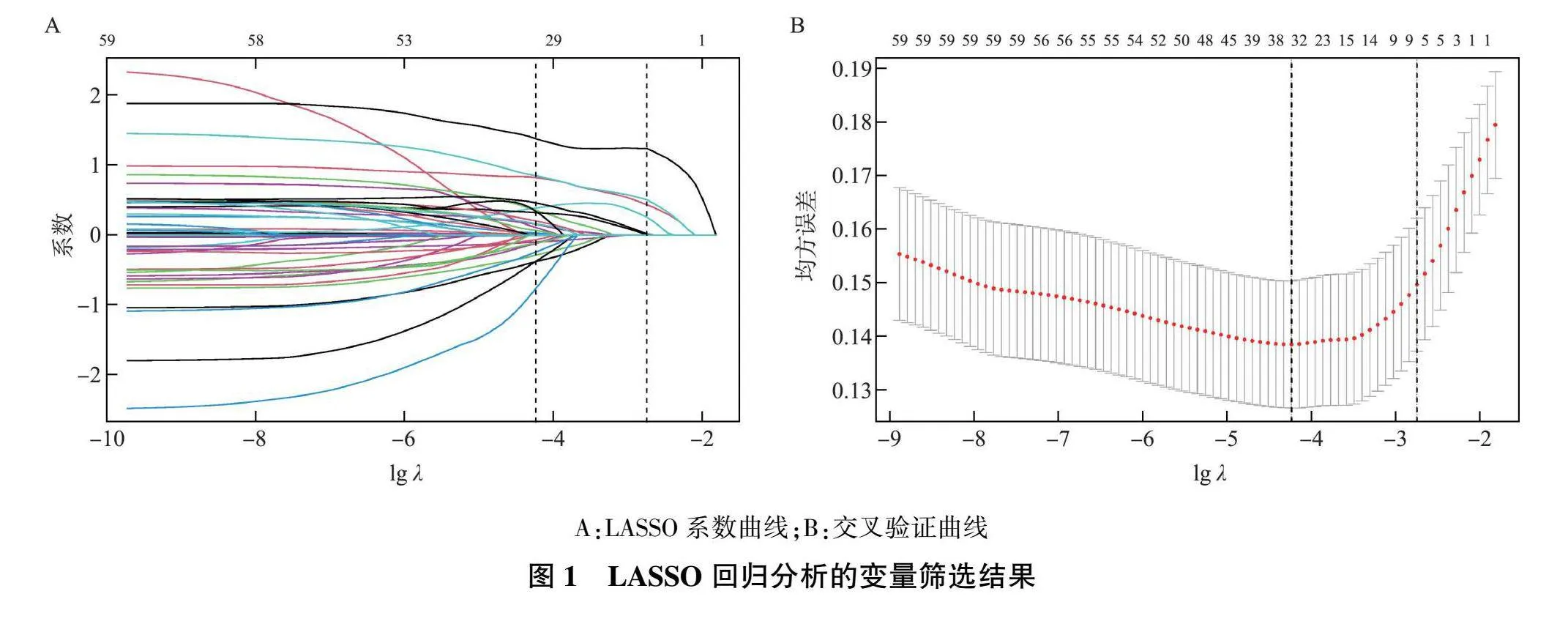
2.2 LASSO回归和多因素Logistic回归分析
采用LASSO回归分析法行单变量筛选(图1),共获得9个危险因素(非零系数),分别为总胆红素、氨基末端脑钠肽前体、丙氨酸氨基转移酶、天冬氨酸氨基转移酶、γ-谷氨酰转肽酶、机械通气、肾功能衰竭、国际标准化比值和急性呼吸衰竭。多因素Logistic回归方法分析上述危险因素,确定与SALI强相关的7个预测因子,分别是总胆红素、丙氨酸氨基转移酶、γ-谷氨酰转肽酶、机械通气、肾功能衰竭、国际标准化比值和急性呼吸衰竭,对应的模型系数分别为0.917、2.133、0.004、0.813、1.192、0.231和0.388;模型公式:Logistic(风险评分)=-3.780+0.917×总胆红素+2.133×丙氨酸氨基转移酶+0.004×γ-谷氨酰转肽酶+0.813×机械通气+1.192×肾功能衰竭+0.231×国际标准化比值+0.388×急性呼吸衰竭。见表2。
2.3 列线图预测模型的建立
基于多因素Logistic回归分析筛选出的独立危险因素,构建SALI预测列线图模型(图2),图中包含7个预测变量:总胆红素、丙氨酸氨基转移酶、机械通气、急性呼吸衰竭、肾功能衰竭、国际标准化比值和γ-谷氨酰转肽酶;在各个变量轴上找到患者对应的临床值,向上引线与“分数”轴相交得到相应分值,将所有变量的分值相加得到总分,在“总分数”轴上找到该值,向下投射到“诊断概率”轴即可得到该患者发生SALI的预测概率。
2.4 列线图模型的内部验证
2.4.1 区分度 通过采用500次重抽样的bootstrap方法,确定列线图模型AUC为0.823(95% CI :0.773~0.873,图3)。由此表明,列线图模型在预测SALI方面具有相对适中的区分能力。
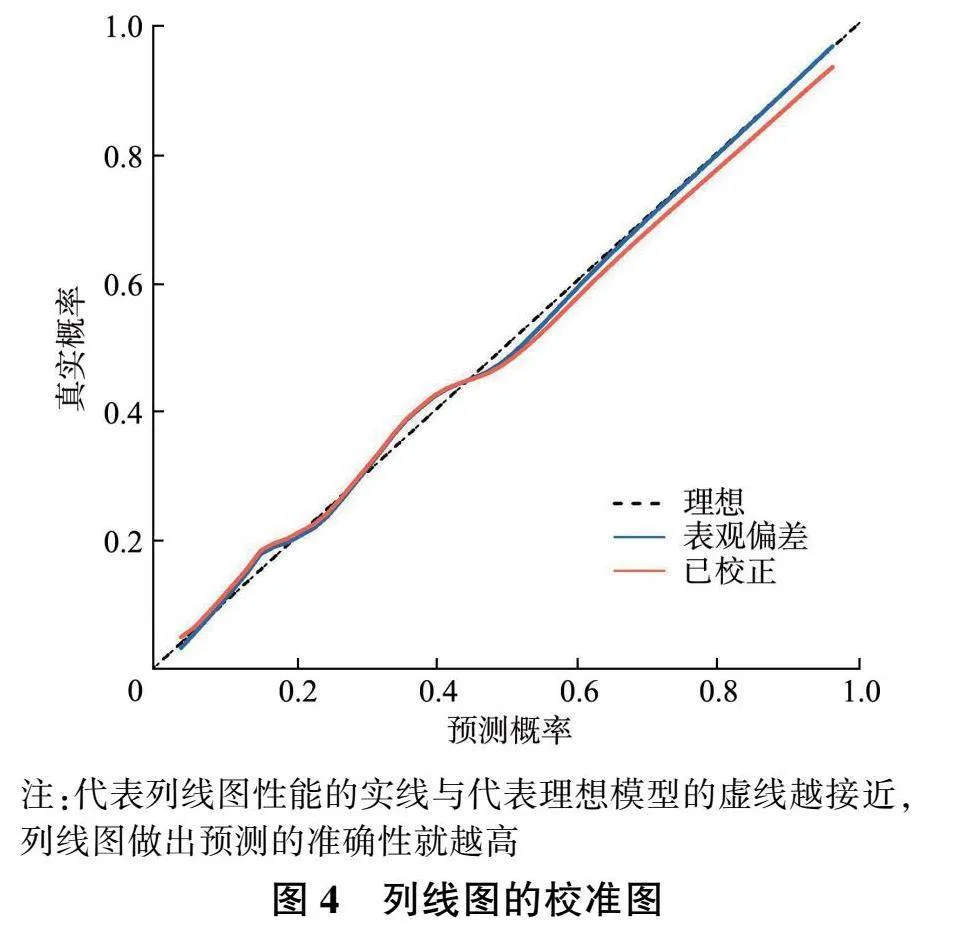
2.4.2 校准度 通过采用500次重抽样的bootstrap方法,结果显示模型预测概率与临床实际观察结果之间的一致性较好(图4);此外,Hosmer-Lemeshow检验验证模型拟合性良好( P =0.613),进一步支持预测模型的准确性。
2.4.3 临床适用度 通过采用500次重抽样的bootstrap方法,如图5所示,当两组人群决策曲线中的阈值概率在5%~100%范围内时,采用该列线图预测SALI发生风险的净收益较高,表明预测模型具有良好的临床适用度。
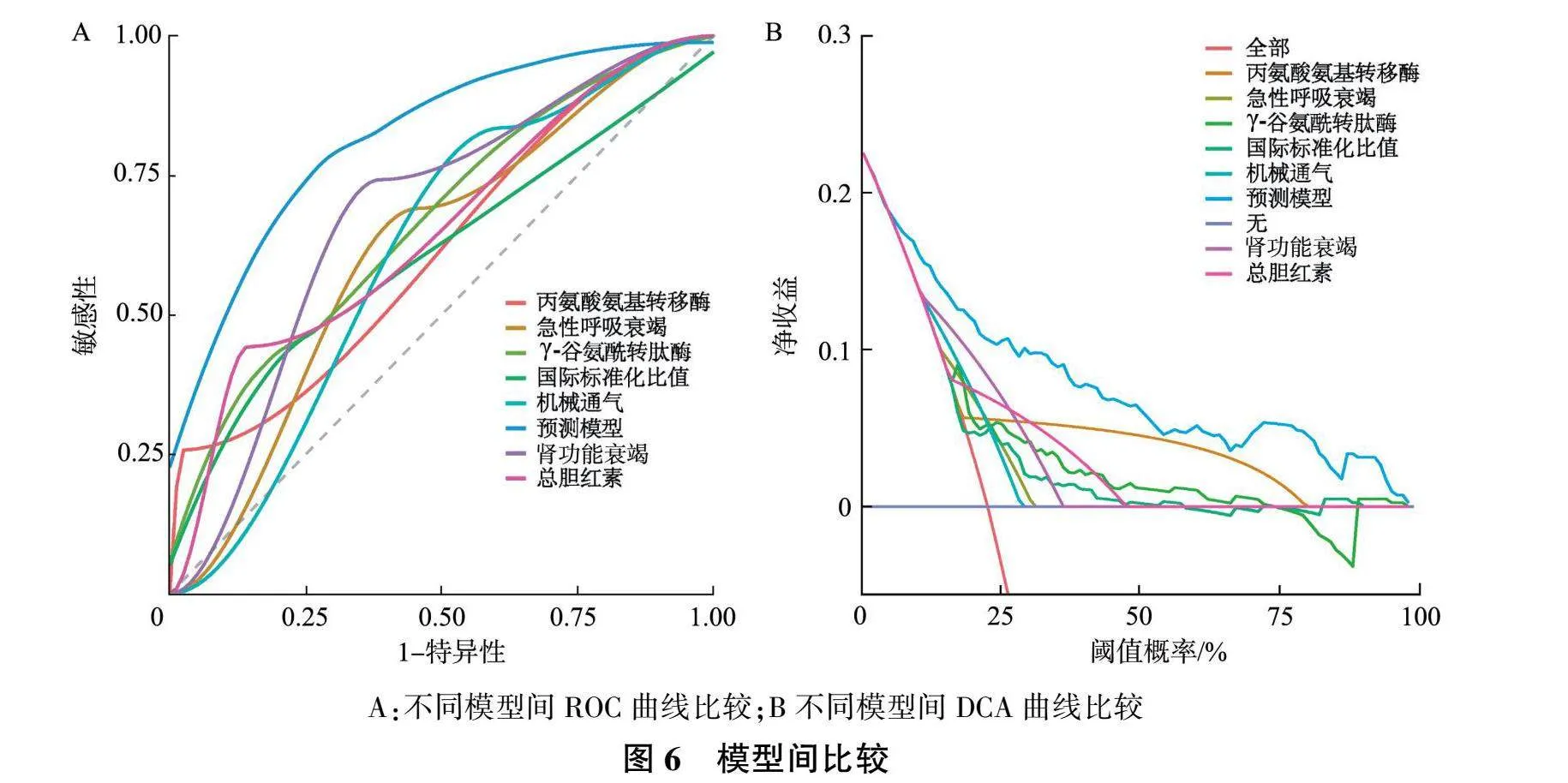
2.5 模型比较
ROC曲线结果显示(图6A),预测模型、总胆红素、丙氨酸氨基转移酶、国际标准化比值、γ-谷氨酰转肽酶、机械通气、肾功能衰竭和急性呼吸衰竭的AUC值分别为0.823、0.649、0.619、0.604、0.670、0.612、0.678和0.617,预测模型在识别有SALI风险患者方面的区别能力优于单个变量( P 均<0.05);DCA结果显示(图6B),与模型中单个变量相比,预测模型在总体净收益中涵盖广泛的阈值概率范围,表现出更卓越的性能。
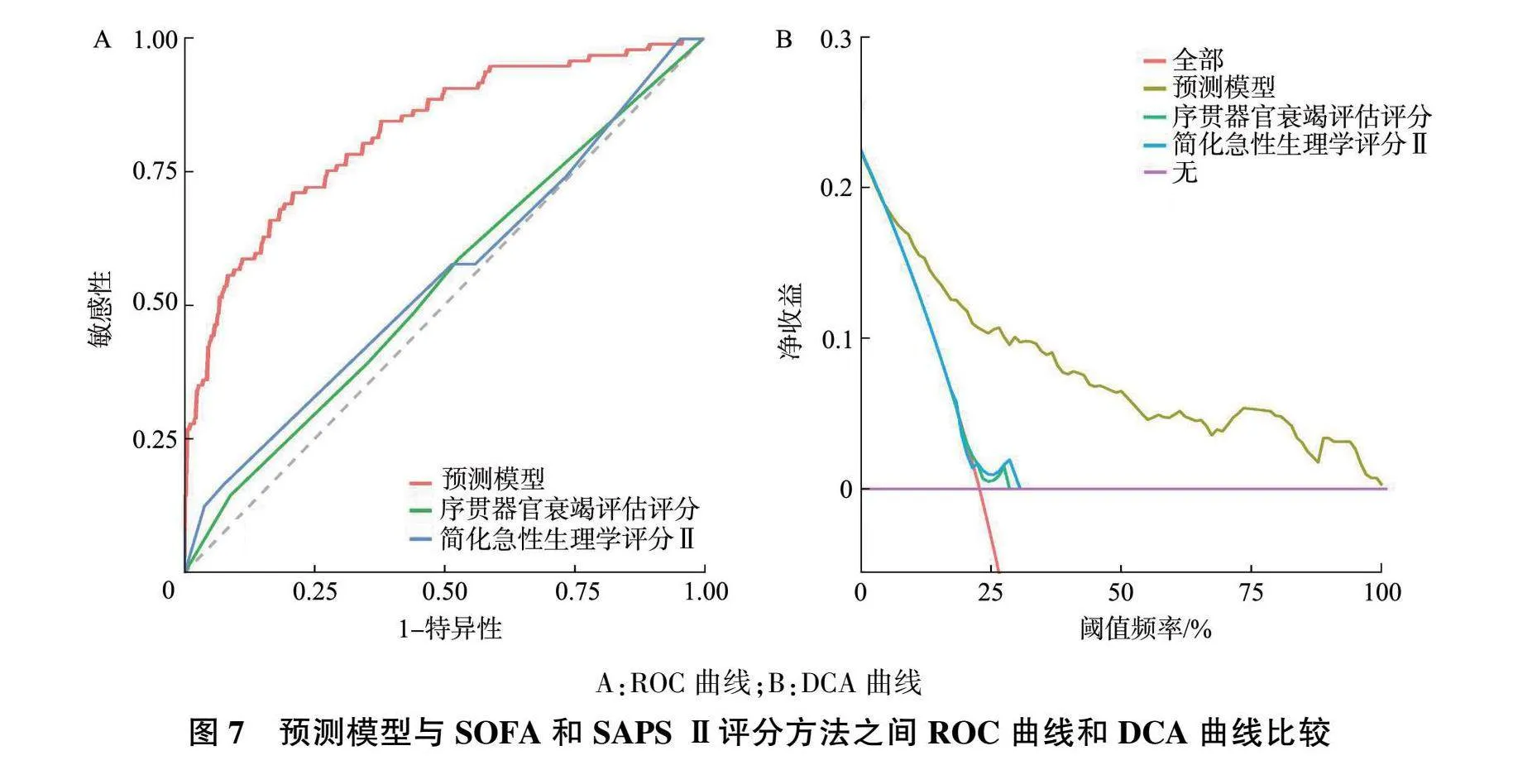
ROC曲线结果显示(图7A),预测模型AUC为0.823(95% CI :0.773~0.873),明显优于SOFA评分(AUC为0.540 ,95% CI :0.473~0.607)和SAPS Ⅱ评分(AUC为0.550,95% CI :0.482~0.618),其脓毒症患者发生SALI风险预测能力明显优于SOFA评分和SAPS Ⅱ评分( P 均<0.05,图7A);DCA结果显示(图7B),当阈值概率在5%~100%范围内时,预测模型净收益均高于SOFA评分和SAPS Ⅱ评分。
3 讨论
本研究结果显示,SALI组患者凝血功能指标(凝血酶原时间、国际标准化比值、活化部分凝血酶原时间、凝血酶时间)、炎症与器官功能指标(乳酸、总胆红素、氨基末端脑钠肽前体、尿素)以及肝功能指标(丙 氨酸氨基转移酶、天冬氨酸氨基转移酶、γ-谷氨酰转肽酶、乳酸脱氢酶)均明显高于非SALI组;同时,SALI组在临床并发症方面,包括机械通气需求、气管插管比例、心功能不全、感染性休克、凝血功能障碍、急性呼吸衰竭、肾功能衰竭、呼吸心跳骤停及多器官功能障碍的发生率也显著高于非SALI组,与既往研究报道一致[22] 。但是,与既往研究仅关注SALI的危险因素不同,本研究将多个独立危险因素整合为一个直观的预测工具,值得注意的是,本研究中SALI组和非SALI组年龄、性别、血气分析指标、炎症指标以及基础疾病等方面均无显著差异,这与部分既往研究结果不尽相同,如Nesseler等[23] 多中心研究发现年龄和糖尿病是SALI的独立危险因素,该差异可能与研究人群特征以及各中心临床实践模式的不同有关。
本研究结果显示,总胆红素、丙氨酸氨基转移酶、机械通气、肾功能衰竭、国际标准化比值、急性呼吸衰竭以及γ-谷氨酰转肽酶是脓毒症患者发生SALI的独立危险因素,这些因素一旦出现异常,往往脓毒症患者发生SALI的风险显著增加;其中,丙氨酸氨基转移酶比值最高,提示其可能是最重要的预测因素。研究表明,血清天冬氨酸氨基转移酶主要存在于肝细胞线粒体中,其水平升高表明肝损伤较为严重[24-25] 。但是,本研究在多因素回归中未将天冬氨酸氨基转移酶纳入模型,可能原因是构建的模型属于诊断模型,早期肝损伤程度较轻,血清天冬氨酸氨基转移酶升高不明显。
丙氨酸氨基转移酶作为评估肝损伤的关键标志物,其升高往往提示肝细胞损伤和炎症反应程度,且通常早于其他肝功能指标出现异常[13] 。本研究结果显示,SALI组患者丙氨酸氨基转移酶、γ-谷氨酰转肽酶、总胆红素、国际标准化比值水平均显著高于非SALI组。γ-谷氨酰转肽酶主要存在于肝细胞的胆道系统中,其异常升高不仅反映肝损伤程度,还与SALI严重程度密切相关[23] 。本研究还发现SALI组机械通气需求、急性呼吸衰竭及肾功能衰竭发生率显著增高。这可能是因为机械通气引起的血流动力学改变及氧供需失衡[26] ,以及肾功能衰竭导致的毒素清除受损、炎症因子蓄积[27] 共同促进SALI的发生发展。此外,国际标准化比值作为评估肝脏合成功能的重要指标,其异常提示肝细胞功能受损,可能通过影响凝血因子的合成进一步加重SALI进展[28] 。
有效的预测模型可以指导临床决策,Chen等[29] 针对初诊即转移的鼻咽癌患者建立了预测模型,纳入年龄、治疗前EB病毒核酸水平、转移部位数量、化疗和免疫治疗的周期等关键因素;基于此对患者进行危险分层后发现,对于预测得分较高的高危肝内胆管癌患者(年龄≥65岁、T3-T4期、有淋巴结转移等),建议积极进行手术、放射治疗和化疗等的综合治疗,其两年生存率可从36.3%提高至72.3%( P =0.003)。本研究建立的预测模型AUC为0.823,具有良好的区分能力;根据该模型,对于预测得分较高的脓毒症患者(如丙氨酸氨基转移酶gt;500 IU/L、γ-谷氨酰转肽酶gt;150 IU/L、总胆红素gt;30 mg/dL ),可提前启动肝保护治疗,密切监测肝功能指标变化;对于预测得分较低的患者,则可采取常规监测方案。
本研究仍然存在一些不足,首先,该预测模型仅采用本院为期3年的回顾性研究数据构建,而SALI患病率可能存在地区差异,有待后续行多中心验证;其次,只评估了患者入院前24 h内的临床和实验室数据,未对其病情变化进行持续追踪。
综上所述,总胆红素、丙氨酸氨基转移酶、机械通气、肾功能衰竭、国际标准化比值、急性呼吸衰竭以及γ-谷氨酰转肽酶是影响脓毒症患者发生SALI的独立危险因素,基于此所建立的新预测模型具有较好的预测价值。
[参考文献]
[1] Fleischmann "C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3): 259-272.
[2] Singer "M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810.
[3] Racanelli "V, Rehermann B. The liver as an immunological organ[J]. Hepatology, 2006, 43(2 Suppl 1): S54-S62.
[4] Jenne "CN, Kubes P. Immune surveillance by the liver[J]. Nat Immunol, 2013, 14(10): 996-1006.
[5] Islam "KB, Fukiya S, Hagio M, et al. Bile acid is a host factor that regulates the composition of the cecal microbiota in rat[J]. Gastroenterology, 2011, 141(5): 1773-1781.
[6] Albillos "A, de Gottardi A, Rescigno M. The gut-liver axis "in liver disease: Pathophysiological basis for therapy[J] . J Hepatol, 2020, 72(3): 558-577.
[7] Yan "J, Li S, Li S. The role of the liver in sepsis[J]. Int Rev Immunol, 2014, 33(6): 498-510.
[8] Tacke "F, Luedde T, Trautwein C. Inflammatory pathways in liver homeostasis and liver injury[J]. Clin Rev Allergy Immunol, 2009, 36(1): 4-12.
[9] Horvatits "T, Trauner M, Fuhrmann V. Hypoxic liver injury and cholestasis in critically ill patients[J]. Curr Opin Crit Care, 2013, 19(2): 128-132.
[10] Kobashi "H, Toshimori J, Yamamoto K. Sepsis-associated liver injury: Incidence, classification and the clinical significance[J]. Hepatol Res, 2013, 43(3): 255-266.
[11] Sands "KE, Bates DW, Lanken PN, et al. Epidemiology of sepsis syndrome in 8 academic medical centers[J]. JAMA, 1997, 278(3): 234-240.
[12] Brun-Buisson "C, Meshaka P, Pinton P, et al. EPISEPSIS: a reappraisal of the epidemiology and outcome of severe sepsis in French intensive care units[J]. Intensive Care Med, 2004, 30(4): 580-588.
[13] Kramer "L, Jordan B, Druml W, et al. Incidence and prognosis of early hepatic dysfunction in critically ill patients—a prospective multicenter study[J]. Crit Care Med, 2007, 35(4): 1099-1104.
[14] Henrion "J, Schapira M, Luwaert R, et al. Hypoxic hepatitis: clinical and hemodynamic study in 142 consecutive cases[J]. Medicine (Baltimore), 2003, 82(6): "392-406.
[15] Verbeeck "RK. Pharmacokinetics and dosage adjustment in patients with hepatic dysfunction[J]. Eur J Clin Pharmacol, 2008, 64(12): 1147-1161.
[16] Liu "Y, Sun R, Jiang H, et al. Development and validation of a predictive model for in-hospital mortality in patients with sepsis-associated liver injury[J]. Ann Transl Med, 2022, 10(18): 997.
[17] Lescot "T, Karvellas C, Beaussier M, et al. Acquired liver injury in the intensive care unit[J]. Anesthesiology, 2012, 117(4): 898-904.
[18] Brienza "N, Dalfino L, Cinnella G, et al. Jaundice in critical illness: promoting factors of a concealed reality[J]. Intensive Care Med, 2006, 32(2): 267-274.
[19] Strnad "P, Tacke F, Koch A, et al. Liver-guardian, modifier and target of sepsis[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(1): 55-66.
[20] Collins "GS, Reitsma JB, Altman DG, et al. Trans- parent reporting of a multivariable prediction model forindividual "prognosis or diagnosis (TRIPOD): "the TRIPOD statement[J]. BMJ, 2015, 350: g7594.
[21] Van "Calster B, Wynants L, Verbeek JFM, et al. Reporting and interpreting decision curve analysis: A guide for investigators[J]. Eur Urol, 2018, 74(6): 796- 804.
[22] Horvatits "T, Drolz A, Trauner M, et al. Liver injury and failure in critical illness[J]. Hepatology, 2019, 70(6): 2204-2215.
[23] Nesseler "N, Launey Y, Aninat C, et al. Clinical review: The liver in sepsis[J]. Crit Care, 2012, 16(5): 235.
[24] Weber "S, Hellmuth JC, Scherer C, et al. Liver function test abnormalities at hospital admission are associated with severe course of SARS-CoV-2 infection: a prospective cohort study[J]. Gut, 2021, 70(10): 1925-1932.
[25] Yan "J, Chen L, Zhang L, et al. New insights into the persistent effects of acute exposure to AFB(1) on rat liver[J]. Front Microbiol, 2022, 13: 911757.
[26] De "Backer D. The effects of positive end-expiratory pressure on the splanchnic circulation[J]. Intensive Care Med, 2000, 26(4): 361-363.
[27] Gustot "T, Fernandez J, Garcia E, et al. Clinical course of acute-on-chronic liver failure syndrome and effects on prognosis[J]. Hepatology, 2015, 62(1): 243-252.
[28] Vincent "JL, Moreno R. Clinical review: scoring systems in the critically ill[J]. Crit Care, 2010, 14(2): 207.
[29] Chen "Y, Chen C, Peng H, et al. Risk-adapted locoregional radiotherapy strategies based on a prognostic nomogram for "de novo "metastatic nasopharyngeal carcinoma patients treated with chemoimmunotherapy[J]. Sci Rep, 2024, 14(1): 3950.
[收稿日期] 2024-01-16" [编辑] 刘星星
