利妥昔单抗治疗难治性急性感染后肾小球肾炎1例报道
2025-01-25崔琳琳徐德超吴俊李林毛志国高翔

[关键词] 急性感染后肾小球肾炎;利妥昔单抗;难治性;预后;肾功能
[中图分类号] R692.3" [文献标志码] A" [文章编号] 1671-7783(2025)01-0073-03
DOI: 10.13312/j.issn.1671-7783.y230236
[引用格式]崔琳琳, 徐德超, 吴俊, 等. 利妥昔单抗治疗难治性急性感染后肾小球肾炎1例报道[J]. 江苏大学学报(医 学版), 2025, 35(1): 73-75.
[基金项目]国家自然科学基金面上项目(82070705);国家自然科学基金青年项目(82000627)
[作者简介]崔琳琳(1990—),女,主治医师,主要从事慢性肾炎诊治、急慢性肾衰竭的血液净化治疗和并发症防治;高翔(通讯作者),副主任医师,E-mail: gaoxiang43100636@163.com
急性感染后肾小球肾炎以儿童链球菌感染多见,通常预后良好,成人有肾功能进行性恶化风险,激素和免疫抑制治疗存在争议[1] 。本科室1例成人难治性急性感染后肾小球肾炎,临床表现为急性肾炎综合征伴肾病综合征,抗感染及对症治疗效果不佳,对激素和环磷酰胺不敏感,并出现肾功能进行性恶化,加用利妥昔单抗后,取得了良好的治疗效果,现报道如下。
1 临床资料
患者,女,37岁,因“肉眼血尿伴泡沫尿1周,全身浮肿2 d”于2021年5月11日入院。1周前无明显诱因出现肉眼血尿,伴泡沫尿,无咽痛、皮疹,无尿路刺激征等症状,2 d前出现全身浮肿,外院就诊查尿蛋白+++,尿红细胞gt;30/高倍视野,近1周体重增加4 kg。体格检查:体温36.8 ℃,脉搏71次/min,血压112/80 mmHg,眼睑及下肢轻度水肿。入院后尿常规:尿蛋白+++,尿红细胞2 059.5/μL,尿白细胞275.7/μL,24 h尿蛋白定量4 449 mg,尿红细胞位相为混合型,尿培养示肺炎 克雷伯菌;血沉27 mm/h;血生化:白蛋白16.3 g/L ,肌酐75 μmol/L,补体C3 0.771 g/L(参考值0.79 g/L~1.52 g/L);补体C4、抗“O”、免疫球蛋白无异常,抗核抗体、抗双链DNA抗体、可提取核抗原10项、抗中性粒细胞胞质抗体、抗肾小球基底膜抗体、抗心磷脂抗体均阴性,血培养阴性;泌尿系超声:右肾101 mm×43 mm,左肾107 mm× 46 mm,皮髓分界清楚,心脏超声未见明显异常。
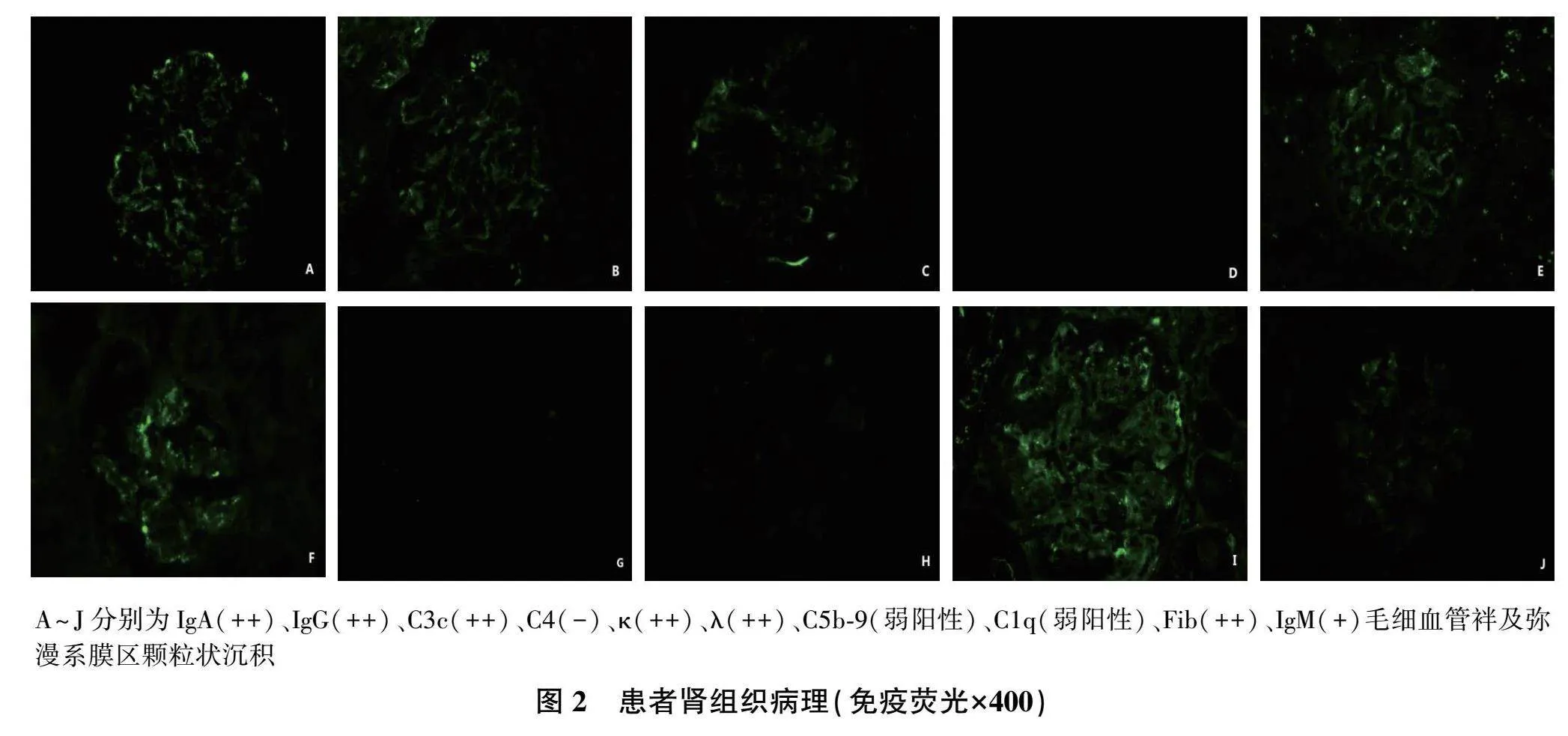
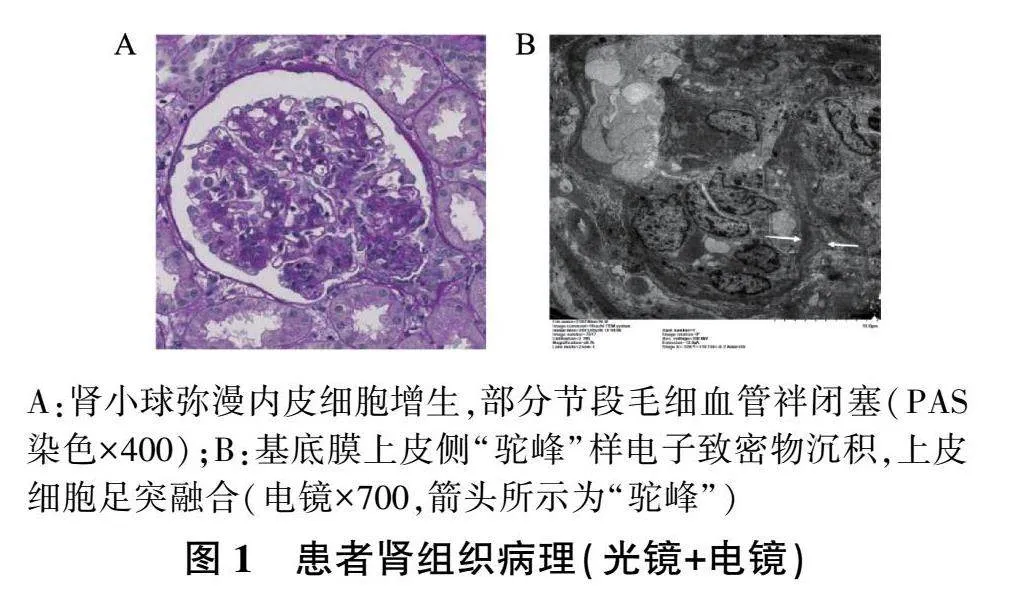
2021年5月13日行肾活检,光镜:共16个小球,未见新月体,球内细胞数80~140个/球,系膜区系膜细胞2~6个,系膜区中度增宽,基质增多,内皮细胞2~5个/毛细血管袢,伴分叶核粒细胞浸润,部分节段毛细血管袢闭塞,肾小管上皮细胞肿胀、颗粒变性,间质5%~10%纤维化,炎性细胞浸润(图1)。免疫荧光:IgG、IgA、C3c、κ轻链、λ轻链及Fib毛细血管袢及弥漫系膜区颗粒状沉积(++,图2),IgM毛细血管袢及弥漫系膜区颗粒状沉积(+,图2)。电镜:基底膜上皮侧可见“驼峰”样电子致密物沉积,系膜区和内皮侧可见电子致密物沉积,上皮细胞足突融合(图1)。
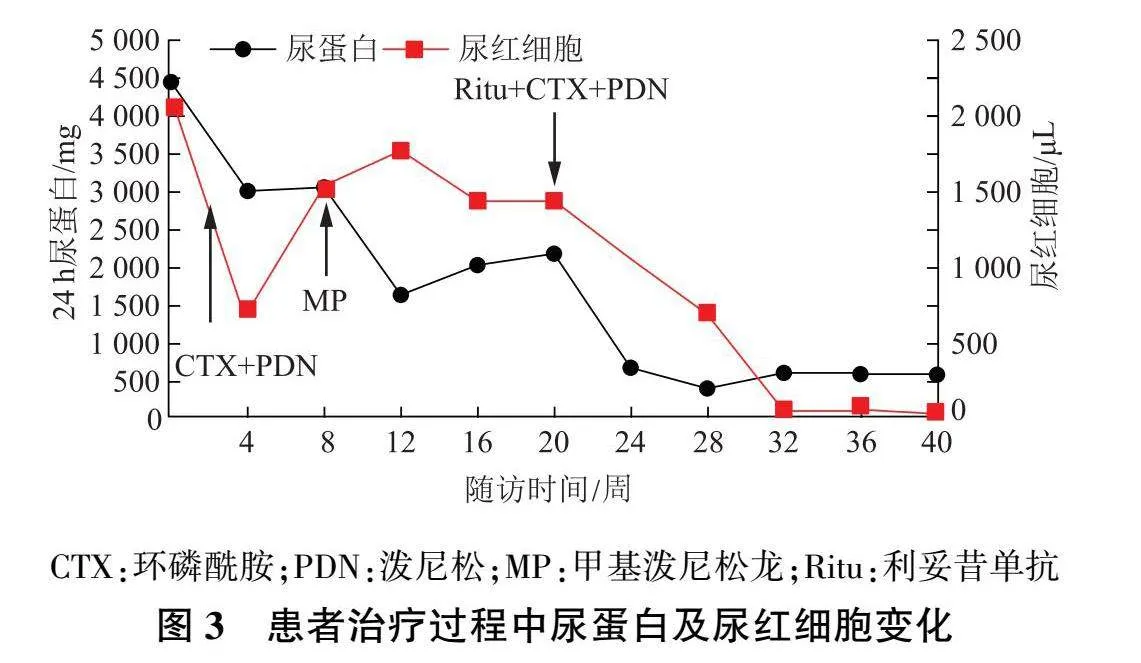
入院后予抗感染及对症支持治疗,患者水肿逐渐改善,但肉眼血尿持续存在。2周后复查尿常规:尿蛋白+++,尿红细胞1 839.0/μL,尿白细胞45/μL,24 h尿蛋白定量2 602 mg;血白蛋白24.2 g/L,血肌酐112 μmol/L,补体C3 0.610 g/L。予泼尼松每天1 mg/kg口服,联合环磷酰胺0.6 g静脉滴注,2周1次 ,治疗期间予甲基泼尼松龙240 mg静脉滴注,每天1次 ,共3 d,治疗2次。患者血尿、蛋白尿无缓解,血肌酐呈进行性升高。2021年9月23日复查尿常规:尿红细胞1 443.3/μL,尿白细胞21.6/μL,24 h尿蛋白定量2 188 mg;血生化:白蛋白26.9 g/L,肌酐163 μmol/L,补体C3 0.768 g/L。于9月26日起予利妥昔单抗治疗(375 mg/m2,每2周静脉滴注1次,共4次),治疗期间泼尼松逐步减量至10 mg每 天1次,维持,环磷酰胺调整为0.4 g静脉滴注,2周1次。患者采用利妥昔单抗500 mg静脉滴注治疗1次后,CD19+ B细胞绝对数降为0;治疗2次后蛋白尿和血尿明显改善;治疗4次后每月随访,2个月后补体C3恢复正常,肾功能逐渐改善(图3 、图4)。在利妥昔单抗治疗和随访过程中,未出现过敏、感染等不良反应。2022年3月8日 复查尿常规:尿红细胞39.0/μL,尿白细胞12/μL ,24 h尿蛋白定量594 mg;血生化:白蛋白39.2 g/L,肌酐123 μmol/L,CD19+ B细胞绝对数为0。
2 讨论
该患者临床表现为急性肾炎综合征伴肾病综合征,补体C3偏低,肾脏病理光镜示毛细血管袢内内皮细胞增生,节段毛细血管袢闭塞,伴中性粒细胞浸润,免疫荧光C3、IgG、IgA等在毛细血管袢及弥漫系膜区颗粒状沉积,电镜下基底膜上皮侧可见“驼峰”样电子致密物沉积,同时伴系膜区和内皮下电子致密物沉积,结合临床表现、实验室检查和肾脏病理,诊断为“急性感染后肾小球肾炎”。因该患者起病过程中伴随补体C3水平降低,故需排除C3肾小球肾炎可能。C3肾小球肾炎由补体途径异常活化导致的以C3及相关激活片段和终产物沉积为主的肾小球肾炎,光镜可以表现为膜增生型、系膜增生型和弥漫毛细血管内增生型等多种类型,但荧光以C3沉积为主,且至少较其他免疫球蛋白荧光强度≥++ ,轻链κ、λ通常阴性,电镜下电子致密物可沉积于系膜区和(或)内皮下、上皮下[2] 。该患者发病前有明确的泌尿道感染史,其补体C3水平虽有降低但下降幅度不大,后续治疗中很快恢复并接近至正常水平;肾穿刺结果提示免疫荧光C3、IgG、IgA、κ、λ及Fib均为++,无明显C3沉积为主,且电子致密物以上皮下沉积为主,无多部位沉积,故不考虑为C3肾小球肾炎。另外该患者诊断过程中还排除了IgA沉积为主的感染后肾小球肾炎,这类疾病也表现为感染后蛋白尿、血尿、急性肾衰竭,大多数患者有低补体血症,光镜下表现为毛细血管内皮增生和渗出性肾小球肾炎,电镜下见系膜区及上皮下“驼峰样”“杯托样”电子致密物沉积,但多继发于金黄色葡萄球菌感染,且免疫荧光仅显示IgA和补体C3在肾小球沉积。该患者为尿中肺炎克雷伯感染,免疫荧光C3、IgG、IgA、κ、λ及Fib均为++,无明显IgA、C3沉积为主,故不考虑。
急性感染后肾小球肾炎合并肾病综合征相对少见,可能与肾小球滤过屏障功能状态相关[3] 。免疫复合物、炎症介质及补体系统激活均可造成滤过膜损伤,致其通透性增加[1] 。此外,还可使脏层上皮细胞足突结构及表面电荷发生改变,从而导致蛋白尿的发生[4] 。
急性感染后肾小球肾炎以儿童链球菌感染多见,近年来其他细菌、病毒、真菌感染也有报道,而成人感染部位除呼吸道、皮肤外,也可见于泌尿道和胃肠道等[5] ;患儿通常预后良好,成人特别是合并持续蛋白尿者肾功能可能会进行性恶化甚至进展至终末期肾病[6-7] 。感染后肾小球肾炎的治疗以抗感染和支持为主,关于激素和免疫抑制治疗尚存争议,使用前需评估激素及免疫抑制治疗的获益、风险及并发症[5-8] 。本病例为青年女性,既往无基础疾病,感染部位为泌尿道,致病菌为肺炎克雷伯菌,予抗感染和对症支持治疗,症状无明显改善,并出现肾功能恶化,补体C3较前下降,考虑患者病情进展,予足量激素联合环磷酰胺治疗,并予甲基泼尼松龙冲击治疗,但疗效不佳;患者因个人原因未进行重复肾活检。为延缓疾病进展,加用CD20单抗利妥昔治疗,取得了良好的效果,患者蛋白尿、血尿和肾功能都得到明显改善。
利妥昔单抗是一种可特异性地作用于B细胞表面CD20抗原的人鼠嵌合型单克隆抗体,通过抗体依赖性、补体依赖性细胞介导的细胞毒性反应及细胞凋亡途径,启动介导耗竭B细胞的免疫反应,已应用于治疗多种病理类型的难治性肾病[9-10] 。B淋巴细胞介导的体液免疫,在急性感染后肾小球肾炎的发病过程中同样发挥重要作用[11] 。基于此,本科室尝试用利妥昔单抗治疗此例对激素和细胞毒类药物不敏感的急性感染后肾小球肾炎,取得良好效果。此外,蛋白尿的迅速改善可能与利妥昔单抗通过调节足细胞功能致肾小球滤过功能趋于稳定有关[12] 。
本病例采用利妥昔单抗治疗难治性急性感染后肾小球肾炎,取得良好疗效,具体机制及更确切的效果尚需进一步的临床研究证实。
[参考文献]
[1] Beck "LH Jr, Ayoub I, Caster D, et al. KDOQI US Commentary on the 2021 KDIGO Clinnical Practice Guideline for the Management of Glomerular Diseases[J]. Am J Kidney Dis, 2023, 82(2): 121-175.
[2] Noris "M, Daina E, Remuzzi G, et al. Membrano- proliferative glomerulonephritis: no longer the same disease and may need very different treatment[J]. Nephrol Dial Transplant, 2023, 38(2): 283-290.
[3] Mazdak "AK, Anthony C. Infection-related glomerulone- phritis[J]. Glomerular Dis, 2021, 1(2): 82-91.
[4] Hunt "EAK, Somers MJG. Infection-related glomerulone- phritis[J]. Pediatr Clin North Am, 2019, 66(1): 59-72.
[5] Samih "HN, Jai R, Vivette DA, et al. Infection-related glomerulonephritis in adults[J]. Kidney Int, 2013, 83(5): "792-803.
[6] Kapadia "AS, Panda M, Fogo AB. Postinfectious glomerulonephritis: Is there a role for steroids?[J]. Indian J Nephrol, 2011, 21(2): 116-119.
[7] 岑 天天, 张晓群, 马红映. 肺出血肾炎综合征合并肺部感染一例并文献复习[J]. 新医学, 2023, 54(10): 743-748.
[8] Nasr "SH, Fidler ME, Valeri AM, et al. Postinfectious glomerulonephritis in the elderly[J]. J Am Soc Nephrol, 2011, 22(1): 187-195.
[9] Kotagiri "P, Martin A, Hughes P, et al. Single-dose rituximab in refractory lupus nephritis[J]. Intern Med J, 2016, 46(8): 899-901.
[10] Lundberg "S, Westergren E, Smolander J, et al. B cell-depleting therapy with rituximab or ofatumumab in immunoglobulin A nephropathy or vasculitis with nephritis[J]. Clin Kidney J, 2017, 10(1): 20-26.
[11] Mohammad "D, Baracco R. Postinfectious glomerulone- phritis[J]. Pediatr Ann, 2020, 49(6): e273-e277.
[12] 王 金泉. 利妥昔单抗治疗难治性肾脏疾病的疗效及潜在问题[J]. 肾脏病与透析肾移植杂志, 2017, 26(1): "56-57.
[收稿日期] 2023-11-07" [编辑] 刘星星
