应用群体药动学模型及蒙特卡洛模拟优化淋巴结核患者使用异烟肼注射剂最佳给药方案
2024-12-31张欢刘小玉丁巧燕张宇李思思马丽华周铭



摘要:目的 应用非线性混合效应法(NLME)建立异烟肼注射剂在中国淋巴结核患者群体的药动学(PPK)模型,采用蒙特卡洛模拟优化异烟肼注射剂在不同NAT2代谢基因型淋巴结核患者中的给药方案。方法 纳入武汉市肺科医院淋巴结核患者28例,收集66个血药浓度数据和相关临床资料。采用NLME法建立PPK模型,考察NAT2代谢基因型等因素对异烟肼注射剂体内药动学特征的影响。采用诊断图、Bootstrap法、NPDE法和VPC法评价PPK模型的预测能力。采用蒙特卡洛模拟法探索不同NAT2代谢基因型患者的最佳给药方案。结果 异烟肼注射剂具有一级吸收的二室模型特征,患者NAT2代谢基因型是影响其清除率的重要因素,快、中间和慢代谢基因型患者清除率分别为:53.7、44.6和25.4 L/h,表观分布容积为29.8 L。模型评价表明,模型参数估算可靠、模型稳定。蒙特卡洛模拟结果显示,NAT2快、中间、慢代谢基因型的淋巴结核患者,异烟肼注射剂最佳给药剂量分别为600、450和300 mg。结论 本研究成功建立中国淋巴结核患者异烟肼注射剂PPK模型,定量描述NAT2代谢基因型对异烟肼注射剂药动学的影响,针对不同基因型患者制定最佳给药方案,为异烟肼个体化治疗提供参考。
关键词:异烟肼注射剂;群体药动学;蒙特卡洛模拟;淋巴结核
中图分类号:R969.1 文献标志码:A
Using the population pharmacokinetic model and Monte Carlo simulation to explore the optimal dosing regimen for isoniazid injection in patients with lymphatic tuberculosis
Zhang Huan, Liu Xiaoyu, Ding Qiaoyan, Zhang Yu, Li Sisi, Ma Lihua, and Zhou Ming
(1 Department of Pharmacy, Pulmonary Hospital of Wuhan, Wuhan 430032;
2 Department of Surgery, Pulmonary Hospital of Wuhan, Wuhan 430032)
Abstract Objective Using the nonlinear mixed-effects method (NLME) to develop a pharmacokinetic (PPK) model of isoniazid(INH) injection in a population of Chinese patients with lymphatic tuberculosis, Monte Carlo simulation was used to optimize the dosing regimen of isoniazid injection in patients with lymphatic tuberculosis of different NAT2 metabolism genotypes. Method Twenty-eight patients with lymphatic tuberculosis from Wuhan Lung Hospital were included, and 66 blood drug concentration data and related clinical information were collected. The NLME method was used to establish a PPK model to investigate the effect of factors such as NAT2 metabolism genotype on the in vivo pharmacokinetic profile of isoniazid injection. Diagnostic plots, the bootstrap method, normalized prediction distribution error (NPDE) and the visual predictive check (VPC) test were used to evaluate the prediction performance of the PPK model. Monte Carlo simulation was used to explore the drug dosing regimen for patients with different NAT2 metabolizing genotypes. Results Isoniazid injection was characterized by a two-compartment model of primary absorption, and the NAT2 metabolism genotype was an important factor influencing its clearance. Clearance rates for patients with fast, intermediate and slow metabolism genotypes were 53.7, 44.6, and 25.4 L/h, respectively, with an apparent volume of distribution of 29.8 L. Model evaluation showed reliable estimation of model parameters and model stability. Monte Carlo simulation results showed that the optimal dosage of isoniazid injection administered to patients with NAT2 fast, intermediate, and slow metabolism genotypes of lymphoid tuberculosis was 600 mg, 450 mg, and 300 mg, respectively. Conclusion In this study, a PPK model for isoniazid injection in Chinese lymphatic tuberculosis patients was successfully established the effects of NAT2 metabolic genes on the PK of isoniazid (INH) injection were quantitatively described, and the optimal dosing regimen for patients with different genotypes was formulated, which provided a reference for the individualization of isoniazid treatment.
Key words Isoniazid injection; Population pharmacokinetics; Monte Carlo simulation; Lymphatic tuberculosis
2023年世界卫生组织(WHO)发布的全球结核病报告显示,2022年全球约有1060万人罹患结核病,我国为结核病高负担国家之一[1]。淋巴结结核作为肺外结核最常见疾病,占比约为肺外结核的30%~40%[2],病程长且隐匿性强,严重危害患者健康。异烟肼是已知的具有最强早期杀菌活性的结核药物,为一线抗结核药物中最重要的药物。然而,临床实践表明,服用标准剂量异烟肼(isoniazid, INH)片剂的结核患者,体内血药浓度相差3~7倍,主要原因是个体差异[3]。淋巴结核患者如何正确使用异烟肼,保证其发挥最佳治疗效果,对淋巴结核治疗尤为重要。临床常用异烟肼片剂进行结核巩固期治疗,异烟注射剂作为另一重要剂型,常用于结核强化期、重症不能口服、需局部注射给药的患者。淋巴结核患者常在颈淋巴结核清扫术后或结核脓肿形成时,静脉滴注或局部浸润注射异烟肼治疗。
群体药动学(PPK)及蒙特卡洛模拟[4]分析功能强大,可以描述目标人群的典型PK参数,研究和评估影响药物暴露的可能因素,模拟不同人群的体内药物暴露情况[5-6]。目前,国内外对异烟肼片剂在结核患者体内药动学特征研究较多[7-10]。然而, 异烟肼注射剂在中国结核患者体内PPK过程,尚未见报道。因此,本文旨在研究异烟肼注射剂在淋巴结核患者体内的暴露情况,针对不同代谢人群,制定异烟肼注射剂给药方案,促进淋巴结核患者的个体化使用异烟肼注射剂。
1 材料与方法
1.1 一般资料
筛选2021年3月—2022年3月武汉市肺科医院诊断为淋巴结结核的患者,经武汉市肺科医院医学伦理委员会伦理审查,本项目符合医学伦理要求(伦理批件号:武肺伦理[2021] 32号)。
纳入标准:①18周岁≤年龄≤65周岁;②符合《临床结核病学》[11]中颈淋巴结结核诊断的患者;③治疗方案为异烟肼-利福平-吡嗪酰胺-乙胺丁醇联用的初治淋巴结结核患者;④无严重基础疾病及肝肾功能不全者;⑤同意参与本试验且同意签署知情同意书者。
排除标准:①同时服用对异烟肼药物浓度有影响的其他药物;②妊娠期或者哺乳期妇女;③合并其他疾病,如糖尿病、艾滋病,需长期服用免疫抑制剂者,严重遗传病者;④病原学诊断结果为耐药者;⑤用药依从性不佳者。
记录患者的一般情况(年龄、性别、体重等),血常规、肝、肾功能等临床检验资料。
1.2 数据分析软件
本研究采用Phoenix®NLME软件(Version 8.3,Pharsight Corporation, USA)进行PPK分析,应用R语言程序(Version 4.2.2,https://www.r-project.org/)进行辅助绘图及分析评价。
1.3 血药浓度监测及基因检测
根据药品说明书及《群体药动学研究技术指导原则》[12],合理设计异烟肼给药方案及采血策略,具体如下:异烟肼注射液(购自西南药业股份有限公司,批号:211202),给药剂量300 mg,每日1次,静脉滴注7日。末次给药结束后,随机对侧静脉采血2~3次,每次2 mL,进行血药浓度监测。
异烟肼血清药物浓度检测:采用超高效液相串联质谱法(UPLC-MS/MS)进行异烟肼血清药物浓度测定,该方法线性范围为0.25~16 mg/L,定量下限为0.25 mg/L,日内日间精密度均小于20%[13]。
N-乙酰转移酶2(N-acetyltransferase,NAT2)基因检测:采用焦磷酸测序法进行NAT2基因检测,检测时严格按照试剂盒(购自湖南菲思特精准医疗科技有限公司,批号:20210626)说明书操作。
1.4 PPK模型
采用指数型描述药动学参数的个体间变异(式 1),分别试用加法模型(式2)、指数法(式3)、比例法(式4)和混合模型(式5)来描述参数的残差变异[14]。
Pi=θi×eηi (1)
加和型:Y=F+ε (2)
指数型:Y=F×eε(3)
比例型:Y=F×(1+ε)(4)
组合型:Y=F×(1+ε1)+ε2(5)
其中Pi为第i个患者的PK参数,θi为此PK参数的群体典型值,ηi符合均数为 0、方差为ω2的正态分布;Y为观测值,F为模型预测值,ε为残差变异。残差变异符合均数为0,方差为σ2的正态分布。
1.5 协变量筛选和最终模型的建立
基础模型建立后,采用逐步法(stepwise)筛选协变量,具体如下:通过向前纳入(forward inclusion)和逆向剔除(backward elimination)两个过程考察协变量对PK参数的影响。将-2倍的对数似然值(-2LL)作为目标函数值(OFV)。在向前纳入过程中,将协变量逐一纳入结构模型,若加入后 OFV值下降大于 3.84(P =0.05,df=1时的χ2分布)则具有统计学意义,将该协变量纳入到模型中。逆向剔除时,当OFV值升高大于6.63(P=0.01,df=1时的χ2分布)时,协变量有显著意义,保留该协变量,逐一剔除其他协变量。协变量的筛选需考虑协变量的临床意义、模型拟合优度等,综合考虑纳入合理性,需避免将具有共线性的协变量同时纳入[15]。
本研究中筛选的协变量包括年龄、性别、体重、NAT2基因代谢型、C反应蛋白(CRP)、白细胞计数(WBC)、中性粒细胞百分数(NEUT%)、丙氨酸转移酶(ALT)、天冬氨酸转移酶(AST)、碱性磷酸酶(ALP)、尿素氮(BUN)、血尿酸(SUA)、血清肌酐(SCr)。其中性别、NAT2基因代谢型为分类变量,采用指数型纳入,其余为连续变量,采用中位值校正的指数型纳入。
θi=θ×(Cj/Cmed)θc(6)
θi=θ×exp(θc)(7)
式中Cj为第j个协变量,Cmed为该协变量的中位数值,θi为PK参数的群体预测值,θ为PK参数的群体典型值,θc为该协变量对PK参数的固定效应。
1.6 PPK模型评价
本研究采用诊断图(GOF)、自举法(bootstrap)、正态化预测分布误差法(normalized prediction distribution error,NPDE)和直观预测检验法(visual predictive check,VPC)对最终模型进行评价[16]。
GOF:包括以下散点图:群体预测值-观测值 ( PRED-DV)、个体预测值-观测值(IPRED-DV)、条件权重残差-群体预测值(CWRES-PRED)和条件权重残差-时间(CWRES-TIME)的散点图。
Bootstrap:重复多次抽样后,对该样本集进行参数计算,与原始计算结果值比较以评价模型的稳定性和参数估算的可靠性。
NPDE和VPC:均由蒙特卡洛模拟法产生模拟数据集,两者均通过统计学检验,前者考察标准化预测误差的分布特征,后者比较预测值与实测值的重合度。
1.7 蒙特卡洛模拟
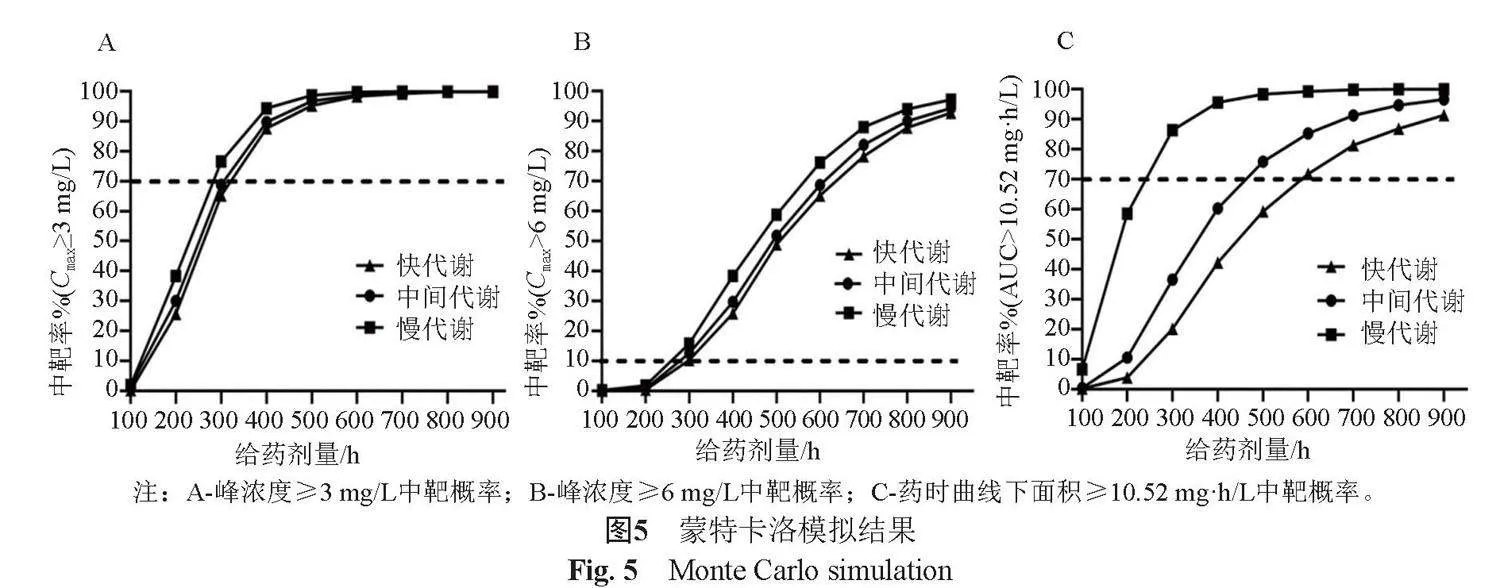
本研究应用蒙特卡洛模拟法[15]评价以下9种异烟肼注射剂给药方案:异烟肼注射剂,100、200、300、400、500、600、700、800和900 mg,qd,静脉滴注。以上不同给药方案运行蒙特卡洛模拟1000次,计算获得异烟肼注射剂的稳态峰浓度及药时曲线下面积的中靶概率(probability of target attainment, PTA)。
2 结果
2.1 患者资料
最终纳入共28例淋巴结核患者,其中男性10例,女性18例,其中NAT2快代谢者9例、中间代谢者14例,慢代谢者5例。获得66个稳态血药浓度数据,患者一般资料见表1,异烟肼注射剂血药浓度-时间散点图见图1。
2.2 PPK模型
2.2.1 基础模型
本研究采用一级消除的二室模型的药动学模型描述异烟肼注射剂的体内PPK特征,个体间变异采用指数模型,残差变异采用加和型。基础模型为:
CL(L/h)=41.8×EXP(ηCL)(8)
V(L)=29.4×EXP(ηV)(9)
式中ηCL和ηV代表中央室PK参数的个体间变异。
2.2.2 协变量筛选和最终模型
被纳入考察的协变量包括:一般资料(年龄、性别、体重)、NAT2基因代谢型、炎症指标(CRP、WBC、NEUT%)、肝功能(ALT、AST、ALP)、肾功能(BUN、SUA、SCr),按照加入协变量后的OFV下降的大小顺序,依次纳入协变量。最终除NAT2基因代谢型外,其余协变量OFV均无显著降低。
2.2.3 最终模型
最终仍采用二室一级消除的药动学模型描述异烟肼注射剂的体内PPK特征,指数模型描述个体间变异,加和模型描述残差变异,纳入的协变量为NAT2基因代谢型。最终模型参数估算表见表2,模型公式如下所示:
NAT2快代谢型:CL(L/h)=53.7×EXP(ηCL)" " "(10)
NAT2中间代谢型:CL(L/h)=44.6×EXP(ηCL) (11)
NAT2慢代谢型:CL(L/h)=25.4×EXP(ηCL)" " "(12)
V(L)=29.8×EXP(ηV)" " " " " " " " " " " " " " " " " " " " "(13)
式中ηCL和ηV代表中央室的药动学参数的个体间变异。
2.3 PPK模型评价
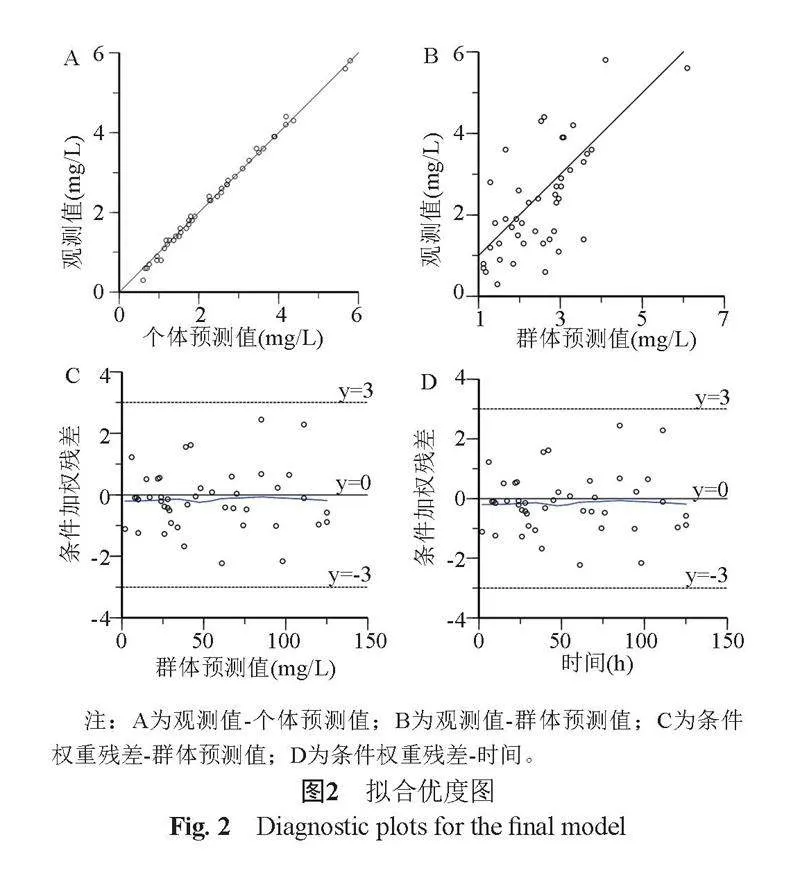
2.3.1 诊断图结果
最终模型的拟合优度图见图2。结果显示,DV-PRED和DV-IPRED散点图中,各散点均匀分布在Y=X趋势线两侧,CWRES-TIME和CWRES-PRED散点图中,CWRES 均匀分布在y=0趋势线的两侧,且在±3之间,无显著趋势性变化。
2.3.2 自举验证(Bootstrap)结果
自举成功率为82.3%,显示模型较为稳定。最终模型的PK参数估算值均落在自举验证参数的95%置信区间内,表明最终模型稳定性好,具体见表2。
2.3.3 正态化预测分布误差检验(NPDE)结果
结果显示,NPDE符合正态分布;Wilcoxon符号秩检验结果为0.111、Fisher检验结果为1、Shapiro-Wilks 检验结果为0.129和 Global adjusted 检验结果为 0.129, 以上检验结果Pgt;0.05,证明该模型的NPDE呈正态分布且方差齐性。进一步表明模型预测能力较好,具体见图3。
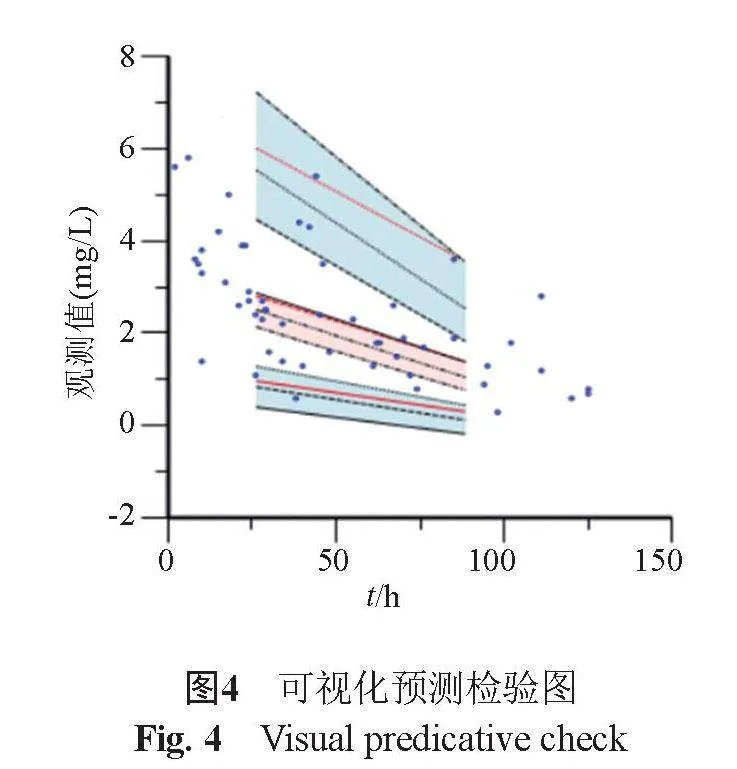
2.3.4 可视化预测检验(VPC)结果
实际检测的血药浓度点(观测值)基本落在预测浓度的90%置信区间内,实测浓度(观测值)与预测浓度的中位线大致吻合,说明最终模型对异烟肼注射剂体内预测性能良好,具体见图4。
2.3.5 蒙特卡洛模拟
按照“1.7”项下的给药方案,进行蒙特卡洛模拟,获得异烟肼注射剂稳态峰浓度(Cmax)及药时曲线下面积(AUC),计算落在异烟肼治疗窗(Cmax:3~6 mg/L,AUC≥10.52 mg·h/L)内外的PTA分布情况。不同NAT2代谢型患者的9种给药方案的模拟结果见图5。结果可知,快、中间、慢代谢者Cmax变化趋势基本类似,但快代谢者Cmax在相同给药剂量下PTA略低于慢代谢者。然而,在300 mg给药剂量下,快代谢者AUC的PTA仅为20%;中间代谢者AUC的PTA为35%;慢代谢者AUC的PTA为90%。当PTA达到70%[7],则不同NAT2代谢基因型患者所需剂量不同,快代谢者需600 mg、中间代谢者需450 mg、慢代谢者需250 mg。综合考虑Cmax模拟结果及临床实际,快、中间、慢代谢者异烟肼注射剂最佳使用剂量为600、450和300 mg。
3 讨论
异烟肼作为敏感结核的首选药物,在临床应用过程血药浓度过低极易导致治疗效果不佳和耐药的发生,过高易导致不良反应[17]。淋巴结核作为肺外结核最常见的病种,体内药物暴露情况直接影响临床治疗效果。研究异烟肼注射剂在淋巴结核患者体内的PPK特征,可发现影响其药物暴露的相关因素,通过蒙特卡洛模拟优化临床异烟肼注射剂给药剂量。
本研究首次报道了异烟肼注射剂在中国淋巴结核患者的PPK特征及NAT2代谢基因型对其PPK的影响。结果表明,异烟肼注射剂在淋巴结核患者体内符合一级消除的二室模型特征,这与文献[8]报道
的异烟肼片剂的药动学模型一致。在协变量模型筛选中,尽管纳入包括体重、AST及SCr等变量,但只有NAT2代谢基因型被纳入最终模型,这与既往研
究[7-9](同时纳入体重及NAT2代谢基因型)有所不同。这可能与本次研究人群中患者数量较少,患者体重变异较小相关。
此外,本研究首次量化了NAT2代谢基因型对淋巴结核患者体内异烟肼清除率(CL)的影响。与既往研究不同的是,异烟肼注射剂在不同NAT2代谢基因型患者体内的CL高于异烟肼片剂。本研究中快、中间、慢代谢者的CL分别为53.7、44.6和25.4 L/h,均高于荆玮等[8]研究(47.5、31.4和12.6 L/h),这可能与注射剂型无口服吸收过程,导致体内异烟肼药量增加,最终导致单位时间内异烟肼清除增加有关。
在基于PPK模型的蒙特卡洛模拟结果显示,与异烟肼片剂显著不同的是,NAT2代谢基因型患者使用不同剂量异烟肼注射剂后,峰浓度(Cmax)中靶概率趋势基本一致。原因可能与注射剂型相关,注射剂血药峰浓度一般为注射结束后的浓度,注射时间较口服吸收时间短,注射结束时,异烟肼代谢差异较小,导致峰浓度差异也较小。本文模拟结果表明,70%的快、中间及慢代谢患者使用300 mg的异烟肼注射剂后,血药峰浓度均能够达到3 mg/L。同时,在此剂量下,约10%不同代谢者血药峰浓度高于6 mg/L,
不良反应发生风险较低。
然而,不同NAT2代谢基因型患者使用不同剂量异烟肼注射剂后,药时曲线下面积(AUC)变化趋势不同,慢代谢者>中间代谢者>快代谢者。这说明,不同代谢型者虽峰浓度类似,但随着时间的延长,代谢差异逐渐凸显,异烟肼体内药物暴露:慢代谢者>中间代谢者>快代谢者。与片剂不同,本文结果显示,对于异烟肼注射剂,如需70%的快、中间、慢代谢者达到治疗目标(AUC≥10.52 mg·h/L),则分别需要约600、450和250 mg。
研究表明,AUC可反映药物在人体血液和组织中的暴露量及持续作用时间,较Cmax提供更全面的信息,AUC与临床疗效之间具有很好的相关性。既往片剂PPK模拟最佳给药剂量各不相同,均高于注射剂给药剂量,Bing等[7]研究表明,快、中间、慢代谢者所需剂量分别为900、600和300 mg;荆玮等[8]研究表明,快、中间、慢代谢者所需剂量分别为700、500和300 mg,差异原因可能与研究方案设计相关。本文在既往研究基础上,综合考虑AUC、Cmax模拟结果及临床实际,针对NAT2快、中间、慢代谢基因型淋巴结核患者,个体化推荐异烟肼注射剂量分别为600、450和300 mg。
综上所述,本研究建立了异烟肼注射剂在中国淋巴结核患者的群体药动学模型,定量描述NAT2代谢基因型对其PK参数影响,并采用蒙特卡洛模拟对不同剂量的异烟肼注射方案进行分析和优化。然而,本研究作为单中心研究,存在一定局限性,MIC等药效学临床数据缺乏,纳入病例数较少。未来,将继续以群体药动学和药效学研究为切入点,扩大样本量,深入探索异烟肼在中国结核患者体内的药动学和药效学特征,为异烟肼个体化用药奠定基础,促进结核病治疗的安全、有效。
参 考 文 献
World Health Organization. Global tuberculosis report 2022[R/OL]. Geneva: WHO, 2020. http www.who.int/tb/publications/global_ report/en/.
Ramírez-Lapausa M, Menéndez-Saldaña A, Noguerado-Asensio A. Tuberculosis extrapulmonar, una revisión [Extrapulmonary tuberculosis][J]. Rev Esp Sanid Penit, 2015, 17(1): 3-11.
黄海荣, 王隽, 初乃惠, 等. 结核病患者N-乙酰基转移酶2编码基因多态性检测与异烟肼合理用药专家共识[J]. 中国防痨杂志, 2021, 43(11): 1107-1112.
金丹婷, 杨晋, 茆海丰, 等. 蒙特卡洛模拟评价万古霉素治疗金黄色葡萄球菌和表皮葡萄球菌引起血流感染的给药方案[J]. 中国抗生素杂志, 2023, 48(11): 1295-1299.
焦正, 李新刚, 尚德为, 等. 模型引导的精准用药:中国专家共识(2021版)[J]. 中国临床药理学与治疗学, 2021, 26(11): 1215-1228.
王艳卉, 王孝茹, 要志清, 等. 基于第三代头孢菌素药动学相关研究的可视化分析[J]. 中国抗生素杂志, 2022, 47(12): 1291-1298.
Bing C, Qiang H S, Rose M F, et al. Population pharmacokinetics and pharmacodynamics of isoniazid and its metabolite acetylisoniazid in Chinese population[J]. Front Pharmacol, 2022, 13: 932686.
荆玮. 异烟肼在肺结核和结核性脑膜炎患者中的群体药动学研究[D]. 北京: 北京市结核病胸部肿瘤研究所, 2020.
Fredj N B, Romdhane H B, Woillard J B, et al. Population pharmacokinetic model of isoniazid in patients with tuberculosis in Tunisia[J]. Int J Infect Dis, 2021, 104: 562-567.
Patricia A H, Edith S M, Arturo O, et al. Population pharmacokinetics of isoniazid and dose recommendations in Mexican patients with tuberculosis.[J]. Int J Clin Pharm," 2020, 42(4): 1217-1226.
唐神结. 临床结核病学[M]. 第2版. 北京: 人民卫生出版社, 2019: 677-686.
国家药品监督管理局. 群体药动学研究技术指导原则[S/OL]. [2020-12-31]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=a8ad0773aa5f4055fa9a51dfcdb86a4d.
张宇, 刘小玉, 徐风, 等. UPLC-MS/MS法测定淋巴结结核患者血浆和组织异烟肼浓度的临床价值研究[J]. 中国药师, 2023, 26(11): 311-318.
李思婵, 徐华, 叶琦, 等. 应用群体药动学模型考察五酯胶囊对肾病综合征患儿体内他克莫司药动学的影响[J]. 中国新药与临床杂志, 2020, 39(8): 477-485.
焦正. 基础群体药动学和药效学分析[M]. 北京: 科学出版社, 2019.
李静静, 刘艺茜, 唐莲, 等. 新生儿万古霉素的群体药动学研究[J]. 中国药学杂志, 2017, 52(16): 1434 -1441.
杨松, 郭建琼, 严晓峰, 等. 宿主N-乙酰转移酶2多态性与异烟肼诱导肝损伤相关性的研究进展[J]. 中华结核和呼吸杂志 ,2022, 45(2): 227-232.
文章编号:1001-8689(2024)09-1068-07
收稿日期:2024-01-15
基金项目:湖北省自然科学基金资助(No. 2023AFB1029);湖北省自然科学基金资助(No. 2022CFC018);湖北省卫生健康委科研基金资助(No. WJ2023M146);武汉市卫生健康科研基金资助(No. WX21D33)
作者简介:张欢,女,生于1989年,硕士,主管药师,研究方向为临床中药学与定量药理学,E-mail: zhanghuan0226@126.com
*通信作者,E-mail: 1260228327@qq.com
