耐万古霉素屎肠球菌的流行病学及耐药性分析
2024-12-31刘平娟陈怡丽郭鹏豪邓间开伍众彭雅琴黄彬廖康



摘要:目的 探讨本中心耐万古霉素屎肠球菌的流行病学及耐药性,为临床合理用药及感控防治提供科学依据。方法 回顾性分析中山大学附属第一医院2017年1月—2023年6月临床分离的104株非重复的耐万古霉素屎肠球菌(vancomycin-resisitant Enterococcus faecium, VRE-fm),分析患者的基本资料、标本类型分布及对不同抗生素的耐药率、菌株携带的耐药基因及毒力基因。结果 共分离104株非重复的VRE-fm菌株,≥60岁患者占63.4%(66/104);VRE-fm菌株主要分离自尿液54.8%、引流液14.4%和血液7.7%;微量肉汤稀释法药敏试验结果显示,104株VRE-fm对利奈唑胺全部敏感,替加环素的敏感率为98.1%,对其他抗菌药物敏感性较差;本中心47株VRE-fm菌株进行全基因组测序结果显示,均携带vanA耐药基因,未检出vanB和vanM耐药基因;47株VRE-fm菌株全部携带acm毒力基因,仅有1株VRE-fm菌携带esp毒力基因,其余毒力基因均为阴性。结论 目前VRE-fm菌株的耐药性严峻,VRE-fm菌株通常同时携带耐药基因和毒力基因,临床可用于治疗VRE-fm感染的药物非常有限。因此,应当加强对万古霉素等糖肽类抗菌药物的使用管理,努力开发和实施感染控制方法,以有效地防止VRE-fm的进一步发生和蔓延。
关键词:耐万古霉素屎肠球菌;细菌耐药性;流行病学;耐药基因;毒力基因
中图分类号:R978.1 文献标志码:A
Epidemiological profiles and drug resistance analysis of vancomycin-resistant Enterococcus faecium clinical isolates
Liu Pingjuan, Chen Yili, Guo Penghao, Deng Jiankai, Wu Zhongwen, Peng Yaqin, Huang Bin, and Liao Kang
(Department of Laboratory Medicine, First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080)
Abstract Objective To explore the epidemiology and drug resistance of vancomycin-resistant Enterococcus faecalis in our center and provide a scientific basis for rational drug use and infection control in clinical practice. Methods A retrospective analysis was conducted on 104 non-repetitive vancomycin-resistant Enterococcus faecalis (VRE-fm) strains clinically isolated from the First Affiliated Hospital of Sun Yat-sen University from January 2017 to June 2023. The patient's basic information, sample type distributions, resistance rates to different antibiotics, and resistance and virulence genes carried by the strains were analyzed. Results A total of 104 non-repetitive VRE-fm strains were isolated, with 63.4% (66/104) of patients aged ≥60 years old; VRE-fm strains were mainly isolated from urine (54.8%), drainage (14.4%), and blood (7.7%). The results of the microbroth dilution method drug sensitivity test showed that 104 strains of VRE-fm were all sensitive to linezolid, and the sensitivity rate to tigecycline was 98.1%, with poor sensitivity to other antibacterial drugs. The whole genome sequencing results of 47 VRE-fm strains in our center showed that they all carried vanA resistance genes, but no vanB or vanM resistance genes were detected. All 47 VRE-fm strains carried acm virulence genes, with only 1 VRE-fm strain carrying esp virulence genes, and all other virulence genes were negative. Conclusion Currently, VRE-fm strains exhibit severe drug resistance, typically carrying both drug resistance genes and virulence genes. Consequently, the number of drugs available for clinical treatment of VRE-fm infections is extremely limited. Hence, it is imperative to enhance the management of the use of glycopeptide antimicrobial drugs such as vancomycin and strive to develop and implement infection control methods to effectively prevent the further occurrence and spread of VRE-fm.
Key words Vancomycin resistant Enterococcus faecium; Bacterial resistance; Epidemiology; Drug resistance genes; Virulence gene
肠球菌属是引起院内感染最常见的革兰阳性球菌之一,属于条件致病菌,可引起泌尿道感染、感染性心内膜炎以及血流感染等多种严重疾病[1-2]。目前已发现的肠球菌共有80多种[3],临床上是以屎肠球菌(Enterococcus faecium)和粪肠球菌(E. faecalis) 为主,在我国肠球菌的分离菌株中,两者的占比超过90%[4]。万古霉素是临床上治疗肠球菌感染最常用和最有效的抗生素之一,近年来由于抗生素不规范使用等原因导致耐万古霉素肠球菌(vancomycin-resisitant enterococci, VRE)出现,尤其是以耐万古霉素屎肠球菌(vancomycin-resisitant Enterococcus faecium, VRE-fm)最为严峻。自20世纪80年代首次出现以来[5],耐万古霉素的屎肠球菌已在全球传播,据2021年全国细菌耐药监测报告显示,我国屎肠球菌对万古霉素耐药率为1.2%,较2020年上升了0.2个百分点,其中北京市最高(9.9%)[6]。目前国内外对于VRE-fm研究的流行病学及耐药性分析的报道较少,鲜有关于广东地区VRE-fm相关研究的报道,因此本研究分析中山大学附属第一医院2017年1月—2023年6月临床分离VRE-fm菌株的流行病学资料及对不同抗生素的耐药率,为进一步预防多重耐药菌的感染提供理论依据。
1 材料与方法
1.1 菌株来源
回顾性分析中山大学附属第一医院自2017年1月—2023年6月临床分离的VRE-fm菌株共104株,剔除同一患者相同部位分离的重复菌株。本试验质控菌株为屎肠球菌ATCC29212。
1.2 细菌鉴定和药敏试验方法
临床标本的采集、接种、培养及鉴定参照《全国临床检验操作规程》[7]进行。VRE-fm入选标准:经基质辅助激光解析电离飞行时间质谱仪VITEK-MS或全自动微生物鉴定药敏分析仪Vitek-2鉴定为屎肠球菌的菌株,万古霉素(vancomycin,VAN)最低抑菌浓度(minimum inhibitory, MIC)为≥32 μg/mL,药敏试验结果参照CLSI 2022 M100标准[8]进行判读。替加环素(tegacycline, TGC)判定折点按照美国FDA关于肠球菌的标准,即敏感≤0.25 mg/L,无中介及耐药折点,因此>0.25 mg/L的结果判断为非敏感(包括中介和耐药)。
1.3 耐药基因及毒力基因检测
对本中心其中47株VRE-fm菌株进行全基因组测序。通过PCR方法检测47株VRE-fm菌株携带vanA、vanB和vanM等耐药基因情况。通过PCR检测8个毒力基因携带情况(cylA, cpd, asa1, ace, acm, esp, gelE, hyl)。检测方法和引物见参考文献[9-10]。
1.4 数据分析
用WHONET 5.6软件进行菌株及药敏统计分析,临床资料应用Spss23.0软件进行统计分析,正态分布的连续变量资料用均数(x)表示,分析采用独立样本t检验;分类变量用率(%)表示,采用χ2检验。
2 结果
2.1 VRE-fm菌株患者的基本资料
2017年1月—2023年6月共检出104株不重复的VRE-fm临床菌株,VRE-fm的平均检出率为4.4%(104/2332),其中2022—2023年VRE-fm的检出量明显上升,分别为44株(42.3%)和43株(41.3%)。患者年龄的中位数为62岁,≥60岁患者共66例(63.4%)其中男性患者59例(56.7%)。患者的科室分布情况分析,ICU和内科分别占33.7%和32.7%,外科和急诊科分别占17.3%和16.3%。
2.2 VRE-fm菌株的标本类型分布
VRE-fm菌株的标本类型分布中,排列前3的分别是尿液(54.8%)、引流液(14.4%)和血液(7.7%),其中超过一半菌株(57,54.8%)分离自尿液标本。结果见表1。
2.3 VRE-fm菌株的耐药性分析
对临床分离的104株VRE-fm菌株的药敏结果分析显示,VRE-fm对替加环素和利奈唑胺的敏感性均较好:本中心未发现对利奈唑胺耐药的VRE-fm菌株,对替加环素的敏感率为98.1%;对替考拉宁耐药率97.2%,对氨苄西林、青霉素G以及左氧氟沙星的耐药率均接近100%。结果见表2。
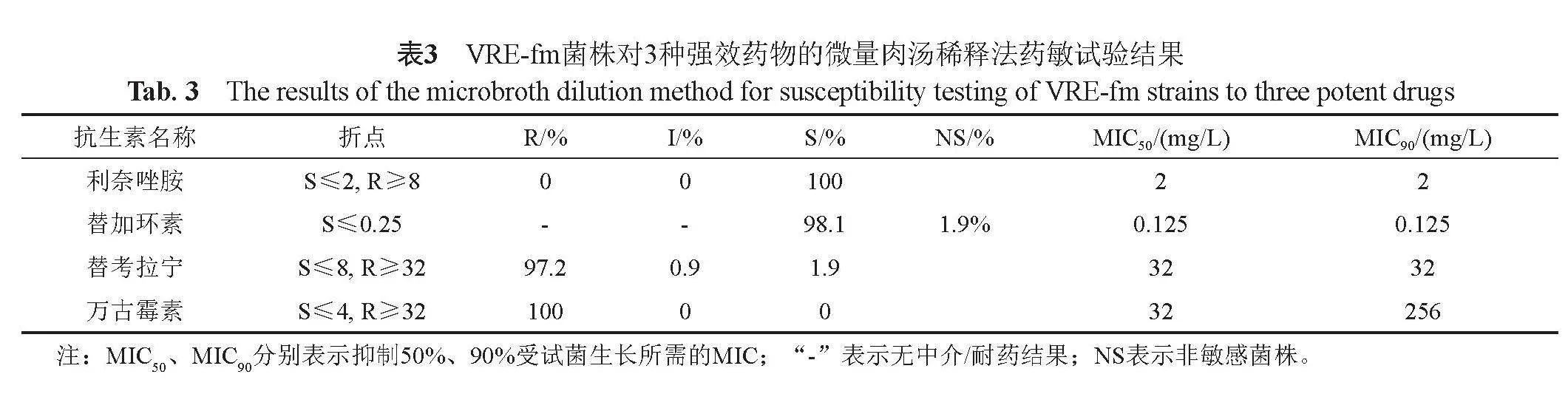
2.4 VRE-fm菌株对万古霉素、利奈唑胺、替加环素、替考拉宁的耐药性分析
微量肉汤稀释法药敏试验结果显示,104株VRE-fm对利奈唑胺全部敏感(MIC50=2 μg/mL,MIC90=
2 μg/mL);替加环素的敏感率为98.1%(MIC50=
0.125 μg/mL,MIC90=0.125 μg/mL);对替考拉宁的耐药率为97.2%(MIC50=32 μg/mL,MIC90=32 μg/mL);万古霉素的MIC50=32 μg/mL,MIC90=256 μg/mL。结果见表3。
2.5 VRE-fm菌株中利奈唑胺、替加环素、替考拉宁的MIC分布比较
本研究通过对104株VRE-fm菌株,利奈唑胺、替考拉宁、替加环素等3种抗生素MIC分布比较,94株(90.4%)菌株对替考拉宁耐药而对替加环素敏感(图1);97株(93.2%)菌株对替考拉宁耐药而对利奈唑胺敏感(图2);2株(2.0%)对替加环素非敏感而对利奈唑胺敏感(图3)。
2.6 对其中47株本中心VRE-fm菌株进行全基因组测序
2.6.1 耐药基因携带情况
通过PCR方法检测本中心其中47株VRE-fm菌株携带vanA、vanB和vanM等耐药基因情况。结果显示,本中心47株VRE-fm菌株均携带vanA基因,包含了完整的操纵子vanRSHAXYZ,该型基因会介导万古霉素和替考拉宁同时耐药,未检出vanB和vanM基因。
2.6.2 毒力基因携带情况
通过PCR检测8个毒力基因携带情况(cylA, cpd, asa1, ace, acm, esp, gelE和hyl)。结果显示本中心47株VRE-fm菌株全部携带acm基因,仅有1株VRE-fm菌携带esp基因,其余毒力基因均为阴性。
3 讨论
万古霉素是目前临床上治疗肠球菌感染最常用和最有效的抗生素之一,近年来在抗生素使用压力下,耐万古霉素屎肠球菌的检出率一直在上升,由耐万古霉素屎肠球菌引起感染的患者大多预后差、死亡率高,给临床诊疗带来巨大挑战,并且昂贵的抗菌药物费用给患者带来巨大的经济负担[9-11]。
本研究数据显示,近7年来本中心耐万古霉素屎肠球菌的检出率为4.4%,与北京协和医院报道的VRE-fm检出率(4%~6%)接近[12],低于国外报道的VRE-fm院内检出率[13-15]。2022—2023年本中心VRE-fm的检出率明显增高,提示应该进一步加强耐药监测以及重视院内感控防治。结果显示,超过50%的VRE-fm菌株分离自尿液标本,与Huh等[16-17]的研究结果一致,有研究显示导尿管的存在是患者发生院内VRE-fm尿路感染最常见的危险因素,尤其是ICU的患者[18-19]。本研究VRE-fm分离菌株的患者中,超过60%为老年患者,与Yan等[17,20]的报道一致,分析原因可能是老年患者的免疫力普遍低下,因此在相同环境下更容易获得VRE-fm的定植与感染。
目前临床上用来治疗VRE-fm的药物主要包括:利奈唑胺、替加环素,因此上述2种药物是临床上治疗VRE-fm的“最后一道防线”[21]。结果显示,临床分离的VRE-fm菌株对利奈唑胺、替加环素、替考拉宁的敏感率与Sengupta等[22]的研究结果一致。利奈唑胺对临床治疗方案严重受限的耐万古霉素肠球菌发挥着极为重要的作用,本中心分离的所有VRE-fm均对利奈唑胺敏感。根据现有的报道,目前已出现对替加环素非敏感的VRE-fm[22-23],这使临床上在治疗VRE-fm感染面临更大的挑战。因此,应该对VRE-fm进行长期的流行病学监测,建立本地VRE-fm数据库,为临床早期、合理使用抗生素提供重要依据。
VRE-fm最常见的耐药基因为vanA和vanB,在全球范围内,vanA是临床分离VRE-fm中最常见的耐药基因,vanA的操纵子携带在Tn1546型转座子上,并表现出高度的异质性[24-26]。对本中心其中47株VRE-fm菌株携带vanA、vanB和vanM等耐药基因情况进行分析,47株VRE-fm菌株均携带vanA基因,未检出vanB和vanM基因,本中心VRE-fm菌株的耐药基因流行情况与目前相关研究结果报道的流行耐药基因结果一致[24-26]。同时,本中心携带vanA基因的VRE-fm菌株均包含了完整的操纵子vanRSHAXYZ,该型基因会介导万古霉素和替考拉宁同时耐药。本中心流行的毒力基因为acm基因,1株携带esp基因,其余毒力基因均为阴性。相关研究结果表明[27],VRE-fm菌株中acm毒力基因携带率最高,与本研究结果一致。据报道[27],VRE-fm携带的esp基因与细菌的黏附和生物膜的形成有一定关系,一项关于屎肠球菌的报道中,esp毒力基因的检出率高达90%[28],本研究中只有1株携带esp基因,这可能与不同区域VRE-fm流行的种类差异有一定的关系,后期加大数据量做进一步研究。
鉴于目前VRE-fm的检出率持续增加,未来需要进一步加强对于VRE-fm的院感防控。有研究表明除针对VRE-fm的积极治疗之外,缩短患者的住院时长、优化对患者导尿管的护理及使用时长、对VRE-fm进行积极监测和主动筛查、同时对VRE-fm感染患者进行接触隔离、医务工作者加强手卫生、加强住院环境的清洁与消毒以及严格把控抗生素的合理应用等措施可有助于减少VRE-fm的临床定植率或感染率[20,29]。
本研究存在两个局限性:一方面本研究是单中心的研究,数据量较小,从而导致流行病学调查结果可能会存在偏移,后续的研究中拟纳入更多中心的流调数据进行分析;另一方面本研究未对患者感染的危险因素及预后做进一步研究,拟在下一步深入研究。
4 结论
VRE-fm菌株的耐药性严峻,VRE-fm菌株通常同时携带耐药基因和毒力基因,临床可用于治疗VRE-fm感染的药物非常有限。因此,应当加强对万古霉素等糖肽类抗菌药物的使用管理,努力开发和实施感染控制方法,以有效地防止VRE-fm的进一步发生和蔓延。
参 考 文 献
Werner G, Neumann B, Weber R E, et al. Thirty years of VRE in Germany-\"expect the unexpected\": The view from the National Reference Centre for Staphylococci and Enterococci[J]. Drug Resist Update, 2020, 53(2): 100732-44.
Selleck E M, Tyne D V, Gilmore M S. Pathogenicity of enterococci[J]. Microbiol Spectr, 2019, 7(4): 53-91.
Parte A C, Sardà Carbasse J, Meier-Kolthoff J P, et al. List of Prokaryotic names with standing in nomenclature (LPSN) moves to the DSMZ[J]. Int J Syst Evol Microbiol. 2020, 70(11): 5607-5612.
胡付品, 郭燕, 朱德妹, 等. 2021年CHINET中国细菌耐药监测[J].中国感染与化疗杂志, 2022, 22(5): 521-530.
Lam S, Singer C, Tucci V, et al. The challenge of vancomycin-resistant Enterococci: A clinical and epidemiologic study[J]. Am J Infect Control, 1995, 23(3): 170-180.
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1): 15-31.
卫生部北京医院. 全国临床检验操作规程[M]." 北京,1999.
CLSI-Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Susceptibility Testing, 32th ed[S]." Wayne, PA, USA, 2022: M100-S32.
Vankerckhoven V, Van Autgacrden T, Vael C, et al. Development of a multiplex PCR for the detection of asa1, gelE, cylA, esp, and hyl genes in enteroccci and survey for virulence determinants among European hospital isolates of Enterococcus faecium. J Clin Microbiol, 2004, 42(10): 4473-4479
Liu H F, Huang X Y, Li Z M, et al. Virlence gene detection and antimicrobial resistance analysis of Enterococcus faecium in captive giant pandas (Ailuropoda melanoleuca) in China. Acta Vet Scand, 2023, 65(1): 4-13.
Jiang H L, Zhou Z, Wang L S, et al. The risk factors, costs, and survival analysis of invasive VRE infections at a medical center in Eastern Taiwan China[J]. Int J Infect Dis, 2017, 54: 18-24.
张小江, 张辉, 杨启文, 等. 世界卫生组织关注的临床重要细菌耐药变迁: 北京协和医院10年数据分析[J]. 协和医学杂志, 2018, 9(1): 48-53.
Crouzet L, Derrien M, Cherbuy C, et al. Lactobacillus paracasei CNCM I-3689 reduces vancomycin-resistant Enterococcus persistence and promotes Bacteroidetes resilience in the gut following antibiotic challenge[J]. Sci Rep, 2018, 8(1): 5098-5109.
Cimen C. Vancomycin-resistant enterococci(VRE) in hospital settings across European borders: A scoping review comparing the epidemiology in the Netherlands and Germany[J]. Infection Control, 2023, 12(1): 78-98.
Azzam A. Prevalence of vancomycin-resistant enterococci (VRE) in Egypt (2010-2022): A systematic review and meta-analysis[J]. JEPHA, 2023, 98(1): 8-21.
Wardenburg K E, Potter R F, D'Souza A W, et al. Phenotypic and genotypic characterization of linezolid-resistant Enterococcus faecium from the USA and Pakistan[J]. JAC, 2019, 74(12): 3445-3452.
Huh K, Chung D R, Ha Y E, et al. Korean Antimicrobial Resistance Surveillance Network (KARS-Net) investigators. Impact of vancomycin resistance in Enterococcus faecium bloodstream infection on mortality: A retrospective analysis of nationwide surveillance data[J]. Int J Infect Dis, 2023, 134: 8-14.
Smout E, Palanisamy N, Valappil S P. Prevalence of vancomycin-resistant enterococci in India between 2000 and 2022: A systematic review and meta-analysis[J]. Antimicrob Resist In, 2023, 12(1): 79-92.
Marra A R, Sampaio Camargo T Z, Gonçalves P, et al. Preventing catheter-associated urinary tract infection in the zero-tolerance era[J]. Am J Infect Control, 2011, 39(10): 817-822.
Yan M Y, He Y H, Ruan G J, et al. The prevalence and molecular epidemiology of vancomycin-resistant enterococcus(VRE) carriage in patients admitted to intensive care units in Beijing, China[J]. J Microbiol Immunol Infect, 2023, 56(2): 351-357.
袁妍, 朱卫民. 耐万古霉素肠球菌患者的临床分布特点及耐药性分析[J]. 中国药房, 2022, 33(10): 1253-1257.
Sengupta M, Sarkar R, Sarkar S, et al. Vancomycin and linezolid-resistant enterococcus isolates from a tertiary care center in India[J]. Diag (Basel), 2023, 13(5): 945-954.
Cho S Y, Kim H M, Chung D R, et al. Resistance mechanisms and clinical characteristics of linezolid-resistant Enterococcus faecium isolates: A single-centre study in South Korea[J]. J Glob Antimicrob Re, 2018, 12: 44-47.
Fiore E, Van Tyne D, Gilmore M S. Pathogenicity of enterococci. Microbiol Spectr[J]. 2019, 7(4):1128-1151.
Gorrie C, Higgs C, Carter G, et al. Genomics of vancomycin-resistant Enterococcus faecium[J]. Microb Genom, 2019, 5(7): e000283-291.
Bender J K, Cattoir V, Hegstad K, et al. Update on prevalence and mechanisms of resistance to linezolid, tigecycline and daptomycin in enterococci in Europe: Towards a common nomenclature[J]. Drug Resist Updat, 2018, 40: 25-39.
Liu H F, Huang X Y, Li Z M, et al. Virulence gene detection and antimicrobial resistance analysis of Enterococcus faecium in captive giant pandas (Ailuropoda melanoleuca) in China[J]. Acta Vet Scand. 2023, 65(1): 4-13.
Erdem F, Kayacan C, Oncul O, et al. Clonal distribution of vancomycin-resistant Enterococcus faecium in Turkey and the new singleton ST733[J]. J Clin Lab Anal, 2020, 34(12): e23541-51.
De Angelis G, Cataldo M A, De Waure C, et al. Infection control and prevention measures to reduce the spread of vancomycin-resistant enterococci in hospitalized patients: A systematic review and meta-analysis[J]. JAC, 2014, 69(5): 1185-1192.
文章编号:1001-8689(2024)09-1057-06
收稿日期:2023-12-01
基金项目:广东省医学科学技术研究基金项目(No. C2023048)
作者简介:刘平娟,女,生于1993年,主管检验技师,主要从事临床微生物检验工作,E-mail: 409772511@qq.com
*通信作者, E-mail: liaokang1971@163.com
