地产化注射用头孢唑林钠对葡萄球菌体外PK/PD研究
2024-12-31杜梦娇王雪婷肖永红


摘要:目的 研究地产化注射用头孢唑林钠对葡萄球菌的体外抗菌效果,为临床用药提供参考。方法 通过药敏实验、杀菌曲线和体外药动学/药效学(pharmacokinetics/pharmacodynamics, PK/PD)模型比较地产化与原厂头孢唑林钠体外抗菌效果。结果 地产化与原厂头孢唑林钠对所测4株细菌的最低抑菌浓度(minimum inhibitory concentration, MIC)值完全一致,对金黄色葡萄球菌ATCC29213、2株临床分离甲氧西林敏感金黄色葡萄球菌(methicillin-susceptible Staphylococcus aureus, MSSA)的MIC值均为0.25 μg/mL,对1株甲氧西林敏感凝固酶阴性葡萄球菌(methicillin-susceptible coagulas-negative Staphylococcus, MSCNS)MIC值均为0.06 μg/mL。2种头孢唑林钠对4株葡萄球菌在3种药物浓度下的杀菌曲线无显著差异,药物浓度为1×MIC时细菌生长受到明显抑制,4株细菌24 h菌液浓度增量小于2 lgCFU/mL,药物浓度为2×MIC和4×MIC时,菌落数量均由6 lgCFU/mL持续下降到3 lgCFU/mL左右。分析动态杀菌曲线发现,2种头孢唑林钠整体PK/PD模拟结果相似,但对于菌株MSCNS117933和MSSA164342的杀菌曲线面积差,地产化头孢唑林钠参数值为(151.40±0.05)和(177.69±2.79) lgCFU·h/mL,原厂头孢唑林钠参数值为(151.10±0.11)和(170.4±1.96) lgCFU·h/mL,地产化参数值均大于原厂。结论 地产化与原厂头孢唑林钠对葡萄球菌的抗菌效果整体相同。
关键词:头孢唑林钠;药动学/药效学;地产化;葡萄球菌;杀菌曲线;体外
中图分类号:R978.1 文献标志码:A
In vitro pharmacokinetic/pharmacodynamic studies on localized cefazolin sodium for injection against staphylococci
Du Mengjiao1,2, Wang Xueting3,4," and Xiao Yonghong2,3,4
(1 Shandong First Medical University amp; Shandong Academy of Medical Sciences, Ji'nan 250117; 2 Jinan Microecological Biomedicine Shandong Laboratory, Ji'nan 250098; 3 Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases , State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, the First Hospital of Zhejiang University School of Medicine, Hangzhou" 310003; 4 Research Units of" Infectious disease and Microecology, Chinese Academy of Medical Sciences, Hangzhou 310003)
Abstract Objective To investigate the in vitro antimicrobial effects of cefazolin sodium for injection against staphylococci and provide reference for clinical medication. Methods Comparison of in vitro antimicrobial efficacy of localized and original cefazolin sodium by in vitro antibacterial susceptibility test, time-kill curve and pharmacokinetics/pharmacodynamics modeling was processed. Results The minimum inhibitory concentration (MIC) values of localized and original cefazolin sodium against staphylococci were consistent, with 0.25 μg/mL against Staphylococcus aureus (S. aureus) ATCC29213 and 2 clinical strains of methicillin-sensitive S. aureus (MSSA), and 0.06 μg/mL against 1 strain of methicillin-sensitive coagulase-negative Staphylococcus (MSCNS). There was no significant difference in the time-kill curve of the 2 types of cefazolin sodium against the 4 strains of S. aureus at 3 drug concentrations. Bacteria was significantly inhibited at the drug concentration of 1×MIC, and the total number of colonies of 4 strains increased by less than 2 lgCFU/mL in 24 h. The number of colonies gradually decreased from 6 lgCFU/mL to about 3 lgCFU/mL at the 2×MIC and 4×MIC drug concentrations. Overall, the PK/PD results of the 2 agents were similar by analyzing the dynamic sterilization curves, but the area difference of the bactericidal curves of localized cefazolin sodium against MSCNS117933 and MSSA164342 were greater than those of the original cefazolin sodium. The parameter values of the original cefazolin sodium were (151.40±0.05)and (177.69±2.79) lgCFU·h/mL, and the localized cefazolin sodium were (151.10±0.11) and (170.4±1.96) lgCFU·h/mL, respectively. Conclusion The antibacterial effect of localized cefazolin sodium against staphylococci is the same as that of original cefazolin sodium.
Key words" " Cefazolin sodium; Pharmacokinetics/Pharmacodynamics; Localized product; Staphylococcus; Time-kill curves; In vitro
头孢唑林为第一代头孢菌素,对革兰阳性球菌的抗菌作用强于第二代和第三代,是世界卫生组织(World Health Organization, WHO)和我国国家基本药物,临床上主要用于甲氧西林敏感金黄色葡萄球菌、甲氧西林敏感凝固酶阴性葡萄球菌等敏感致病菌引起的各种感染及外科围术期预防用药[1]。
ACS Dobfar公司生产的头孢唑林钠于1973年以品牌产品在美国注册上市,已同时被美国药监局和中国药监局认定为参比制剂(标准制剂)[2]。现已广泛在欧洲、美国和中国等多个地区和国家临床应用[3]。广东金素制药有限公司所持证的注射用头孢唑林钠为采用参比制剂持证商ACS Dobfar相同供应链并获其授权进行地产化品种,首家通过了国家药监局仿制药质量与疗效一致性评价并中选第五批国家药品集中采购[4]。
体外PK/PD模型是药效学和药动学的综合分析模型,可以对多种给药方式、剂量、间隔乃至适应症等进行模拟分析,能够部分反映药物、机体和病原菌三者之间的相互作用关系和药效随时间变化的规律,目前已广泛应用于抗菌药物研究的多个方面[5-6]。故本研究选择体外PK/PD模型,进行地产化与原厂头孢唑林钠的体外抗菌活性的比较,评估二者药效学一致性,为临床用药提供参考。
1 材料和方法
1.1 材料
1.1.1 药品和培养基
参比制剂原厂头孢唑林钠(生产批号2010E0)购自意大利ACS Dobfar公司;地产化头孢唑林钠(生产批号101220500)购自广东金素制药有限公司; Mueller-Hinton Broth液体培养基(MHB,货号CM0405B),Mueller-Hinxton Agar固体培养基(MHA,货号CM0337),均购自英国Oxoid公司。
1.1.2 实验菌株
金黄色葡萄球菌标准株ATCC29213;临床分离株MSSA164342、MSSA172694和MSCNS117933,均为本实验室保存菌株。
1.2 方法
1.2.1 最低抑菌浓度测定
测定方法参照美国临床和实验室研究标准(Clinical And Laboratory Standards Institute, CLSI)推荐方法[7],地产化与原厂头孢唑林钠对4株细菌的MIC值采用琼脂稀释法进行测定。
1.2.2 静态杀菌曲线测定
过夜培养的菌液,使用比浊仪调至1.5×108 CFU/mL,将调配好的菌悬液10倍稀释后分别取400 μL加入药物浓度分别为0、1×MIC、2×MIC和4×MIC的摇菌管(加入菌液前管中MHB肉汤体积为3.6 mL,加入菌液后相当于菌液作10倍稀释)中震荡孵育,使初始接种菌量为106 CFU/mL左右。细菌接种到摇菌管后连续孵育24 h,在实验开始后的0、1、2、4、6、8、12和24 h各收集100 μL样品,使用0.9%生理盐水稀释后接种至MHA平板,37 ℃孵育20 h后进行计数。实验均重复3次,根据3次实验结果绘制杀菌曲线。由于菌落计数的最佳数量为300~30个菌落,超过则过密,小于则稀释倍数太大,原液涂板时,菌落数为30定为检测下限,大约为3.96×102 CFU/mL,少于30则按照实际数量进行计数。
1.2.3 头孢唑林钠体外PK过程模拟
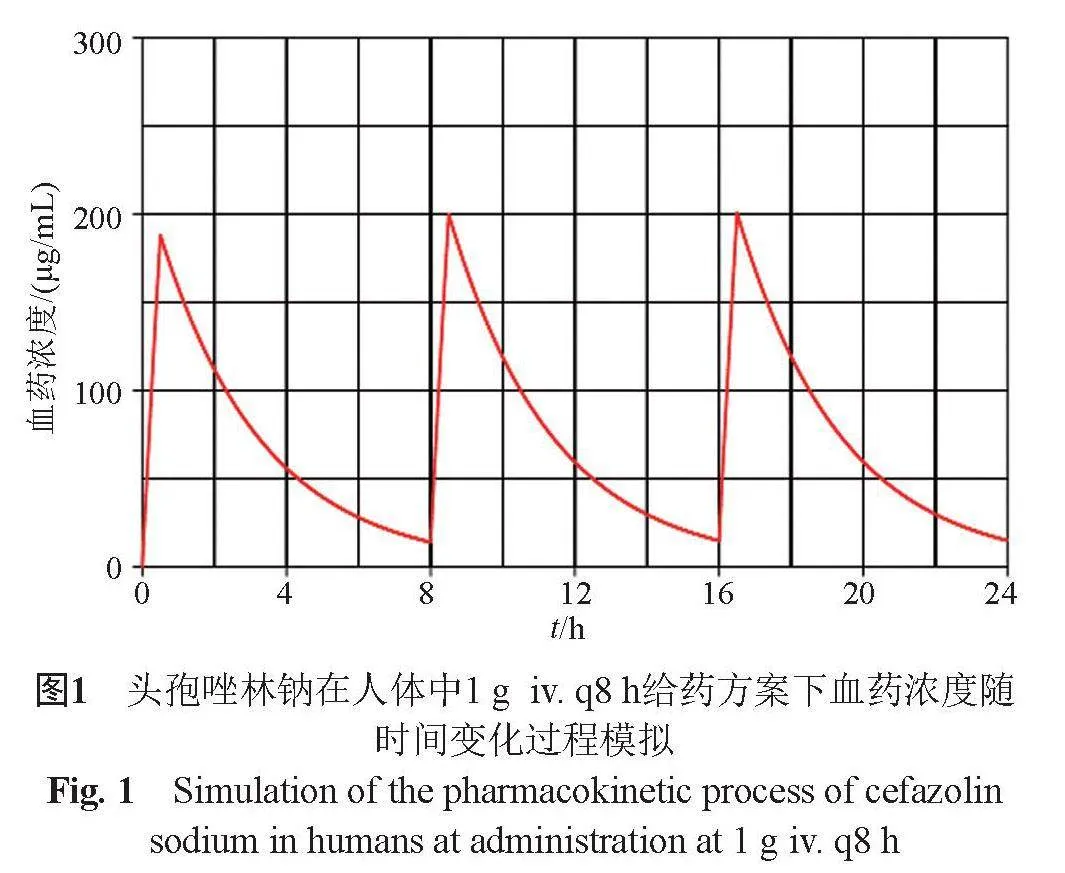
按照说明书中头孢唑林钠在健康人体内的药动学参数进行PK过程的模拟,给药方案为1g iv. q8h,每次静滴0.5 h,共24 h[8]。原厂头孢唑林钠具体PK参数:峰浓度(Cmax)185 μg/mL,半衰期(t1/2)2.0 h以及达峰时间(Tmax)为30 min[1];地产化头孢唑林钠峰浓度为188 μg/mL,其余参数同原厂参比制剂。根据一房室模型绘制药时浓度曲线[9](图1)。
1.2.4 体外PK/PD模拟
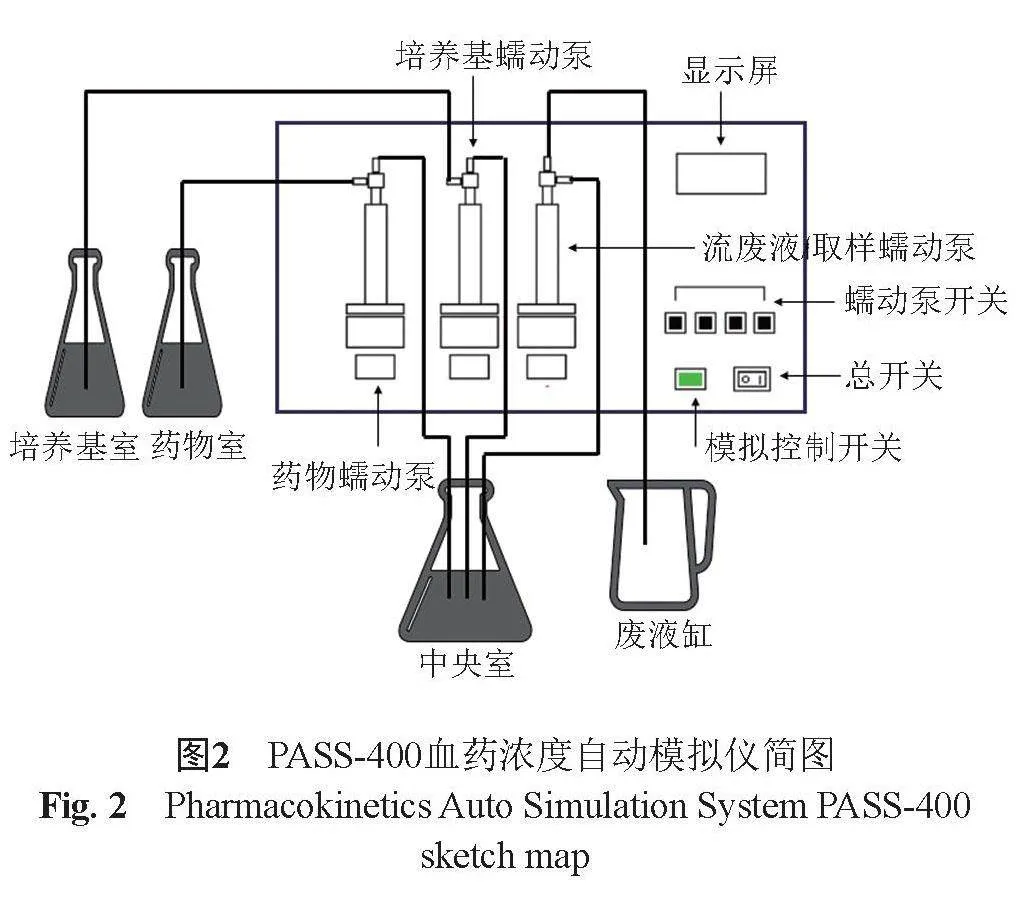
本研究采用PASS-400血药浓度自动模拟仪(日本Dainippon Seiki公司)(图2)进行体外PK/PD研究,该仪器由配套软件PASS-402W(Version 2.00,日本Dainippon Seiki公司)操控,仪器分为中央室、培养基储液室、抗菌药物储液室和废液室4部分,各部分由无菌注射器、灭菌三通和配管相互连接,形成一个封闭系统。中央室、培养基储液室、抗菌药物储液室为3个1000 mL三角烧瓶,中央室中有一个磁力搅拌子,持续旋转使中央室药物浓度均一。在PASS-402W软件中输入药物在体内的药动学参数后,软件将根据模拟出的药物浓度时间曲线(图1)操控PASS-400仪器还原抗菌药物在人体内的代谢过程,借助气缸泵将抗菌药物从药物储液室以恒定的速度泵入中央室,给药过程持续30 min,同时将新鲜的肉汤从培养基储液室泵入中央室和以不同的消除速度将含药培养基从中央室泵出,模拟药物的代谢过程。模拟过程中,中央室的体积恒定,中央室、培养基储液室和抗菌药物储液室均置于37 ℃恒温水浴中。实验前后各部分需要高压灭菌,组装各部件时需要无菌操作。
将高压灭菌后的各部件组装完成后,添加适量头孢唑林钠储备液至含有500 mL 0.9%生理盐水的抗菌药物储液室中,储液室中所需地产化与原厂头孢唑林钠药物浓度分别为275和350 μg/mL(药物浓度通过PASS-402W软件模拟得出)。过夜培养的菌液,使用比浊仪调至1.5×108 CFU/mL,取1 mL接种到含有100 mL MHB肉汤的中央室中,初始接种菌量为106 CFU/mL左右。细菌接种到中央室后连续孵育24" h,在预定时间点(0、1、2、4、6、8、12和24 h)收集1 mL样品,使用0.9%生理盐水稀释后接种至MHA平板,37 ℃孵育20 h后进行计数,实验均重复3次,根据3次实验结果进行统计分析。
1.2.5 PD参数测定
最大杀菌量(maximum kill down, MKD)、再生至初始菌量所需时间(bacterial growth recovery time, RT)和24 h杀菌量(ΔlgN24)使用PASS-400系统分析得出,杀菌曲线下面积(area under kill curve, AUKC)和药物杀菌曲线与细菌生长空白对照曲线面积差(IE)使用GraphPad Prism 8.0.2软件(美国graphpad software公司)积分获得,杀菌速率(killing rate, KR)计算:各时间点给药组减去对照组菌落计数,然后0与2 h菌落计数差值相减再除以时间差[6],可以转化为下式(图3):
KR=
N给药(0h):给药组0 h时菌落计数值;N给药(2h):给药组2 h时菌落计数值;N对照(0h):对照组0 h时菌落计数值;N对照(2h):对照组2 h时菌落计数值。
1.2.6 统计分析
使用GraphPad Prism 8.0.2软件(美国Graphpad software公司)对数据进行统计分析,地产化与原厂头孢唑林钠对4株菌的PD参数的值以(x±s)表示,采用独立样本t检验比较二者对4株细菌的PD参数是否有差异,Plt;0.05为差异具有统计学意义。
2 结果
2.1 药敏实验
地产化与原厂头孢唑林钠对4株细菌均敏感且MIC值一致,ATCC29213、2株MSSA的MIC值均为0.25 μg/mL,1株MSCNS的MIC值均为0.06 μg/mL。
2.2 静态杀菌曲线
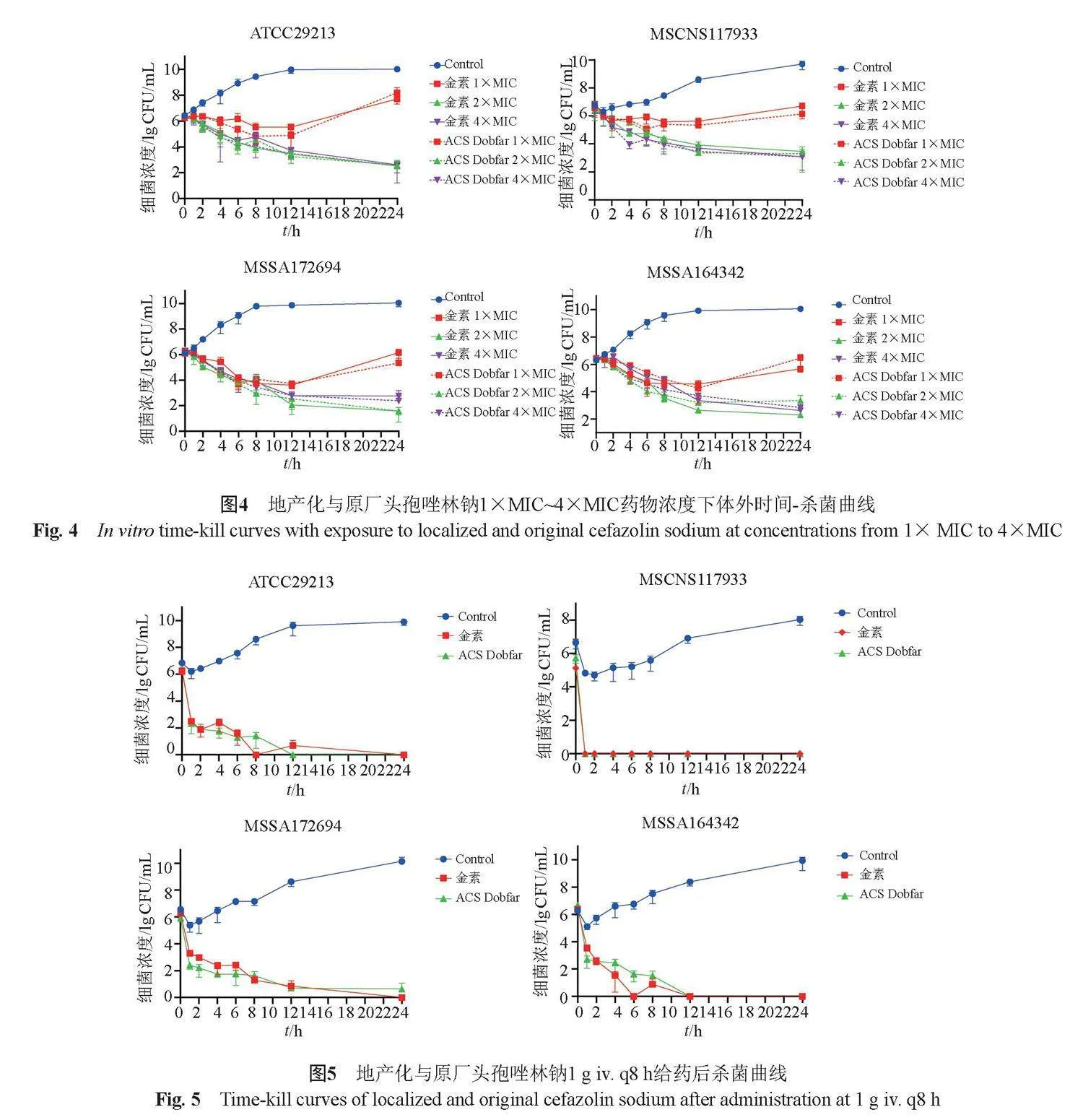
1×MIC、2×MIC和4×MIC药物浓度下,地产化与原厂头孢唑林钠对4株细菌的杀菌曲线均无显著差异。药物浓度为1×MIC时,4株菌的生长均受到明显抑制,12 h之后菌落数量缓慢上升,24 h菌液浓度增量小于2 lgCFU/mL;药物浓度为2×MIC和4×MIC时杀菌效果类似,符合头孢唑林时间依赖型杀菌的特点,菌落数量呈现出一直下降的趋势,由6 lgCFU/mL下降到3 lgCFU/mL左右,地产化与原厂头孢唑林钠均表现出良好的杀菌效果(图4)。
2.3 动态杀菌曲线
2.3.1 地产化与原厂头孢唑林钠杀菌作用
在体外PK模拟情况下,地产化与原厂头孢唑林钠整体杀菌效果类似。但对ATCC29213,原厂头孢唑林钠较地产化头孢唑林钠更加迅速地将细菌清除,12 h时所采集样本已不能培养出细菌,且无菌株复生现象,对MSSA172494,原厂头孢唑林钠则稍差于地产化头孢唑林钠,24 h时仍能检出细菌(菌量在1 lgCFU/mL左右)。从杀菌曲线下面积分析,对MSSA164342,地产化头孢唑林钠杀菌曲线几乎在实验全程中都明显低于参比头孢唑林钠杀菌曲线,显示出更优越的杀菌效果(图5)。
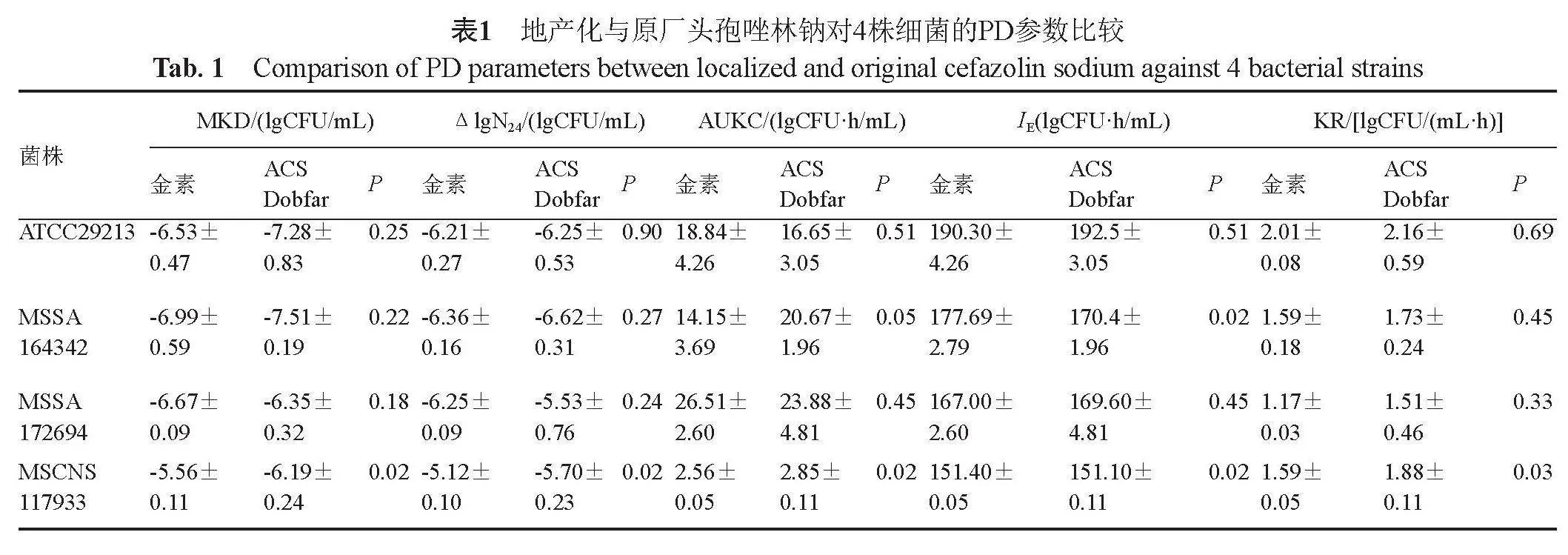
2.3.2 地产化与原厂头孢唑林钠PD参数比较
比较地产化与原厂头孢唑林钠对菌株ATCC29213和MSSA172694的各PD参数发现均无统计学差异。对于菌株MSSA164342,地产化头孢唑林钠IE为(177.69±2.79) lgCFU·h/mL,原厂头孢唑林钠为(170.4±1.96) lgCFU·h/mL,二者具有统计学差异。对于菌株MSCNS117933,地产化与原厂头孢唑林钠对PD参数MKD、ΔlgN24、AUKC、IE以及KR均表现出统计学差异,P<0.05(表1)。地产化与原厂头孢唑林钠组24 h内各菌株均未发现再生现象,故再生至初始菌量时间RT均记为大于24 h。
3 讨论
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常具有完整的临床研究数据,如原研药品或国际公认的同种药物。参比制剂是处方工艺合理、质量稳定、疗效确切的药品。由于常规的注射用药品一致性评价并不要求进行药效学比较临床研究,不能完全反映抗菌药物临床使用过程的一致性[2]。《医疗机构抗菌药物集中带量采购管理专家共识》鼓励医疗机构完善集采抗菌药物临床综合评价的方法学体系建设,充分利用各级医疗卫生机构的真实世界数据,按照《药品临床综合评价管理指南(2021版试行)》组织开展科学规范的抗菌药物临床综合评价。先后有多位学者采用体外和体内多种实验方法对仿制药和参比制剂疗效是否一致进行了考察。包括通过药敏实验和静态杀菌曲线比较仿制药和参比药的体外抗菌活性和杀菌效率[10-11];通过蒙特卡罗模拟比较仿制药和参比制剂在特定给药方案以及不同MIC下PK/PD靶值的达标概率,进行临床疗效的预测[12-13];通过体外PK/PD模型动态研究抗菌药物与细菌的作用关系,绘制杀菌曲线、比较PD参数[6,14];以及利用动物感染模型[15]和开展临床试验[16-18]进行仿制药和参比药体内抗菌疗效的比较等。部分结果表明,通过了生物等效性评价的一些仿制药药效仍不能与参比制剂相媲美。原因可能在于仿制药活性成分实际含量与标注含量有所差异[12]以及杂质和所添加辅料影响了药效的发挥[16]。
本研究实验结果显示,地产化与原厂头孢唑林钠对4株细菌均敏感且MIC值完全一致,2株MSSA MIC值为0.25 μg/mL,与文献中0.25~0.5 μg/mL药敏结果相符[19]。基于MIC值,观察在1、2和4倍MIC药物浓度下杀菌情况,地产化与原厂头孢唑林钠杀菌曲线同样没有显著差异。1×MIC药物浓度下细菌生长先被抑制,大约12 h后菌落数量开始明显增加,2×MIC和4×MIC药物浓度杀菌效果类似,与文献中结果一致[20],该结果与头孢唑林钠为时间依赖型抗菌药物相符。
进一步PK/PD模拟的结果表明,地产化与原厂头孢唑林钠对其中2株细菌PD参数的值存在统计学差异。对于菌株MSCNS,PD参数MKD、ΔlgN24、KR、AUKC和IE皆有差异。由于PD参数IE综合考虑了药物杀菌曲线与细菌生长空白对照曲线,直接衡量抗菌剂的抗菌效果,有学者认为IE更能全面、无偏倚地评估各抗菌药物不同给药方案下的治疗效果[21]。同样另一株MSSA164342也是地产化头孢唑林钠IE的值大于参比头孢唑林钠,提示地产化头孢唑林钠的药效不逊色甚至略优于原厂头孢唑林钠。
本研究亦有一些不足之处,虽然有研究表明体外模型和动物感染模型的研究结果差异无统计学意义[22],但是体外PK/PD模型无法模拟机体、细菌和药物之间的相互作用,包括免疫系统对细菌的清除能力,药物对机体免疫能力的影响,机体对药物的代谢作用、机体内代谢产物以及内环境的理化性质对药物的影响等[23],所以对于地产化与原厂头孢唑林钠整体抗菌效果类似的实验结果,仍需在动物实验以及临床应用中进一步验证。其次,本研究的实验菌株只有4株,数量较少,考虑在进一步的研究中,扩大菌株数量,使实验结果更具有代表性。此外,在接下来的研究中也会增加对中央室药物浓度的检测,确保中央室药物浓度与人体药动学过程相契合。
总之,本研究的实验结果表明参比制剂地产化(金素)与原厂(ACS Dobfar)头孢唑林钠对葡萄球菌整体抗菌效果类似。结果一方面可以弥补地产化头孢唑林钠临床疗效研究的不足,作为临床用药时的重要参考,增加医师、药师和患者对于广东金素头孢唑林钠的用药信心,缓解患者经济压力;另一方面又为一致性评价方法提供思路,作为药效学和药动学的综合分析模型,体外PK/PD模型是能够反映药效随药物浓度及时间变化的规律, 比起以PK参数为终点评价指标的生物等效性研究,具有独特优势。
参 考 文 献
Sagent Pharmaceuticals. Cefazolin for Injection, USP[EB/OL]. [2023-09-20]. https://www.sagentpharma.com/wp-content/uploads/2021/01/Cefazolin-for-Injection_SDV_PI_Dec-2020.pdf.
Food and Drug Administration. Drugs@FDA: FDA-Approved Drugs[EB/OL]. [2023-04-20]. https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.processamp;ApplNo=065306.
武建卓, 肖慧, 洪建文. 注射用头孢唑林钠国内外质量现状分析[J]. 国外医药(抗生素分册), 2020, 41(6): 416-419.
山东金城医药集团股份有限公司董事会. 山东金城医药集团股份有限公司关于子公司注射用头孢唑林钠首家通过仿制药质量与疗效一致性评价的公告[EB/OL]. [2023-08-20]. http://static.cninf o.com.cn/finalpage/2021-01-19/1209142398.PDF.
王芳, 刘亚娜, 吴香云, 等. 药动学-药效学模型在制定及优化抗菌药物给药方案中的应用[J]. 动物医学进展, 2021, 42(7): 110-114.
杨凯, 张舜天, 黄晨, 等. 国产与原研利奈唑胺对革兰阳性菌体外PK/PD比较研究[J]. 中国抗生素杂志, 2023, 48(2): 209-214.
Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing, 32st edition[EB/OL]. [2023-01-20]. https://clsi.org/ standards/products/microbiology/documents/m100/.
山东金城医药集团股份有限公司. 注射用头孢唑林钠说明书[EB/OL]. [2024-03-20]. http://www.jinchengpharm.com/wap_products_detail_cn/id/70.html.
Andriole V T. Pharmacokinetics of cephalosporins in patients with normal or reduced renal function[J]. J Infect Dis, 1978," 137(Suppl): S88-s99.
马攀, 陈勇川, 胡显飞, 等. 仿制和原研左氧氟沙星的体外抗菌活性比较[J]. 中南药学, 2021, 19(1): 56-61.
胡显飞. 基于抗菌药物PK/PD特性的头孢克洛仿制药质量与疗效一致性评价[D]. 重庆: 陆军军医大学, 2021.
Schito G C, Keenan M H. Predicting the clinical efficacy of generic formulations of ceftriaxone[J]. J Chemother, 2005, 17(Suppl 2): 33-40.
Ma P, Shang S, Feng W, et al. Pharmacokinetic/pharmacodynamic comparison between generic and brand-name levofloxacin based on Monte Carlo simulation[J]. J Glob Antimicrob Resist, 2023, 33: 120-129.
张舜天, 黄晨, 嵇金如, 等. 体外PK/PD对国产与原研替加环素抗菌效果比较[J]. 中华临床感染病杂志, 2020, 13(4): 264-269.
Agudelo M, Rodriguez C A, Pelaez C A, et al. Even apparently insignificant chemical deviations among bioequivalent generic antibiotics can lead to therapeutic nonequivalence: The case of meropenem[J]. Antimicrob Agents Chemother, 2014, 58(2): 1005-1018.
Bendas E R, Rezk M R, Badr K A. Drug interchangeability of generic and brand products of fixed dose combination tablets of sofosbuvir and ledipasvir (400/90 mg): Employment of reference scaled average bioequivalence study on healthy egyptian volunteers[J]. Clin Drug Investig, 2018, 38(5): 439-448.
Chen B, Chen Z, Lv D, et al. Pharmacokinetics, bioequivalence, and safety studies of amlodipine besylate in healthy subjects[J]. Clin Pharmacol Drug Dev, 2022, 11(6): 717-723.
Pathak P, Pandit V A, Dhande P P. Bioequivalence of generic and branded amoxicillin capsules in healthy human volunteers[J]. Indian J Pharmacol, 2017, 49(2): 176-181.
Sweeney D, Shinabarger D L, Arhin F F, et al. Comparative in vitro activity of oritavancin and other agents against methicillin-susceptible and methicillin-resistant Staphylococcus aureus[J]. Diagn Microbiol Infect Dis, 2017, 87(2): 121-128.
Heffernan A, Alawie J, Wallis S C, et al. Pharmacodynamic evaluation of a single dose versus a 24-Hour course of multiple dxoses of cefazolin for surgical prophylaxis[J].Antibiotics (Basel), 2021, 10(5): 602.
Firsov A A, Vostrov S N, Shevchenko A A, et al. Parameters of bacterial killing and regrowth kinetics and antimicrobial effect examined in terms of area under the concentration-time curve relationships: Action of ciprofloxacin against Escherichia coli in an in vitro dynamic model[J]. Antimicrob Agents Chemother, 1997, 41(6): 1281-1287.
Bonapace C R, Friedrich L V, Bosso J A, et al. Determination of antibiotic effect in an in vitro pharmacodynamic model: Comparison with an established animal model of infection[J]. Antimicrob Agents Chemother, 2002, 46(11): 3574-3579.
王林, 刘伟, 李昕, 等. 体外PK/PD模型在优化抗菌药物给药方案中的应用[J]. 中国感染控制杂志, 2014, 13(1): 58-61.
文章编号:1001-8689(2024)09-1075-07
收稿日期:2024-02-26
作者简介:杜梦娇,女,生于2000年,在读硕士研究生,主要研究方向为抗菌药物PK/PD研究,E-mail: 2567529079@qq.com
*通信作者,E-mail: xiao-yonghong@163.com
