基于网络药理学和生物信息学方法探讨黄连解毒汤治疗阿尔茨海默病的作用机制
2024-12-31郭斌薛佳贾保平王建玲张鑫马义鹏张伟




摘要" 目的:采用网络药理学和生物信息学的方法探讨黄连解毒汤治疗阿尔茨海默病(AD)的活性成分、关键靶点和潜在分子机制。方法:从中药系统药理学分析数据库(TCMSP)和中医药百科全书平台数据库(ETCM)中检索黄连解毒汤的活性成分、潜在靶点。通过GEO数据库基因芯片分析获得AD的差异表达基因,联合GeneCards、OMIM、PharmGkb、TTD、DrugBank数据库筛选出AD的潜在疾病基因。对疾病基因和活性成分靶点取交集,利用Cytoscape 3.9.1软件构建活性成分-靶点关系网络,基于STRING数据库,构建蛋白互作(PPI)网络,分析筛选出核心靶点,并进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)信号通路富集分析。结果:筛选出64种黄连解毒汤活性成分,265个黄连解毒汤与AD交集基因,10个主要作用成分,12个起关键调控作用的潜在靶点。GO功能富集分析得到生物学过程2 480条,细胞组分94条,分子功能248条,KEGG通路富集分析得到187条相关信号通路。黄连解毒汤通过槲皮素、黄芩素、β-谷甾醇、豆甾醇、山柰酚等主要活性成分作用于TP53、雌激素受体1(ESR1)、丝裂原活化蛋白激酶1(MAPK1)、蛋白激酶B1(AKT1)、白细胞介素6(IL6)、原癌基因(FOS)、肿瘤坏死因子(TNF)、BCL2等核心靶点,调控脂质与动脉粥样硬化通路、乙型肝炎信号通路、卡波西肉瘤相关疱疹病毒感染、流体剪切应力与动脉粥样硬化、白细胞介素17(IL-17)等信号通路,并且参与外源性刺激反应、膜电位调节、活性氧反应、氧化应激反应、脂多糖反应等生物学过程以发挥治疗AD的作用。结论:黄连解毒汤可能通过多成分、多靶点和多途径来治疗改善AD。
关键词" 阿尔茨海默病;黄连解毒汤;网络药理学;生物信息学
doi:10.12102/j.issn.1672-1349.2024.19.009
Exploration on the Molecular Mechanisms of Huanglian Jiedu Decoction in Treating Alzheimer′s Disease Based on Network Pharmacology and Bioinformatics
GUO Bin, XUE Jia, JIA Baoping, WANG Jianling, ZHANG Xin, MA Yipeng, ZHANG Wei
Shanxi Cardiovascular Hospital, Taiyuan 030024, Shanxi, China
Corresponding Author" ZHANG Wei, E-mail: 13994213629@163.com
Abstract" Objective:A network pharmacology-based approach combined with bioinformatics was performed to determine the bioactives,key targets,and potential molecular mechanisms of Huanglian Jiedu Decoction(HLJDD) against Alzheimer′s disease(AD).Methods:Bioactives and potential targets of HLJDD were retrieved from Traditional Chinese Medicine Systems Pharmacology Analysis Database(TCMSP) and The Encyclopedia of Traditional Chinese Medicine(ETCM).The differentially expressed genes of AD were obtained by gene chip analysis of GEO database,and the potential disease genes of AD were screened jointly with GeneCards,OMIM,PharmGkb,TTD,and DrugBank databases.The intersection of disease genes and active ingredient targets was taken,and the active ingredient-target relationship network was constructed using Cytoscape 3.9.1 software.Based on the STRING database,the protein-protein interaction(PPI) network was constructed,and the core targets were analyzed and screened out,and gene ontology(GO) functional enrichment analysis and Kyoto Encyclopedia of Genes and Genomes(KEGG) signaling pathway enrichment analysis were performed.Results:A total of 64 bioactive ingredients of HLJDD,265 HLJDD-AD intersecting genes,10 major components,12 potential targets with key regulatory roles were screened,and 2 480 biological processes,94 cellular components,248 molecular functions were obtained from GO functional enrichment analysis,and 187 relevant signaling pathways were obtained from KEGG pathway enrichment analysis.HLJDD acted on core targets such as TP53,estrogen receptor 1(ESR1),mitogen-activated protein kinase(MAPK1),protein kinase B1(AKT1),interleukin(IL)6,FOS,tumor necrosis factor(TNF),and BCL2 through core bioactive ingredients such as quercetin,baicalein,β-sitosterol,stigmasterol,and kaempferol.It could regulate signaling pathways such as lipid and atherosclerosis pathway,hepatitis B signaling pathway,Kaposi′s sarcoma-associated herpesvirus infection,fluid shear stress and atherosclerosis,interleukin(IL)-17,and participates in biological processes such as exogenous stimulus response,membrane potential modulation,reactive oxygen species response,oxidative stress response,and lipopolysaccharide response to exert some role in the" improvement of AD.Conclusion:HLJDD may act against AD through multi-bioactives,multi-targets,and multi-pathways.
Keywords"""" Alzheimer′s disease; Huanglian Jiedu decoction; network pharmacology; bioinformatics
基金项目" 山西省中医药管理局科研课题资助项目(No.2023ZYYB2026)
作者单位" 1.山西省心血管病医院(太原 030024);2.山西医科大学基础医学院
通讯作者" 张伟,E-mail:13994213629@163.com
引用信息" 郭斌,薛佳,贾保平,等.基于网络药理学和生物信息学方法探讨黄连解毒汤治疗阿尔茨海默病的作用机制[J].中西医结合心脑血管病杂志,2024,22(19):3510-3518.
阿尔茨海默病(Alzheimer′s disease,AD),俗称老年痴呆症,是一种严重的慢性神经退行性疾病,病人通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。由于AD病因复杂,目前AD发病机制尚未明确,主流观点认为AD病因是β-淀粉样蛋白(Aβ)、Tau蛋白沉积造成神经元大量死亡,目前仍无治疗和预防的有效手段。在过去的研究中,一系列单独针对Aβ、Tau蛋白和神经炎症的药物均不能阻止或延缓AD的进展,这意味着AD可能是一种系统性疾病,涉及多种途径和靶点之间的相互作用。由此可知,单一药物的治疗是有限的,复方药物的协同作用可能为AD的治疗带来更好的选择[1]。而具有多成分、多靶点特点的中药复方在AD治疗中逐渐被应用。
黄连解毒汤是黄连、黄芩、黄柏和栀子组成的清热解毒经典中药方剂,广泛应用于脑血管疾病、缺血性中风、AD的治疗。越来越多的证据表明,黄连解毒汤及其成分在治疗AD的药理作用方面取得了良好的效果,如改善认知功能障碍、减轻斑块积累和氧化应激及改变脂质代谢[2-5]。然而,黄连解毒汤改善AD的潜在机制仍未知。因此,本研究采用网络药理学结合生物信息学方法构建药物-成分-靶点关系网络,从中药整体角度探讨黄连解毒汤治疗AD的分子作用机制,以期为后续的实验研究提供依据。
1" 资料与方法
1.1" 黄连解毒汤活性成分检索及相关靶点筛选
在中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)中检索黄连解毒汤中4味中药,即黄连、黄柏、黄芩、栀子的化学成分,通过口服生物利用度(oral bioavailability,OB)≥30%及类药性(drug likeness,DL)≥0.18 对4味中药所含的化合物进行筛选,获取其活性成分;同时在该数据库中获取相应活性成分的作用靶点。在中医药百科全书平台数据库(ETCM)对活性成分靶点进行补充,整合所有活性成分的作用靶点,即为黄连解毒汤的作用靶点。
1.2" 基因芯片及差异表达基因筛选
在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中以“Alzheimer′s disease”为关键词进行检索,在条目类型中选择“series”,将“Organisms”设置为“Homo sapiens”,选择样本量≥20的基因芯片表达数据。仔细筛选后,选择符合条件的数据集:GSE97760、GSE138260。利用perl脚本对矩阵数据进行注释。采用R语言Limma程序包对数据进行标准化,以差异倍数(fold change,FC)对数的绝对值(|log2 FC|)>1,adjP<0.05为阈值筛选差异基因。
1.3" 疾病潜在基因靶点的筛选
分别在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、PharmGkb(https://www.pharmgkb.org/)、TTD(https://db.idrblab.net/ttd/)、DrugBank(https://www.drugbank.com/)数据库中检索与AD相关的基因,将各数据库检索到的基因与上述基因芯片差异表达基因数据取并集、去重,得到AD相关潜在基因靶点。
1.4" 疾病药物共同作用靶点的获取
将获得的黄连解毒汤作用靶点与AD相关潜在靶点取交集,交集基因即为疾病药物共同作用靶点,利用R语言Venn程序包绘制交集基因Venn图。
1.5" 黄连解毒汤活性成分与共同作用靶点网络的构建
利用Cytocsape 3.9.1软件构建黄连解毒汤活性成分与共同作用靶点的网络关系图,将活性成分与共同作用靶点进行关联可视化。
1.6" 蛋白互作网络可视化分析
将共同作用靶点列表上传到STRING数据库(https://cn.string-db.org/),以最小互作分数>0.400进行筛选,构建共同作用靶点蛋白互作(PPI)网络。节点代表基因、蛋白或其他分子,节点之间的连线代表生物分子之间的相互作用。
1.7" PPI网络拓扑分析及核心基因的筛选
将STRING数据库得到的PPI网络导入Cytocsape 3.9.1中,使用cytoNCA插件进行拓扑分析,计算每个靶点基因的中介中心性(BC)、紧密中心性(CC)、度中心性(DC)、特征向量中心性(EC)、局部平均连通性(LAC)、网络中心性(NC)拓扑学参数,选择大于每个参数中位值的基因,如果得到的PPI网络基数过多,则重复上述步骤进行二次筛选,构建新的核心基因PPI网络。
1.8" 功能富集分析
用R语言clusterProfiler包对交集基因进行基因本体(GO)功能富集分析以及京都基因与基因组百科全书(KEGG)通路富集分析,并使用enrichplot、 ggplot及pathview包对聚类结果进行可视化处理。
2" 结" 果
2.1" 黄连解毒汤主要活性成分及作用靶点
在TCMSP数据库中,通过OB≥30%、DL≥0.18对黄连解毒汤的4味中药主要活性成分及靶点进行检索,得到黄连成分14种、靶点596个;黄柏成分37种,靶点1 346个;黄芩成分36种,靶点1 203个;栀子成分15种,靶点866个。在ETCM数据库中对4味中药的成分及靶点进行检索,与TCMSP数据库检索结果进行整合、去重、合并后共得到黄连解毒汤活性成分64种,作用靶点301个。
2.2" 差异表达基因筛选
在GEO数据库选择符合筛选条件的数据集:GSE97760、GSE138260,利用R语言Limma程序包,以|log2 FC|>1,adj P<0.05为阈值对所有样本进行差异分析。GSE97760筛选出6 822个差异表达基因,其中上调基因3 810个,下调基因3 012个,GSE138260筛选出39个差异表达基因,其中上调基因32个,下调基因7个,各差异表达基因见图1,合并、去重后得到差异表达基因6 855个。
(A为GSE97760;B为GSE138260)
2.3" AD相关潜在靶点的筛选
分别在GeneCards、OMIM、PharmGkb、TTD、DrugBank、GEO数据库中检索与AD相关的基因,其中GeneCards获得10 914个基因,OMIM中获得325个基因,PharmGkb中获得63个基因,TTD中获得100个基因,DrugBank中145个,将这些基因与基因芯片差异表达基因数据取并集、去重,得到AD相关潜在基因靶点15 881个。详见图2。
2.4" 疾病药物共同作用靶点的获取
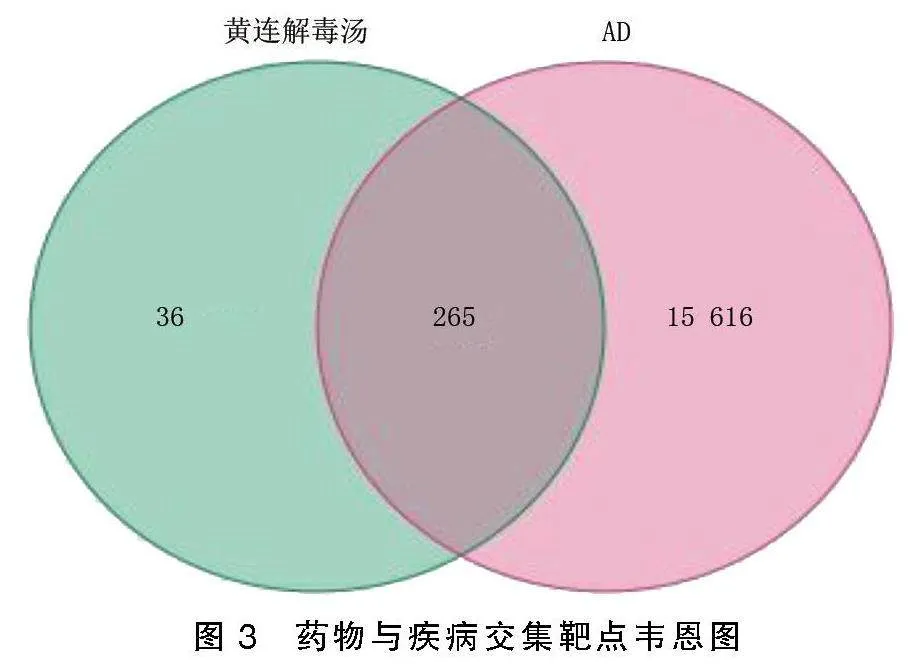
将黄连解毒汤作用靶点与AD相关潜在基因靶点取交集,得到交集基因265个,即为疾病药物共同作用靶点。详见图3。
2.5" 黄连解毒汤活性成分与共同作用靶点网络的构建和分析
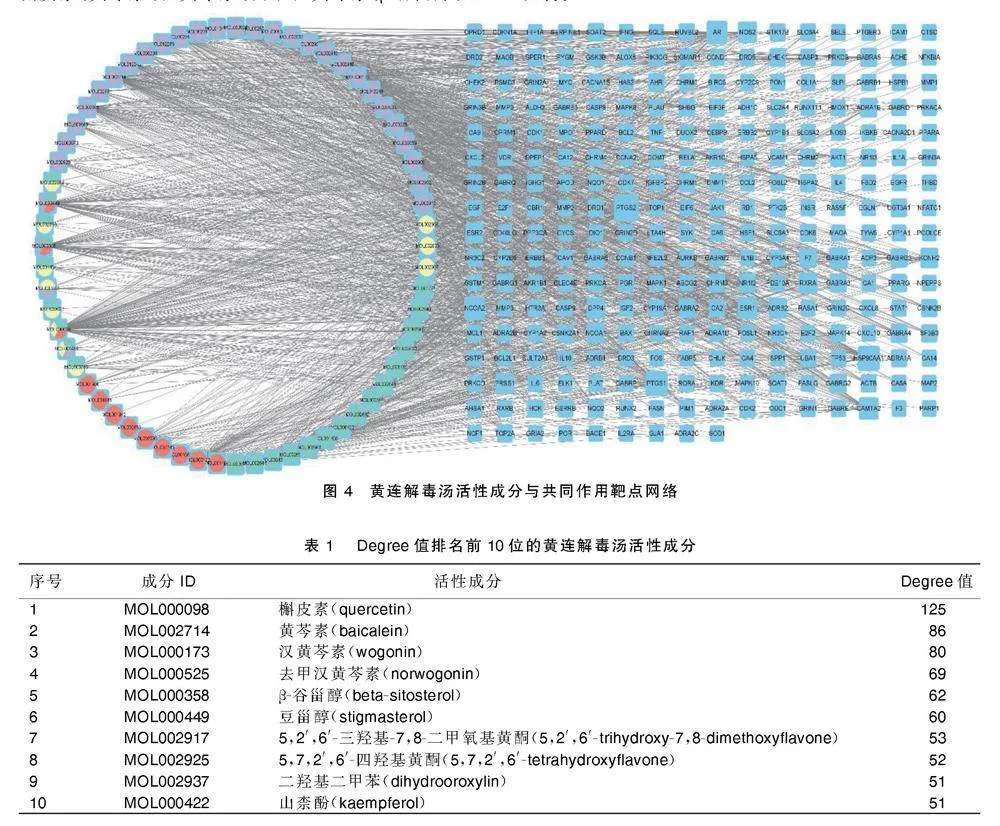
将黄连解毒汤活性成分与共同作用靶点导入Cytocsape 3.9.1软件,构建活性成分与共同作用靶点网络关系图(见图4)。其中圆形节点代表黄连解毒汤活性成分,紫色圆形节点表示活性成分来源于黄芩,黄色圆形节点表示活性成分来源于黄连,红色圆形节点表示活性成分来源于栀子,青色圆形节点表示活性成分来源于黄柏,融合圆形节点表示该活性成分来源于不同颜色对应的药物,矩形节点代表共同作用靶点,连线代表活性成分与靶点之间的相互作用关系,共得到329个节点、1 493条连线。按照拓扑学参数度值(Degree)进行排序,排名前10位的活性成分见表1。槲皮素、黄芩素、汉黄芩素、去甲汉黄芩素、β-谷甾醇、豆甾醇、5,2′,6′-三羟基-7,8-二甲氧基黄酮、5,7,2′,6′-四羟基黄酮、二羟基二甲苯、山柰酚分别靶向125、86、80、69、62、60、53、52、51、51个与AD相关的基因,这些活性成分可能通过调控这些基因来发挥治疗AD的作用,体现了黄连解毒汤多成分、多靶点治疗AD的作用机制。
2.6" 蛋白互作网络可视化分析
将共同作用靶点基因列表上传到STRING数据库,以最小互作分数>0.400进行筛选,构建共同作用靶点(PPI)网络(见图5)。节点代表基因、蛋白或其他分子,节点之间的连线代表生物分子之间的相互作用。
2.7" PPI网络拓扑分析
将STRING数据库得到的PPI网络导入Cytocsape 3.9.1中,得到一个209个节点、689条边的网络图,计算每个靶点基因的BC、CC、DC、EC、LAC、NC拓扑学参数,根据BC>79.096 173 65,CC>0.039 634 146,DC>4,EC>30.019 346 936,LAC>2,NC>2.8(中位值)进行筛选,得到一个51个节点、250条边的网络图,重复上述步骤,根据BC>19.069 50 609,CC>0.485 436 893,DC>8,EC>0.107 631 452,LAC>4.285 714 286,NC>5.35(中位值)进行二次筛选,得到一个12个节点、38条边的网络图,这12个核心基因在黄连解毒汤治疗AD的过程中可能起着关键调控作用。详见图6。
2.8" 功能富集分析
GO功能富集分析共得到2 822条结果,其中,生物学过程(biological process,BP)2 480条,细胞组分(cellular components,CC)94条,分子功能(molecular function,MF)248条。可见黄连解毒汤治疗AD的BP主要富集在对外源性刺激的反应(response to xenobiotic stimulus)、突触后膜电位的调节(regulation of postsynaptic membrane potential)、膜电位的调节(regulation of membrane potential)等方面;CC主要富集在突触后膜(postsynaptic membrane)、突触膜(synaptic membrane)、GABA-A受体复合物(GABA-A receptor complex)等;MF主要富集在神经递质受体活性(neurotransmitter receptor activity)、发射器门控单原子离子通道活性(transmitter-gated monoatomic ion channel activity)、发射器门控通道活性(transmitter-gated channel activity)等方面。详见图7。
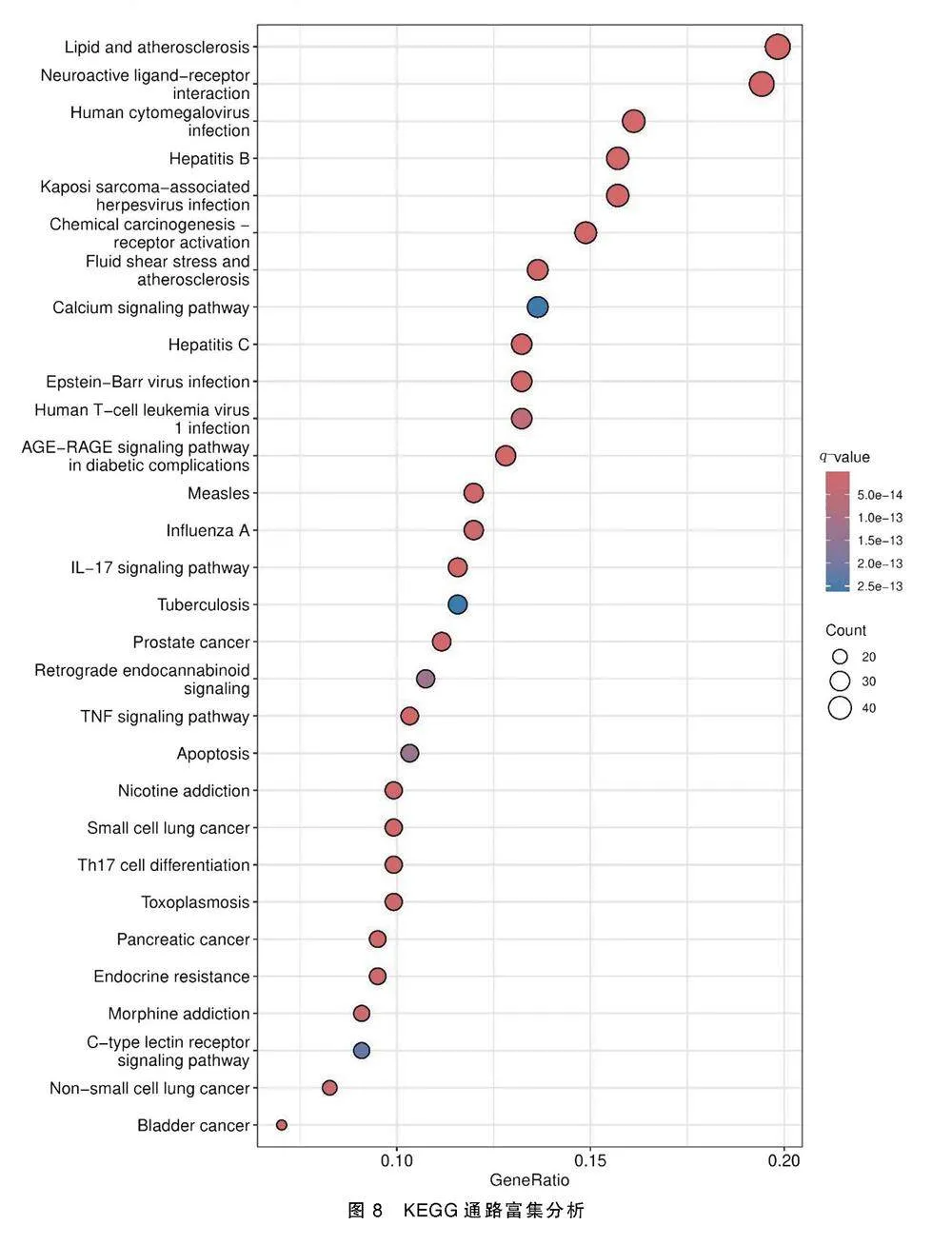
KEGG通路富集分析得到187条相关信号通路,见图8,包括脂质与动脉粥样硬化通路(lipid and atherosclerosis)、乙型肝炎信号通路(hepatitis B)、尼古丁成瘾通路(nicotine addiction)、晚期糖基化终产物及其受体(AGE-RAGE)信号通路在糖尿病并发症中的作用(AGE-RAGE signaling pathway in diabetic complications)、卡波西肉瘤相关疱疹病毒感染(Kaposi sarcoma-associated herpesvirus infection)、流体剪切应力与动脉粥样硬化(fluid shear stress and atheros clerosis)、白细胞介素-17(IL-17)信号通路(IL-17 signaling pathway)等,提示黄连解毒汤可能通过作用于以上多条通路来发挥治疗AD的作用。
3" 讨" 论
本研究采用网络药理学结合生物信息学方法从中药整体角度探讨黄连解毒汤治疗AD的分子作用机制。黄连解毒汤通过槲皮素、黄芩素、β-谷甾醇、豆甾醇、山柰酚等主要活性成分作用于TP53、雌激素受体1(ESR1)、丝裂原活化蛋白激酶1(MAPK1)、蛋白激酶B1(AKT1)、白细胞介素6(IL6)、FOS、肿瘤坏死因子(TNF)、BCL2等核心靶点调控脂质与动脉粥样硬化通路、乙型肝炎信号通路、卡波西肉瘤相关疱疹病毒感染、流体剪切应力与动脉粥样硬化、IL-17等信号通路,并且参与外源性刺激反应、膜电位调节、活性氧反应、氧化应激反应、脂多糖反应等生物学过程以发挥治疗AD的作用。
基于黄连解毒汤活性成分与共同作用靶点网络分析发现槲皮素、黄芩素、汉黄芩素、去甲汉黄芩素、β-谷甾醇、豆甾醇、5,2′,6′-三羟基-7,8-二甲氧基黄酮、5,7,2′,6′-四羟基黄酮、二羟基二甲苯、山柰酚等活性成分在黄连解毒汤治疗AD过程中发挥重要作用。研究表明,AD病人的大脑神经元衰老水平更高,并且衰老的神经元具有促炎的衰老相关分泌表型,可以引起星形胶质细胞增生,而衰老的神经元可以被抗衰老药物达沙替尼和槲皮素组合清除,进而预防或减缓AD[6],Gonzales等[7]也发现达沙替尼与槲皮素联合疗法可以清除大脑中的β-淀粉样蛋白,进而清除衰老细胞,同时降低血液炎症。王文潇等[8]研究表明,黄芩素可能通过调节神经传导相关蛋白的表达来改善AD模型鼠的认知功能障碍。Lee等[9]研究表明,黄芩素能通过减少活性氧保护多巴胺能神经元细胞株 SH-SY5Y 细胞免受 6-羟基多巴胺(6-OHDA)诱导的损伤。Li等[10]实验研究表明,黄芩素通过减少 TNF-α、一氧化氮(NO)和过氧化物的产生,保护E-14 大鼠胚胎原代中脑胶质细胞。汉黄芩素在局部缺血模型中也被发现可以抑制小胶质细胞释放炎性因子诱导型一氧化氮合酶(iNOS)、TNF-α 等,起到神经保护作用[11]。实验证明豆甾醇的摄入有效减少了淀粉样蛋白前体(APP)/早老性痴呆基因1(PS1)小鼠血清、皮质和海马体中炎症因子 TNF-α 和白细胞介素1β(IL-1β)的分泌,且能够抑制皮质和海马体中小胶质细胞和星形胶质细胞的过度激活,对小鼠脑内的核因子-κB(NF-κB)信号通路和 NOD样受体蛋白3(NLRP3)炎症小体具有潜在调控作用[12]。方飞教授发现山柰酚在人体细胞、线虫和小鼠神经系统中显著诱导线粒体自噬,并改善记忆,提高谷氨酸能神经元和胆碱能神经元的存活率和功能性,减缓Aβ和Tau蛋白病理变化,对AD小鼠神经退行性改变有着显著改善作用[13]。
本研究通过PPI网络拓扑分析筛选出12个核心基因,TP53、ESR1、MAPK1、AKT1、热休克蛋白HSP90a(HSP90AA1)、IL6、FOS、细胞周期蛋白D1(CCND1)、TNF、MYC、BCL2、周期素依赖性激酶抑制因子1A(CDKN1A)等靶基因可能是潜在的黄连解毒汤治疗AD的关键作用靶点。目前研究显示,AD病人脑部神经元及胶质细胞、皮肤成纤维细胞和外周血细胞中TP53总水平均较非AD病人升高,并且大量以mt-p53形式表达,失去正常构象的mt-p53具有抗氧化损伤作用,mt-p53有可能是机体为延缓神经元退行性变、抑制对氧化敏感的信号传导通路[14]。现在越来越多的证据表明,MAPK信号通路在调节炎症和应激反应等各种生物学过程中发挥着至关重要的作用[15],而且该通路不仅与神经元凋亡密切相关,还与Aβ和 Tau蛋白过度磷酸化密切相关[16-17]。ESR1是雌激素敏感组织中激素反应的重要介质,在AD过程中,雌激素有助于促进神经元细胞存活,减轻神经元损伤,保护神经元细胞免受神经毒素的侵害,以及加强突触传递和神经发生[18]。当与雌激素结合时,ESR1可以通过调节区域和靶基因之间的相互作用来调节基因表达及其相应的功能[19],这也可以解释为什么女性病人发病率高于男性。Gu等[20]实验表明,神经炎症与AD的发病密切相关,炎性因子IL-6的上调迫使小胶质细胞分化为促炎细胞和发生神经退行性病变,而黄连解毒汤可以降低AD模型小鼠脑和血清中IL-6的表达,逆转AD模型小鼠的认知障碍。
本研究对黄连解毒汤和AD共同作用靶点交集基因进行了 GO 生物学功能分析和 KEGG 通路富集分析。GO富集分析生物学过程分析主要涉及对外源性刺激的反应、膜电位的调节、对活性氧的反应、对脂多糖的反应、对氧化应激的反应、对细菌来源分子的反应及对辐射的反应等方面。KEGG通路富集分析主要包括脂质与动脉粥样硬化通路、癌症信号通路、病毒感染信号通路、肝炎信号通路、尼古丁成瘾、AGE-RAGE信号通路在糖尿病并发症中的作用、IL-17信号通路、神经活性配体-受体相互作用通路。提示高胆固醇、高血脂、糖尿病、肝炎等病毒感染及吸烟等都是AD的危险因素。
综上所述,本研究采用网络药理学和生物信息学方法对黄连解毒汤治疗AD的主要作用成分、核心靶点和信号通路进行阐述,进一步证实黄连解毒汤是一种有效的多成分、多靶点、多通路治疗AD的方法,为黄连解毒汤的药物研发及临床应用提供依据。本研究的不足之处在于未能对得到的核心靶点和信号通路进行实验验证,以进一步明晰黄连解毒汤治疗AD的分子机制。
参考文献:
[1]" ATRI A.The Alzheimer′s disease clinical spectrum:diagnosis and management[J].The Medical Clinics of North America,2019,103(2):263-293.
[2]" ZHENG R Y,SHI S G,ZHANG Q,et al.Molecular mechanisms of Huanglian Jiedu Decoction in treating Alzheimer′s disease by regulating microbiome via network pharmacology and molecular docking analysis[J].Frontiers in Cellular and Infection Microbiology,2023,13:1140945.
[3]" QI Y Y,HENG X,YAO Z Y,et al.Involvement of Huanglian Jiedu Decoction on microglia with abnormal sphingolipid metabolism in Alzheimer′s disease[J].Drug Des Devel Ther,2022,16:931-950.
[4]" FAN X R,LIU B,ZHOU J Y,et al.High-fat diet alleviates neuroinflammation and metabolic disorders of APP/PS1 mice and the intervention with Chinese medicine[J].Frontiers in Aging Neuroscience,2021,13:658376.
[5]" 顾欣如,方思月,任维,等.黄连解毒汤在阿尔茨海默病模型大鼠体内药代动力学及对脑内炎症微环境改善的研究[J].中国中药杂志,2018,43(14):3006-3011.
[6]" HERDY J R,TRAXLER L,AGARWAL R K,et al.Increased post-mitotic senescence in aged human neurons is a pathological feature of Alzheimer′s disease[J].Cell Stem Cell,2022,29(12):1637-1652.e6.
[7]" GONZALES M M,GARBARINO V R,KAUTZ T F,et al.Senolytic therapy in mild Alzheimer′s disease:a phase 1 feasibility trial[J].Nat Med,2023,9(10):2481-2488.
[8]" 王文潇,卫东锋,张占军,等.黄芩素对阿尔茨海默病大鼠早期脑组织蛋白表达谱的影响[J].中国中医药信息杂志,2016,23(8):59-63.
[9]" LEE H J,NOH Y H,LEE D Y,et al.Baicalein attenuates 6-hydroxydopamine-induced neurotoxicity in SH-SY5Y cells[J].European Journal of Cell Biology,2005,84(11):897-905.
[10]" LI F Q,WANG T,PEI Z,et al.Inhibition of microglial activation by the herbal flavonoid baicalein attenuates inflammation-mediated degeneration of dopaminergic neurons[J].Journal of Neural Transmission,2005,112(3):331-347.
[11]" LEE H,KIM Y O,KIM H,et al.Flavonoid wogonin from medicinal herb is neuroprotective by inhibiting inflammatory activation of microglia[J].FASEB Journal,2003,17(13):1943-1944.
[12]" 揭璠.豆甾醇对阿尔茨海默病中神经炎症的潜在影响及调控机制研究[D].杭州:浙江大学,2022.
[13]" XIE C L,ZHUANG X X,NIU Z M,et al.Amelioration of Alzheimer′s disease pathology by mitophagy inducers identified via machine learning and a cross-species workflow[J].Nature Biomedical Engineering,2022,6(1):76-93.
[14]" 黎巍威,张伯礼,王学美.p53与阿尔茨海默病[J].中华老年医学杂志,2009,28(9):786-789.
[15]" VENIGALLA R K C,TURNER M.RNA-binding proteins as a point of convergence of the PI3K and p38 MAPK pathways[J].Frontiers in Immunology,2012,3:398.
[16]" SONG J,PARK K A,LEE W T,et al.Apoptosis signal regulating kinase 1 (ASK1):potential as a therapeutic target for Alzheimer′s disease[J].International Journal of Molecular Sciences,2014,15(2):2119-2129.
[17]" KHEIRI G,DOLATSHAHI M,RAHMANI F,et al.Role of p38/MAPKs in Alzheimer′s disease:implications for amyloid beta toxicity targeted therapy[J].Reviews in the Neurosciences,2018,30(1):9-30.
[18]" PIRSKANEN M,HILTUNEN M,MANNERMAA A,et al.Estrogen receptor beta gene variants are associated with increased risk of Alzheimer′s disease in women[J].European Journal of Human Genetics,2005,13(9):1000-1006.
[19]" XU C Y,JIANG Z N,ZHOU Y,et al.Estrogen receptor α roles in breast cancer chemoresistance[J].Asian Pacific Journal of Cancer Prevention Apjcp,2013,14(7):4049-4052.
[20]" GU X R,ZHOU J Y,ZHOU Y Y,et al.Huanglian Jiedu Decoction remodels the periphery microenvironment to inhibit Alzheimer′s disease progression based on the \"brain-gut\" axis through multiple integrated omics[J].Alzheimer′s Research amp; Therapy,2021,13(1):44.
(收稿日期:2023-06-13)
(本文编辑郭怀印)
