外源2,4-表芸苔素内酯对盐胁迫下不同盐敏感型番茄种子萌发的影响
2024-12-31奚瑞陈怡佳李宁余庆辉王强秦勇
摘 要:【目的】研究盐胁迫下不同浓度2,4-表芸苔素内酯(2,4-Epibrassinolide,EBR)处理对番茄种子萌发特性和关键酶活性的影响,筛选影响番茄种子萌发及生长发育效果的最佳浓度,为外源EBR的科学应用提供理论依据。
【方法】以盐敏感型‘M82’和耐盐型‘IL-7-5-5’番茄种子为材料,在50 mmol/L的NaCl处理下,添加0.01、0.1和0.5 μmol/L的外源EBR,测定番茄种子在萌发过程中的发芽率、发芽势等形态指标,分析抗氧化酶活性和渗透调节物质含量的变化。
【结果】外源EBR处理后的‘M82’和‘IL-7-5-5’种子的发芽势较盐胁迫处理均提高了10%~30%以上,种子活力指数均提高了100~200以上,并且随着EBR浓度升高,2个番茄品种的发芽率、发芽势均呈下降的趋势。0.01 μmol/L EBR处理的‘M82’种子胚芽长和鲜重较盐胁迫下分别增加了94.26%和135.71%;0.1 μmol/L EBR处理的‘IL-7-5-5’胚芽长和鲜重较盐胁迫分别增加了32.48%和14.52%。幼芽体内MDA和SOD、CAT、POD活性显著提升,可溶性蛋白、可溶性糖等渗透调节物质含量显著增加,但不同EBR浓度、不同番茄品种之间的生理指标变化存在明显差异。
【结论】外源EBR可以增强在盐胁迫条件下番茄种子萌发过程中调节渗透的能力,增强体内抗氧化系统的活性,膜脂过氧化产物的积累减少,促进番茄种子萌发和生长发育,提高番茄种子萌发期的耐盐性。盐胁迫下0.01 μmol/L的EBR处理对‘M82’的缓解效果最佳,0.1 μmol/L对‘IL-7-5-5’的缓解效果最佳。
关键词:番茄;2,4-表芸苔素内酯;盐胁迫;种子萌发
中图分类号:S641.2 ""文献标志码:A ""文章编号:1001-4330(2024)08-1983-10
收稿日期(Received):2024-02-05
基金项目:国家自然科学基金项目(31860554);新疆维吾尔自治区蔬菜产业技术体系资助(绿色栽培岗)
作者简介:奚瑞(1999-),女,吉林人,硕士研究生,研究方向为蔬菜栽培生理与逆境胁迫,(E-mail)Tsuki_re@163.com
通讯作者:秦勇(1962-),男,甘肃人,教授,博士,硕士生/博士生导师,研究方向为蔬菜栽培与生理,(E-mail)352167610@qq.com
王强(1983-),男,甘肃人,研究员,博士,硕士生导师,研究方向为蔬菜栽培生理与逆境胁迫,(E-mail)wangqiang201004@sina.com
0 引 言
【研究意义】盐胁迫是限制植物生长发育的主要非生物胁迫之一[1]。不合理的施肥和灌溉等,将使土壤盐分表积现象明显,导致产生土壤次生盐清化[2]。由于气候条件的变化,盐碱地面积每年还在不断增长[3-4]。植物是否能正常生长与其所在的环境密不可分,土壤盐渍化导致植物渗透压平衡、离子平衡遭到破坏[5],损伤细胞结构[6],影响植物形态、生理代谢特性及正常生长发育,从而导致作物产量下降[7-9]。因此,研究筛选影响番茄种子萌发及生长发育的最佳浓度,对选育番茄抗盐性品种有重要意义。【前人研究进展】芸苔素内酯又称油菜素内酯(Brassinosteroids,BRs)是植物体内普遍存在的一种甾醇类物质[10-11],具有高效、广谱、无毒的生理活性,其在植物体内的含量极少,生理活性极强[12]。BR通过改善植物的防御系统,以耐受各种胁迫,最终增加光合能力,增强抗氧化系统能力,并上调胁迫响应基因超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)[13]。近年来,BRs已被广泛用于非生物胁迫,例如干旱、盐分、高温等[14]。芸苔素内酯中最具生物活性的是2,4-表芸苔素内酯(2,4-Epibrassinolide,EBR)、28-表高芸苔素内酯及油菜素内酯[15]。EBR是市售芸苔素内酯较多的植物激素[15],其在调节各种生理和发育过程中起关键作用,包括细胞分裂和伸长、气孔发育、基因表达、种子萌发直至成熟[16],缓解各种生物和非生物因素对植物产生的胁迫作用十分关键[13-16]。【本研究切入点】盐胁迫将影响番茄种子的萌发,且不同盐敏感型番茄品种对于盐胁迫的抗性也各不相同。但目前不同浓度激素对于不同盐敏感型番茄种子萌发特性和关键酶活性的影响还缺乏系统研究。需研究外源2, 4-表芸苔素内酯对盐胁迫下不同盐敏感型番茄种子萌发的影响。【拟解决的关键问题】以2个不同盐敏感型的番茄品种为材料,设置不同浓度的激素处理,在盐胁迫的条件下测定种子发芽率、发芽指数以及种子萌发过程中的种子活力、种胚酶活性的变化,分析盐胁迫下不同激素浓度处理影响番茄种子萌发的生理机制,并筛选EBR对盐胁迫下番茄种子萌发及生长发育缓解效应的最佳浓度。
1 材料与方法
1.1 材 料
供试番茄品种为耐盐型品种‘IL-7-5-5’和盐敏感品种‘M82’,2,4—表芸苔素内酯、NaCl试剂购于北京酷来搏科技公司。
1.2 方 法
1.2.1 试验设计
筛选出3个对番茄种子萌发具有促进效果的EBR浓度,将50 mmol/L作为试验最终模拟盐胁迫的浓度(轻度盐胁迫)。试验共设5个处理:(1)CK:为蒸馏水处理;(2)T1:50 mmol/L NaCl;(3)T2:50 mmol/L NaCl+0.01 μmol/L EBR;(4)T3:50 mmol/L NaCl+0.1 μmol/L EBR;(5)T4:50 mmol/L NaCl+0.5 μmol/L EBR。设置4次重复,每个重复放置40粒种子。选取均匀、饱满、大小一致的供试番茄种子,将种子消毒、漂洗,用吸水纸吸干,将种子分别浸泡在不同处理溶液中,随后将番茄种子均匀摆放至铺有两层滤纸的培养皿中,在恒温培养箱(27℃)中萌发。自种子发芽之日起,每日观察并记录发芽种子数,在发芽第4 d时统计种子的发芽势,第10 d时统计种子的发芽率、发芽指数和活力指数,测量胚芽长、胚根长、鲜重。在第10 d结束时,每个处理随机选取3份全株幼苗,用于测定相关生理指标。
1.2.2.1 发芽率、发芽势、发芽指数、活力指数、盐害指数和盐害级别
发芽率(G)=发芽试验结束后种子发芽数/种子数×100%;
发芽势(Gr)=发芽试验初期(种子发芽第4 d)种子发芽数/种子数×100%;
发芽指数(Gi)=Σ(每天发芽数量/发芽日数);
活力指数(Vi)=Gi×发芽试验结束后的平均鲜重(mg);
根长、芽长:在第10 d使用直尺测量(以胚根超过种子一半长度为统计标准);
鲜重:使用万分之一电子天平测量单株鲜重;
盐害指数(%)=(对照发芽率-处理发芽率)/对照发芽率×100%。
盐害级别标准:当发芽率大于对照时为无盐害,记为0;1级(盐害指数≤20%);2级(20%lt;盐害指数≤40%);3级(40%<盐害指数≤60%);4级(60%lt;盐害指数≤80%);5级(盐害指数>80%)。
1.2.2.2 MDA含量和三大保护酶活性
采用苏州科铭生物技术有限公司的试剂盒测定MDA含量、CAT、SOD、POD活性。
1.2.2.3 可溶性糖(SS)、可溶性蛋白质(SP)
采用苏州科铭生物技术有限公司的试剂盒测定可溶性糖含量、可溶性蛋白含量。
1.3 数据处理
使用Excel软件统计数据;用Duncan’s法(α=0.05)检验显著差异性;采用GraphPad prism8.0软件作图。
2 结果与分析
2.1 不同浓度外源EBR对盐胁迫下番茄种子发芽的影响
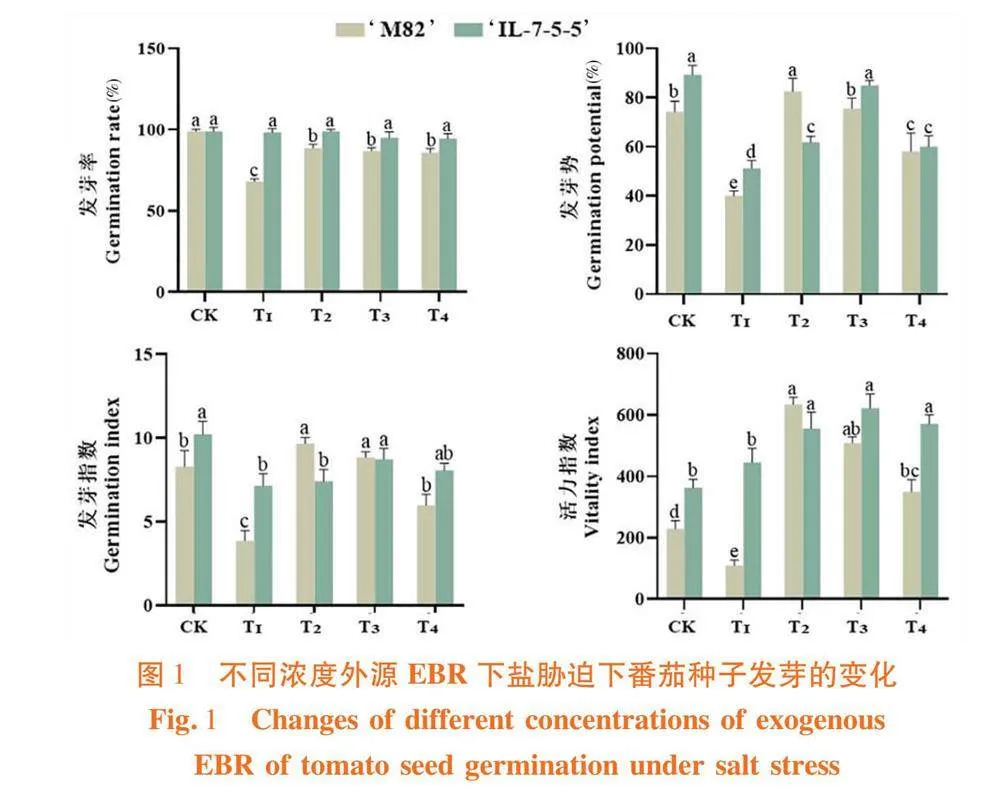
研究表明,在50 mmol/L的盐胁迫条件下,盐敏感型番茄品种‘M82’的发芽率、发芽势较对照显著降低,而耐盐型番茄品种‘IL-7-5-5’的发芽率并无明显影响,但发芽势显著降低。在NaCl胁迫处理下,‘M82’和‘IL-7-5-5’的发芽势分别比对照降低了34.38%和38.13%;外源EBR处理后2个品种的发芽势较T1均提高了10%~30%以上,但‘IL-7-5-5’在经过不同浓度的EBR处理下,总体发芽率、发芽势均较高于‘M82’。随着EBR浓度的升高,2个番茄品种的发芽率、发芽势均呈下降趋势,较高浓度的EBR对番茄种子的萌发有抑制作用。EBR处理对盐胁迫下番茄种子萌发具有缓解作用,可以显著提高其发芽指数和活力指数。盐胁迫处理下,‘M82’的活力指数比对照降低了52.01%,但‘IL-7-5-5’比对照增加了22.49%;外源EBR处理后的种子活力指数较T1均提高了100~200以上。T2(0.01 μmol/LEBR)处理对‘M82’品种的种子发芽效果最佳,而T3(0.1 μmol/LEBR)对‘IL-7-5-5’品种的种子发芽效果最佳。图1
2.2 不同浓度外源EBR对盐胁迫下番茄种子胚根胚芽的影响
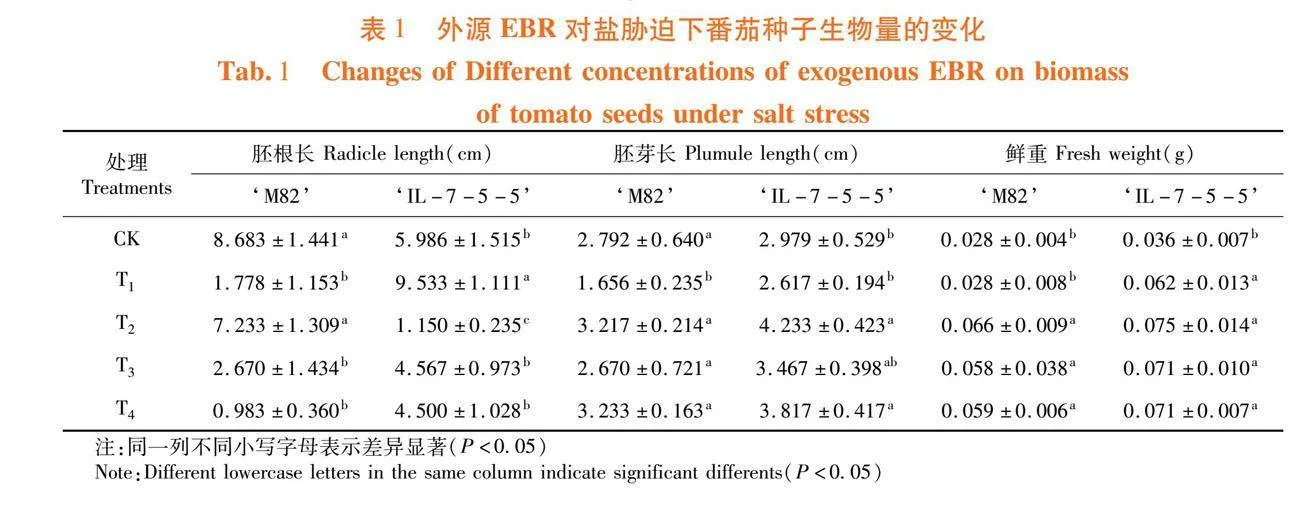
研究表明,50 mmol/L的盐胁迫显著抑制了‘M82’胚根和胚芽的生长,但对耐盐型品种‘IL-7-5-5’的胚根的生长和鲜重有促进作用,在盐胁迫条件下的胚根长和鲜重较对照增加59.24%和75.49%。随外源EBR处理浓度的增加,2个番茄品种的胚芽长度和鲜重均逐渐增加。T2处理的‘M82’种子胚芽长和鲜重较T1分别增加了94.26%和135.71%;经过T3处理的‘IL-7-5-5’胚芽长和鲜重较T1分别增加了32.48%和14.52%。T4处理会显著抑制‘M82’胚根的生长,而T2处理则会抑制‘IL-7-5-5’的胚根发育。T2(0.01 μmol/LEBR)处理对‘M82’品种的生物量影响效果最佳,而T3和T4(0.1和0.5 μmol/LEBR)对‘IL-7-5-5’品种的生物量影响效果最佳。表1
2.3 不同浓度外源EBR对盐胁迫下番茄种子幼芽形态的影响
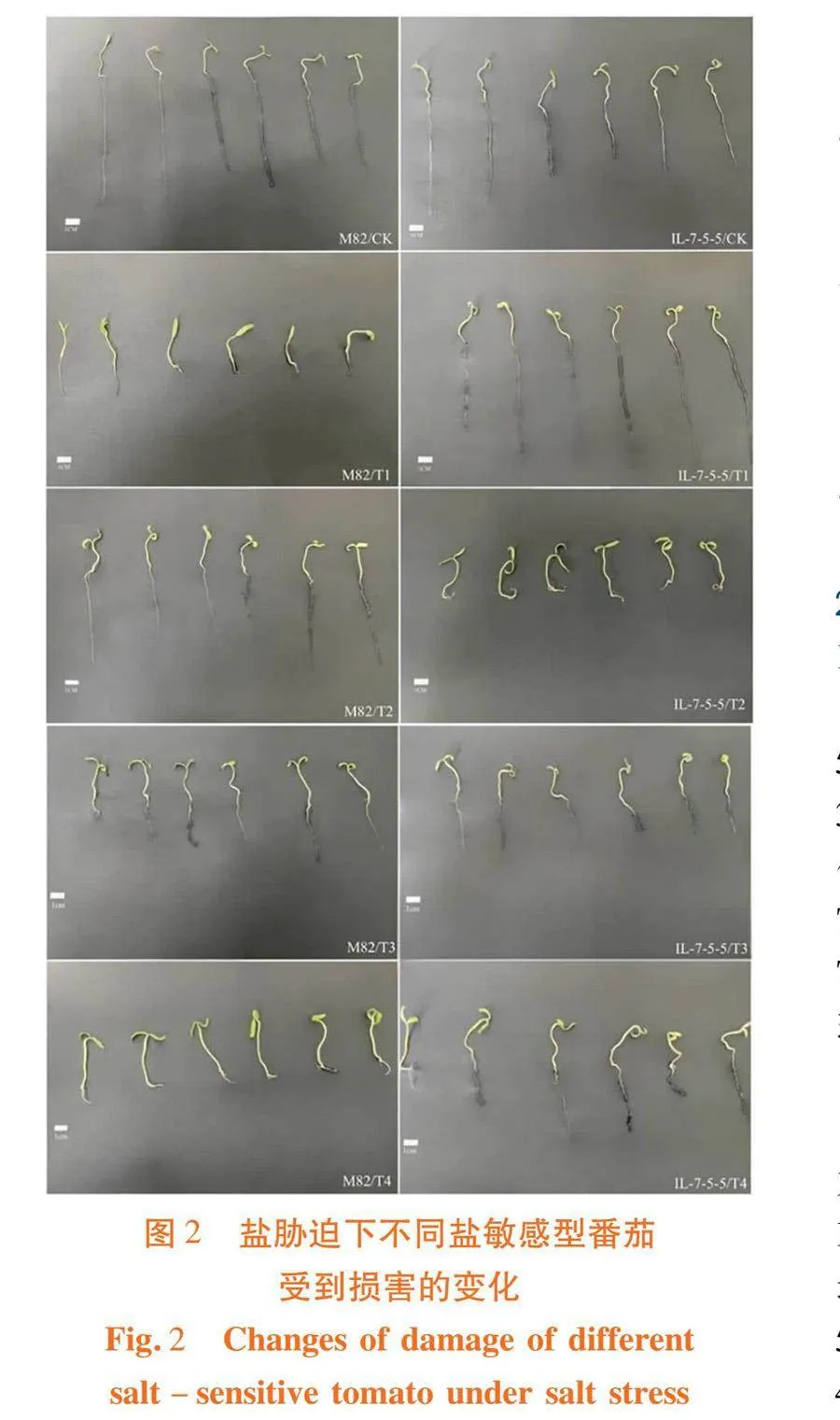
研究表明,与对照相比,50 mmol/L的NaCl胁迫下的‘M82’生长速度变慢,相同发育时间内子叶未完全展开,茎、叶发黄,茎粗增加,根长缩短,与对照有明显的表型差异。在T2处理下,‘M82’根、茎生长状态正常,侧根数目增加;但子叶发黄,且均呈卷曲状。T3处理下,‘M82’根长下降,叶面卷曲程度好转,叶片发黄程度减轻。T4处理下的侧根数目显著增多,叶片基本保持拉伸状态,且颜色正常。与其他处理相比,T4处理下的幼芽形态更加健康,T4(0.5 μmol/LEBR)对番茄有一定的壮苗作用。
‘IL-7-5-5’番茄品种的幼芽在50 mmol/L的NaCl胁迫下,根长显著增加,茎长度无明显变化,茎粗增加,但子叶发黄干枯,且叶片有一定程度的卷曲。所有不同处理下,T2处理对盐害的缓解效果最明显,幼芽发育状况最佳,其他处理的植株均有不同程度的萎缩和发黄现象。图2
2.4 不同浓度外源EBR对盐胁迫下番茄种子盐害指数和盐害级别的影响
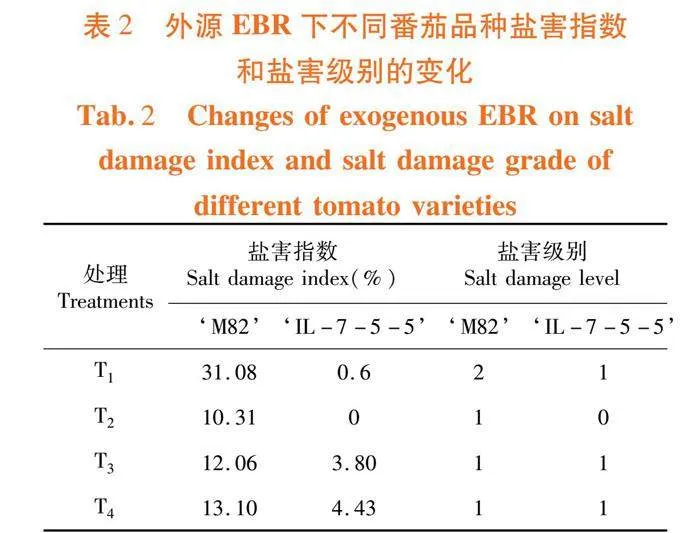
研究表明,不同番茄品种的盐害指数表现出明显差异。‘M82’在盐胁迫下的盐害指数比‘IL-7-5-5’高30.48%,盐害等级为2级。而‘IL-7-5-5’在50 mmol/L的NaCl影响下只受到轻微盐害,盐害等级为1级。随着EBR浓度的增加,‘M82’和‘IL-7-5-5’的盐害指数也逐渐上升,但2品种之间的差异并不明显。T2、T3和T4处理下的‘M82’的盐害指数比‘IL-7-5-5’高8.67%~10.31%。T2处理下的番茄种子对盐胁迫的缓解能力最好,耐盐型番茄‘IL-7-5-5’在T2处理下的种子萌发不受盐胁迫的侵害,盐害指数为0,EBR处理能在盐害的条件下提升了番茄种子的发芽率。表2
2.5 不同浓度外源EBR对盐胁迫下番茄种子MDA和抗氧化酶活性的影响
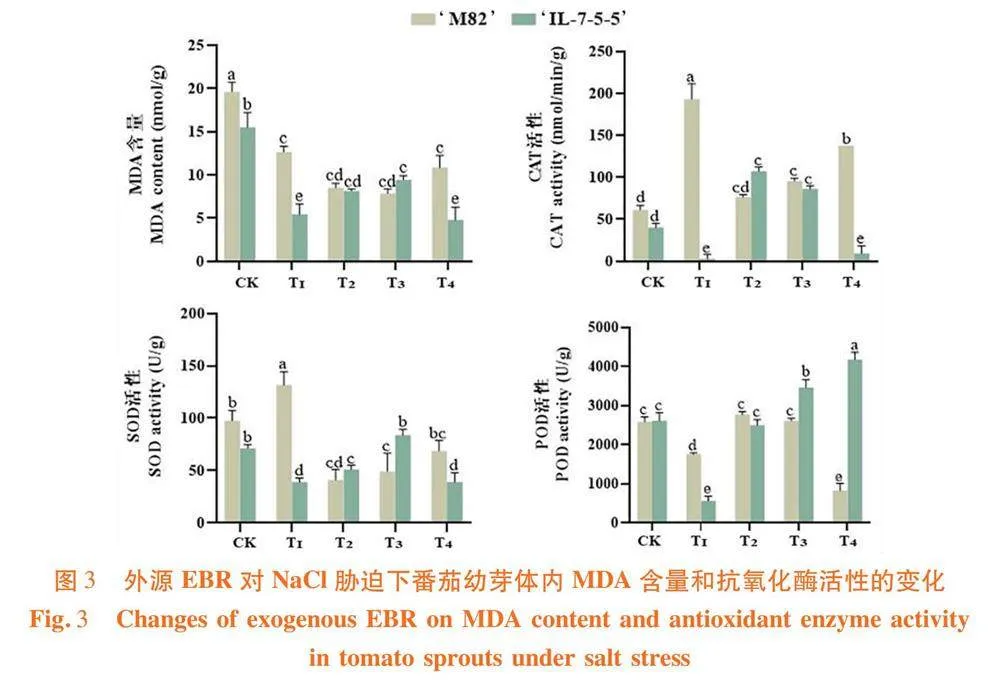
研究表明,盐胁迫下,‘M82’和‘IL-7-5-5’的MDA含量相较于对照组分别降低了35.54%和65%。在‘M82’中,T2、T3处理分别降低了植物体内32.64%和37.75%的MDA含量,T4处理与T1无显著性差异。‘IL-7-5-5’中T2、T3处理较T1增加了50%和73.81%,而T4处理降低了11.90%。
50 mmol/L的盐胁迫条件下,盐敏感型‘M82’品种体内的CAT和SOD活性显著增加,较对照相比分别增加了215.2%和35.04%;外源EBR处理下,‘M82’的CAT和SOD活性呈梯度增加,但是较T1处理分别降低了60.45%、50.62%、28.62%和68.80%、62.68%和47.84%。而耐盐型番茄品种‘IL-7-5-5’在盐胁迫条件下体内的CAT和SOD活性较对照相比分别降低了92.41%和45.46%。T2、T3处理下的CAT活性较T1显著增加,T3处理下的SOD活性增长效果最明显,较T1处理增加了115.45%。盐胁迫条件下‘M82’和‘IL-7-5-5’的POD活性较对照相比分别降低了33.77%和78.48%,但在添加外源EBR后显著提高了POD活性。‘M82’中T2、T3处理较T1分别增长了57.66%和47.98%;‘IL-7-5-5’的POD活性随EBR浓度增加逐渐增加,其中T4处理的增长效果最明显,且远远高于对照。图3
2.6 不同浓度外源EBR对盐胁迫下番茄种子可溶性糖和可溶性蛋白含量的影响
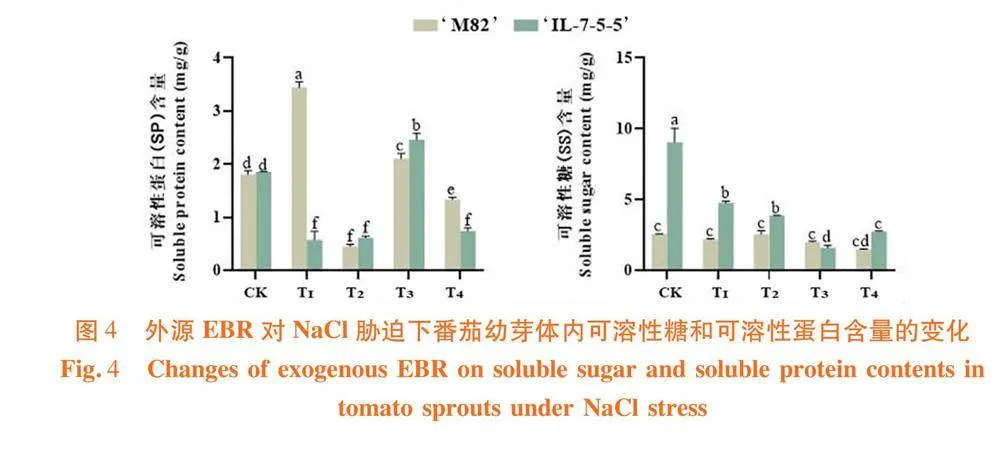
研究表明,50 mmol/L的盐胁迫条件下,‘M82’和‘IL-7-5-5’的可溶性糖含量较对照分别降低了15.72%和47.28%;‘M82’的T2较T1处理的可溶性糖含量增加了18.29%,‘IL-7-5-5’经过外源EBR处理后的可溶性糖含量较T1均有不同程度的降低。在盐胁迫下‘M82’的可溶性蛋白含量较对照增加了90.23%,其余EBR处理浓度较T1相比均呈下降趋势;‘IL-7-5-5’的T1处理较对照降低了68.93%,其余EBR处理中的T3处理对可溶性蛋白含量的提高最显著,T2和T4并无明显变化。图4
2.7 不同浓度外源EBR对盐胁迫下番茄种子萌发生理指标参数变异的影响
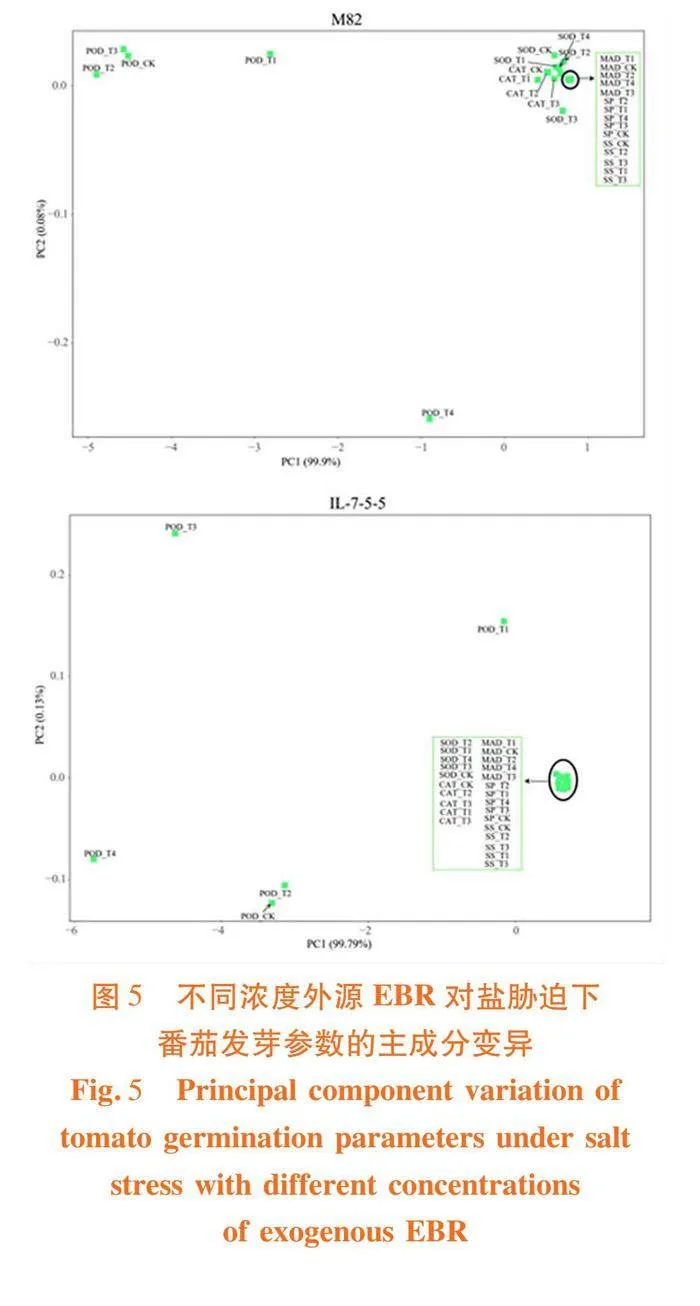
研究表明,前2个主成分,其中M82的2个主成分的总体贡献率达到了99.98%,IL-7-5-5的总体主成分贡献率为99.92%,主成分对综合原始变量的信息的能力较强。在第1主成分中,‘M82’品种中的SOD、CAT、MAD、SP和SS的权重系数均高于0.5,‘IL-7-5-5’品种中的SOD、CAT、MAD、SP和SS均高于0.6。其中,不同的EBR浓度处理对2个品种生理指标参数的变化影响较大。在第2主成分中,‘M82’的MAD、SP和SS;‘IL-7-5-5’的SOD、CAT、MAD、SP和SS的载荷值较高。表3,图5
3 讨 论
3.1
番茄作为一种盐敏感的农业种植作物,盐害将严重影响番茄的生长发育,导致番茄减产甚至死亡[17]。土壤中当盐浓度超过一定阈值时就会造成植物吸水困难,抑制种子的萌发和幼苗的生长[18-19]。试验结果表明,在50 mmol/L的NaCl胁迫环境中,添加EBR可以缓解番茄在种子萌发期受到的不良影响,提高番茄种子的发芽率、发芽势等各项生理生化指标,且不同品种、不同EBR浓度之间存在显著差异,该结果与水稻[20]、番茄[21]、黑麦草[22]的研究结果一致。
3.2
植物能否在盐碱环境中生存,取决于是否可以在盐胁迫环境下发芽势、发芽率的高低以及发芽速度的快慢[23]。在高浓度盐胁迫下,用5 μM/L的芸苔素内酯处理可以提高苜蓿种子的发芽率、发芽指数和活力指数,同时茎鲜重、茎干重和根干重、根长和根活力显著增加[24]。将大豆和绿豆使用天然芸苔素内酯溶液浸种可提高大豆和绿豆种子发芽率、芽长和下胚轴胚根比,促进豆芽生长[25]。研究中,盐胁迫下2个不同盐敏感型番茄经过EBR处理后的发芽率影响并不显著,但发芽势、发芽指数和活力指数显著增加;根长、芽长和鲜重也显著高于对照,与在不同盐敏感型水稻中的研究结果相似[26],是因为BRs参与细胞伸长、编码木糖葡聚糖内转移葡萄糖基酶/水解酶的基因调控,还可以在应激条件下维持植物膜的稳定性,并通过激活细胞壁松弛酶来调节细胞伸长和分裂活动[27]。芸苔素内酯以剂量依赖性方式影响植物的生长[28],不同浓度的EBR处理对盐胁迫的缓解效果也不同。低BR浓度(0.1和0.01 μg/L)可以促进马铃薯根伸长和侧根发育,而高BR浓度(1~100 μg/L)则抑制根系伸长[29]。试验也有相同的结论,随EBR浓度的增加,2个番茄品种的侧根数目逐渐增加,但胚根、胚芽和鲜重都呈现先增加后下降的趋势,其中‘M82’比‘IL-7-5-5’的指标变化更明显。根长和芽长对EBR浓度响应的不同,对明显促进芽长发育的EBR浓度对根长的促进效果不显著,可能与EBR调控根尖分生区有关[21]。用5种不同浓度EBR对黑枸杞进行浸种处理后,发现低浓度EBR可以促进黑果枸杞种子在盐胁迫下的萌发,高浓度则起到抑制作用,其中0.05 mg/L EBR对黑果枸杞种子萌发的促进效果最为明显[29]。在中等盐胁迫下,使用0.05~0.5 mg/L浓度的芸苔素内酯浸种,与CK相比,亚麻种子发芽势、发芽率均显著提高,其中0.5 mg/L的芸苔素内酯浸种效果最好。芸苔素内酯在胁迫环境中对种子萌发起到促进作用,且不同作物品种和不同的胁迫等级施用的最适宜浓度均存在显著差异。
3.3
使用28-表高芸苔素内酯对芥菜种子进行预处理,发现其通过严格调节ROS的积累,对SOD、CAT、APX、GR和脱氢抗坏血酶还原酶和单脱氢抗酸还原酶的活性均有积极影响,提高了植物对抗盐胁迫的毒性效应的潜力[30,31]。在50 mmol/L的盐胁迫条件下,盐敏感型品种‘M82’体内的CAT和SOD活性显著增加,表明植株在盐胁迫下启动防御机制,利用自身清除活性氧来抵御盐胁迫的侵害,与杨文文等[32]在番茄中的研究结果一致。盐胁迫下使用6 μm/L芸苔素内酯处理苜蓿种子后,可以显著提升苜蓿幼苗中的POD、SOD和CAT的活性[33]。用EBR处理盐胁迫下的玉米种子,发现脂质过氧化水平随EBR的应用而降低,显示出较少的氧化损伤,幼苗的SOD、POD和APOX活性显著增强[34]。试验在添加外源EBR后,2个不同品种番茄的MDA、CAT、SOD和POD活性均有不同程度的提高,其中,以0.1和0.5 μmol/L浓度的EBR处理提升抗氧化酶活性的效果最显著,‘IL-7-5-5’品种在盐胁迫下对外源EBR的响应更强烈。
渗透调节是植物减少胁迫伤害的一个重要特征,植物自身也会发生一些生理生化变化来适应盐胁迫环境,如增加体内渗透调节物质来增加细胞液的渗透势[35]。渗透调节物质(脯氨酸、可溶性糖、可溶性蛋白、甜菜碱等)的吸收和合成,可以使植物细胞内能够维持较高的渗透水平[36]。在180 mmol/L的盐胁迫下,使用0.05 mg/L EBR处理玉米种子后脯氨酸和可溶性糖含量提高,可以显著缓解盐胁迫的伤害[37]。在100 mmol/L NaCl胁迫下研究EBR对2种燕麦种子萌发抑制的缓解效应,研究结果显示0.01 μmol/L外源EBR可以显著降低燕麦种子萌发过程中的蛋白水解酶活性,可溶性糖、可溶性蛋白、游离脯氨酸等渗透调节物质含量相应提高[38]。试验结论与前人一致,在NaCl胁迫环境下,经过外源EBR处理后番茄中渗透调节物质含量增加,且0.1 μmol/L EBR处理可以显著提高2个番茄品种的可溶性蛋白含量,0.01 μmol/L EBR浓度对可溶性糖含量的提升效果更好。
4 结 论
在盐胁迫下,不同浓度外源EBR处理的2个番茄品种的种子均显著影响其发芽率、发芽势、发芽指数和活力指数。‘M82’的MAD、SP和SS;‘IL-7-5-5’的SOD、CAT、MAD、SP和SS的载荷值较高,EBR能够显著提高番茄种子萌发过程的渗透调节能力,同时显著提高番茄的抗氧化系统活性,有效降低活性氧和膜脂过氧化产物的积累,提高番茄种子萌发期的耐盐性。但随EBR浓度的提升,番茄种子的萌发指数、抗氧化酶活性和渗透调节物质含量呈先增加后降低的趋势。在50 mmol/L的NaCl胁迫下,不同的盐敏感型番茄品种种子的适宜浓度不同。其中,0.01 μmol/L对‘M82’缓解盐胁迫的效果最佳,而0.1 μmol/L对‘IL-7-5-5’的效果最佳。
参考文献(References)
[1]罗子敬, 孙宇涵, 卢楠, 等. 杨树耐盐机制及转基因研究进展[J]. 核农学报, 2017, 31(3): 482-492.
LUO Zijing, SUN Yuhan, LU Nan, et al. Research advances on salt-tolerance mechanism and genetic transformation of poplar[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(3): 482-492.
[2] 刘振斌, 任东涛. 应对土壤盐渍化日益增加的农作物育种策略分析[J]. 中国农业信息, 2016,(16): 6-7.
LIU Zhenbin, REN Dongtao. Analysis of crop breeding strategy to deal with the increasing soil salinization[J]. China Agricultural Information, 2016,(16): 6-7.
[3] Zelm E V, Zhang Y, Testerink C. Research advances on salt-tolerance mechanism and genetic transformation of poplar[J]. Annual Review of Plant Biology, 2020, 71 (1): 403-433.
[4] 毛恋, 芦建国, 江海燕. 植物响应盐碱胁迫的机制[J]. 分子植物育种, 2020, 18(10): 3441-3448.
MAO Lian, LU Jianguo, JIANG Haiyan. Mechanisms of plant responses to salt-alkali stress[J]. Molecular Plant Breeding, 2020, 18(10): 3441-3448.
[5] 王学征, 李秋红, 吴凤芝. NaCl胁迫下栽培型番茄Na+、K+吸收、分配和转运特性[J]. 中国农业科学, 2010, 43(7): 1423-1432.
WANG Xuezheng, LI Qiuhong, WU Fengzhi. Study on the characteristics of absorption, distribution and selective transport of Na+ and K+ in tomato plants under salt stress[J]. Scientia Agricultura Sinica, 2010, 43(7): 1423-1432.
[6] 李换丽. 硅对番茄幼苗抗盐性的影响及机理初探[D]. 杨凌: 西北农林科技大学, 2015.
LI Huanli. The Effect And Mechanism of Exogenous Silicon on Salt Resistance of Tomato Seedlings[D]. Yangling: Northwest A amp; F University, 2015.
[7] Siddiqui M H, Mohammad F, Khan M M A, et al. Cumulative effect of nitrogen and sulphur on Brassica juncea L. genotypes under NaCl stress[J]. Protoplasma, 2012, 249(1): 139-153.
[8] Singh M. Plant tolerance mechanism against salt stress: the nutrient management approach[J]. Biochemistry amp; Pharmacology: Open Access, 2014, 3(5): 165-178.
[9] Tabi K, Tabi F, Ait Abderrahim L, et al. Effect of salt stress on growth, chlorophyll content, lipid peroxidation and antioxidant defence systems in Phaseolus vulgaris L[J]. South African Journal of Botany, 2016, (105): 306-312.
[10] 王晚霞, 高立杨, 张瑞, 等. 2, 4-表油菜素内酯对盐碱胁迫下垂丝海棠光合及生理特性的影响[J]. 果树学报, 2021, 38(9): 1479-1490.
WANG Wanxia, GAO Liyang, ZHANG Rui, et al. Effects of 2, 4 epbrassinolide on photosynthetic and physiological characteristics of Malusa halliana under saline-alkali stress[J]. Journal of Fruit Science, 2021, 38(9): 1479-1490.
[11] Fujioka S, Yokota T. Biosynthesis and metabolism of brassinosteroids[J]. Annual Review of Plant Biology, 2003, (54): 137-164.
[12] 郭慧琴, 任卫波, 李平, 等. 2, 4-表油菜素内酯和赤霉素互作对羊草种子萌发及幼苗生长的影响[J]. 草业科学, 2014, 31(6): 1097-1103.
GUO Huiqin, REN Weibo, LI Ping, et al. Effect of epi-brassinosteroid and Gibberellin on seed germination and seedling growth of Leymus chinensis[J]. Pratacultural Science, 2014, 31(6): 1097-1103.
[13] Shu S, Tang Y Y, Yuan Y H, et al. The role of 24-epibrassinolide in the regulation of photosynthetic characteristics and nitrogen metabolism of tomato seedlings under a combined low temperature and weak light stress[J]. Plant Physiology and Biochemistry, 2016, (107): 344-353.
[14] Bajguz A, Hayat S. Effects of brassinosteroids on the plant responses to environmental stresses[J]. Plant Physiology and Biochemistry, 2009, 47(1): 1-8.
[15] Li J, Yang P, Kang J G, et al. Transcriptome analysis of pepper (Capsicum annuum) revealed a role of 24-epibrassinolide in response to chilling[J]. Frontiers in Plant Science, 2016, (7): 1281.
[16] Oh E, Zhu J Y, Wang Z Y. Interaction between BZR1 and PIF4 integrates brassinosteroid and environmental responses[J]. Nature Cell Biology, 2012, 14(8): 802-809.
[17] 杨爽. 钾介导番茄耐盐机理的研究[D]. 沈阳: 沈阳农业大学, 2020.
YANG Shuang. Study on the Mechanism of Potassium-mediated Tomato Salt Tolerance[D]. Shenyang: Shenyang Agricultural University, 2020.
[18] 施雨. 褪黑素对盐胁迫下紫花苜蓿种子萌发及幼苗生长生理特性的影响[D]. 扬州: 扬州大学, 2022.
SHI Yu. Effects of Melatonin on Seed Germination and Seedling Growth and Physiological Characteristics of Alfalfa under Salt Stress[D]. Yangzhou: Yangzhou University, 2022.
[19] 李彦, 张英鹏, 孙明, 等. 盐分胁迫对植物的影响及植物耐盐机理研究进展[J]. 中国农学通报, 2008, 24(1): 258-265.
LI Yan, ZHANG Yingpeng, SUN Ming, et al. Research advance in the effects of salt stress on plant and the mechanism of plant resistance[J]. Chinese Agricultural Science Bulletin, 2008, 24(1): 258-265.
[20] 侯会云. 油菜素内酯对盐胁迫下水稻种子萌发的影响[J]. 热带农业科学, 2020, 40(7): 1-6.
HOU Huiyun. Effects of brassinolide on seed germination of rice under salt stress[J]. Chinese Journal of Tropical Agriculture, 2020, 40(7): 1-6.
[21] 舒思晨, 王娟, 王柏柯, 等. 外源MeJA和BR对番茄种子萌发及幼根生长的影响[J]. 农业工程, 2022, 12(3): 138-143.
SHU Sichen, WANG Juan, WANG Boke, et al. Effects of exogenous MeJA and BR on tomato seed germination and root growth[J]. Agricultural Engineering, 2022, 12(3): 138-143.
[22] 王丹, 刘亚西, 周扬, 等. 油菜素内酯对盐胁迫下黑麦草种子萌发及幼苗生长的生理调控作用[J]. 草业科学, 2021, 38(6): 1110-1118.
WANG Dan, LIU Yaxi, ZHOU Yang, et al. Physiological regulation of brassinosteroids on seed germination and seedling growth in Lolium perenne in response to salt stress[J]. Pratacultural Science, 2021, 38(6): 1110-1118.
[23] 于明艳. 不同外源性试剂对盐胁迫下黄瓜种子萌发的影响[J]. 农业科技与装备, 2019,(2): 27-29.
YU Mingyan. Effects of different exogenous reagents on seed germination of Cucumis sativus L[J]. Agricultural Science amp; Technology and Equipment, 2019,(2): 27-29.
[24] Zhang S, Hu J, Zhang Y, et al. Seed priming with brassinolide improves lucerne (Medicago sativa L.) seed germination and seedling growth in relation to physiological changes under salinity stress[J]. Australian Journal of Agricultural Research, 2007, 58(8): 811-815.
[25] CHENG C, HAN H, DING D, et al. Effects of Natural Brassinolide on Seed Germination and Hypocotyl Elongation of Beans[J]. Agricultural Biotechnology, 2015, 4(5): 26-28.
[26] Larré C F, de Moraes D M, Lopes N F. Qualidade fisiológica de sementes de arroz tratadas com soluo Salina e 24-epibrassinolídeo[J]. Revista Brasileira De Sementes, 2011, 33(1): 86-94.
[27] Tanveer M, Shahzad B, Sharma A, et al. 24-Epibrassinolide; an active brassinolide and its role in salt stress tolerance in plants: a review[J]. Plant Physiology and Biochemistry, 2018, (130): 69-79.
[28] 纪秀娥, 史留功, 胡春红, 等. 油菜素内酯对小麦、玉米种子萌发的影响[J]. 江苏农业科学, 2014, 42(9): 88-89.
JI Xiue, SHI Liugong, HU Chunhong, et al. Effect of brassinolide on seed germination of wheat and maize[J]. Jiangsu Agricultural Sciences, 2014, 42(9): 88-89.
[29] Hu Y Q, Xia S T, Su Y, et al. Brassinolide increases potato root growth in vitro in a dose-dependent way and alleviates salinity stress[J]. BioMed Research International, 2016, 2016: 8231873.
[30] 赵旭庆, 徐珊珊, 李强, 等. 盐胁迫下24-表油菜素内酯浸种对黑果枸杞种子萌发的影响[J]. 林业科技通讯, 2021,(3): 59-61.
ZHAO Xuqing, XU Shanshan, LI Qiang, et al. Effects of EBR immersion on seed germination of Lycium ruthenicum under salt stress[J]. Forest Science and Technology, 2021,(3): 59-61.
[31] Kaur H, Sirhindi G, Bhardwaj R, et al. 28-homobrassinolide regulates antioxidant enzyme activities and gene expression in response to salt- and temperature-induced oxidative stress in Brassica juncea[J]. Scientific Reports, 2018, 8(1): 8735.
[32] 杨文文, 刘媛, 聂书明. 外源油菜素内酯对盐胁迫下番茄种子萌发的影响[J]. 园艺与种苗, 2022, 42(11): 43-46.
YANG Wenwen, LIU Yuan, NIE Shuming. Effect of exogenous brassinosteroids on germination of tomato seeds under salt stress[J]. Horticulture amp; Seed, 2022, 42(11): 43-46.
[33] Zhang S, Hu J, Zhang Y, et al. Seed priming with brassinolide improves lucerne (Medicago sativa L.) seed germination and seedling growth in relation to physiological changes under salinity stress[J]. Australian Journal of Agricultural Research, 2007, 58(8): 811.
[34] Arora N, Bhardwaj R, Sharma P, et al. Effects of 28-homobrassinolide on growth, lipid peroxidation and antioxidative enzyme activities in seedlings of Zea mays L. under salinity stress[J]. Acta Physiologiae Plantarum, 2008, 30(6): 833-839.
[35] Wu W L, Zhang Q, Ervin E H, et al. Physiological mechanism of enhancing salt stress tolerance of perennial ryegrass by 24-epibrassinolide[J]. Frontiers in Plant Science, 2017, (8): 1017.
[36] 高景慧, 母养秀, 张越利, 等. 外源NO对渗透胁迫下多年生黑麦草幼苗生长和生理特性的影响[J]. 草地学报, 2011, 19(4): 625-630.
GAO Jinghui, MU Yangxiu, ZHANG Yueli, et al. Effects of exogenous nitric oxide on the growth and physiological characteristics of perennial ryegrass seedlings under osmotic stress[J]. Acta Agrestia Sinica, 2011, 19(4): 625-630.
[37] 闫慧萍, 彭云玲, 赵小强, 等. 外源24-表油菜素内酯对逆境胁迫下玉米种子萌发和幼苗生长的影响[J]. 核农学报, 2016, 30(5): 988-996.
YAN Huiping, PENG Yunling, ZHAO Xiaoqiang, et al. Effect of exogenous 24-epibrassinolide on seed germination and seedling growth of maize under different stress[J]. Journal of Nuclear Agricultural Sciences, 2016, 30(5): 988-996.
[38] 寇江涛. 外源2, 4-表油菜素内酯对盐胁迫下燕麦种子萌发抑制的缓解效应[J]. 草业科学, 2020, 37(5): 916-925.
KOU Jiangtao. Mitigating effect of exogenous 2, 4-epibrassinolide on the inhibition of oat seed germination under salt stress[J]. Pratacultural Science, 2020, 37(5): 916-925.
Effects of exogenous 2, 4-epibrassinolide on seed germination
of different salt-sensitive tomatoes under salt stress
XI Rui1,2, CHEN Yijia1,2, LI Ning2, YU Qinghui2, WANG Qiang2, QIN Yong1
(1.College of Horticulture, Xinjiang Agricultural University, Urumqi 830052, China;2. Xinjiang Vegetable Engineering Technology Research Center/ Institute of Horticultural Crops, Xinjiang Academy of Agricultural Sciences, Urumqi 830091, China)
Abstract:【Objective】 To study the effects of different concentrations of 2, 4-Epibrassinolide (EBR) on the germination characteristics and key enzyme activities of tomato seeds under salt stress and" determine the optimal concentration of exogenous EBR for tomato seed germination and growth in the hope of providing theoretical support for the effective application of this plant growth regulator.
【Methods】 The seeds of salt-sensitive tomato ‘M82’ and salt-tolerant tomato ‘IL-7-5-5’ were treated with 50 mmol/L NaCl, and exogenous EBR of 0.01, 0.1 and 0.5 μmol/L were added to assess tomato seed germination stage of germination rate, germination potential, morphological characteristics, and analysis of antioxidant enzymes activity and osmotic regulation substances content changes.
【Results】 Compared with salt stress treatment, the germination potential of ‘M82’ and ‘IL-7-5-5’ after exogenous EBR treatment was increased by more than 10% to 30%, and the seed vigor index was increased by more than 100 to 200. With the increase of EBR concentration, the germination rate and germination potential of the two tomato varieties showed a decreasing trend. Compared with salt stress, the seed germ length and fresh weight of ‘M82’ treated with 0.01 μmol/L EBR increased by 94.26% and 135.71%, respectively. The germ length and fresh weight of ‘IL-7-5-5’ treated with 0.1 μmol/L EBR increased by 32.48% and 14.52%, respectively, compared with salt stress. The contents of osmoregulatory substances such as soluble protein and soluble sugar were significantly increased, and the activities of MDA, SOD, CAT and POD in the sprouts were significantly increased, but there were significant differences in physiological indexes between different EBR concentrations and different tomato varieties.
【Conclusion】 In the presence of salt stress, exogenous EBR can enhance the adaptability of tomato seeds to osmotic regulation during germination, improve the efficacy of antioxidant system in vivo, reduce the accumulation of membrane lipid peroxidation products, promote the germination and growth of tomato seeds, thus enhancing the tolerance of tomato seeds to salt during germination. 0.01 μmol/L EBR treatment has the best effect on ‘M82’ and 0.1 μmol/L on ‘IL-7-5-5’ under salt stress.
Key words:tomato; EBR; salt stress; seed germination
Fund projects:The Project of National Natural Science Foundation of China (31860554); The Vegetable Industry Technology System Support Project of Xinjiang Uygur Autonomous Region (Green Cultivation Post)
Correspondence author:QIN Yong(1962-),male,from Gansu, professor, Ph.D, Ph.D supervisor, research direction: Vegetable cultivation and physiology,(E-mail)352167610@qq.com
WANG Qiang(1983-),male,from Gansu, researcher, master supervisor, research direction: Physiology and Stress of vegetable cultivation,(E-mail)wangqiang201004@sina.com
