牛羊布鲁氏菌天然半抗原琼脂扩散试验的建立与应用
2024-12-31刘丽娅剡文亮曹瑞叶锋马晓菁谷文喜赵江山张子荣宋洁李岩易新萍

摘 要:【目的】建立并优化布鲁氏菌天然半抗原琼脂扩散试验(Native hapten agar gel immuno-diffusion test,NH-AGID),检测临床样品。
【方法】建立NH-AGID方法,评价方法特异性、敏感性及重复性;检测免疫地区2 287份、非免疫地区252份牛、羊血清。
【结果】建立了NH-AGID方法,检测稳定,重复性好,具有较高的特异性;对自然感染阳性动物检测敏感性低于80%,对排菌动物的检测敏感性高于90%,检出布病阳性抗体的阈值高于RBT。免疫地区血清NH抗体平均检出率17.8%,LPS抗体平均检出率52.3%;非免疫地区血清NH抗体平均检出率40.9%,LPS抗体平均检出率54.8%。
【结论】应用NH-AGID方法可鉴别区分免疫地区牛、羊布病感染动物和免疫动物。检出NH抗体动物处于布鲁氏菌活动期或排菌期为布病感染动物,应及时剔除出群。
关键词:布鲁氏菌病;半抗原-琼脂扩散试验;诊断
中图分类号:S855 ""文献标志码:A ""文章编号:1001-4330(2024)08-2063-08
收稿日期(Received):2024-01-18
基金项目:新疆维吾尔自治区重点研发专项(2022B03013-1);新疆生产建设兵团重点领域科技攻关计划项目(2020AB015)
作者简介:刘丽娅(1984-),女,安徽阜阳人,副研究员,硕士,研究方向为动物疫病防控,(E-mail)286238083@qq.com
通讯作者:易新萍(1970-),女,湖北公安人,研究员,博士,研究方向为动物疫病防控,(E-mail)821489803@qq.com
李岩(1966-),男,山东人,研究员,硕士生导师,研究方向为动物疫病预防控制,(E-mail)bt4641862@ 163.com
0 引 言
【研究意义】布鲁氏菌病Brucellosis(简称布病)是人畜共患病[1]。自2000年以来,我国布病发病率呈逐年上升趋势,且上升速度很快[2]。该病影响畜牧业可持续发展[3]。疫苗免疫是防控布病的重要手段[4],虽然牲畜免疫后可产生一定的免疫保护效果,但也存在感染风险,以及免疫后无法区分免疫抗体和自然感染抗体,干扰血清检测等缺陷[5-6]。建立并优化布病鉴别诊断的方法,对准确早期鉴别及诊断牛、羊该病有实际意义。【前人研究进展】目前我国尚无对疫苗免疫动物和自然感染动物进行有效鉴别诊断的血清学方法[7]。有研究采用酶联免疫吸附试验或虎红平板凝集试验进行初筛,再通过NH-AGID确诊,区分了布鲁氏菌疫苗Rev.1株免疫抗体和感染抗体[8],也可应用NH-AGID对布病自然感染牛和免疫S19株疫苗牛进行鉴别诊断[9]。还有使用NH-AGID方法对血清检测阳性动物区分自然感染抗体和疫苗抗体,实现了布病的净化[10]。【本研究切入点】有关牛羊布鲁氏菌天然半抗原琼脂扩散试验的建立与应用文献研究较少,需研究鉴别诊断布病疫苗免疫背景下区分自然感染动物和疫苗免疫动物的NH-AGID方法。【拟解决的关键问题】建立布鲁氏菌NH-AGID试验方法,优化检测条件,并应用建立的方法检测不同免疫背景和自然感染的牛、羊血清样本,为畜间布病鉴别诊断提供可选择的方法及相关研究临床检测数据。
1 材料与方法
1.1 材 料
1.1.1 试剂
布病虎红平板凝集试验(RBT)、试管凝集试验(SAT)和补体结合试验(CFT)抗原购自青岛立见生物科技有限公司;2×PCRmix、无水乙醇、硼酸、氯化钾、NaOH、琼脂糖购自生工生物工程(上海)股份有限公司。引物合成自生工生物工程(上海)股份有限公司。
1.1.2 NH和LPS抗原
由青岛瑞尔唯特生物技术有限公司提供。
1.1.3 血清样品
1.1.3.1 布病阳性血清
在无布病疫苗接种史的羊群采集布病阳性血清共6份:RBT、SAT 和CFT检测均为阳性,其中牛、羊强阳性血清各1份、中阳性各1份、弱阳性血清各1份;布病PCR诊断阳性、RBT诊断阳性牛、羊血清各24份;经RBT、SAT 检测均为阳性的无布病疫苗接种史牛、羊血清各50份。
1.1.3.2 布病阴性血清
采集自无布病疫苗接种史的牛群和羊群,经RBT、SAT和CFT检测均为阴性的牛、羊血清各20份。
1.1.3.3 其他阳性血清
口蹄疫O型抗体阳性血清、A型抗体阳性血清、牛支原体抗体阳性血清、牛分枝杆菌抗体阳性血清、大肠杆菌抗体阳性血清均为新疆畜牧科学院兽医所保存血清。
1.1.3.4 临床样品
收集布病疫苗免疫后一年内经RBT、SAT检测均为阳性的血清共2 287份,其中布鲁氏菌A19-ΔVirB12疫苗免疫牛血清342份、A19疫苗免疫牛血清1 688份、M5株疫苗免疫羊血清257份;非免疫地区经RBT、SAT检测均为阳性的血清共252份,其中牛血清55份、羊血清197份。
1.2 方 法
1.2.1 诊断抗原的制备
参照WOAH陆生动物疾病诊断和疫苗手册在生物安全三级实验室条件下,将培养的羊种布鲁氏菌16M菌液进行灭活;12 000 r/min、4 ℃离心10 min,弃上清后将沉淀物加ddH2O重悬,12 000 r/min、4℃离心10 min,洗涤2次;按1∶4体积比加ddH2O重悬沉淀物,121℃高压30 min后12 000 r/min 4℃离心20 min,取上清加入3倍体积无水乙醇,4℃搅拌过夜;15 000 r/min、4℃离心20 min,取沉淀物用适量双蒸水重悬,透析12 h、冻干、称重,重量应不低于5 mg,所得产物为NH和LPS抗原混合物,-20℃保存备用。
1.2.2 琼脂平板的制备
配制硼酸缓冲液:分别称取硼酸6.2 g、氯化钾7.25 g,加入ddH2O 800 mL,搅拌至药品完全溶化。用1 mol/L的NaOH溶液调pH至8.3后,定容至1 000 mL。每100 mL硼酸缓冲液中加入不同浓度的琼脂糖,水浴加热至完全溶解。在直径为60 mm的一次性平皿中加入5 mL琼脂溶液,凝固后用孔径4 mm、孔距3 mm的7孔梅花型打孔器打孔,加热封底。4℃保存备用。
1.2.3 操作及判定
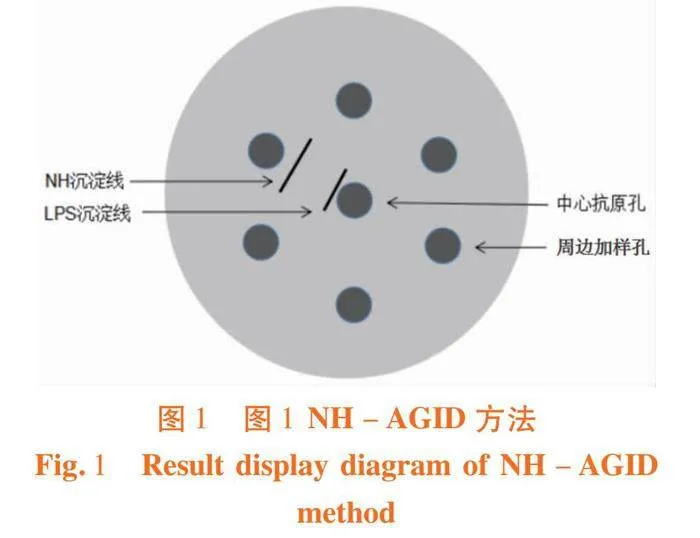
中心孔加抗原,侧面孔加被检血清。LPS沉淀线靠近中心抗原孔端,出现LPS沉淀线判定为免疫动物;NH沉淀线靠近侧面加样孔端,同时出现NH、LPS两条沉淀线或只出现NH沉淀线均判定为感染动物。图1
1.2.4 条件优化
1.2.4.1 NH和LPS混合抗原浓度
将NH和LPS抗原混合物用ddH2O分别稀释至0.5、1.0、1.5、2.0、 2.5和3.0 mg/mL等6个不同浓度,取15 μL加入中央孔,周边6个孔各加入15 μL羊布病阳性血清(2份强阳性、2份中阳性、2份弱阳性),放置湿盒中,连续观察,记录结果。
1.2.4.2 琼脂浓度
依次配制0.6%、1.0%、1.2%、1.5%、1.7%和2.0%等6种不同浓度的琼脂平板,中央孔加入15 μL最佳浓度抗原,周边6个孔各加入15 μL羊布病阳性血清,放置湿盒中,连续观察记录。
1.2.4.3 孵育温度和孵育时间
琼脂平板中央孔加入15 μL最佳浓度抗原,周边6个孔各加入15 μL阳性血清。将平板置于湿盒中,分别放在18、22、25、30和37℃ 5个温度条件下,孵育4、8、16及24 h,连续观察记录。
1.2.5 敏感性检测
1.2.5.1 与RBT方法敏感性比对
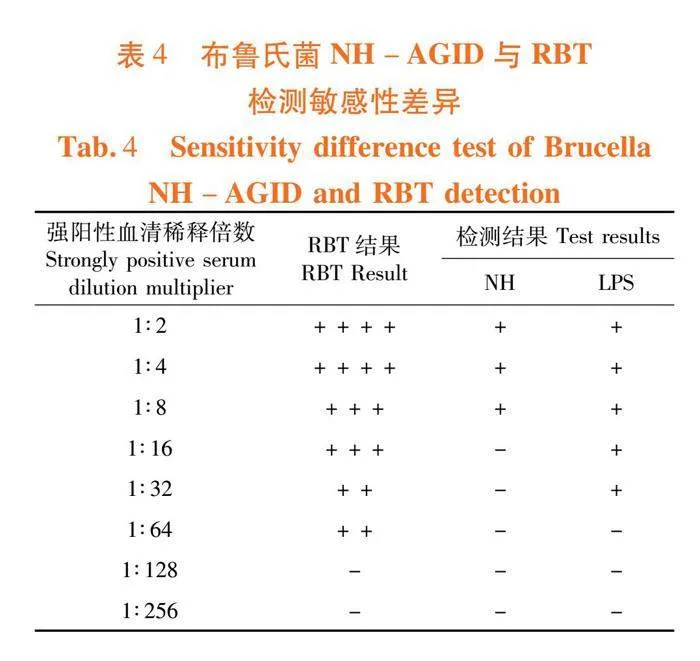
将布病强阳性血清1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128和1∶256倍稀释后,应用建立的NH-AGID方法和RBT方法同时检测,比较NH-AGID方法与RBT方法的敏感性差异。
1.2.5.2 自然感染血清
检测50份自然感染牛、50份自然感染羊血清样品,评价该方法对自然感染血清检测敏感性。
1.2.5.3 病原学阳性样品
检测25份布病PCR诊断阳性牛血清、25份布病PCR诊断阳性羊血清样品,评价该方法检测NH抗原的敏感性。
1.2.6 特异性
应用建立的NH-AGID方法检测口蹄疫O型抗体阳性血清、A型抗体阳性血清、牛支原体抗体阳性血清、牛分枝杆菌抗体阳性血清、大肠杆菌抗体阳性血清和布病阴性血清,评价该检测方法的特异性。
1.2.7 重复性
按照优化后的NH-AGID最佳抗原浓度和琼脂浓度,制备3批检测平板,分别检测布病阳性血清和布病阴性血清,评价方法的重复性。
1.2.8 临床血清样品
应用建立的NH-AGID方法检测收集自免疫地区和非免疫地区的2 539份牛、羊阳性血清进行。
2 结果与分析
2.1 试验条件优化
2.1.1 最佳抗原浓度
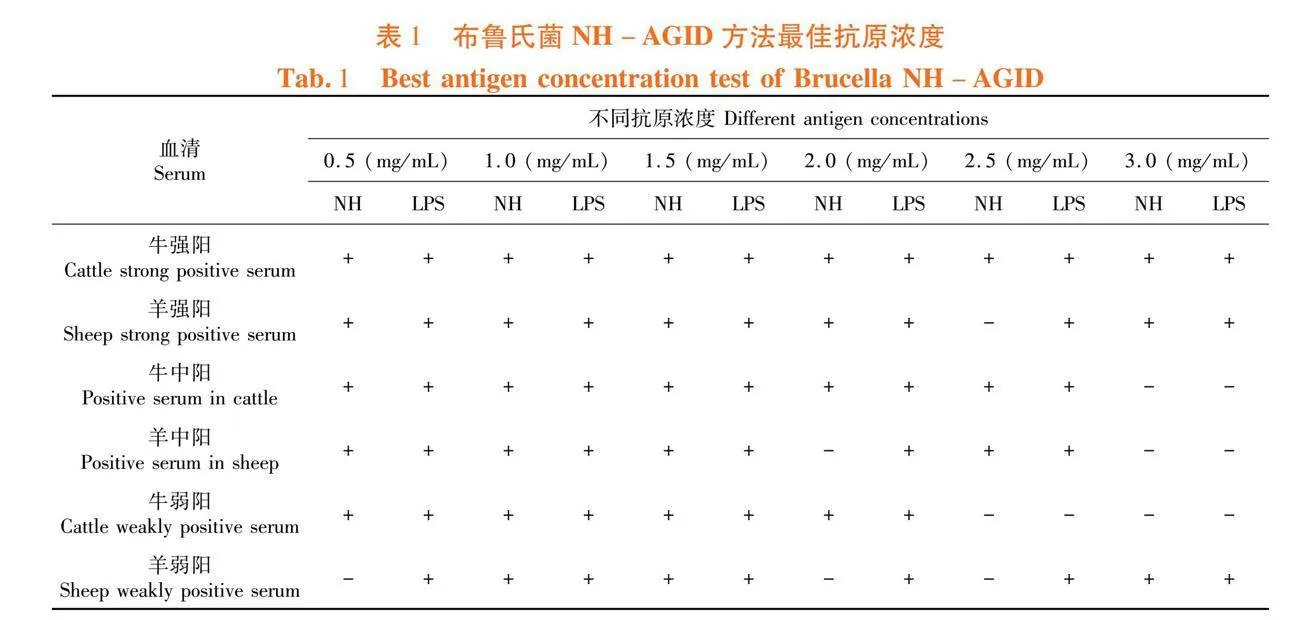
研究表明,当混合抗原浓度为1.0和1.5 mg/mL时,布病强阳、中阳、弱阳性血清均能形成NH沉淀线和LPS沉淀线,选定最佳抗原浓度为1.0 mg/mL。表1
2.1.2 最佳琼脂浓度
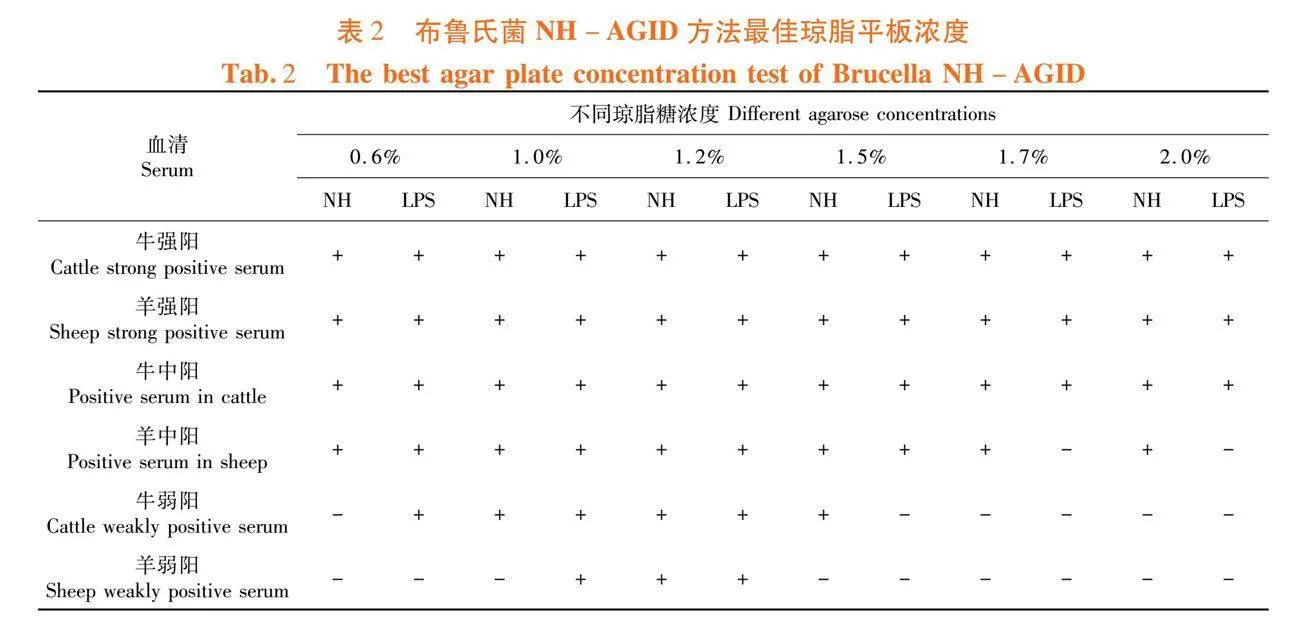
研究表明,当琼脂平板浓度为1.2%时,布病强阳、中阳、弱阳性血清均能够形成NH沉淀线和LPS沉淀线,并且此时弱阳性血清出现的NH沉淀线最清晰。选定琼脂糖平板最佳浓度为1.2%。表2
2.1.3 最佳孵育温度和孵育时间
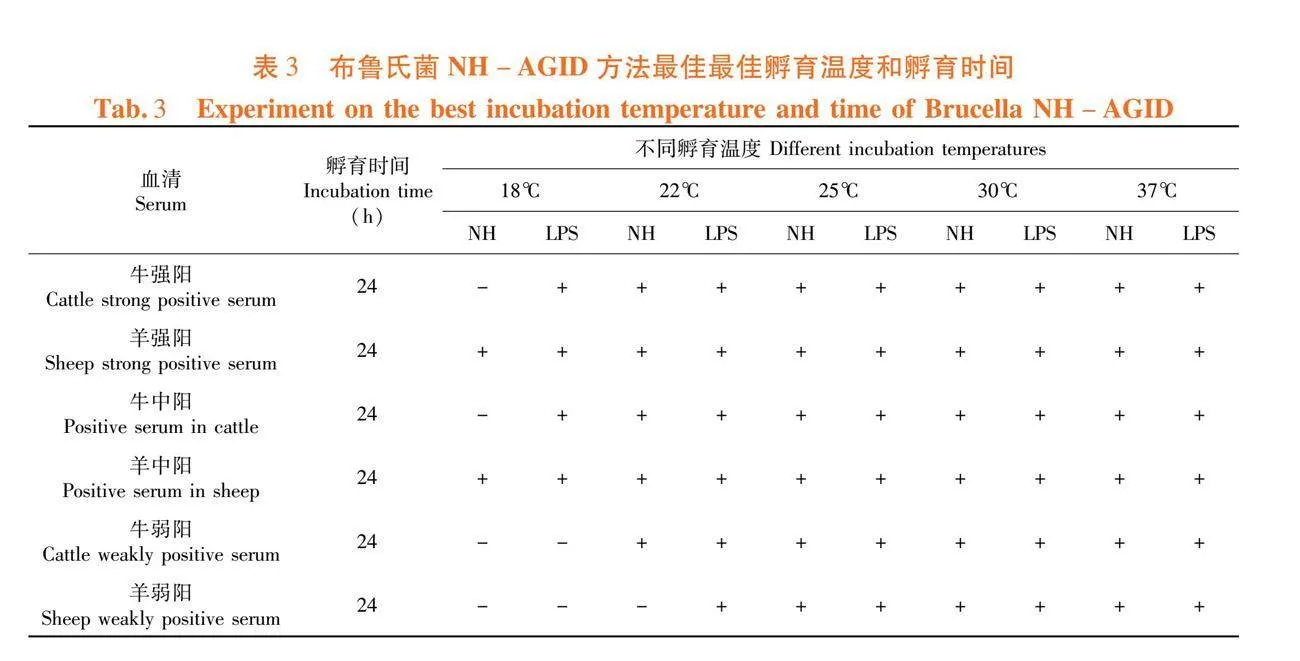
研究表明,在22、25和30℃条件孵育4 h时强阳血清出现NH抗原沉淀带;8 h时中等阳性血清出现NH抗原沉淀带;16 h时出现LPS抗原沉淀带,且弱阳性血清出现NH抗原沉淀带;24 h以上弱阳性NH沉淀带最为完整、清晰。最终选定最佳孵育温度为(25±3)℃,最佳孵育时间为24 h。表3
2.2 敏感性检测
2.2.1 应用NH-AGID方法
研究表明,布病强阳性血清在1∶64稀释时检测为阳性。RBT检测敏感性高于NH-AGID方法。表4
2.2.2 布病自然感染阳性动物对应血清NH-AGID方法检测
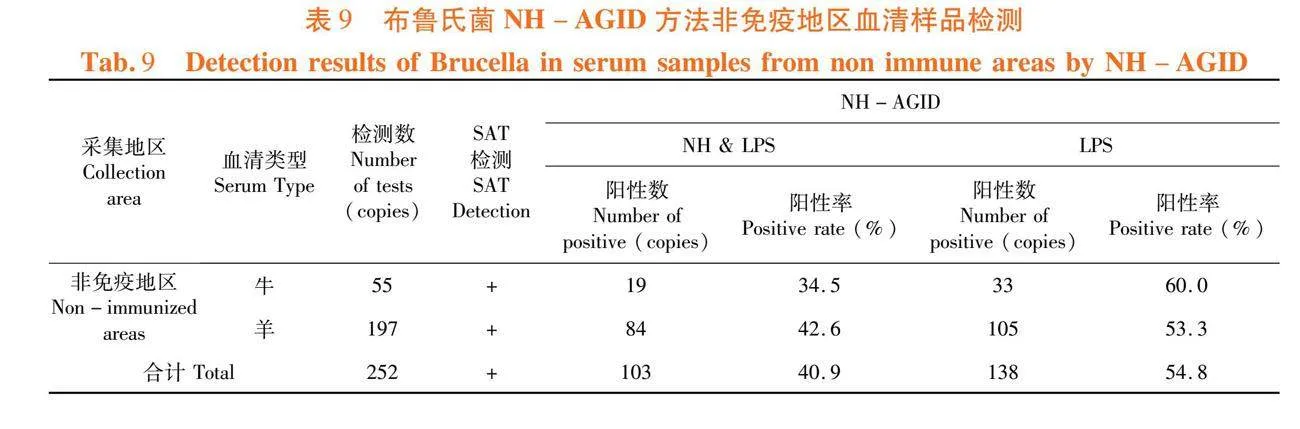
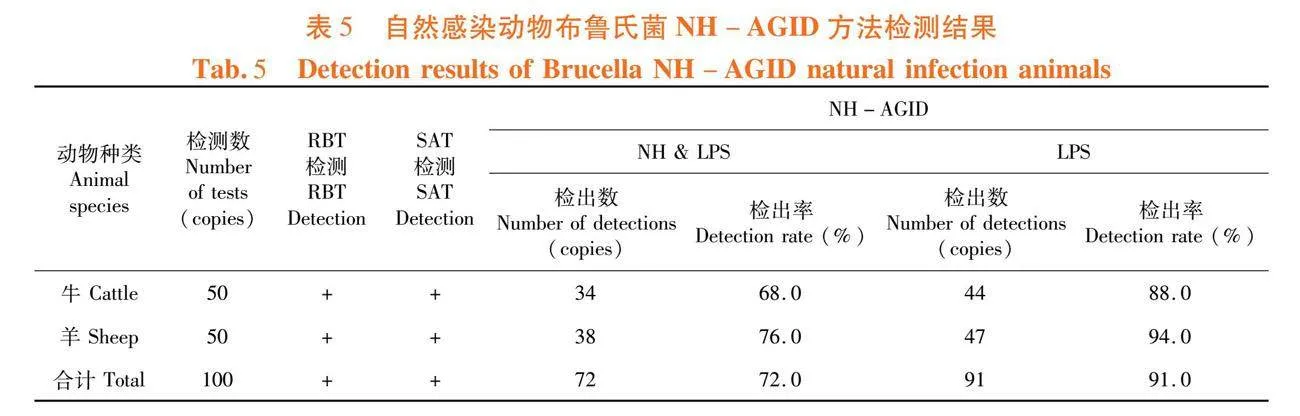
研究表明,牛、羊血清NH和LPS沉淀线检出率均在80%以下,牛、羊LPS沉淀线检出率分别为88%、94%。NH-AGID方法对自然感染动物检测敏感性为72%。表5
2.2.3 布病PCR诊断阳性动物对应血清NH-AGID方法检测
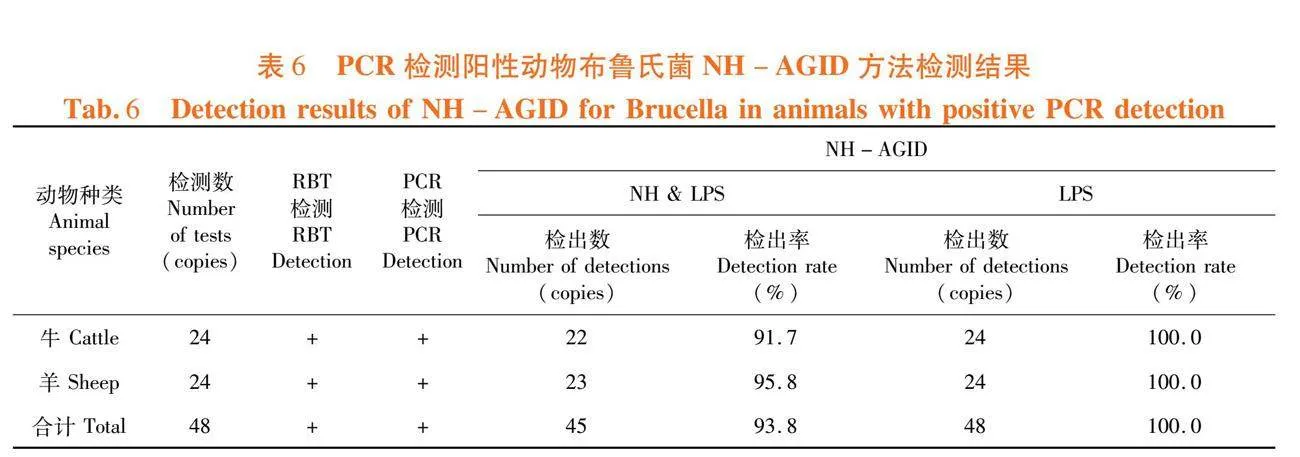
研究表明,牛、羊血清NH和LPS沉淀线检出率均在90%以上,LPS沉淀线检出率为100%。表明NH-AGID方法对PCR阳性动物检测敏感性为93.8%。表6
2.3 特异性及重复性检测
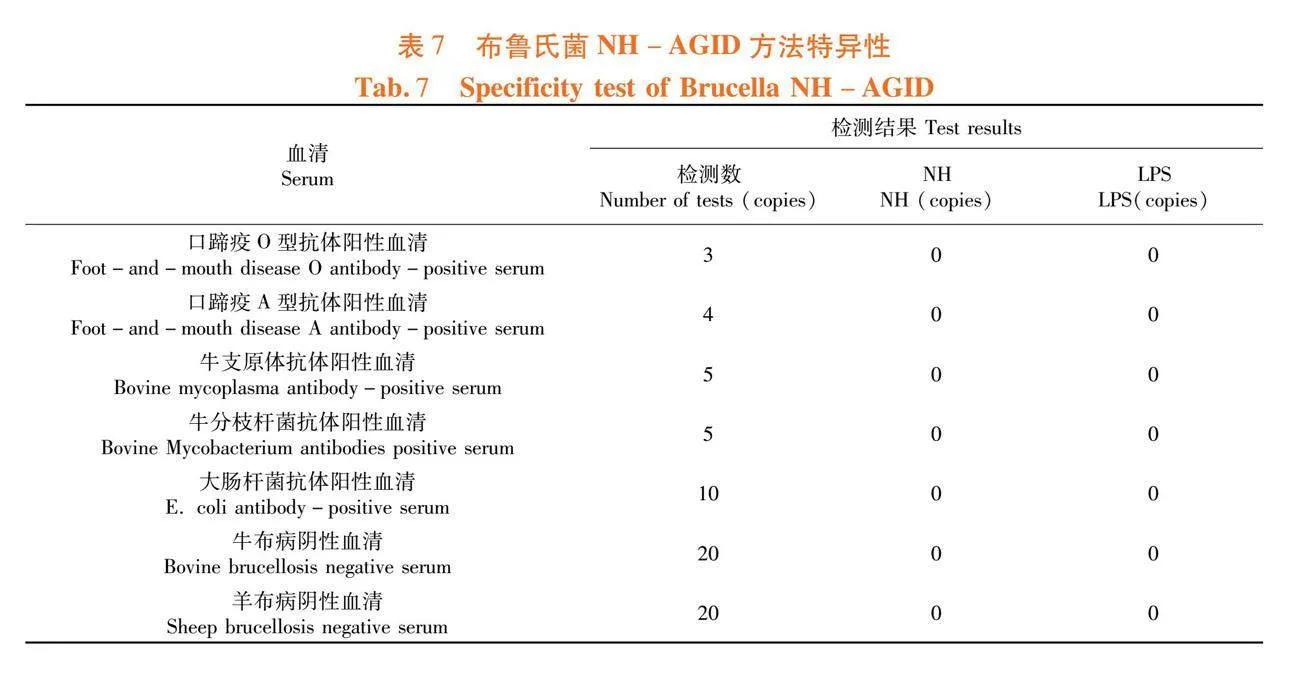
研究表明,对口蹄疫O型抗体阳性血清、A型抗体阳性血清、牛支原体抗体阳性血清、牛分枝杆菌抗体阳性血清、大肠杆菌抗体阳性血清和布病阴性血清进行检测,均未检测到NH沉淀线和LPS沉淀线。
应用3批布鲁氏菌NH半抗原琼脂扩散检测平板,分别进行敏感性和特异性检测,检测结果符合率在97%以上。表7
2.4 临床样品检测
2.4.1 布病不同疫苗免疫后血清检测
研究表明,A19-VirB12株免疫牛NH抗体检出率为5.6%,LPS抗体检出率为78.7%;A19株免疫牛NH抗体检出率为18.5%,LPS抗体检出率为46.4%;M5株免疫羊NH抗体检出率为28.8%,LPS抗体检出率为55.3%。免疫地区血清NH抗体平均检出率为17.8%,LPS抗体平均检出率为52.3%。表8
2.4.2 布病自然感染血清
研究表明,牛血清LPS抗体检出率为60%,NH抗体检出率为34.5%;羊血清LPS抗体检出率为53.3%,NH抗体检出率为42.6%。非免疫地区血清NH抗体平均检出率为40.9%,LPS抗体平均检出率为54.8%。表9
3 讨 论
3.1
琼脂扩散试验又称为双向双扩散试验,原理是通过抗原、抗体在琼脂凝胶中由近及远不断地自由扩散形成浓度梯度,在适当比例处相遇形成沉淀线,以此来对抗体或抗原进行鉴定、区分的一种试验方法[11]。NH-AGID是基于光滑型布鲁氏菌表面天然半抗原(NH)和脂多糖(S-LPS)的免疫原性差异所建立的琼脂扩散试验方法,可对布病免疫动物和感染动物进行鉴别诊断。LPS抗原免疫原性强,无论是自然菌还是疫苗菌均能刺激机体产生LPS抗体[12];NH抗原免疫原性弱[13-15],只有在布鲁氏菌感染,尤其是活动期、排菌期,持续强烈刺激机体才能产生NH抗体[16]。检测时根据形成不同的沉淀线对免疫动物和感染动物进行鉴别区分。
3.2
试验结果表明,NH-AGID方法检测稳定,重复性好,与其他5种疫病阳性血清无非特异性反应,布病阴性血清检测也均为阴性,检测特异性较高。但该方法的检测敏感性低于RBT,对布病自然感染牛、羊血清NH抗体的检出率低于80%,与杨珍等[17]研究结果一致,NH-AGID方法具有较好的特异性,但敏感性略低。因NH抗体的出现与布鲁氏菌排出情况有关[18],试验表明该方法对排菌动物的检测敏感性高于90%,进一步验证了NH抗体的出现与布鲁氏菌排出情况的密切相关性。
3.3
试验结果表明,免疫地区M5株疫苗免疫羊血清NH抗体检出率最高,达28.8%,可能和M5疫苗是我国目前使用疫苗中毒力最强的毒株,易引起动物机体毒力过高有关[19]。A19-VirB12株标记疫苗缺失了VirB12毒力基因,免疫保护力与亲本株A19无显著差异,但毒力减弱[20-21]。应用NH-AGID方法检测A19-VirB12株免疫牛血清效果较为理想,NH抗体检出率为5.6%,LPS抗体检出率为78.7%。免疫地区血清NH抗体平均检出率达17.8%。
4 结 论
建立NH-AGID方法检测稳定,重复性好,具有较高的特异性。在免疫地区可应用NH-AGID方法鉴别区分牛、羊布病感染动物和免疫动物。先用常规布病血清学方法进行初筛,初筛阳性血清再用NH-AGID方法进行鉴别诊断。
参考文献(References)
[1]赵婷婷, 赵世刚, 苏霄, 等. 神经型布鲁氏菌病的发病机制、诊断方法及预防[J]. 中国人兽共患病学报, 2020, 36(6): 503-508.
ZHAO Tingting, ZHAO Shigang, SU Xiao, et al. Pathogenesis, diagnosis and prevention of neuropathic brucellosis[J]. Chinese Journal of Zoonoses, 2020, 36(6): 503-508.
[2] Lai S J, Zhou H, Xiong W Y, et al. Changing epidemiology of human brucellosis, China, 1955-2014[J]. Emerging Infectious Diseases, 2017, 23(2): 184-194.
[3] Nurpeisova A K, Kolomeietz A N. The perspectives of studying of polymorphism of genes of gamma-interferon under chronic brucellosis[J]. Klinicheskaia Laboratornaia Diagnostika, 2016, 61(2): 110-113.
[4] 汪洁英, 宁博, 景伟, 等. 布鲁氏菌病及其在我国的防控现状与建议[J]. 中国兽医科学, 2022, 52(12): 1578-1585.
WANG Jieying, NING Bo, JING Wei, et al. Research progress and suggestions regarding on the prevention and control of brucellosis in China: a review[J]. Chinese Veterinary Science, 2022, 52(12): 1578-1585.
[5] 刘志国, 王妙, 崔步云, 等. 布鲁氏菌胞内存活及疫苗研究进展[J]. 中国人兽共患病学报, 2019, 35(5): 430-439.
LIU Zhiguo, WANG Miao, CUI Buyun, et al. Brucella intracellular survival and vaccine research progress[J]. Chinese Journal of Zoonoses, 2019, 35(5): 430-439.
[6]景志刚, 严家瑞, 范伟兴. 布鲁氏菌病疫苗研究进展[J]. 中国人兽共患病学报, 2016, 32(2): 188-199.
JING Zhigang, YAN Jiarui, FAN Weixing. Research progress of brucellosis vaccines[J]. Chinese Journal of Zoonoses, 2016, 32(2): 188-199.
[7] 朱一帆, 陈颖钰, 胡长敏, 等. 我国牛重要传染病流行现状和防控建议[J/OL]. 华中农业大学学报, 2022: 1-8.
ZHU Yifan, CHEN Yingyu, HU Changmin, et al. Epidemiological status and prevention and control suggestion of important bovine infectious diseases in China[J/OL]. Journal of Huazhong Agricultural University, 2022: 1-8.
[8] Marín C M, Moreno E, Moriyón I, et al. Performance of competitive and indirect enzyme-linked immunosorbent assays, gel immunoprecipitation with native hapten polysaccharide, and standard serological tests in diagnosis of sheep brucellosis[J]. Clinical and Diagnostic Laboratory Immunology, 1999, 6(2): 269-272.
[9] Jones L M, Berman D T, Moreno E, et al. Evaluation of a radial immunodiffusion test with polysaccharide B antigen for diagnosis of bovine brucellosis[J]. Journal of Clinical Microbiology, 1980, 12(6): 753-760.
[10] 景添, 王天星, 陈曦, 等. 羊布鲁氏菌病及其国内外防控净化措施[J]. 动物医学进展, 2022, 43(2): 116-120.
JING Tian, WANG Tianxing, CHEN Xi, et al. Control and eradication of brucellosis in goats and sheep: experiences learned from China and other countries[J]. Progress in Veterinary Medicine, 2022, 43(2): 116-120.
[11] 张军, 黄宇翔, 王志强, 等. 影响琼脂扩散试验因素分析[J]. 畜禽业, 2019, 30(8): 14.
ZHANG Jun, HUANG Yuxiang, WANG Zhiqiang, et al. Analysis of factors affecting agar diffusion test[J]. Livestock and Poultry Industry, 2019, 30(8): 14.
[12] 王金涛, 陈国福, 刘光前. 动物布鲁氏菌病免疫学诊断方法研究进展[J]. 现代化农业, 2022,(1): 2-4.
WANG Jintao, CHEN Guofu, LIU Guangqian. Research progress on immunological diagnosis methods of animal brucellosis[J]. Modernizing Agriculture, 2022,(1): 2-4.
[13] Bundle D R, Cherwonogrodzky J W, Perry M B. Characterization of Brucella polysaccharide B[J]. Infection and Immunity, 1988, 56(5): 1101-1106.
[14] Aragón V, Díaz R, Moreno E, et al. Characterization of Brucella abortus and Brucella melitensis native haptens as outer membrane O-type polysaccharides independent from the smooth lipopolysaccharide[J]. Journal of Bacteriology, 1996, 178(4): 1070-1079.
[15] 梅建军, 石慧英, 王兴龙. 布鲁氏菌表面抗原研究进展[J]. 动物医学进展, 2005, 26(10): 13-18.
MEI Jianjun, SHI Huiying, WANG Xinglong. Progress on surface antigens of Brucella spp[J]. Progress In Veterinary Medicine, 2005, 26(10): 13-18.
[16] Forsyth J R L. Joint FAO/WHO expert committee on brucellosis joint FAO/WHO expert committee on brucellosis. World Health Organization, Geneva, 1986. ISBN 92-4-120740-X, pp. 132. US$10.80[J]. Pathology, 1987, 19(4): 437.
[17] 杨珍, 尼博, 田莉莉, 等. 半抗原-琼脂扩散试验鉴别布鲁氏菌感染抗体和S2、Rev.1免疫抗体的研究与应用[J]. 中国人兽共患病学报, 2017, 33(2): 126-130.
YANG Zhen, NI Bo, TIAN Lili, et al. Application of native hapten-gel diffusion test in differential diagnosis of Brucella-infected antibody and S2 or Rev.1-vaccinated antibody[J]. Chinese Journal of Zoonoses, 2017, 33(2): 126-130.
[18] Forsyth J R L. Joint FAO/WHO expert committee on brucellosis[J]. Pathology, 1987, 19(4): 437.
[19] 孙晶晶, 吴锦艳, 曹小安, 等. 布鲁氏菌S2、M5及A19疫苗免疫羊抗体消长规律研究[J]. 中国预防兽医学报, 2020, 42(3): 287-292.
SUN Jingjing, WU Jinyan, CAO Xiaoan, et al. Study on the growth and decline of antibody against Brucella S2, M5 and A19 vaccine in immunized sheep[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(3): 287-292.
[20] 易新萍, 谷文喜, 吴冬玲, 等. 流产布鲁氏菌疫苗A19-ΔVirB12突变株生物学特性研究[J]. 中国人兽共患病学报, 2013, 29(9): 836-840.
YI Xinping, GU Wenxi, WU Dongling, et al. Biological characteristics of vaccine candidate A19-ΔVirB12 mutant strain of Brucella abortus[J]. Chinese Journal of Zoonoses, 2013, 29(9): 836-840.
[21] 易新萍, 叶锋, 姚刚, 等. 牛布鲁氏菌A19突变株的构建及在BALB/c鼠中的免疫保护评估[J]. 微生物学报, 2013, 53(11): 1213-1220.
YI Xinping, YE Feng, YAO Gang, et al. Construction of Brucella abortus A19-Δ VirB12 mutant and evaluation of its protective efficacy against 2308 strain challenge in BALB/c mice[J]. Acta Microbiologica Sinica, 2013, 53(11): 1213-1220.
Establishment and application of natural hapten agar diffusion
test for brucella
LIU Liya1, YAN Wenliang2, CAO Rui3, YE Feng1, MA Xiaojing1, GU Wenxi1, ZHAO Jiangshan4,
ZHANG Zirong5, SONG Jie6, LI Yan2, YI Xinping1
(1.Xinjiang Key Laboratory of Animal Infectious Diseases, Institute of Veterinary Medicine, Xinjang Academy of Animal Sciences, Urumqi 830011,China; 2. The General Station of Animal Husbandry and Veterinary of Xinjiang Production and Construction Corps, Urumqi 830021, China ;3.Qingdao Real Bio-Technology Co., Ltd, Qingdao Shandong 266000, China ;4. Centre for Disease Control and Prevention of Xinjiang Uygur Autonomous Region, Urumqi 830000,China; 5. Animal Husbandry and Veterinary Work Station of the Sixth Division, Xinjiang Production and Construction Corps, Wujiaqu Xinjiang 831304,China;6.Xinjiang Tianrun Dairy limited Co.,Ltd, Urumqi 830000, China)
Abstract:【Objective】 To establish and optimize the natural hapten agar gel immuno-diffusion test (NH-AGID) for Brucella abortus in clinical samples.
【Methods】 The NH-AGID method was established to evaluate the specificity, sensitivity and reproducibility of the method; 2,287 bovine and sheep sera from immunized areas and 252 from non-immunized areas were tested.
【Results】 The NH-AGID method with stable and reproducible assay and high specificity was successfully established; The sensitivity of the assay for naturally infected positive animals was lower than 80%; The sensitivity of the assay for releasing animals was higher than 90%; The threshold for detecting bruclosis-positive antibodies was higher than RBT. The average detection rate of serum NH antibodies in immunized areas was 17.8%, and the average detection rate of LPS antibodies was 52.3%; the average detection rate of serum NH antibodies in non-immunized areas was 40.9%, and the average detection rate of LPS antibodies was 54.8%.
【Conclusion】 The NH-AGID method can be applied to identify and distinguish bovine and sheep brucellosis-infected animals from immunized animals in immunized areas. Animals detected with NH antibodies in the active or excretory phase of Brucella abortus are brucellosis-infected animals and should be removed from the herd in time.
Key words:brucellosis; native hapten-agar gel immuno diffusion; diagnosis
Fund projects:Key Ramp;D Special Project of Xinjiang Uygur Autonomous Region" (2022B03013-1) ;The Project of Tackling Hard-Nut Problems in Science and Technology of XPCC (2020AB015)
Correspondence author:YI Xinping(1970-), female, from Gongan, Hubei, PhD, researcher, research direction: animal disease prevention and control research, (E-mail)821489803@qq.com
LI Yan(1966-), male, from Shandong, researcher,Master's supervisor, research direction: animal disease prevention and control, (E-mail)bt4641862@ 163.com
