T1、T2期乳腺癌腋窝淋巴结转移的危险因素及预测模型的构建
2024-12-04司璐意沙胜楠梅海军



[摘" "要]" "目的:根据乳腺癌患者的临床资料及影像报告评估患者腋窝淋巴结转移的危险因素,并构建风险评分模型来筛选适合前哨淋巴结活检术的乳腺癌人群。方法:收集自2020年5月—2021年5月于南通大学附属医院接受单侧乳腺癌改良根治术的353例女性乳腺癌患者的临床资料和影像报告,包括:患者的年龄、BMI、肿瘤位置、肿瘤直径、多灶性、超声特征(形态,边界,钙化,血流信号,超声腋窝淋巴结状态)及钼靶腋窝淋巴结状态,根据是否发生腋窝淋巴结转移分为转移组(n=123)和非转移组(n=230)。采用单因素Cox分析和二元Logistic回归分析确定乳腺癌转移的相关危险因素并构建风险评分模型,利用Bootstrap抽样进行内部验证。通过收集2021年6月—2022年1月在南通大学附属医院行单侧乳腺癌改良根治术的128例患者的临床资料及影像报告建立验证集,判断该风险评分模型的合理性。结果:单因素Cox分析显示转移组和非转移组中肿瘤直径、肿瘤形态、多灶性、超声腋窝淋巴结状态及钼靶腋窝淋巴结状态均有统计学意义(均Plt;0.05)。二元Logistic回归分析显示肿瘤直径、多灶性、超声腋窝淋巴结状态及钼靶腋窝淋巴结状态是女性乳腺癌患者发生腋窝淋巴结转移的独立危险因素,并根据多因素结果构建预测模型,预测腋窝淋巴结转移的模型曲线下面积为0.823(95%CI:0.778~0.868,Plt;0.001)。结论:根据乳腺癌患者的临床资料和影像报告构建的预测模型可较好地预测乳腺癌腋窝淋巴结是否发生转移。
[关键词]" "乳腺癌;腋窝淋巴结转移;超声检查;钼靶;预测模型
[中图分类号]" "R737.9" " " " " " " "[文献标志码]" "B" " " " " " " "[文章编号]" "1674-7887(2024)04-0384-05
2020年,乳腺癌取代肺癌成为全球癌症发生的最主要原因,平均每年有超过200万新增病例,占所有癌症病例的11.7%[1]。在女性肿瘤中,乳腺癌发病率占比gt;30%,是威胁女性健康的第一元凶[2]。淋巴转移是乳腺癌最常见的转移途径,腋窝淋巴结(axillary lymph node, ALN)是最早的转移部位,也是乳腺癌最重要的转移途径[3],且ALN状态在很大程度上决定了患者的手术方式及后期化疗方案,最终影响患者的生存预后。乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy, SLNB)是一项评估ALN转移与否的活检技术[4],前哨淋巴结阴性的患者可避免非必要腋窝淋巴结清扫术(axillary lymph node biopsy, ALNB),显著减少手术创伤及并发症,保障了患者的生活质量。然而,针对临床ALN阴性(cN0)患者是否需要行SLNB,其评估方式多种多样,本研究旨在建立一个简明的评估方式,能较好地预测患者的ALN情况,提高其临床实用价值。一项为期10年的乳腺癌登记数据[5]显示,762例超声ALN阴性的T1、T2期患者的ALN阳性率为23.1%,意味着gt;3/4的患者ALN未发生转移。此外,临床工作中经乳腺B超和钼靶诊断为cN1的乳腺癌患者,术后病理报告也有部分显示淋巴结转移阴性,这导致患者承受了更大的手术创伤,术中术后的血管神经损伤、切口感染和淋巴水肿的发生率也明显提高。因此,仅依据ALN触诊和影像报告,并不能实现ALN状态和腋窝术式的精准匹配。因此,本研究期望根据患者的术前临床资料和影像报告建立一个有价值的ALN预测模型,为SLNB筛选更为合适的患者。本研究回顾性分析南通大学附属医院353例乳腺癌患者的临床资料以及影像报告,总结其可能发生ALN转移的危险因素,并基于此建立了风险评分模型,同时利用Bootstrap抽样进行模型的内部验证。随后,该模型被应用于2021年6月—2022年1月在南通大学附属医院行单侧乳腺癌改良根治术的128例患者作为外部验证。
1" "资料与方法
1.1" "一般资料" "收集2020年5月—2022年1月在南通大学附属医院首次进行单侧乳腺癌改良根治术手术的患者。排除标准:(1)乳房手术或腋窝手术史;(2)接受新辅助治疗;(3)病理诊断为炎性乳癌;(4)临床数据不完整。最终,本研究共纳入符合条件的乳腺癌患者481例,其中2020年5月—2021年5月353例患者纳入训练集,2021年6月—2022年1月128例患者纳入验证集。
1.2" "研究方法" "通过研究乳腺癌患者临床特征和影像资料,分析发生ALN转移的风险因素,包括:钼靶ALN状态、超声ALN状态、单多病灶、肿瘤直径、边界、肿瘤位置、形态、钙化灶、BMI、血流信号及年龄等。对于临床特征,根据身高和体质量计算BMI公式,并根据中国WHO的成人肥胖标准将参与者分为正常组,肥胖组(BMI≥24 kg/m2)。
所有患者术前均行乳腺彩色多普勒超声检查及乳腺钼靶检查,每例患者的超声和钼靶检查报告均由两位影像科医师共同判读,当两位医师作出的判断不一致时,将会由1名经验丰富的上级医师作出决断。所有患者术后肿瘤标本及ALN组织标本由两位经验丰富的病理学医师进行交叉检查,并由1名上级病理医师进行审核。一侧乳房发生两个及以上的病灶被定义为多病灶。乳腺癌按腋窝的位置分为外侧(腋窝同侧)、内侧(腋窝对侧)。当患者为多病灶乳腺癌时,选择较大的瘤体,依据实体瘤疗效评估标准(response evaluation criteria in solid tumors, RECIST),采用单径测量法测量肿瘤纵横两个方向的最长径定义为肿瘤最大直径,即为肿瘤直径。
1.3" "统计学方法" "所有数据均采用SPSS 26.0、GraphPad Prism9.0及R 4.4.2软件软件进行数据分析。连续变量表示为■±s,分类变量表示为n(%)。使用t检验及χ2检验或Fisher精确检验对两组患者基线特征进行比较。在单因素Cox分析中,筛选出前哨淋巴结(sentinel lymph node, SLN)转移的潜在危险因素(Plt;0.05)被纳入二分类Logistic回归,分析出预测ALN转移的独立危险因素(Plt;0.05)。根据各变量的回归系数β×2的取值方式建立评分系统,按照4舍6入5看后原则,换算成相应的分值,总分等于各变量得分之和。根据每位患者的ALN转移风险评分,绘制ROC曲线,计算AUC和95%CI。使用Bootstrap法进行内部验证,从原始数据中重复抽样1 000次,对C-index指数进行校正。Hosmer-Lemeshow拟合优度统计用于评估模型的可靠性。根据ROC曲线,ALN转移的风险分为低风险组和高风险组。根据SLN转移的风险评分从小到大分层,确定SLN转移的低风险组和高风险组的边界值。
2" "结" " " 果
2.1" "ALN转移的单因素分析" "训练集353例患者中,ALN阳性123例(34.8%),ALN阴性230例(65.2%),年龄28~91岁,平均55.88岁;均接受单侧ALNB。单因素分析显示肿瘤直径、肿瘤形态、钼靶ALN状态、多灶性、超声ALN状态是ALN转移的潜在预测因子(Plt;0.05,表1)。
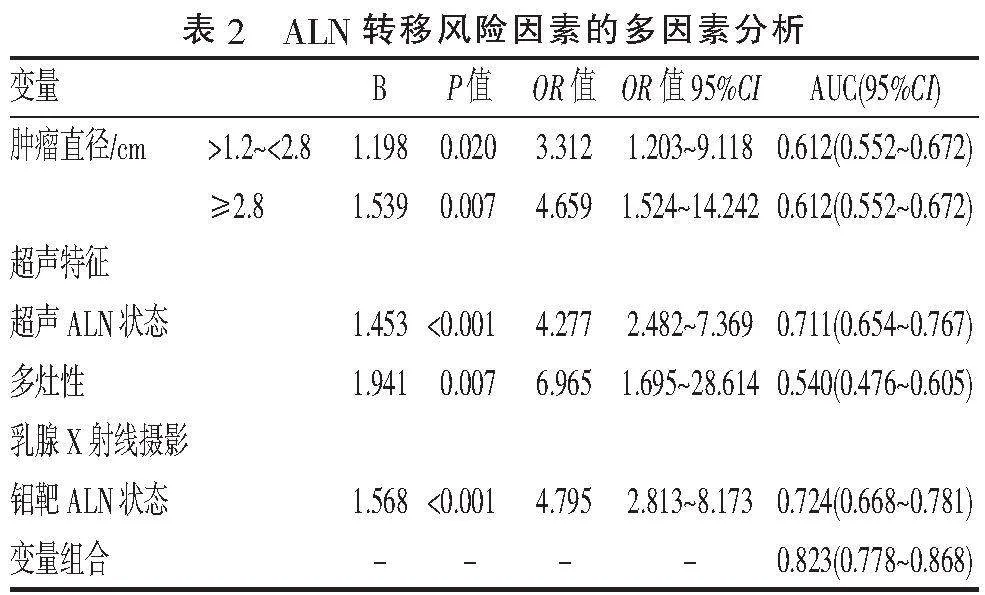
2.2" "影响腋窝ALN转移的多因素分析" "多因素Logistic回归分析结果显示,肿瘤直径、多灶性、钼靶ALN状态、超声ALN状态是ALN转移的独立危险因素(Plt;0.05,表2),并采用森林图的形式直观地展示了各独立危险因素的相对危险度(图1)。
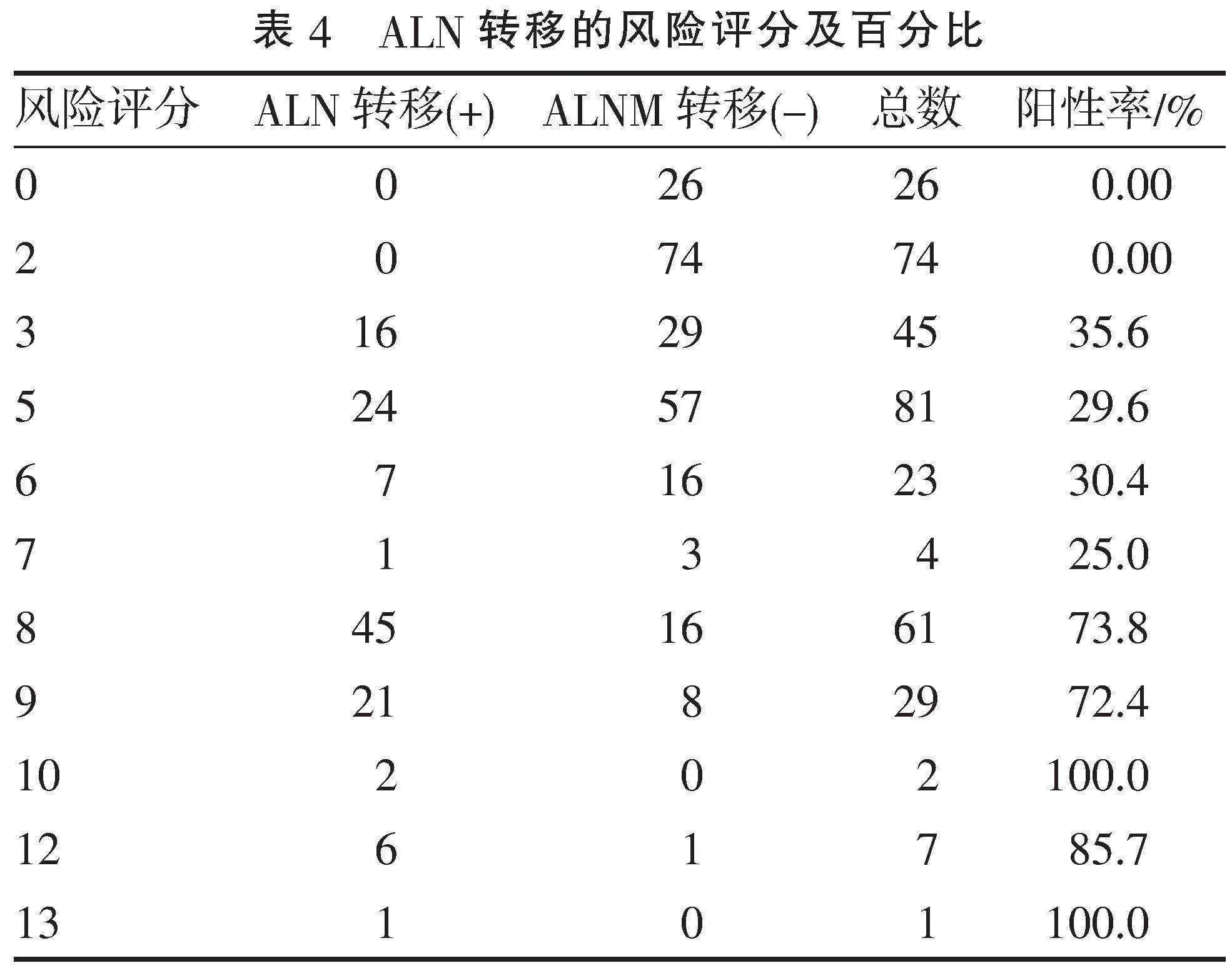
2.3" "建立评分系统" "根据各变量的回归系数β值建立评分系统,得分范围为0~13分(表3)。在接受SLNB的353例中,有SLN转移60例(26.8%)。研究人群风险评分显示,得分为7分的SLN的转移率为25.0%,得分为8分的SLN的转移率为73.8%(表4)。因此,0~7分被定义为低风险,8~13分被定义为高风险。
2.4" "评分系统模型的有效性评估" "根据每个参与者的SLN转移风险评分,绘制SLN转移风险评分系统的ROC曲线,AUC为0.823(95%CI:0.778~0.868)(图2A),Kappa值为0.593(95%CI:0.340~0.846,Plt;0.001),具有中等强度的一致性,表明该评分系统具有较好的预测能力。Hosmer-Lemeshow拟合优度检验结果为0.259,表明Logistic回归模型的拟合优度良好(Pgt;0.05)。当对不同风险患者进行分类(即≥8分被判断为SLN转移患者),根据评分系统的判断方法进一步分析检测结果。计算相应的敏感度、特异度分别为60.1%、89.1%。
2.5" "评分系统有效性的内部验证及外部验证" "首先,采取内部验证的方式,利用Bootstrap抽样产生的新样本对预测模型的准确性进行检验,重复抽样内部验证校正后C-index指数为0.808,校正曲线显示该模型的预测结果与实际结果之间具备较好的一致性(图2B)。验证集128例中,ALN阳性43例(33.6%),ALN阴性85例(66.4%),年龄27~87岁,平均57.44岁。将验证集患者的临床数据参数代入已建立的模型中,并根据相关危险因素评估每位患者的ALN转移概率,即为危险评分。以术后病理作为金标准,所得的ROC曲线的AUC为0.755(95%CI:0.662~0.848,Plt;0.001)(图2C)。
3" "讨" " " 论
随着对乳腺肿瘤机制理解的不断改变,乳腺癌腋窝术式也在不断改良,旨在提供更好的肿瘤治疗和提高患者的生存质量[6-7]。乳腺癌患者ALN情况对于制定治疗方案和评估肿瘤预后具有重要参考价值[8]。随着乳房体检的日益常态化,早期乳腺癌的患病率不断增加,ALN阴性乳腺癌占新发病例的半数以上[9]。X.F.WANG等[10]对2 250例接受SLN清扫术乳腺癌患者分析,发现72.13%(1 623/2 250)的患者ALN阴性,这与本研究收集的数据相似,ALN阴性的比例在训练集为65.2%(230/353),在验证集为66.4%(85/128)。真实世界数据[11]显示,尽管大多早期乳腺癌患者病理结果并未显示ALN转移,但是T1、T2期乳腺癌患者接受SLNB的比例却不足50%,部分原因在于根据腋窝触诊和影像资料,患者已被评估为临床ALN阳性(cN1)。根据收集的训练集资料,117例经超声或(和)钼靶评估为cN1的患者,术后病理为pN0。事实上,这些患者原本有机会进行SLNB。因此,本研究评估所建立的模型能否无创预测ALN转移,进一步使医疗资源分配精准化,筛选出最合适的SLNB候选人,提高患者的生存质量。
乳腺癌ALN的转移与多种因素密切相关。在本研究的预测模型中,肿瘤直径是预测ALN转移的独立危险因素之一,这在各类研究预测模型[12-13]中也得到了一致认可,肿瘤直径在一定程度上可以预估ALN转移的数量。根据临床经验,肿瘤原发病灶越大,邻近淋巴导管的受累范围也越大,发生腋窝转移甚至远处转移的概率就会增加。此外,肿瘤的形状也反映了肿瘤的生长特征,较为光滑的圆形肿块往往生长缓慢,偏向良性或低度恶性,而不规则形状的肿块往往具备低分化肿瘤浸润性生长的特点[14]。肿瘤原发病灶形态不规则或呈“毛刺征”多提示肿瘤细胞的高侵袭性。本研究数据表明,肿瘤形状是ALN转移的危险因素。
随着我国经济的发展,乳房X线造影开始普及[15]。关于乳房X线预测ALN转移的报道较少,在本研究训练集中,乳房X线下ALN阳性预测ALN转移的AUC为0.724(95%CI:0.668~0.781),具有较好的预测能力。近年来,多普勒彩色超声技术不断更新完善,相较于乳房X线具有便携方便,无放射性且肿瘤检测不受肿块密度限制等优点,有助于提高乳腺癌的筛检率[16]。乳腺ALN超声检测包括腋窝淋巴结门、皮质髓质的厚度和清晰度以及淋巴结纵横比等,但由于超声医师的主观性较强,因此本研究并未采用,而是选择客观性较强、较易分辨的ALN状态(阳性、阳性)进行分类。然而,在常规超声预测为SLN阴性的受试者中,21%的淋巴结在SLNB后呈阳性[9],说明仅依靠乳房X线和超声等影像检查进行ALN转移的预测是不够的,需要结合临床资料进行综合评估。
围绕乳腺癌多灶性,临床一直聚焦于能否进行乳癌保乳手术[17-18]或SLN清扫术[19]。本研究Logistic分析显示多灶性是乳腺癌ALN转移的独立危险因素。既往研究[20]也证实了相较于单灶乳腺癌,多灶乳腺癌具有更高的淋巴结转移率、Ki67增殖指数以及雌激素受体阳性率等特征。多灶性乳腺癌具有发病年龄早,肿瘤体积大和预后更差的特点,且多灶性乳腺癌的腋窝转移倾向明显高于单病灶的乳腺癌患者[21-22]。此外,单灶和多灶乳腺癌在基因表达层面也存在较大差异,且差异表达基因主要表现在细胞因子-受体相互作用,以及跨化学突触、神经系统的传递上,微阵列分析显示多灶性乳腺癌患者的BRCA2、ABCC11、PRODH等基因显著过表达[23-24]。
本研究联合应用超声、钼靶影像报告及临床资料,构建预测模型来预测乳腺癌ALN转移,分析结果显示肿瘤直径、多灶性、超声ALN状态及钼靶ALN状态是ALN转移的独立危险因素,联合模型预测乳腺癌ALN转移的效能高于任一单一因素,且与病理结果的一致性尚可,Kappa值=0.593(95%CI:0.340~0.846,Plt;0.001),具有中等强度的一致性。综上,基于上述危险因素建立的风险评分模型对预测T1、T2期乳腺癌ALN转移具有较好的准确性,对术前ALN状态的评估具有一定的预测价值。本研究的主要局限在于单中心而非多中心回顾性研究,且样本数据量较小。未来,希望可以基于大数据背景下的多中心研究样本来进一步验证。
精准医学时代下,乳腺癌的外科决策治疗也必须要求个体化,期望根据乳腺癌影像特征及临床资料构建Logistic回归模型可以较好的预测乳腺癌患者ALN转移情况,更加有效地筛选出乳腺癌ALN转移的高危和低危人群,为术前制定手术方案提供重要参考。
[参考文献]
[1]" "SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249.
[2]" "SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1):7-30.
[3]" "YANG C M, DONG J, LIU Z Y, et al. Prediction of metastasis in the axillary lymph nodes of patients with breast cancer: a radiomics method based on contrast-enhanced com-puted tomography[J]. Front Oncol, 2021, 11:726240.
[4]" "中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2021年版)[J]. 中国癌症杂志, 2021, 31(10):954-1040.
[5]" "KEELAN S, HEENEY A, DOWNEY E, et al. Breast cancer patients with a negative axillary ultrasound may have clinically significant nodal metastasis[J]. Breast Cancer Res Treat, 2021, 187(2):303-310.
[6]" "MAGNONI F, GALIMBERTI V, CORSO G, et al. Axillary surgery in breast cancer: an updated historical perspective[J]. Semin Oncol, 2020, 47(6):341-352.
[7]" "WILLIAMS R T, WINCHESTER D P, YAO K, et al. Who should have or not have an axillary node dissection with breast cancer?[J]. Adv Surg, 2012, 46:1-18.
[8]" "KHAN A, MASROOR I, KHANDWALA K, et al. Utility of ultrasound and mammography in detection of negative axillary nodal metastasis in breast cancer[J]. Cureus, 2020, 12(1):e6691.
[9]" "WANG L N, LI J T, QIAO J H, et al. Establishment of a model for predicting sentinel lymph node metastasis in early breast cancer based on contrast-enhanced ultrasound and clinicopathological features[J]. Gland Surg, 2021, 10(5):1701-1712.
[10]" "WANG X F, ZHANG G C, ZUO Z C, et al. Sentinel lymph node positive rate predicts non-sentinel lymph node metastasis in breast cancer[J]. J Surg Res, 2022, 271:59-66.
[11]" "ZHANG J L, WANG T, YAN C J, et al. Clinical practice status of sentinel lymph node biopsy for early-stage breast cancer patients in China: a multicenter study[J]. Clin Epidemiol, 2020, 12:917-924.
[12]" "NIINIKOSKI L, HUKKINEN K, LEIDENIUS M H K, et al. Axillary nodal metastatic burden in patients with breast cancer with clinically positive axillary nodes[J]. Br J Surg, 2020, 107(12):1615-1624.
[13]" "MERETOJA T J, AUDISIO R A, HEIKKIL P S, et al. International multicenter tool to predict the risk of four or more tumor-positive axillary lymph nodes in breast cancer patients with sentinel node macrometastases[J]. Breast Cancer Res Treat, 2013, 138(3):817-827.
[14]" "GUO Q, DONG Z, ZHANG L, et al. Ultrasound features of breast cancer for predicting axillary lymph node metastasis[J]. J Ultrasound Med, 2018, 37(6): 1354-1353.
[15]" "NYSTRM L, ANDERSSON I, BJURSTAM N, et al. Long-term effects of mammography screening: updated overview of the Swedish randomised trials[J]. Lancet, 2002, 359(9310):909-919.
[16]" "BERG W A, BANDOS A I, MENDELSON E B, et al. Ultrasound as the primary screening test for breast cancer: analysis from ACRIN 6666[J]. J Natl Cancer Inst, 2016, 108(4):djv367.
[17]" "LIM W, PARK E H, CHOI S L, et al. Breast conserving surgery for multifocal breast cancer[J]. Ann Surg, 2009, 249(1):87-90.
[18]" "WINTERS Z E, HORSNELL J, ELVERS K T, et al. Systematic review of the impact of breast-conserving surgery on cancer outcomes of multiple ipsilateral breast cancers[J]. BJS Open, 2018, 2(4):162-174.
[19]" "MOODY L C, WEN X F, MCKNIGHT T, et al. Indications for sentinel lymph node biopsy in multifocal and multicentric breast cancer[J]. Surgery, 2012, 152(3):389-396.
[20]" "LANG Z, WU Y, LI C, et al. Multifocal and multicentric breast carcinoma: a significantly more aggressive tumor than unifocal breast cancer[J]. Anticancer Res, 2017, 37(8):4593-4598.
[21]" "DURAKER N, CAYNAK Z C. Axillary lymph node status and prognosis in multifocal and multicentric breast carcinoma[J]. Breast J, 2014, 20(1):61-68.
[22]" "PANUA A, RADU I, GAFTON B, et al. Multiple versus unifocal breast cancer: clinicopathological and immunohistochemical differences[J]. Rev Roum De Morphol Embryol, 2019, 60(1):103-110.
[23]" "MCCRORIE A D, ASHFIELD S, BEGLEY A, et al. Multifocal breast cancers are more prevalent in BRCA2 versus BRCA1 mutation carriers[J]. J Pathol Clin Res, 2020, 6(2):146-153.
[24]" "LANG Z Q, WU Y Q, PAN X B, et al. Study of differential gene expression between invasive multifocal/multicentric and unifocal breast cancer[J]. J BUON, 2018, 23(1):134-142.
