缓释BMP-2透明质酸-肝素支架的制备及其对牙髓干细胞分化的研究
2024-12-04邱滢夏鸿吴凯鹏黄天意


[摘" "要]" "目的:为了使透明质酸(hyaluronic acid, HA)具备负载和释放生长因子的能力,设计制备透明质酸-肝素(hyaluronic acid-heparin, HA-Hep)支架作为骨形态发生蛋白2(bone morphogenetic protein 2, BMP-2)缓释载体,并探讨其对牙髓干细胞(dental pulp stem cells, DPSCs)成牙本质分化的影响。方法:化学方法制备不同投料比HA-Hep材料。通过傅立叶变换红外光谱与元素分析技术表征肝素与HA的接枝位点、效率等特点。扫描电镜观察该材料微观形态和结构特点。借助静电吸附法将BMP-2加载至HA-Hep,并测绘其释放曲线。通过测定DPSCs增殖情况评价该材料的生物相容性。qPCR检测成牙分化相关基因的表达水平,评估HA-Hep负载BMP-2对DPSCs成牙分化的影响。结果:HA-Hep微观呈疏松多孔网状结构,能够缓释BMP-2达28 d,且释放速率随材料肝素含量比例的增加呈减缓趋势。HA-Hep对DPSCs增殖有促进作用,且与材料浓度呈正相关;qPCR结果表明,与对照组相比,载BMP-2的HA-Hep材料组牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)、Ⅰ型胶原蛋白(typeⅠcollagen, Col-1)和牙本质基质蛋白-1(dentin matrix protein-1, DMP-1)表达水平在7、14 d均显著升高(均P<0.001)。结论:肝素修饰HA能延缓BMP-2释放,HA-Hep负载BMP-2可上调DPSCs成牙基因(DSPP、Col-1、DMP-1)的表达,有助于生长因子在细胞分化中发挥长期效应。
[关键词]" "透明质酸;肝素;缓释;支架;生长因子;牙髓干细胞
[中图分类号]" "R783.3" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)04-0320-06
Preparation of hyaluronic-heparin scaffold capable of sustainably releasing BMP-2 and the study of its influence on the differentiation of dental pulp stem cells
[Abstract]" "Objective: In order to enable hyaluronic acid(HA) to load and release growth factors, a hyaluronic acid-heparin (HA-Hep)scaffold was designed as a sustained-release carrier for bone morphogenetic protein 2(BMP-2), and the effect of the scaffold on odontogenic differentiation of dental pulp stem cells(DPSCs) was studied. Methods: HA-Hep materials with different ratios were prepared using chemical methods. The connection position and efficiency of heparin and hyaluronic acid were detected by Fourier transform infrared spectroscopy and elemental analysis. The microstructure and structural characteristics of the materials were observed by scanning electron microscope. BMP-2 was loaded into HA-Hep by electrostatic adsorption method, and its release curve was measured and drawn. To evaluate the biocompatibility of HA-Hep by detecting the proliferation of DPSCs. The expression levels of odontogenic differentiation-related genes were detected by qPCR to evaluate the effect of HA-Hep loading BMP-2 on odontogenic differentiation of dental pulp stem cells. Results: Microscopically, HA-Hep showed a loose porous network structure. The release of BMP-2 was sustained for 28 days, and the release rate slowed down with the increase of heparin content. HA-Hep promoted the proliferation of DPSCs was positively correlated with the materials concentration. qPCR results showed that the expression levels of dentin sialophosphoprotein(DSPP), typeⅠcollagen(Col-1), and dentin matrix protein-1(DMP-1) in BMP-2-loaded HA-Hep material group were significantly higher than those in the control group at 7 and 14 days(all Plt;0.001). Conclusion: Heparin-modified HA can delay the release of BMP-2. HA-Hep loaded with BMP-2 can up-regulate the expression of odontoblast genes(DSPP, Col-1, and DMP-1) in DPSCs, which contributes to the long-term effect of growth factors in cell differentiation.
[Key words]" "hyaluronic acid; heparin; slow release; scaffold; growth factor; dental pulp stem cell
因深龋、外伤等导致的牙髓感染是一类口腔常见疾病,目前主要通过根管治疗控制感染、保留患牙[1-2]。但根管治疗后失去生活牙髓的牙齿因丧失感觉、营养等功能而变脆易裂[3]。牙髓再生是一种利用组织工程技术,即应用干细胞、支架和生长因子等重建牙髓与牙本质、根尖周的功能性关联,最终使患牙能够再生牙髓组织的新技术,逐渐成为解决牙髓疾病的治疗策略和研究热点[4-5]。与传统根管治疗相比,牙髓再生可以更有效地促进牙齿的自然修复过程,降低与根管治疗相关的根折或根管再感染的可能性[6]。牙髓再生有望成为传统根管治疗的替代方案,使功能性牙髓得以再生,从而更好地恢复患牙功能。目前,已有研究[7]借助牙髓组织工程技术再生具有神经、血管的牙髓样组织。然而牙髓再生仍然存在挑战,例如支架材料的选择与制备,生长因子易失活、利用率较低等,因此制备功能型支架并有效利用生长因子是牙髓再生成功的关键环节[8]。
透明质酸(hyaluronic acid, HA)是体内天然存在的多糖,是细胞外基质的主要成分之一,在调节组织损伤和修复中起着至关重要的作用[9]。D.ATILA等[10]制备了载有Tideglusib(Td)与人参皂苷Rg1的可注射HA水凝胶系统,经体外研究发现,水凝胶通过释放Td促进牙髓干细胞(dental pulp stem cells, DPSCs)成牙本质分化,通过释放Rg1促进牙髓血管化。HA具有优良的生物相容、生物降解和非免疫原,在牙髓再生的支架制备方面具有巨大潜力,是牙髓组织修复再生的理想生物材料。
生长因子是刺激细胞活动、促进组织修复和再生的信号肽,是组织工程中常用的重要药物之一[11-12]。有研究[13]将牙本质形成诱导因子骨形态发生蛋白2(bone morphogenetic protein 2, BMP-2)或牙本质基质蛋白-1(dentin matrix protein-1, DMP-1)的质粒DNA加载到经过处理的牙本质支架上,快速诱导DPSCs分化为成牙本质细胞,从而重建牙本质-牙髓界面,且表现出与天然组织相似的结构和力学性能。此外,还有学者[14]研究BMP-2促进牙本质形成的分子机制,证实BMP-2通过p38MAPK介导,激活WNT/β-catenin信号通路,从而促进DPSCs的成牙分化和牙本质的形成。可见,生长因子在干细胞诱导与促进牙本质形成方面具有重要作用,但生长因子的突释性、体内稳定性差等特性限制了其应用[15-16],导致再生体系难以维持长期的诱导效果。迄今为止,生长因子的可控和持续输送仍然是一个挑战。因此,构建生长因子原位缓释的载体系统已逐渐成为功能型生物支架制备的目标之一。
肝素是一种高度硫酸化的天然糖胺聚糖,已被证明能与多种蛋白质相互作用,其酸性硫酸盐基团与生长因子碱性结合结构域存在静电吸附作用,具有较高亲和力,可作为载体制备缓释药物[17]。许多生长因子通过与肝素相互作用而与细胞外基质结合,细胞外基质能够保护生长因子免于降解并调节其在组织中的分布[18]。目前,肝素已被广泛应用于生长因子的控制释放与稳定调节[19],但以肝素修饰支架应用于DPSCs分化及牙髓再生的研究尚不多见。
本研究以牙髓天然组分HA为支架主链,借助肝素修饰制备复合支架,选取BMP-2为模型生长因子检测支架缓释情况,并进一步探讨其对DPSCs增殖分化的影响,为牙髓再生制备功能型支架材料提供新思路。
1" "材料与方法
1.1" "试剂与仪器" "HA(山东西亚化学工业有限公司);吗啉乙磺酸(morpholine ethanesulfonic acid, MES)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[1-ethyl -(3-dimethylaminopropyl) carbodiimide hydrochloride, EDC](上海阿拉丁生物试剂有限公司);肝素钠(上海源叶生物科技有限公司);重组人BMP-2(MedChemExpress,美国);重组人BMP-2 ELISA分析试剂(江苏绿叶生物科技有限公司);高糖DMEM液体培养基、FBS(Gibco,美国);MTT试剂盒(Amresco,美国);TRIzol(Takara,中国);Hifair"Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR(Yeasen,中国);引物合成(Takara,中国);HieffTM qPCR SYBR"Green Master Mix(Yeasen,中国);冷冻干燥机(Labconco,美国);傅立叶变换红外光谱仪(Bruker,德国);扫描电子显微镜(JEOL,日本);元素分析仪(Elementar,德国);倒置相差显微镜(OLYMPUS,日本);离心机(Eppendorf,美国);酶标仪(Rayto,美国);MX3005P qPCR system(Agilent,美国)。
1.2" "实验方法
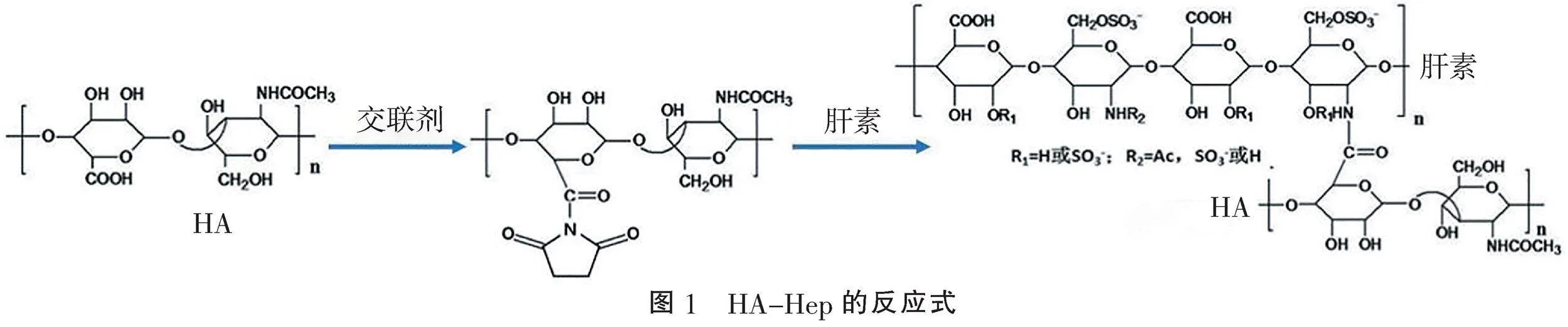
1.2.1" "透明质酸-肝素(hyaluronic acid-heparin, HA-Hep)支架的制备与表征" "设计3种投料比(表1)。将250.0 mg透明质酸溶于50 mL MES缓冲液(pH4.5、0.05 mol/L),先后加入交联剂(142.7 mg NHS、237.7 mg EDC),随后加入对应比例的肝素,室温搅拌过夜,然后渗析纯化3 d,反应式如图1。冻干72 h,得到HA-Hep。
取少量HA、HA-Hep通过傅立叶变换红外光谱仪检测其红外吸光度;通过扫描电子显微镜(scanning electron microscope, SEM)观察HA-Hep冻干样品的微观形态和结构特点;利用元素分析仪测量肝素原材料和HA-Hep材料的硫元素(S)含量,计算各组材料肝素含量。
1.2.2" "DPSCs的分离与培养" "经患者本人知情同意与荆楚理工学院学术诚信与科研伦理委员会审核批准同意(伦理审批号:2024-01-04),选取人新鲜拔除的健康第三磨牙,劈开取髓、剪碎、消化分散后静置培养1周。倒置相差显微镜观察细胞生长至覆盖瓶底面积80%时传代培养,直至P2代备用(图2)。
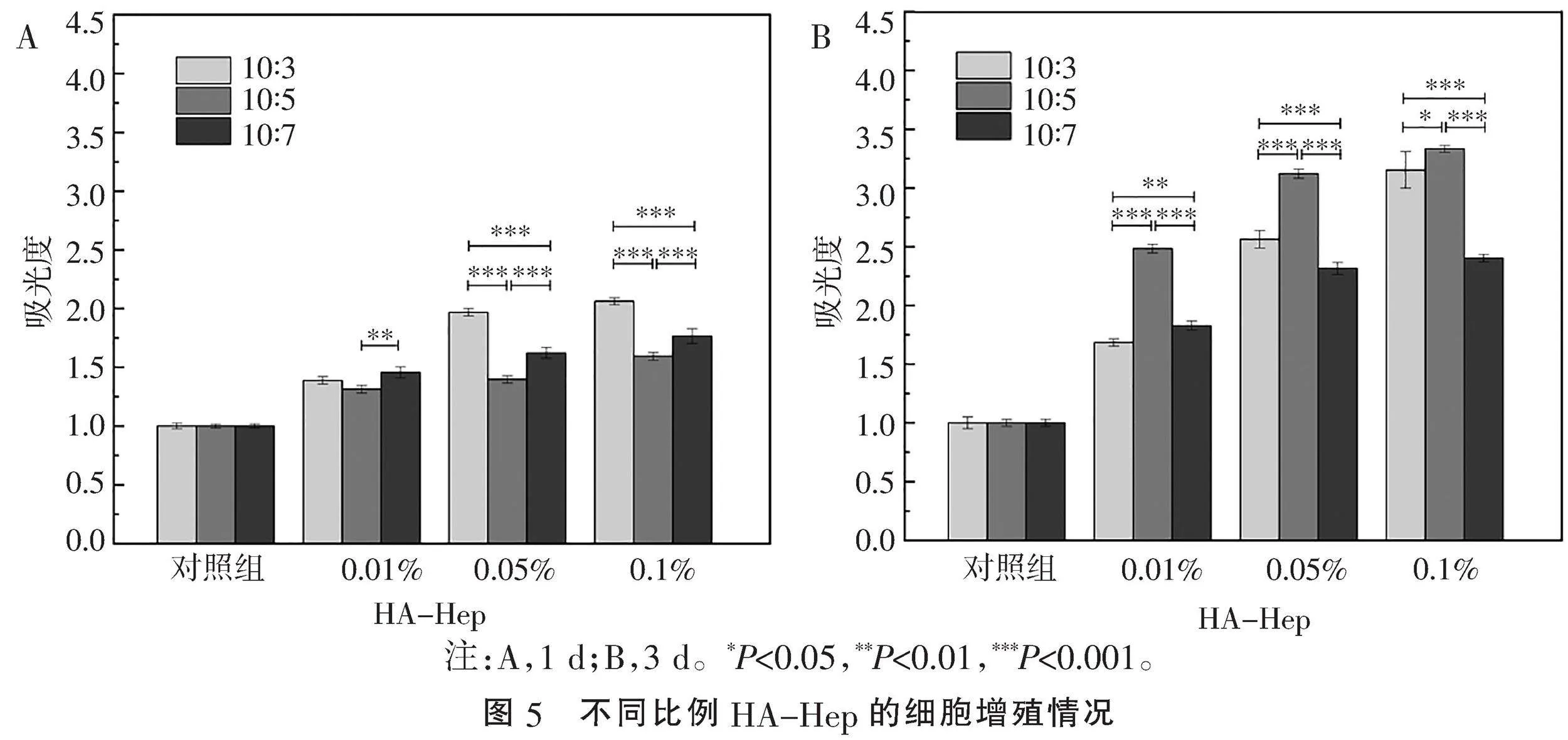
1.2.3" "HA-Hep对DPSCs体外增殖的影响" "称取10 mg不同比例HA-Hep材料,紫外消毒后分别浸泡在10 mL培养基中,得到质量浓度为1 mg/mL(0.1%)的HA-Hep混悬液。为了后续实验在材料浓度筛选与应用方面的需要,将上述0.1%的HA-Hep混悬液再倍比稀释到0.05%、0.01%,37 ℃静置24 h后收集上清液作为HA-Hep条件培养基备用。将P2代DPSCs接种至96孔板(3×103个/孔),对照组用正常培养基,实验组用上述条件培养基,继续培养1、3 d。按照MTT法处理后检测各孔在波长490 nm处的吸光度。
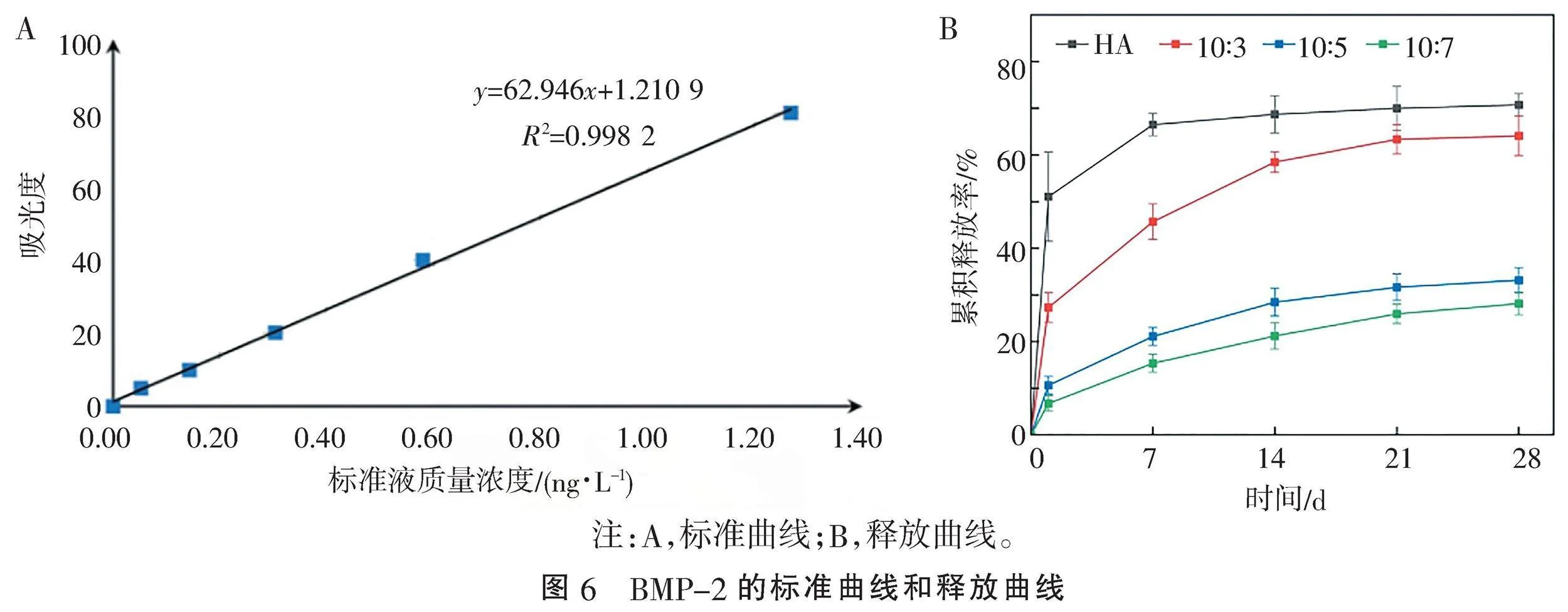
1.2.4" "BMP-2的载入与释放" "称取10 mg HA与不同比例HA-Hep材料,紫外消毒后分别浸泡于1 mL BMP-2溶液(500 ng/mL),12 h后,离心取全部上清留存,沉淀冻干得到负载BMP-2的HA-Hep材料(HA-Hep-BMP-2),将其浸泡于等量PBS溶液中,37 ℃孵育,分别在1、7、14、21、28 d离心(3 000 r/min,10 min)后吸取上清液(500 μL),同时补充等量PBS溶液。最后,用ELISA试剂盒和酶标仪测定上述收集到的上清液和BMP-2标准溶液的吸光度值,绘制标准曲线与释放曲线。
1.2.5" "HA-Hep载BMP-2对DPSCs体外分化的实验" "通过上述初步筛选,选取投料比为10∶5的HA-Hep及相应的HA-Hep-BMP-2进行后续实验。分别称取10 mg HA、HA-Hep、HA-Hep-BMP-2,紫外消毒,同样方法制备浓度为0.1%的条件培养基备用。选取P2代DPSCs接种至6孔板(5×104个/孔),实验组换成上述条件培养基,继续培养7、14 d。选取β-actin为内参基因,利用qPCR技术检测目的基因牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)、Ⅰ型胶原蛋白(typeⅠcollagen, Col-1)和牙本质基质蛋白-1(dentin matrix protein-1, DMP-1)表达结果,数据采用2-ΔΔCt法进行分析。
1.2.6" "统计学方法" "所有实验均进行3次,数据表示为x±s。通过SPSS 22.0软件采用单因素方差分析,P<0.05为差异有统计学意义。
2" "结" " " 果
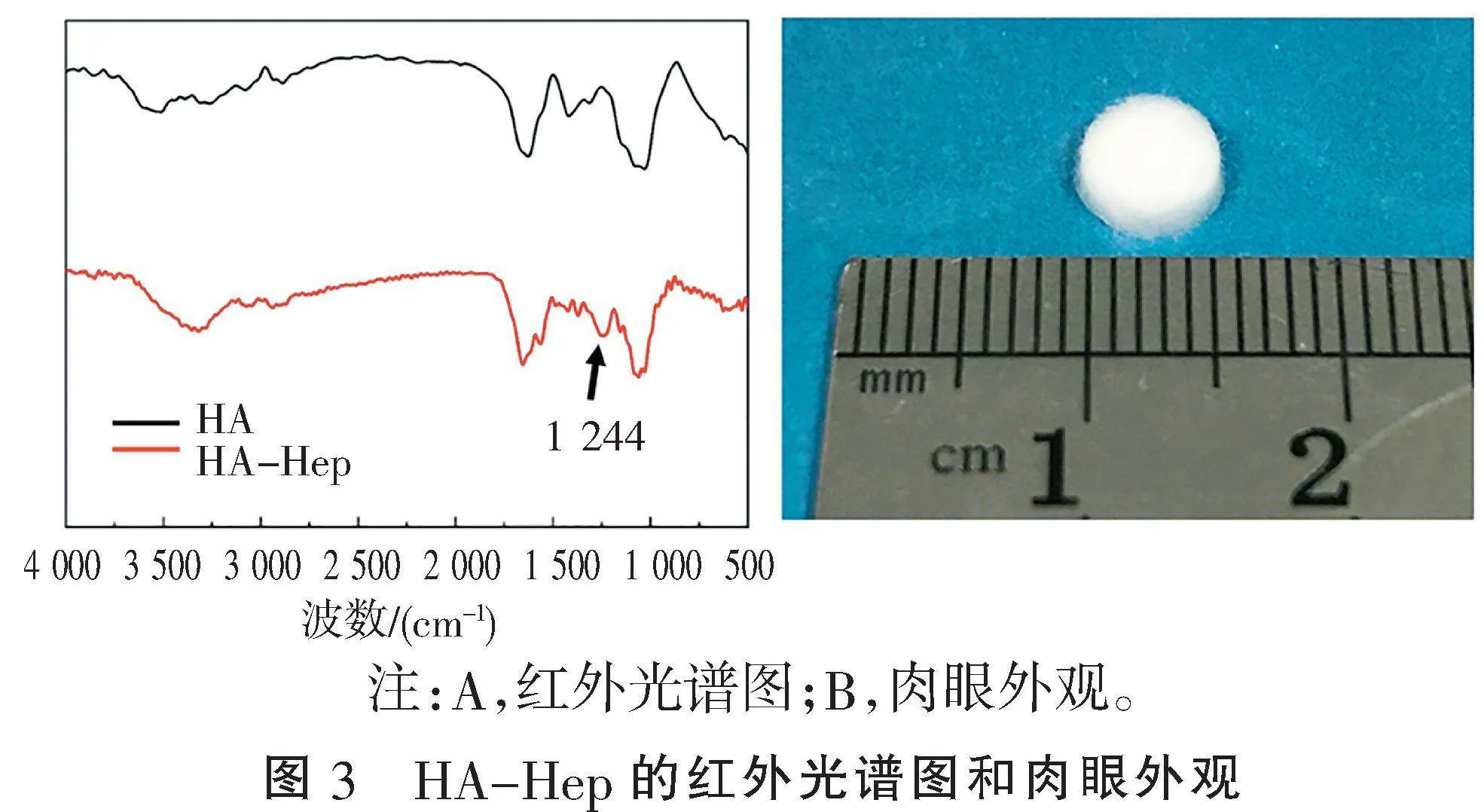
2.1" "获得HA-Hep支架材料" "红外光谱曲线显示,HA-Hep在1 244 cm-1周围存在SO3-拉伸带峰,为肝素分子中SO3-基团,而HA曲线中未发现此峰(图3A),说明肝素成功接枝到HA。肉眼观察HA-Hep材料呈白色扁圆形的海绵样外观(图3B),形态稳定。
扫描电镜观察HA-Hep呈疏松网状结构(图4),其中10∶5和10∶7两组材料可见三维多孔结构,孔隙排布均匀,孔间连通度良好,经ImageJ软件测量上述两组材料的平均孔径分别为(58.07±13.37) μm和(62.96±14.23) μm。
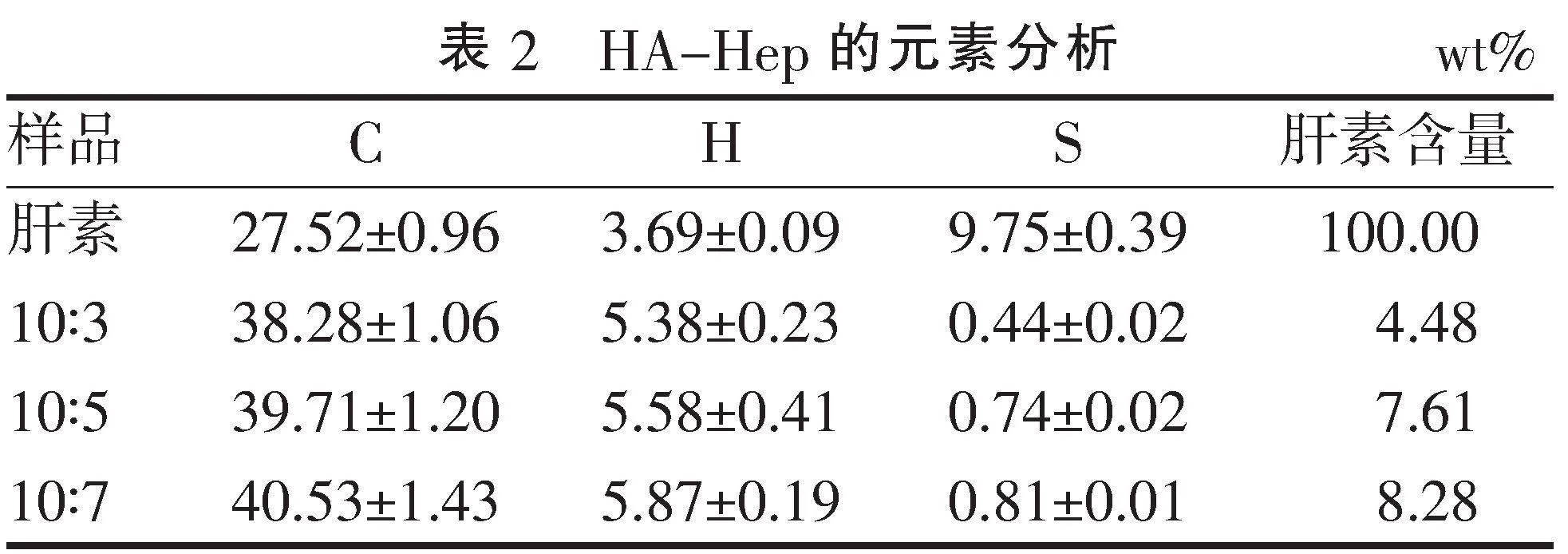
通过元素分析发现,3组材料均检测出S元素,而HA中不含有,说明肝素接枝成功。将原材料的肝素含量定义为100%,计算各组材料肝素含量百分比,其中最高为10∶7组,最低为10∶3组(表2)。
2.2" "HA-Hep材料对细胞体外增殖的影响" "与对照组相比,3组材料在1、3 d对DPSCs增殖均有促进作用,且随各组浓度的升高促进作用逐渐增强,说明HA-Hep对细胞增殖无毒性。观察1 d时,当浓度为0.01%时,10∶7组促进DPSCs增殖效果强于10∶5组(P=0.004),10∶5组与10∶3组差异无统计学意义;当浓度为0.05%与0.1%时,10∶3组促进DPSCs增殖效果均显著强于其他两组(Plt;0.001)。观察3 d时,当浓度为0.01%与0.05%时,10∶5组促进DPSCs增殖效果均显著强于其他两组(Plt;0.001);当浓度为0.1%时,10∶5组的促进作用高于10∶3组(P=0.032),显著高于10∶7组(Plt;0.001)(图5)。可见,3组不同比例相比,随着培养时间的延长,10∶5组对DPSCs的增殖表现出渐强的促进作用。不同浓度相比,3组材料均在高浓度(0.1%)时表现出更强的增殖促进作用。鉴于上述结果综合考虑,预选取比例为10∶5、浓度为0.1%的材料进行后续分化实验。
2.3" "BMP-2的释放" "绘制标准曲线(图6A)和BMP-2释放曲线(图6B),3组材料均表现为缓慢释放曲线,且释放率与肝素含量呈负相关。其中,对照组HA在1 d的释放率为51.06%,存在一定突释,7 d累积释放率达到66.49%,此后释放曲线增长缓慢,28 d释放率为70.73%。
10∶3组在1 d释放率为27.30%,7 d累积释放率达45.68%,14 d释放率达58.47%,此后释放趋于平缓;10∶5和10∶7组1 d释放率分别为10.65%和6.76%,低于HA组与10∶3组的首日释放率,此后释放曲线均呈现缓慢平稳上升之势,28 d累积释放率分别为33.16%和28.15%,均低于10∶3组,总体呈现缓释趋势。
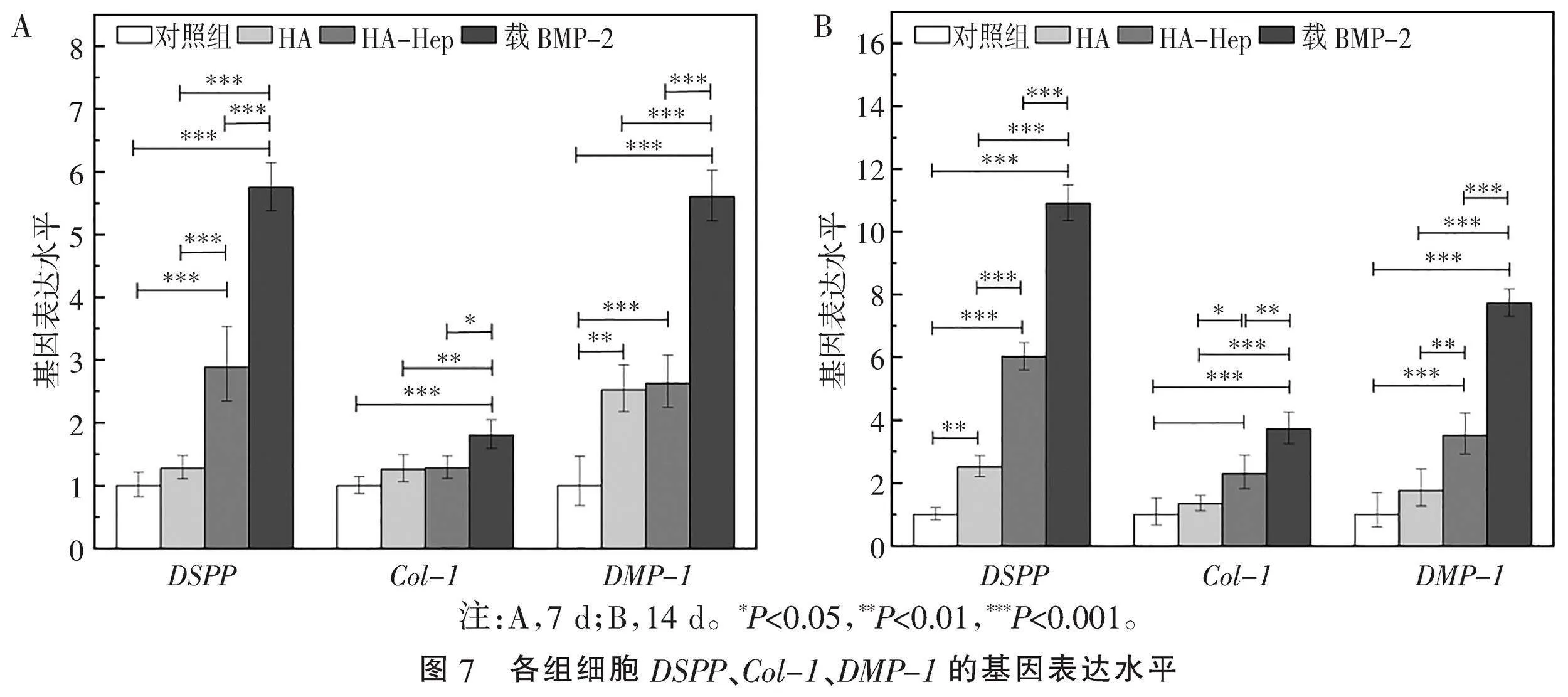
2.4" "载BMP-2的HA-Hep对DPSCs成牙分化的影响" "观察DSPP的表达,载BMP-2组相比于其他3组,在7、14 d均显著上调(Plt;0.001);HA-Hep组在7、14 d均明显高于对照组与HA组(Plt;0.001);HA组在7 d与对照组比较差异无统计学意义,在14 d高于对照组(P=0.002)(图7)。
观察Col-1的表达,载BMP-2组与对照组相比,在7、14 d显著升高(Plt;0.001);与HA-Hep组相比7 d有所升高(P=0.011),14 d明显增高(P=0.003);与HA组相比7 d明显升高(P=0.009),14 d显著升高(Plt;0.001);HA-Hep在7 d与对照组、HA组比较差异无统计学意义,在14 d高于HA组(P=0.02)与对照组(P=0.005);HA组与对照组在7、14 d比较差异均无统计学意义(图7)。
观察DMP-1的表达,载BMP-2组相比于其他3组,在7、14 d均显著上调(Plt;0.001);HA-Hep组在7、14 d均显著高于对照组(Plt;0.001),与HA组7 d比较差异无统计学意义,在14 d高于HA组(P=0.005);HA组相较于对照组在7 d明显增高(P=0.002),在14 d差异无统计学意义(图7)。
3" "讨" " " 论
牙髓组织工程需要干细胞、支架和生长因子的合理搭配与恰当应用,其中生长因子由于生物半衰期短、局部清除快等特性难以长期发挥诱导干细胞定向分化的功能。肝素作为一种高度硫酸化的糖胺聚糖,是由糖醛酸和葡萄糖胺组成的二糖单元,其中含有带大量负电荷的磺酸基团(SO3-),对生长因子带正电荷的氨基酸残基具有强亲和性,可作为载体制备缓释药物[20]。因此本研究以HA为主链,借助交联剂EDC与NHS使HA的羧基(-COOH)与肝素的氨基(-NH2)结合制备HA-Hep复合支架,并探讨该支架作为载体缓释BMP-2的特点及其对DPSCs成牙分化的影响。
BMP-2是一种有效的骨诱导因子,常用于诱导DPSCs的成牙成骨分化,肝素与之结合能使肽因子持续被引入其同源信号受体,进而增强BMP-2生物活性。A.K.JHA等[21]研究发现相同浓度下,高分子量肝素对TGFβ-1的负载量最大、释放最慢。本研究以同等分子量肝素为原料,制备不同肝素含量的HA-Hep材料,结果显示肝素含量较高材料(10∶7组)释放最慢,与上述研究结果有相似之处,由此猜测肝素作为生长因子载体,其分子质量和相对浓度是调节负载效率和释放动力学的关键变量。
DSPP在牙本质钙化过程中参与羟基磷灰石矿物相的成核与控制,作为牙本质非胶原基质蛋白,是牙本质正常矿化的指标,也是成牙分化的重要标志[22]。BMP-2可通过Smads和Runx2等作用调节DSPP的转录激活[23]。Col-1参与调节DPSCs的黏附和扩散,在诱导细胞牙源性分化中起重要作用。DMP-1参与调节磷酸盐稳态,通过调控羟基磷灰石晶体成核影响牙本质矿化,是成牙本质细胞分化的多功能蛋白[24]。本研究HA-Hep组相比于对照组和HA组,DSPP的表达在7、14 d均明显上调(Plt;0.01),Col-1与DMP-1的表达相比于对照组和HA组在14 d也有不同程度上调(Plt;0.05),说明HA-Hep材料本身具有促进DPSCs成牙本质分化的潜能;载BMP-2组相比于HA-Hep组,DSPP与DMP-1的表达在7、14 d均显著升高(Plt;0.001),Col-1的表达于7 d上调(Plt;0.05),14 d明显升高(Plt;0.01),此结果提示以HA-Hep为载体释放的BMP-2在促进DPSCs成牙分化中发挥了长期作用,说明肝素修饰的功能型支架在生长因子应用方面具备可行性,一定程度上弥补了半衰期短、重复给药等不足。
总之,本研究制备的HA-Hep支架,微观结构疏松多孔,能促进DPSCs增殖,可吸附BMP-2并延缓释放,其负载的BMP-2可上调DPSCs成牙基因DSPP、Col-1、DMP-1的表达,该材料为牙髓再生缓释支架的制备及生长因子的有效应用提供了新思路。
[参考文献]
[1]" "SCHMALZ G, WIDBILLER M, GALLER K M. Clinical perspectives of pulp regeneration[J]. J Endod, 2020, 46(9S):S161-S174.
[2]" "PALMA P J, RAMOS J C, MARTINS J B, et al. Histologic evaluation of regenerative endodontic procedures with the use of chitosan scaffolds in immature dog teeth with apical periodontitis[J]. J Endod, 2017, 43(8):1279-1287.
[3]" "BHUVA B, IKRAM O. Complications in endodontics[J]. Prim Dent J, 2020, 9(4):52-58.
[4]" "LIANG C, LIAO L, TIAN W D. Stem cell-based dental pulp regeneration: insights from signaling pathways[J]. Stem Cell Rev Rep, 2021, 17(4):1251-1263.
[5]" "XU F F, QIAO L, ZHAO Y M, et al. The potential application of concentrated growth factor in pulp regeneration: an in vitro and in vivo study[J]. Stem Cell Res Ther, 2019, 10(1):134.
[6]" "LI X L, FAN W, FAN B. Dental pulp regeneration strategies: a review of status quo and recent advances[J]. Bioact Mater, 2024, 38:258-275.
[7]" "AHMED G M, ABOUAUF E A, ABUBAKR N, et al. Cell-based transplantation versus cell homing approaches for pulp-dentin complex regeneration[J]. Stem Cells Int, 2021, 2021:8483668.
[8]" "HASHEMI-BENI B, KHOROUSHI M, FOROUGHI M R, et al. Tissue engineering: Dentin-pulp complex regeneration approaches(a review)[J]. Tissue Cell, 2017, 49(5):552-564.
[9]" "LA NOCE M, STELLAVATO A, VASSALLO V, et al. Hyal-uronan-based gel promotes human dental pulp stem cells bone differentiation by activating YAP/TAZ pathway[J]. Cells, 2021, 10(11):2899.
[10]" "ATILA D, CHEN C Y, LIN C P, et al. In vitro evaluation of injectable Tideglusib-loaded hyaluronic acid hydrogels incorporated with Rg1-loaded chitosan microspheres for vital pulp regeneration[J]. Carbohydr Polym, 2022, 278:118976.
[11]" "QU M Y, JIANG X, ZHOU X W, et al. Stimuli-responsive delivery of growth factors for tissue engineering[J]. Adv Healthc Mater, 2020, 9(7):e1901714.
[12]" "OLIVEIRA ?魪 R, NIE L, PODSTAWCZYK D, et al. Advances in growth factor delivery for bone tissue engineering[J]. Int J Mol Sci, 2021, 22(2):903.
[13]" "MACHLA F, SOKOLOVA V, PLATANIA V, et al. Tissue engineering at the dentin-pulp interface using human treated dentin scaffolds conditioned with DMP1 or BMP2 plasmid DNA-carrying calcium phosphate nanoparticles[J]. Acta Bio-mater, 2023, 159:156-172.
[14]" "YANG J, YE L, HUI T Q, et al. Bone morphogenetic protein 2-induced human dental pulp cell differentiation inv-olves p38 mitogen-activated protein kinase-activated cano-nical WNT pathway[J]. Int J Oral Sci, 2015, 7(2):95-102.
[15]" "REN X C, ZHAO M Y, LASH B, et al. Growth factor engineering strategies for regenerative medicine applications[J]. Front Bioeng Biotechnol, 2020, 7:469.
[16]" "CHEN L, LIU J X, GUAN M, et al. Growth factor and its polymer scaffold-based delivery system for cartilage tissue engineering[J]. Int J Nanomedicine, 2020, 15:6097-6111.
[17]" "ZHAO Y L, LIN Z Z, LIU W Q, et al. Controlled release of growth factor from heparin embedded Poly(aldehyde guluronate) hydrogels and its effect on vascularization[J]. Gels, 2023, 9(7):589.
[18]" "BHUTADA S S, SRIRAM M, KATTI D S. Sulfated carbo-xymethylcellulose conjugated electrospun fibers as a growth factor presenting system for tissue engineering[J]. Carbohydr Polym, 2021, 268:118256.
[19]" "MAYS E A, KALLAKURI S S, SUNDARARAGHAVAN H G. Heparin-hyaluronic acid nanofibers for growth factor sequestration in spinal cord repair[J]. J Biomed Mater Res A, 2020, 108(10):2023-2031.
[20]" "ZUO Q H, GUO R, LIU Q, et al. Heparin-conjugated alg-inate multilayered microspheres for controlled release of bFGF[J]. Biomed Mater, 2015, 10(3):035008.
[21]" "JHA A K, MATHUR A, SVEDLUND F L, et al. Molecular weight and concentration of heparin in hyaluronic acid-based matrices modulates growth factor retention kinetics and stem cell fate[J]. J Control Release, 2015, 209:308-316.
[22]" "YAMAKOSHI Y. Dentinogenesis and dentin sialophosphoprotein(DSPP)[J]. J Oral Biosci, 2009, 51(3):134.
[23]" "QIN W, YANG F, DENG R, et al. Smad 1/5 is involved in bone morphogenetic protein-2-induced odontoblastic diff-erentiation in human dental pulp cells[J]. J Endod, 2012, 38(1):66-71.
[24]" "CHAUSSAIN C, EAPEN A S, HUET E, et al. MMP2-cleavage of DMP1 generates a bioactive peptide promoting differentiation of dental pulp stem/progenitor cell[J]. Eur Cell Mater, 2009, 18:84-95.
