三色旋花化学成分及抗炎活性研究
2024-11-29李雨欣祝东荣张熙晗祁天姿顾金萍林斌陆天琦王雯丽范博义
[摘" "要]" "目的:研究三色旋花种子的化学成分及单体化合物的抗炎活性。方法:采用硅胶、十八烷基硅烷键合硅胶填料(Octadecylsilyl, ODS)反相色谱和制备型HPLC等方法分离纯化,并利用核磁共振(nuclear magnetic resonance, NMR)、质谱(mass spectrometry, MS)等波谱学方法鉴定化合物的结构。利用脂多糖(lipopolysaccharide, LPS)诱导的RAW264.7细胞模型及分子对接技术,初步探索所分离化合物的抗炎作用。结果:从三色旋花种子的二氯甲烷部位中分离得到11个化合物,分别是α-亚油酸(1)、1-亚油酸甘油酯(2)、N-亚油酸乙醇胺(3)、咖啡酸乙酯(4)、5-hydroxy-3, 4-dimethy-5-pentyl-2(5H)-furanone(5)、东莨菪素(6)、3-吲哚甲醛(7)、methyl dioxindole-3-acetate(8)、ethyl dioxindole-3-acetate(9)、coixspirolactam B(10)、coixspirolactam C(11)。活性研究发现,化合物4能够显著抑制LPS诱导的一氧化氮生成,而且能显著抑制炎症因子诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧合酶-2(cyclooxygenase-2, COX-2)的表达,并能与iNOS和COX-2蛋白结合,进而发挥抗炎作用。结论:化合物2~5和7~11为首次从旋花属植物中分离得到,化合物1为首次从植物三色旋花中分离得到。其中,化合物4具有显著的抗炎活性,具有进一步研究开发的价值。
[关键词]" "三色旋花;化学成分;抗炎活性;分子对接
[中图分类号]" "Q946" " " " " " " "[文献标志码]" "A" " " " " " " "[文章编号]" "1674-7887(2024)02-0111-06
Chemical constituents from Convolvulus tricolor L. and their anti-inflammatory activities*
LI Yuxin1**#, ZHU Dongrong2**#, ZHANG Xihan1, QI Tianzi1, GU Jinping1, LIN Bin3, LU Tianqi4, WANG Wenli1***, FAN Boyi1***" " " " (1School of Pharmacy, Nantong University, Jiangsu 226019; 2School of Chemistry and Chemical Engineering, Tianjin University of Technology; 3Wuya College of Innovation, Shenyang Pharmaceutical University; 4Jiangsu Haofeng Bio-technology Co.)
[Abstract]" "Objective: To study the chemical constituents from Convolvulus tricolor L.(C. tricolor) and their anti-inflammatory activities. Methods: The chemical constituents were separated and purified by silica gel, Octadecylsilyl(ODS) reverse phase chromatography and preparative HPLC, and were identified by nuclear magnetic resonance(NMR) and mass spectrometry(MS) spectroscopic techniques. The lipopolysaccharide(LPS)-induced RAW264.7 cell model and molecular docking technology were used to evaluate the anti-inflammatory activities. Results: Eleven compounds were isolated from dichloromethane extract of C. tricolor seeds, and were identified as α-linoleic acid(1), 1-monolinolein(2), N-linoleoylethanolamine(3), ethyl caffeate(4), 5-hydroxy-3, 4-dimethy-5-pentyl-2(5H)-furanone(5), scopoletin(6), 3-indole formaldehyde(7), methyl dioxindole-3-acetate(8), ethyl dioxindole-3-acetate(9), coixspirolactam B(10), coixspirolactam C(11). The activity research found that compound 4 could significantly reduce LPS-induced nitric oxide generation, which can also significantly inhibit the expression of inducible nitric oxide synthase(iNOS) and cyclooxygenase-2(COX-2), and bind to iNOS and COX-2 proteins, thereby exerting anti-inflammatory effects. Conclusions: Compounds 2-5 and 7-11 were firstly isolated from genus Convolvulus, while compound 1 was isolated C. tricolor for the first time. Among them, compound 4 exhibited potent anti-inflammatory activity, and had value for further research and development.
[Key words]" "Convolvulus tricolor L.; chemical constituents; anti-inflammatory activity; molecular docking
旋花属(Convolvulus)为旋花科一年生或多年生植物。全球约250种,广布于两半球温带及亚热带,极少数在热带[1]。旋花属包含多种药用植物,如田旋花(C.arvensis)、药旋花(C.scammonia)、C.pluricaulis等,在世界各地作为传统药物广泛使用[2-3]。截至目前,从旋花属植物中分离得到多种活性成分,如挥发油、萜类、黄酮、甾体、香豆素、花青素、生物碱和树脂糖苷类等。现代药理研究[2-5]表明,旋花属植物及其活性成分具有抗菌、抗氧化、抗肿瘤、抗阿尔茨海默病、镇静及神经保护等药理作用,具有广泛的开发前景和价值。
三色旋花(Convolvulus tricolor L., C. tricolor)是旋花科旋花属草本植物[6]。三色旋花原产于地中海沿岸、北非等地区,由于其花色丰富,具有较高的观赏价值,因此在我国各地均有栽培。不过目前对该植物的化学成分及生物活性研究较少,仅从花朵及种子中分离得到少量生物碱、香豆素、黄酮和半乳甘露聚糖等类型化合物[7-9]。因此,为了进一步研究三色旋花植物的开发价值,本文对三色旋花种子二氯甲烷部位的化学成分进行提取、分离、纯化和结构鉴定,并对这些化合物进行抗炎活性测定,以期发展和丰富该植物的化学成分,并开发具有一定药用价值的活性化合物。
1" "材料与方法
1.1" "仪器与材料
1.1.1" "仪器" "LC-2030C 3D高效液相色谱仪(日本岛津 SHIMADZU);RID-10A示差型高效液相色谱(日本岛津SHIMADZU);LC-10AD制备型高效液相色谱仪(日本岛津 SHIMADZU);Bruker 600 AV NEO核磁共振波谱仪(瑞士布鲁克公司);AVANCE III HD 400核磁共振波谱仪(瑞士布鲁克公司);EU-K1-10TY实验室级超纯水器(河南森空仪器设备有限公司);MLT35HA数控超声波清洗器(江苏米力特科学仪器有限公司);SHX-2旋转蒸发仪(荥阳市科鑫仪器厂);DWX-5/20 ℃低温冷却液循环泵(上海冉富仪器有限公司);YR-3M多功能粉碎机(河北本辰科技有限公司);MS204S分析天平(上海甄明科学仪器有限公司);JY5002电子天平(上海舜宇科学仪器有限公司)。
1.1.2" "材料" "硅胶(中国青岛海洋化工有限公司);ODS C18填料(日本富士株式会社);Sephadex LH-20(Pharmacia公司);预制硅胶薄层G板(10~40 μm青岛海洋化工厂);制备型YMC-Pack ODS-A 色谱柱(12.0 mm×250 mm, 5 μm, YMC);显色剂:10%浓硫酸-乙醇。所用水为超纯水,所用试剂均为分析纯或色谱纯。
实验用药材于2022年5月购买自江苏省宿迁市沭阳县佳康园林绿化苗木场,经南通大学药学院杨敏副教授鉴定为旋花科旋花属植物三色旋花C. tricolor的干燥种子,标本存放于南通大学天然药物化学教研室内,标本编号为No.202205。
1.2" "实验方法
1.2.1" "提取分离" "采用95%乙醇对三色旋花种子粉末(5 kg)进行热回流提取,合并提取液减压浓缩。总浸膏用水重悬,依次用二氯甲烷、正丁醇试剂进行萃取。二氯甲烷部位浓缩后得到173 g浸膏,以二氯甲烷-甲醇(1∶0~1∶1, v/v)为洗脱剂,用硅胶柱层析进行分离,得到3个馏分Frs.A~C。将Fr.C(39.8 g)用ODS柱层析,以甲醇-水(30∶70~100∶0, v/v)洗脱,得到6个馏分(Frs.CA~CF)。
将组分Fr.CD(6.8 g)以二氯甲烷-甲醇(10∶1~1∶1, v/v)为洗脱剂,用硅胶柱层析得到9个馏分(Frs.CDA~CDI)。组分Fr.CDC以82%甲醇-水溶液为流动相,经制备型HPLC制备得到化合物3(tR=31 min, 2.6 mg)和化合物2(tR=36 min, 3.5 mg)。组分Fr.CDE以77%甲醇-水溶液为流动相,经制备型HPLC制备得到化合物1(tR=60 min, 3.8 mg)。
将组分Fr.CC(2.6 g)以二氯甲烷-甲醇(15∶1~1∶1, v/v)为洗脱剂,用硅胶柱层析得到12个馏分(Frs.CCA~CCL)。组分Fr.CCB以50%甲醇-水溶液为流动相,经制备型HPLC制备得到化合物4(tR=28 min, 3.0 mg)和5(tR=63 min, 7.0 mg)。
将组分Fr.CB(1.7 g)以二氯甲烷-甲醇(15∶1~1∶1, v/v)为洗脱剂,用硅胶柱层析得到14个馏分(Frs.CBA~CBN)。组分Fr.CBB以30%甲醇-水溶液为流动相,经制备型HPLC制备化合物6(tR=42 min, 1.4 mg)和7(tR=61 min, 1.2 mg)。组分Fr.CBD以25%甲醇-水溶液为流动相,经制备型HPLC制备化合物8(tR=30 min, 0.8 mg)、10(tR=50 min, 6.0 mg)、9(tR=59 min, 5.0 mg)和11(tR=93 min, 4.5 mg)。
1.2.2" "抗炎活性" "研究取对数生长期的RAW264.7细胞,胰酶消化为单细胞悬液后,经细胞计数后,接种于96孔板,每孔细胞密度为1×106/100 μL,置37 ℃、5%CO2培养箱内培养24 h后,进行分组、给药。实验分为空白组、模型组和样品组。空白组中只加入DMEM培养基,模型组中加入1 μg/mL脂多糖(lipopolysaccharide, LPS),样品组中除加入LPS外,分别加入不同浓度(0.5~8 μmol/L)的测试样品。给药16 h后,吸取上清液,用一氧化氮(nitric oxide, NO)检测试剂盒测定培养基中NO的含量。利用MTT法检测化合物对RAW264.7细胞存活率的影响。利用Western Blot分析化合物4(0.5~2 μmol/L)对RAW264.7细胞中诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧合酶-2(cyclooxygenase-2, COX-2)蛋白含量的变化。
1.2.3" "分子对接" "利用Schro?觟dinger suite 2021-2和PyMOL软件[10],以及iNOS(PDB ID: 4NOS)和COX-2(PDB ID:5IKT)的蛋白结构,对化合物4进行分子对接。首先,在Glide中使用XP模式,COX-2和iNOS作为受体,设置默认对接网格为20 ?魡,将共晶配体放置在口袋中心。最后,基于验证的参数,将化合物4与iNOS和COX-2分别进行对接。
2" "结" " " 果
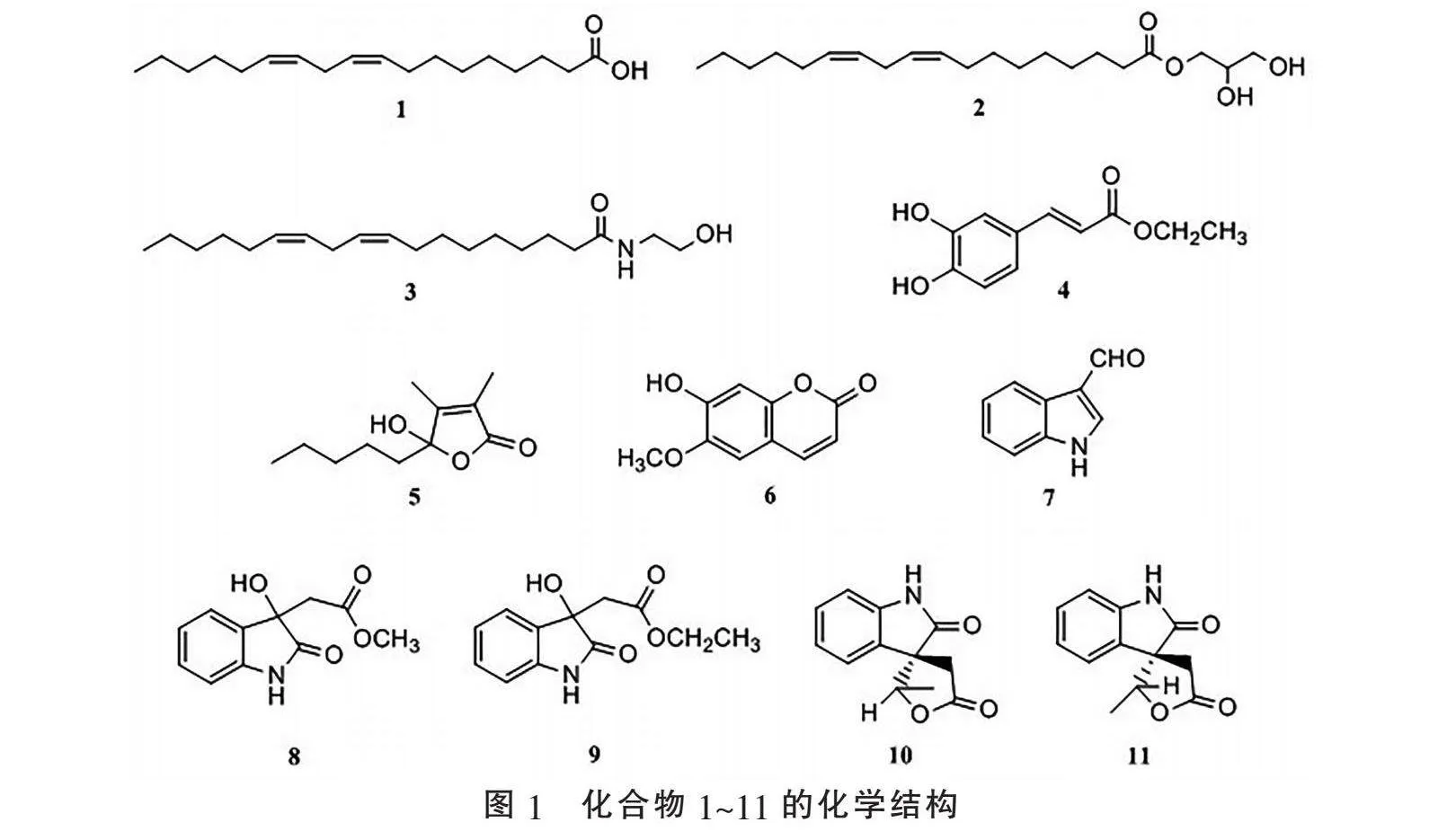
2.1" "化合物分离结果" "化合物1:淡黄色油状物;ESI-MS: m/z 281[M+H]+,分子式C18H32O2。1H NMR(600 MHz, CDCl3) δ: 5.29~5.40(4H, m, H-9, 10, 12, 13), 2.76(2H, t, J=7.2 Hz, H-11), 2.35(2H, m, H-2), 2.04(4H, m, H-8, 14), 1.59(2H, m, H-3), 1.25~1.38(14H, m, H-4~7, 15~17), 0.87(3H, t, J=6.6 Hz, H-18); 13C NMR(150 MHz, CDCl3) δ: 178.2(C-1), 34.2(C-2), 25.0(C-3), 29.4~29.9(C-4~7, 15), 27.3(C-8), 130.1(C-9), 128.2(C-10), 25.8(C-11), 128.0(C-12), 130.4(C-13), 27.4(C-14), 31.7(C-16), 22.7(C-17), 14.2(C-18)。以上数据与文献[11]报道基本一致,故鉴定化合物1为α-亚油酸。
化合物2:无色粉末;ESI-MS: m/z 355[M+H]+,分子式C21H38O4。1H NMR(600 MHz, CDCl3) δ: 5.43~5.29(4H, m, H-9, 10, 12, 13), 4.21(1H, dd, J=11.4, 4.8 Hz, H-1a′), 4.15(1H, dd, J=11.4, 6.0 Hz, H-1b′), 3.93(1H, m, H-2′), 3.70(1H, dd, J=12.0, 4.2 Hz, H-3a′), 3.60(1H, dd, J=12.0, 5.4 Hz, H-3b′), 2.77(2H, t, J=7.2 Hz, H-11), 2.36(1H, t, J=7.2 Hz, H-2), 2.05(4H, m, H-8, 14), 1.63(2H, m, H-3), 1.37~1.28(14H, m, H-4~7, 15~17), 0.89(3H, t, J= 6.6 Hz, H-18); 13C NMR(150 MHz, CDCl3) δ: 174.5(C-1), 34.3(C-2), 25.0(C-3), 29.2~29.7(C-4~7, 15), 27.3(C-8), 130.1(C-9), 128.2(C-10), 25.8(C-11), 128.1(C-12), 130.4(C-13), 27.4(C-14), 31.7(C-16), 22.7(C-17), 14.2(C-18), 65.3(C-1′), 70.4(C-2′), 63.5(C-3′)。以上数据与文献[12]报道基本一致,故鉴定化合物2为1-亚油酸甘油酯。
化合物3:黄色油状物;ESI-MS: m/z 324 [M+H]+,分子式C20H37NO2。1H NMR(600 MHz, CDCl3) δ:5.97 (1H, brs, NH), 5.40~5.30(4H, m, H-9, 10, 12, 13), 3.72(2H, t, J=4.8 Hz, H-2′), 3.42(2H, q, J=4.8 Hz, H-1′), 3.24(1H, brs, OH), 2.76(2H, t, J=7.2 Hz, H-11), 2.20 (2H, t, J=7.8 Hz, H-2), 2.04(4H, m, H-8, 14), 1.61~1.64(2H, m, H-3), 1.38~1.25(14H, m, H-4~7, 15~17), 0.88(3H, t, J=6.6 Hz, -CH3); 13C NMR(150 MHz, CDCl3) δ: 174.7(C-1), 36.8(C-2), 25.8(C-3), 29.3~29.7(C-4~7, 15), 27.3(C-8, 14), 130.2(C-9), 128.2(C-10), 25.8(C-11), 128.0(C-12), 130.4(C-13), 31.7(C-16), 22.6(C-17), 14.1(C-18), 42.6(C-1′), 62.8(C-2′)。以上数据与文献[13]报道基本一致,故鉴定化合物3为N-亚油酸乙醇胺。
化合物4:黄色结晶;ESI-MS: m/z 209[M+H]+,分子式C11H12O4。1H NMR(400 MHz, CDCl3) δ: 7.56 (1H, d, J=16.0 Hz, H-3), 7.08(1H, brs, H-5), 6.98(1H, d, J=8.0 Hz, H-9), 6.86(1H, d, J=8.0 Hz, H-8), 6.25(1H, d, J=16.0 Hz, H-2), 4.25(2H, q, J=7.2 Hz, -OCH2-), 1.33(3H, t, J=7.2 Hz, -CH3); 13C NMR(100 MHz, CDCl3) δ: 167.9(C-1), 114.4(C-2), 144.2(C-3), 127.6(C-4), 115.6(C-5), 145.0(C-6), 146.6(C-7), 115.7(C-8), 122.5(C-9), 60.7(C-10), 14.5(C-11)。以上数据与文献[14]报道基本一致,故鉴定化合物4为咖啡酸乙酯。
化合物5:无色油状物;ESI-MS: m/z 199[M+H]+,分子式C11H18O3。1H NMR(400 MHz, CDCl3) δ: 1.98(1H, m, H-6a), 1.75(1H, m, H-6b), 1.28(5H, m, H-7a, 8, 9), 1.15(1H, m, H-7b), 0.87(3H, t, J=6.0 Hz, H-10), 1.93(3H, brs, H-11), 1.81(3H, brs, H-12); 13C NMR(100 MHz, CDCl3) δ: 172.4(C-1), 125.4(C-2), 158.0(C-3), 107.2(C-4), 36.1(C-5), 31.7(C-6), 22.7(C-7), 22.6(C-8), 14.1(C-9), 10.9(C-10), 8.6(C-11)。以上数据与文献[15]报道基本一致,故鉴定化合物5为5-hydroxy-3, 4-dimethy-5- pentyl-2(5H)-furanone。
化合物6:黄色结晶;ESI-MS: m/z 193[M+H]+,分子式C10H8O4。1H NMR(400 MHz, CDCl3) δ: 7.60(1H, d, J=9.2 Hz, H-4), 6.92(1H, s, H-8), 6.85(1H, s, H-5), 6.27(1H, d, J=9.2 Hz, H-3), 4.00(3H, s, -OCH3); 13C NMR(100 MHz, CDCl3) δ: 161.6(C-2), 113.6(C-3), 143.5(C-4), 107.6(C-5), 150.4(C-6), 144.1(C-7), 103.3(C-8), 149.8(C-9), 111.6(C-10), 56.5(-OCH3)。以上数据与文献[16]报道基本一致,故鉴定化合物6为东莨菪素。
化合物7:黄色结晶;ESI-MS: m/z 146[M+H]+,分子式C9H7NO。1H NMR(400 MHz, CDCl3) δ: 10.08(1H, s, CHO), 8.78(1H, brs, NH), 8.33(1H, m, H-4), 7.86(1H, d, J=3.2 Hz, H-2), 7.45(1H, m, H-7), 7.33(2H, m, H-5, 6); 13C NMR(100 MHz, CDCl3) δ: 185.3(CHO), 135.1(C-2), 122.2(C-4), 124.6(C-5), 123.2(C-6), 111.6(C-7)。以上数据与文献[17]报道基本一致,故鉴定化合物7为3-吲哚甲醛。
化合物8:黄色油状物;ESI-MS: m/z 222[M+H]+,分子式C11H11NO4。1H NMR(400 MHz, CDCl3) δ: 8.27(1H, brs, NH), 7.38(1H, d, J=7.2 Hz, H-4), 7.27(1H, t, J=7.2 Hz, H-6), 7.06(1H, t, J =7.2 Hz, H-5), 6.89(1H, d, J=7.2 Hz, H-7), 3.68(3H, s, -OCH3), 2.96(2H, s, H-8); 13C NMR(100 MHz, CDCl3) δ: 178.4(C-2), 73.9(C-3), 130.4(C-3a), 129.7(C-4), 123.4(C-5), 124.4(C-6), 110.7(C-7), 140.7(C-7a), 41.0(C-8), 171.1(C-9), 52.3(-OCH3)。以上数据与文献[18]报道基本一致,故鉴定化合物8为methyl dioxindole-3-acetate。
化合物9:黄色油状物;ESI-MS: m/z 236[M+H]+,分子式C12H13NO4。1H NMR(400 MHz, CDCl3) δ: 7.38(1H, brs, H-4), 7.26(1H, s, H-6), 7.05(1H, m, H-5), 6.87(1H, brs, H-7), 2.95(2H, s, H-8), 4.12(2H, t, J=6.8 Hz, H-10), 1.17(3H, t, J=6.8 Hz, H-11); 13C NMR(100 MHz, CDCl3) δ: 178.8(C-2), 74.1(C-3), 130.3(C-3a), 129.7(C-4), 123.4(C-5), 124.4(C-6), 110.7(C-7), 140.7(C-7a), 41.3(C-8), 170.6(C-9), 61.4(C-10), 14.0(C-11)。以上数据与文献[19]报道基本一致,故鉴定化合物9为ethyl dioxindole-3-acetate。
化合物10:黄色油状物;ESI-MS: m/z 218[M+H]+,分子式C12H11NO3。1H NMR(400 MHz, CDCl3) δ: 8.65(1H, brs, NH), 7.31(1H, d, J=7.6 Hz, H-4), 7.27(1H, t, J=7.6Hz, H-5), 7.12(1H, t, J=7.6 Hz, H-6), 6.97(1H, d, J=7.6 Hz, H-7), 2.98(2H, s, H-8), 4.75(1H, q, J=6.4 Hz, H-10), 1.35(3H, d, J=6.4 Hz, -CH3); 13C NMR(100 MHz, CDCl3) δ: 173.9(C-2), 54.7(C-3), 141.1(C-3a), 110.7(C-4), 123.5(C-5), 129.8(C-6), 123.0(C-7), 127.5(C-7a), 38.8(C-8), 178.2(C-9), 82.3(C-10), 15.0(C-11)。以上数据与文献[18]报道基本一致,故鉴定化合物10为coixspirolactam B。
化合物11:黄色油状物;ESI-MS: m/z 218[M+H]+,分子式C12H11NO3。1H NMR(400 MHz, CDCl3) δ: 8.33(1H, brs, NH), 7.32(1H, d, J=7.6 Hz, H-4), 7.11(1H, t, J=7.6 Hz, H-5), 7.22(1H, t, J=7.6 Hz, H-6), 6.98(1H, d, J=7.6 Hz, H-7), 3.33(1H, d, J=17.2 Hz, H-8a), 2.70(1H, d, J=17.2 Hz, H-8b), 4.88(1H, q, J=6.4 Hz, H-10), 1.11(3H, d, J=6.4 Hz, -CH3); 13C NMR(100 MHz, CDCl3) δ: 174.1(C-2), 56.0(C-3), 140.0(C-3a), 110.8(C-4), 124.4(C-5), 129.6(C-6), 123.5(C-7), 128.3(C-7a), 40.3(C-8), 176.7(C-9), 81.7(C-10), 15.6(C-11)。以上数据与文献[18]报道基本一致,故鉴定化合物11为coixspirolactam C。
化合物1~11的化学结构见图1。
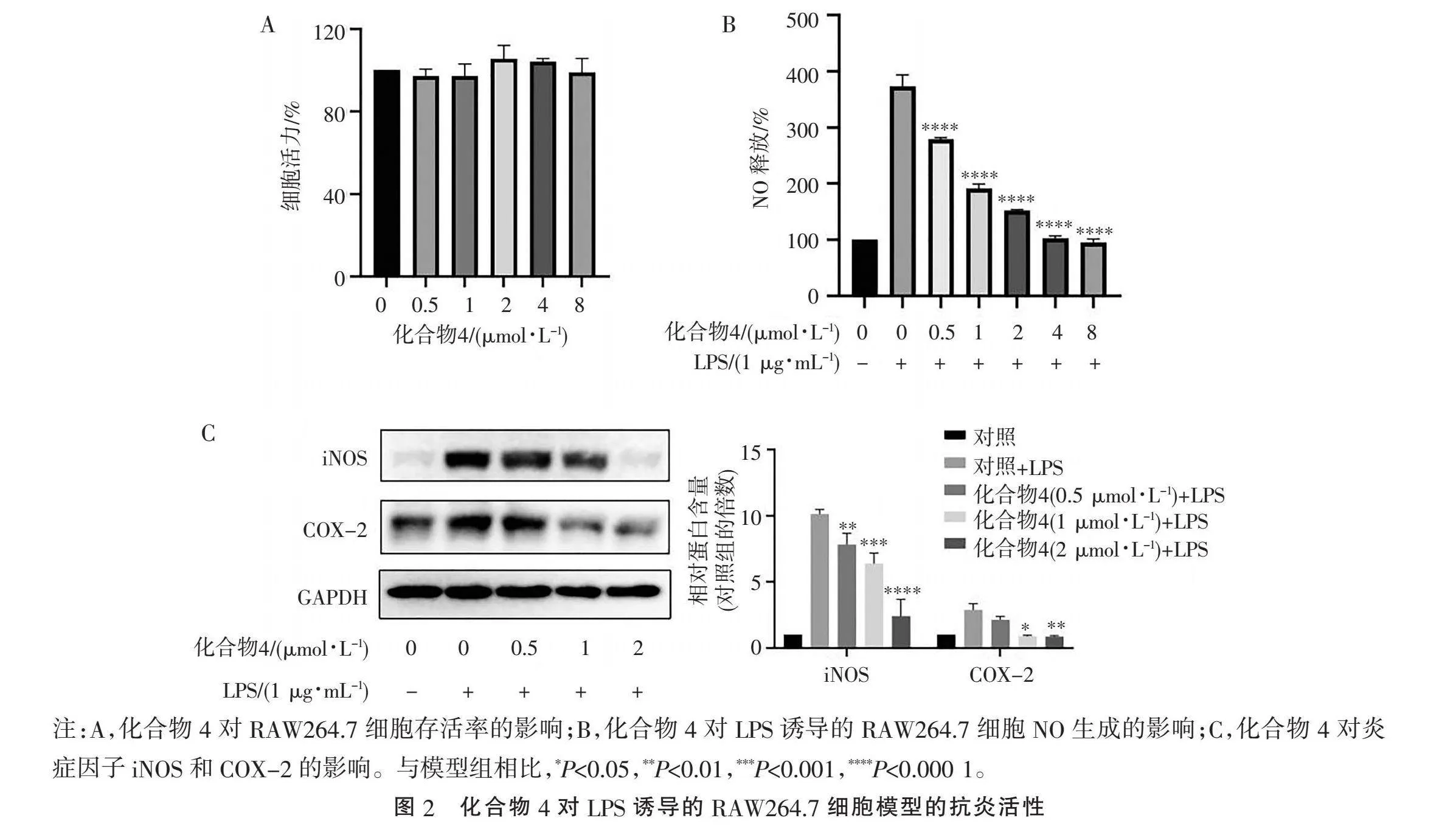
2.2" "活性研究" "利用LPS诱导的RAW264.7细胞模型,检测化合物1~11的抗炎活性。结果表明,化合物4在0.5~8 μmol/L的浓度下,能够不影响细胞存活率,并剂量依赖性地显著抑制NO的生成,IC50为(2.32±0.18) μmol/L(图2A~B)。进一步研究发现,化合物4在0.5~2 μmol/L的浓度下,能够剂量依赖性地显著抑制炎症因子iNOS和COX-2的表达,从而抑制细胞的炎症反应(图2C)[20]。
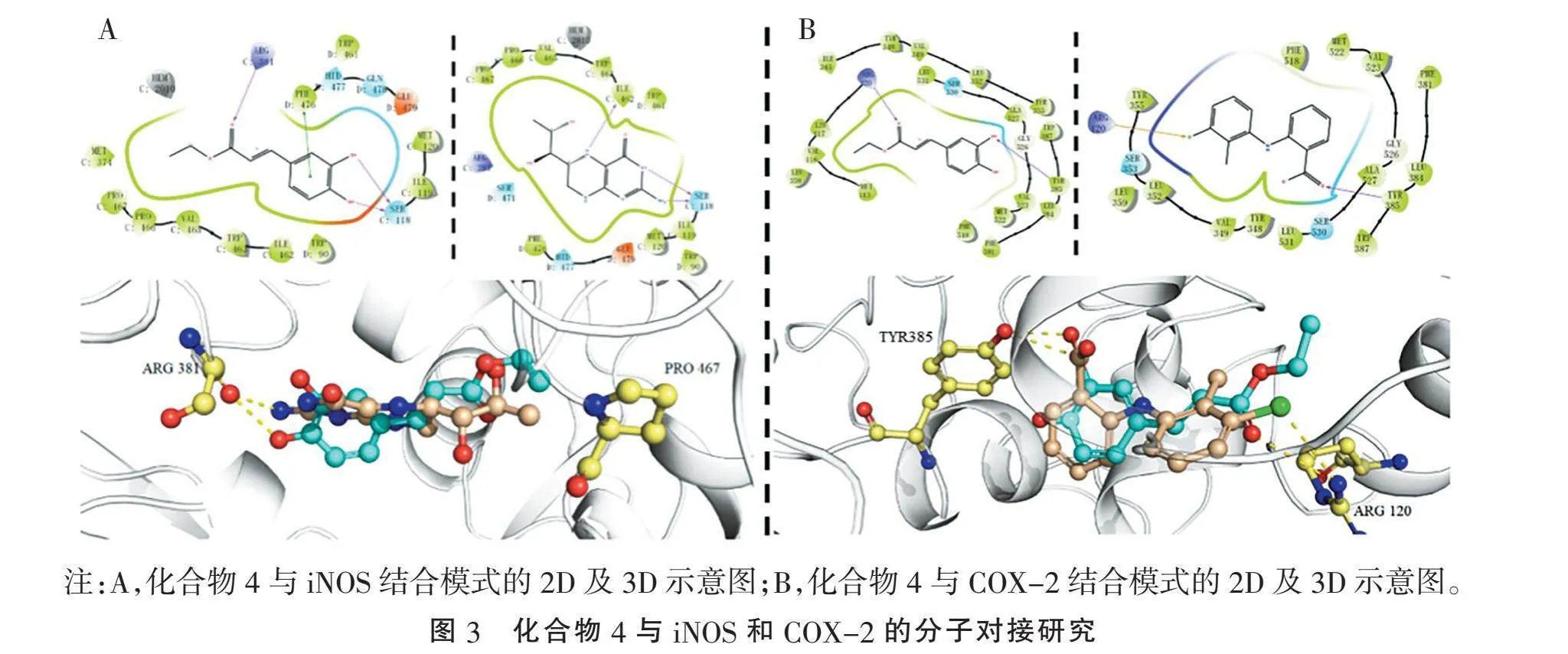
2.3" "分子对接" "利用分子对接技术研究发现,化合物4能够与iNOS蛋白中疏水口袋的氨基酸残基,如PRO 467,进行结合,并能与ARG 381残基形成稳定氢键(图3A);同时,化合物4能够与COX-2蛋白的TYR 385和ARG 120残基形成稳定氢键(图3B)。
3" "讨" " " 论
运用现代技术对旋花科植物三色旋花种子的二氯甲烷部位进行提取分离,得到单体化合物11个。化合物2~5和7~11为首次从该属植物中分离得到,化合物1为首次从植物三色旋花中分离得到。利用LPS诱导的RAW264.7细胞模型,对化合物1~11进行初步的抗炎活性研究。结果显示,化合物4能够显著抑制LPS诱导的NO生成,并能显著抑制炎症因子iNOS和COX-2的蛋白表达。利用分子对接技术研究发现,化合物4能与iNOS和COX-2蛋白结合,进而发挥抗炎作用。
综上所述,本文通过对三色旋花种子单体成分的分离提取及抗炎活性研究,丰富了该植物的化学成分种类,并为后续学者开发抗炎药物提供了先导化合物。
[参考文献]
[1]" "中国科学院中国植物志编辑委员会. 中国植物志第六十四卷第一分册[M]. 北京: 科学出版社, 1979:52.
[2]" "SALEHI B, KROCHMAL-MARCZAK B, SKIBA D, et al. Convolvulus plant-a comprehensive review from phytochemical composition to pharmacy[J]. Phytother Res, 2020, 34(2):315-328.
[3]" "CHEN G T, LU Y, YANG M, et al. Medicinal uses, pharmacology, and phytochemistry of Convolvulaceae plants with central nervous system efficacies: a systematic review[J]. Phytother Res, 2018, 32(5):823-864.
[4]" "AGARWA P, SHARMA B, FATIMA A, et al. An update on Ayurvedic herb Convolvulus pluricaulis Choisy[J]. Asian Pac J Trop Biomed, 2014, 4(3):245-252.
[5]" "KALADHAR D S V G K. An in vitro callus induction and isolation, identification, virtual screening and docking of drug from Convolvulus alsinoidesLinn.against aging diseases[J]. Int J Life Sci Biotechnol Pharma Res, 2012, 1(3):93-103.
[6]" "WOOD J R, WILLIAMS B R, MITCHELL T C, et al. A foundation monograph of Convolvulus L.(Convolvulaceae)[J]. PhytoKeys, 2015(51):1-282.
[7]" "SCHIMMING T, JENETT-SIEMS K, MANN P, et al. Calystegines as chemotaxonomic markers in the Convolvulaceae[J]. Phytochemistry, 2005, 66(4):469-480.
[8]" "KACEM N, HAY A E, MARSTON A, et al. Antioxidant compounds from Algerian Convolvulus tricolor(Convolvulaceae) seed husks[J]. Nat Prod Commun, 2012, 7(7):873-874.
[9]" "KOOIMAN P. Structures of the galactomannans from seeds of Annonamuricata, Arengasaccharifera, Cocosnucifera, Convolvulus tricolor, and Sophorajaponica[J]. Carbohydr Res, 1971, 20(2):329-337.
[10]" "LU C, WU C J, GHOREISHI D, et al. OPLS4: improving force field accuracy on challenging regimes of chemical space[J]. J Chem Theory Comput, 2021, 17(7):4291-4300.
[11]" "毛婷, 毛乐, 张屏, 等. 蒙药土木香的化学成分研究[J]. 天然产物研究与开发, 2023, 35(6):973-980.
[12]" "洪承权, 朴香兰, 楼彩霞. 泽泻化学成分的分离与鉴定[J]. 重庆工学院学报(自然科学版), 2008, 22(4):78-81.
[13]" "OTTRIA R, CASATI S, CIUFFREDA P. 1H, 13C and 15N NMR assignments for N- and O-acylethanolamines, important family of naturally occurring bioactive lipid mediators[J]. Magn Reson Chem, 2012, 50(12):823-828.
[14]" "石宝俊, 侴桂新, 王峥涛. 林荫千里光的化学成分[J]. 中国药科大学学报, 2010, 41(1):26-28.
[15]" "苏丽丽, 唐旭利, 张婧, 等. 中国南海海底柏柳珊瑚化学成分研究[J]. 中国海洋药物, 2011, 30(5):18-22.
[16]" "郭嘉铭, 于绡梅, 蒋波, 等. 假黄皮中化学成分及其抑制滑膜成纤维细胞增殖活性研究[J]. 中国中药杂志, 2021, 46(17):4438-4445.
[17]" "季宇彬, 郑婷, 尹姣定. 中国南海海绵Cinachyrella sp.的化学成分研究[J]. 中国海洋药物, 2018, 37(2):7-12.
[18]" "LEE M Y, LIN H Y, CHENG F, et al. Isolation and characterization of new lactam compounds that inhibit lung and colon cancer cells from adlay(Coixlachryma-jobi L. var. ma-yuenStapf) bran[J]. Food Chem Toxicol, 2008, 46(6):1933-1939.
[19]" "CHUNG C P, HSU C Y, LIN J H, et al. Antiproliferative lactams and spiroenone from adlay bran in human breast cancer cell lines[J]. J Agric Food Chem, 2011, 59(4):1185-1194.
[20]" "ZHU Y T, ZHU M, LANCE P. iNOS signaling interacts with COX-2 pathway in colonic fibroblasts[J]. Exp Cell Res, 2012, 318(16):2116-2127.
[收稿日期] 2023-12-05
