靶向肝星状细胞分子成像在肝纤维化评估上的研究进展
2024-10-30李韩梅余进洪蒋琼冯琳莉张菊英杨友


摘要:肝纤维化是一种由多种慢性肝病引起的肝脏病理过程,其特征是肝细胞外基质的异常沉积。肝纤维化早期具有可逆性,早期诊断肝纤维化及准确判断肝纤维化分期具有重要临床意义。肝星状细胞作为肝纤维化形成过程中的核心细胞,在肝纤维化的发生和发展中起着关键作用。针对靶向肝星状细胞的分子成像技术能精准、无创的结合生理、病理代谢分子信息,有利于早期特异性诊断肝纤维化。因此,靶向肝星状细胞分子成像在肝纤维化评估上的研究进展具有重要的目的与意义,不仅有助于提高肝纤维化的诊断准确性和治疗效果,还将推动相关学科的发展和创新。本文将综述近年来靶向肝星状细胞分子成像在肝纤维化上的研究进展,总结针对肝星状细胞各靶点的不同分子探针对肝纤维化诊断、分期的研究情况及应用价值。
关键词:靶向性;肝星状细胞;肝纤维化;生物标志物;分子成像
Advances in molecular imaging of targeted hepatic stellate cells for the assessment of liver fibrosis
LI Hanmei, YU Jinhong, JIANG Qiong, FENG Linli, ZHANG Juying, YANG You
Department of Ultrasound," Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, China
Abstract: Liver fibrosis is a degenerative condition of the liver induced by a number of chronic liver disorders that is distinguished by aberrant deposition of hepatic extracellular matrix. Liver fibrosis is reversible in its early stages, thus early detection and proper staging are critical in clinical practice. Hepatic stellate cells, which are the core cells in the formation of hepatic fibrosis, play an important role in its initiation and progression. Molecular imaging approaches for targeting hepatic stellate cells integrate physiological and pathological metabolic molecular information in an accurate and non-invasive manner, allowing for the early and specific identification of liver fibrosis. As a result, the advancement of targeted hepatic stellate cell molecular imaging in the assessment of liver fibrosis serves an important purpose and significance, not only in improving diagnostic accuracy and therapeutic efficacy of liver fibrosis, but also in promoting the development and innovation of related disciplines. In this paper, we will review recent research progress in molecular imaging of targeted hepatic stellate cells in liver fibrosis, as well as summarize the research and application value of different molecular probes against various hepatic stellate cell targets for the diagnosis and staging of early liver fibrosis.
Keywords: targeting; hepatic stellate cells; liver fibrosis; biomarkers; molecular imaging
肝纤维化是由肝脏的反复损伤反应引起的慢性疾病,可进展为肝硬化和肝癌[1] 。肝纤维化早期具有可逆性及可治愈性,早期发现肝纤维化对于预防致命疾病的进展和提高患者的预后至关重要[2] 。肝活检被用作评估肝纤维化分期的“金标准”。但它存在一些风险和局限性,激发了对纤维化检测的替代性非侵入性方法的研究[2, 3] 。超声和磁共振弹性成像可测量肝脏硬度,在诊断晚期肝纤维化和肝硬化方面显示出极好的准确性,但肝脏僵硬只是纤维化的间接衡量标准,容易出现炎症、血流动力学改变(门静脉高压症或心脏病)和胆汁淤积等混杂因素[4, 5] 。因此,开发用于肝纤维化早期诊断和分期的无创和可重复的替代方案,并监测由于治疗效果引起的疾病进展或消退至关重要。
目前肝纤维化常用分子探针有RGDUSPIO[6] 、18F-FPP-RGD2[7, 8] 及EP-3533[9-11] 、CM101[12] 、18F-FPP-BF[6] ,肝纤维化分子探针能够无创、可视化地反映肝纤维化过程中分子水平的改变,如使用EP-3533分子探针,其PET显像结果可以显著区分不同处理组与对照组的T1信号强度差异。PET技术通过注射含有放射性同位素的示踪剂可以观察到肝脏内代谢的异常变化,进而推测肝纤维化的程度和分布。PET技术能够提供深入的生物代谢信息和功能成像[13] 。分子探针技术不仅可以用于诊断,还可以协助靶向药物的研发。通过了解肝纤维化过程中特定分子的表达情况,设计针对这些分子的靶向药物,提高治疗效果[14, 15] 。
慢性肝损伤导致肝脏炎症和纤维化,使肝星状细胞(HSCs)激活并转化为肌成纤维细胞,肌成纤维细胞分泌细胞外基质蛋白,纤维胞外基质蛋白主要是I型和III型交联胶原组成[16] 。 HSCs的激活在肝纤维化的发生和进展中起着关键作用[17, 18] 。肝纤维化时 HSCs 的生物学功能会改变,细胞膜上生物标志物的表达也会随之发生改变[19] 。分子成像是一种很有前途的生物医学方法,可以使细胞和亚细胞过程的非侵入性可视化。目前靶向HSCs的分子探针它提供了一种独特的方法来监测和量化失调分子纤维化的途径[14] 。靶向HSCs分子成像有望用于肝纤维化早期检测、疾病分期和预后,以及评估疾病活动度和治疗反应[20] 。
靶向HSCs分子探针在肝纤维化早期诊断的临床应用中展现出巨大的潜力和价值。然而,靶向HSCs分子探针的应用目前仍有很多问题亟待解决:分子探针在人体中应用的安全性和可行性仍需要大量的研究证据支持;目前靶向递送载体的制备技术依然存在不足。首先,大多数生物标志物不只在靶细胞表达,其他细胞也有少量表达,肝脏被认为是第二复杂的器官。肝脏的其他细胞类型,如 Kupffer 细胞、正弦内皮细胞和肝细胞,可能会非特异性摄取探针。肝纤维化调节机制非常复杂,涉及多种细胞和细胞因子的协同作用,而且许多作用靶点及调节通路有待进一步深入研究。因此,多机制、多功能以及多靶点协同作用的分子成像也是进一步研究的重点和难点。
1" 靶向HSCs分子成像的基本原理
靶向HSCs的分子成像技术主要基于HSCs表面或内部表达的特异性分子标记物。这些标记物可以是细胞表面的受体、酶、抗原或其他蛋白质。通过设计和制备能够特异性结合这些标记物的探针(如抗体、多肽、小分子等),可以实现对HSCs的精准定位和定量分析。
2" 靶向HSCs分子成像在肝纤维化上的研究进展
2.1" 特异性标记物的发现
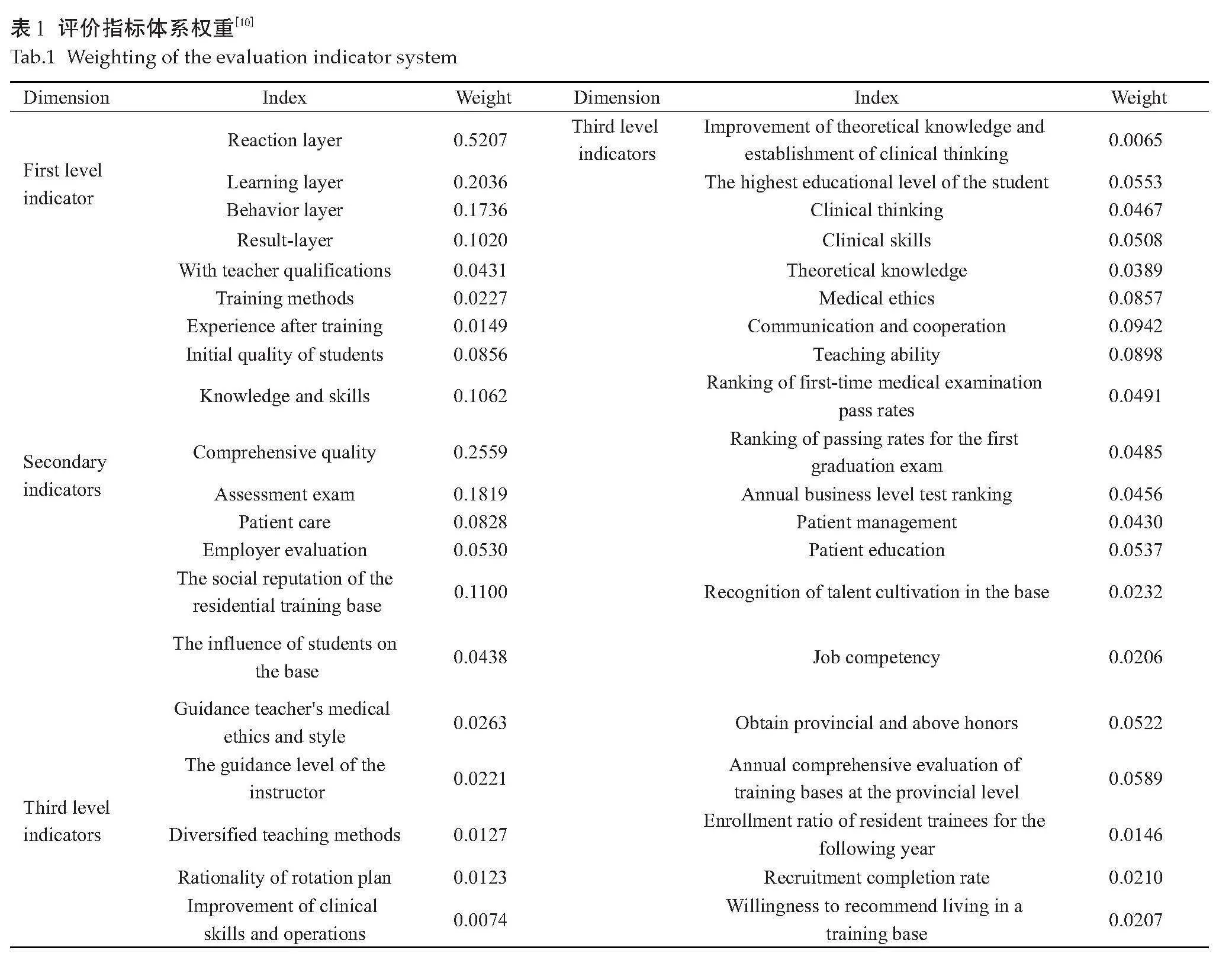
肝纤维化时 HSCs 的生物学功能会改变,细胞膜上生物标志物的表达也会随之发生改变[19] 。HSCs的生物标志物主要包括α-SMA、维生素A和脂滴等[21] 。在正常肝脏中,HSCs处于静止状态,不表达α-SMA[22] 。然而,当肝脏受到炎症或机械刺激等损伤时,HSCs被激活,并开始表达α-SMA[23] 。除了α-SMA和维生素A/脂滴外,近年来,研究人员发现还有一些其他的生物标志物也被用于评估HSCs的激活和肝纤维化的程度[24] 。例如,血小板衍生生长因子受体(PDGFR)[25, 26] 整合素 αvβ3 受体[27, 28] 、结缔组织生长因子(CTGF)[29, 30] 、和趋化因子受体 4 型(CXCR4)[31, 32] 、波形蛋白和结蛋白[33] 、甘露糖 6-磷酸/胰岛素样生长因子Ⅱ受体(M6P/IGF-IIR)[34] 、CD44[35] 等,它们在 HSCs 的活化、增殖、迁移与生存的过程中发挥了重要作用[36, 37] 。这些标志物的表达水平通常与肝纤维化的程度密切相关。通过检测这些生物标志物的表达水平,可以帮助医生更准确地诊断肝纤维化,并评估其进展程度。这些标记物的发现为靶向HSCs的分子成像提供了重要的基础。根据这些标记物的特点,展开了对HSCs各靶点相关分子探针的研究。
2.2" 靶向PDGFR-β的分子成像
血小板衍生生长因子(PDGF)被认为是 HSCs 活化非常重要的有丝分裂原[38, 39] 。PDGF家族包括PDGF-A、-B、-C、-D 4 种亚型,分别形成 PDGF-AB、
-AA、-BB、-CC和-DD,PDGF通过与受体 PDGFR-α 和 PDGFR-β 结合发挥生物学作用,PDGFR-α 在 qHSCs 表 达,PDGFR-β在aHSCs大量表达[39, 40] 。有研究表明,PDGF-BB 的精氨酸 27 和 异亮氨酸 30 的替换会导致 PDGF-BB 在受体亲和力和细胞激活方面存在缺陷,表明精氨酸和异亮氨酸是结合 PDGFR-β 的关键位点。因此,Beljaars等[38] 团队首次合成了含有精氨酸和异亮氨酸的环肽 C* SRNLIDC*(C*为半胱氨酸残基),称为血小板衍生生长因子 β 受体结合肽(pPB)。有研究用钆(Gd)修饰pPB的MRI分子探针,通过可视化肝脏PDGFR-β的表达来区分肝纤维化的过程,证明了肝脏中PDGFR-β的表达水平与肝纤维化的进展密切相关[41] 。有学者开发了血小板源性生长因子受体β(PDGFRβ)靶向放射性示踪剂,通过Ga标记的ZPDGFRβ(68Ga-DOTA-ZPDGFRβ)显示与aHSCs PDGFRβ依赖的结合 [42] 。PDGFRβ靶向PET成像可用于小鼠肝纤维化的无创监测,并评估了其作为新型PET示踪剂的潜力,用于无创监测小鼠肝纤维化的进展和治疗反应。
2.3" 靶向整合素 αvβ3 受体的分子成像
整合素是一类重要的细胞外基质受体,能将细胞内的信号转导与细胞外环境紧密联系整合素家族由18个α亚单位和8个β亚单位通过特殊组合连接形成的24个异二聚体家族组成[36] 。多种肝脏病理过程中,整合素受体功能发现异常,aHSCs表面会大量表达αvβ3受体[43, 44] 。有研究设计了cRGD-PLGA/IOFA纳米颗粒(NPs),可通过将表面cRGD肽与活化的HSCs结合,用于整合素靶向的肝纤维化MRI成像、分级[45] 。有研究制备的99mTc-3PRGD2可以实现SPECT/CT监测大鼠肝纤维化的进展,可用于评估靶向抗纤维化治疗或影响HSCs状态的治疗效果[46] 。有学者合成了一个新的环八肽cRGD(C*GRGDSPC*),将其连接到聚乳酸-乙醇酸(PLGA)偶联的全氟辛基溴化物(PFOB)纳米粒外周得cRGD-PLGA-PFOBNPs,可以被HSC-T6细胞摄取,实现超声与CT双模态成像[47] 。有学者利用18F-AlfatidePET示踪剂特异性地可视化临床前肝纤维化模型和人体组织中αvβ3表达的增加,18F-Alfatide是二聚体RGD肽之一,可以特异性靶向HSCs的αvβ3受体,可用早期检测肝纤维化[48] 。
2.4" 靶向CXCR4 受体的分子成像
CXCR4是一种参与细胞运动的趋化因子受体和肿瘤转移的经典标志物,在细胞的迁移和黏附中起主要作用[49, 50] 。在肝纤维化的进展过程中,CXCR4通过各种细胞应激诱导HSCs的活化。研究表明,肝损伤时缺氧和其他细胞应激促进CXCL12/CXCR4轴在HSCs中表达上调,CXCL12激活HSCs表面的CXCR4,通过活化MAPK通路直接诱导HSCs的分化和增殖,导致HSCs激活[51] 。有学者设计了一种名为CT-SCLMs的纳米治疗系统,通过整合靶肽CTCE9908,CT-SCLM通过与CXCR4的结合亲和力,显示出对aHSCs的主动靶向能力,并且加入了ONOO-响应荧光传感器NOF2,它可以作为检测肝纤维化,用于肝纤维化的早期诊断和治疗[52] 。
2.5" 靶向波形蛋白和结蛋白的分子探针
波形蛋白和结蛋白是间充质细胞表面的丝状蛋白, 属于Ⅲ型中间丝蛋白,具有高度保守的 α 螺旋“杆状”结构域,由头部、杆Ia(rod-Ia)、杆Ib(rod-Ib)、杆Ⅱ(rod-Ⅱ)和尾结构域组成,在星状细胞激活过程中,结蛋白和波形蛋白的表达强烈上调,活化的造血干细胞比静止的造血干细胞和其他非实质细胞表达更多的结蛋白和波形蛋白[53] 。最近,有报道称,含有n-乙酰氨基葡萄糖(GlcNAc)的聚合物通过与细胞表面蛋白的棒状II结构域结合,对结蛋白和波形蛋白具有强烈的亲和力[54] 。有研究利用人工仿生糖聚物,发现波形蛋白和结蛋白在细胞表面具有结合N-乙酰葡萄糖胺(GlcNAc)的凝集素样特性,因此GlcNAc可以作为靶向波形蛋白和结蛋白的特异性糖配体,用来递送示踪剂监测CCl4小鼠肝纤维化进展[53] 。有研究合成了一种相对分子质量约3.3×103的小分子放射性示踪剂99mTc-GlcNAc-PEI,在CCl4诱导的纤维化小鼠体内成像显示,99mTc-GlcNAc-PEI的肝脏摄取量随病情进展而增加,99mTc-GlcNAc-PEI比正常肝组织更容易与纤维化肝组织结合,证实GlcNAc-PEI可以靶向aHSCs表面的结蛋白,证明了99mTc-GlcNAc-PEI可以用于肝纤维化的早期诊断和抗纤维化药物疗效的监测[55] 。
2.6" 靶向CD44受体的分子成像
透明质酸(HA)是一种线性多糖,具有非免疫原性、普遍存在和突出的生物相容性和降解性[56] ,HA作为一种天然多糖,主要由HSC合成,由肝窦内皮细胞(LSEC)降解,HA对肝脏中大量存在的HA受体具有很高的特异性[57] 。HSCs是肝脏中表达CD44的主要细胞。特别是当肝纤维化发生时,HSCs的增殖伴随着CD44的表达显著增加。有学者研究出一种HA衍生的成像探针,用于增强肝纤维化的成像和准确分期,HA-Target-Cy5.5-DOTA-Gd(HTCDGd),以氧胺组靶向纤维组织中的赖氨酸,具有纳米级的高弛豫性,实现基于HA的MRI/荧光显像剂[58] 。
2.7" 其他受体分子成像
胶原Ⅵ型受体(CVIR)、p75 神经营养因子受体(p75NTR)、甘露糖6-磷酸/胰岛素样生长因子Ⅱ受体(M6P/IGF-IIR)等受体在HSCs的活化、增殖、迁移与生存的过程中也发挥了重要作用。但是相关研究较少,Ⅵ型胶原是肝脏中一种重要的细胞外基质蛋白,在正常的肝脏中主要分布于内皮细胞、肝细胞和qHSCs中,通过维持基质与细胞之间的相互作用调节基质稳态,是参与细胞与周围基质黏附的重要基质蛋白之一。p75NTR调节HSCs分化为aHSCs,其表达变化是肝纤维化进展的标志,p75NTR在正常肝脏HSCs的表达量低,在肝损伤后aHSCs中的表达强烈上调,在肝细胞不表达,在肝纤维化时细胞膜上的M6P/IGF-IIR发挥作用。正常的肝脏中qHSCs仅表达少量M6P/IGF-IIR,aHSCs表面的M6P/IGF-IIR受体表达上调。这些是研究靶向HSCs分子成像可以探索的潜在靶点。
随着分子靶向成像技术的发展,MRI、SPECT、PET和超声成像是近年来发展起来的新技术。通过设计和制备靶向肝纤维化中的多个靶点,具有多靶向性的纳米探针,可以实现对HSCs的高效、特异性成像。这些纳米探针通常结合了特定的配体或抗体,能够与HSCs表面的特定受体或标记物结合,从而实现更高效的靶向HSCs。
3" 多模态成像技术的发展
目前结合CT、MRI、超声造影及PET等多种成像模式,形成多模态成像已成为医学领域研究前沿,多模态成像技术是指结合2种或2种以上的成像方法,以提供更全面、更准确的诊断信息[59] 。在靶向HSCs的分子成像中,多模态成像技术得到了广泛应用。有团队合成靶向HSCs的MR/光学双模探针(SPIO@SiO2-ICG-RGD),通过体外及动物在体实验验证了探针对肝纤维化进行早期诊断的可行性及特异性[60] 。有学者使用cRGD-PLGA-Fe3O4-PFOB NPs联合US/CT/MR分子成像特异性靶向整合素αvβ3对于监测星状细胞活性和评估肝纤维化进展[61] ,这3种技术获得互补和不同的信息,提高了单一成像技术的诊断准确性。有研究开发了一种基于CREKA肽和CS的级联靶向纳米药物,靶向活化的HSCs的高尔基体与CD44受体,这种多功能纳米颗粒系统可以有效地靶向活化的HSCs的高尔基体与细胞表面受体[62] 。有研究合成18F-FDG-RGD分子探针,实现PET/CT 监测活化的HSCs整合素受体αvβ3的表达情况来评价肝纤维化程度[63] 。多模态成像技术不仅提高了成像的分辨率和灵敏度,还为疾病的诊断和治疗提供了更多的信息。
4" 总结与展望
探索靶向HSCs分子探针实现多模态成像早期诊断肝纤维化是目前研究的主要方向。目前靶向HSCs分子成像主要聚焦于活化HSCs上的PDGFR-β、整合素 αvβ3 、CXCR4 、波形蛋白和结蛋白及CD44受体等,随着靶向HSCs分子成像技术的不断发展,特异性标记物的不断发现和纳米技术的不断进步,各种特异性探针的不断研发。针对这些靶点的分子探针如Ga-DOTA-ZPDGFRβ、cRGD-PLGA/ IOFA、 cRGD-PLGA-PFOB NPs、99mTc-GlcNAc-PEI、SPIO@SiO2-ICG-RGD不仅具有高度的特异性和灵敏度,而且可以用于肝纤维化的早期诊断、药物疗效监测以及治疗策略的制定等方面。
然而,目前对于靶向HSCs分子探针在特异性、安全性等方面存在诸多问题。未来,针对靶向HSCs的分子探针可结合不同成像技术的优势,结合其他临床指标和生物标志物,建立肝纤维化早期诊断的综合评估体系。比如利用基因编辑技术,在动物模型中模拟肝纤维化的发生和发展过程。探究HSCs在肝纤维化过程中的关键作用机制,为分子成像技术的优化和创新提供理论支持。随着靶向HSCs分子探针的不断成熟,将推进多模态多靶点成像在分子层面早期肝纤维化的诊断及治疗等方面的发展,为肝纤维化患者随访监测及疗效评估等提供更精确的信息。
参考文献:
[1]" "Ginès P, Krag A, Abraldes JG, et al. Liver cirrhosis[J]. Lancet, 2021, 398(10308): 1359-76.
[2]" " Friedman SL, Pinzani M. Hepatic fibrosis 2022: Unmet needs and a blueprint for the future[J]. Hepatology, 2022, 75(2): 473-88.
[3]" " Lurie Y, Webb M, Cytter-Kuint R, et al. Non-invasive diagnosis of liver fibrosis and cirrhosis[J]. World J Gastroenterol, 2015, 21(41): 11567-83.
[4]" "Pavlov CS, Casazza G, Nikolova D, et al. Transient elastography for diagnosis of stages of hepatic fibrosis and cirrhosis in people with alcoholic liver disease[J]. Cochrane Database Syst Rev, 2015, 1(1): CD010542.
[5]" Rinaldi L, Giorgione C, Mormone A, et al. Non‑invasive measurement of hepatic fibrosis by transient elastography: a narrative review[J]. Viruses, 2023, 15(8): 1730.
[6]" "Sakai T, Ohba H, Nishiyama S, et al. Sensitive and early detection of mitochondrial dysfunction in the liver of NASH model mice by PET imaging with 18F-BCPP-BF[J]. EJNMMI Res, 2018, 8(1): 61.
[7]" " Li F, Song ZJ, Li QH, et al. Molecular imaging of hepatic stellate cell activity by visualization of hepatic integrin αvβ3 expression with SPECT in rat[J]." Hepatology, 2011, 54(3): 1020-30.
[8]" "Rokugawa T, Konishi H, Ito M, et al. Evaluation of hepatic integrin αvβ3 expression in non-alcoholic steatohepatitis (NASH) model mouse by 18F-FPP-RGD2 PET[J]. EJNMMI Res, 2018, 8(1): 40.
[9]" "Zhang CY, Liu HH, Cui YF, et al. Molecular magnetic resonance imaging of activated hepatic stellate cells with ultrasmall superparamagnetic iron oxide targeting integrin αvβ for staging liver fibrosis in rat model[J]. Int J Nanomedicine, 2016, 11: 1097-108.
[10]" Polasek M, Fuchs BC, Uppal R, et al. Molecular MR imaging of liver fibrosis: a feasibility study using rat and mouse models[J]. J Hepatol, 2012, 57(3): 549-55.
[11]" Fuchs BC, Wang HF, Yang Y, et al. Molecular MRI of collagen to diagnose and stage liver fibrosis[J]. J Hepatol, 2013, 59(5): 992-8.
[12]" Farrar CT, Gale EM, Kennan R, et al. CM-101: type I collagen-targeted MR imaging probe for detection of liver fibrosis[J]. Radiology, 2018, 287(2): 581-9.
[13]" Su S, Xiang XH, Lin LP, et al. Cell death PET/CT imaging of rat hepatic fibrosis with 18F-labeled small molecule tracer[J]. Nucl Med Biol, 2021, 98/99: 76-83.
[14]" 王" 璐, 辛" 军. 分子影像探针早期诊断肝纤维化研究进展[J]. 中国医学影像技术, 2020, 36(9): 1400-4.
[15]" 杨" 尹, 李晓霞, 李红俊, 等. 超声造影在器官纤维化评价中的应用研究进展[J]. 医学影像学杂志, 2024, 34(3): 109-12.
[16]Ezhilarasan D. Hepatic stellate cells in the injured liver: perspectives beyond hepatic fibrosis[J]. J Cell Physiol, 2022, 237(1): 436-49.
[17] Yang FM, Li H, Li YM, et al. Crosstalk between hepatic stellate cells and surrounding cells in hepatic fibrosis[J]. Int Immunopharmacol, 2021, 99: 108051.
[18]" Cai XY, Wang JJ, Wang JC, et al. Intercellular crosstalk of hepatic stellate cells in liver fibrosis: new insights into therapy[J]. Pharmacol Res, 2020, 155: 104720.
[19] Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(3): 151-66.
[20]" Montesi SB, Désogère P, Fuchs BC, et al. Molecular imaging of fibrosis: recent advances and future directions[J]. J Clin Invest, 2019, 129(1): 24-33.
[21]" Bourebaba N, Marycz K. Hepatic stellate cells role in the course of metabolic disorders development‑A molecular overview[J]. Pharmacol Res, 2021, 170: 105739.
[22] Tsuchida T, Friedman SL. Mechanisms of hepatic stellate cell activation[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(7): 397-411.
[23]" Higashi T, Friedman SL, Hoshida Y. Hepatic stellate cells as key target in liver fibrosis[J]. Adv Drug Deliv Rev, 2017, 121: 27-42.
[24]" 郝玉梅, 谢" 安, 李" 鹤, 等. 活化肝星状细胞生物标志物与靶向递送系统研究进展[J]. 中国药学杂志, 2021, 56(7): 517-25.
[25]" Borkham-Kamphorst E, Weiskirchen R. The PDGF system and its antagonists in liver fibrosis[J]. Cytokine Growth Factor Rev, 2016, 28: 53-61.
[26]" Kocabayoglu P, Lade A, Lee YA, et al. β-PDGF receptor expressed by hepatic stellate cells regulates fibrosis in murine liver injury, but not carcinogenesis[J]. J Hepatol, 2015, 63(1): 141-7.
[27]" Zhou XY, Murphy FR, Gehdu N, et al. Engagement of alphavbeta3 integrin regulates proliferation and apoptosis of hepatic stellate cells[J]. J Biol Chem, 2004, 279(23): 23996-4006.
[28]" Zhang X, Xin J, Shi Y, et al. Assessing activation of hepatic stellate cells by 99mTc‑3PRGD2 scintigraphy targeting integrin αvβ3: a feasibility study[J]. Nucl Med Biol, 2015, 42(3): 250-5.
[29]" Hao CQ, Xie YM, Peng MJ, et al. Inhibition of connective tissue growth factor suppresses hepatic stellate cell activation in vitro and prevents liver fibrosis in vivo[J]. Clin Exp Med, 2014, 14(2): 141-50.
[30]" Rachfal AW, Brigstock DR. Connective tissue growth factor" (CTGF/CCN2) in hepatic fibrosis[J]. Hepatol Res, 2003, 26(1): 1-9.
[31] Ullah A, Wang KK, Wu PK, et al. CXCR4‑targeted liposomal mediated co‑delivery of pirfenidone and AMD3100 for the treatment of TGFβ‑induced HSC‑T6 cells activation[J]. Int J Nanomedicine, 2019, 14: 2927-44.
[32] Hong F, Tuyama A, Lee TF, et al. Hepatic stellate cells express functional CXCR4: role in stromal cell‑derived factor‑1alpha-mediated stellate cell activation[J]. Hepatology, 2009, 49(6): 2055-67.
[33] Puche JE, Saiman Y, Friedman SL. Hepatic stellate cells and liver fibrosis[J]. Compr Physiol, 2013, 3(4): 1473-92.
[34]" Mousavi SA, Fønhus MS, Kindberg GM, et al. Enhanced activity of lysosomal proteases in activated rat hepatic stellate cells is associated with a concomitant increase in the number of the mannose-6-phosphate/insulin-like growth factor II receptor[J]. Cell Biol Int, 2013, 37(7): 703-12.
[35]nbsp; Osawa Y, Kawai H, Tsunoda T, et al. Cluster of differentiation 44 promotes liver fibrosis and serves as a biomarker in congestive hepatopathy[J]. Hepatol Commun, 2021, 5(8): 1437-47.
[36]" Li D, He L, Guo HZ, et al. Targeting activated hepatic stellate cells (aHSCs) for liver fibrosis imaging[J]. EJNMMI Res, 2015, 5(1): 71.
[37] Kamm DR, McCommis KS. Hepatic stellate cells in physiology and pathology[J]. J Physiol, 2022, 600(8): 1825-37.
[38]" Beljaars L, Weert B, Geerts A, et al. The preferential homing of a platelet derived growth factor receptor-recognizing macromolecule to fibroblast-like cells in fibrotic tissue[J]. Biochem Pharmacol, 2003, 66(7): 1307-17.
[39]" Pinzani M, Milani S, Herbst H, et al. Expression of platelet-derived growth factor and its receptors in normal human liver and during active hepatic fibrogenesis[J]. Am J Pathol, 1996, 148(3): 785-800.
[40]" Clements JM, Bawden LJ, Bloxidge RE, et al. Two PDGF-B chain residues, arginine 27 and isoleucine 30, mediate receptor binding and activation[J]. EMBO J, 1991, 10(13): 4113-20.
[41] Wu L, Huang XQ, Li N, et al. A magnetic resonance imaging modality for non-invasively distinguishing progression of liver fibrosis by visualizing hepatic platelet‑derived growth factor receptor-beta expression in mice[J]. J Gastroenterol Hepatol, 2021, 36(12): 3448-56.
[42]" Li Z, Yang H, Li X, et al. Platelet-derived growth factor receptor β-targeted positron emission tomography imaging for the noninvasive monitoring of liver fibrosis[J]. Eur J Nucl Med Mol Imaging, 2024, 51(6): 1530-43.
[43] Seguin L, Desgrosellier JS, Weis SM, et al. Integrins and cancer: regulators of cancer stemness, metastasis, and drug resistance[J]. Trends Cell Biol, 2015, 25(4): 234-40.
[44]" Zheng YJ, Leftheris K. Insights into protein-ligand interactions in integrin complexes: advances in structure determinations[J]. J Med Chem, 2020, 63(11): 5675-96.
[45]Hu QH, Su YZ, Ma SY, et al. Integrin‑targeted theranostic nanoparticles for clinical MRI-traceable treatment of liver fibrosis[J]. ACS Appl Mater Interfaces, 2024, 16(2): 2012-26.
[46] Yu XH, Wu Y, Liu H, et al. Small-animal SPECT/CT of the progression and recovery of rat liver fibrosis by using an integrin αvβ3-targeting radiotracer[J]. Radiology, 2016, 279(2): 502-12.
[47]" Xuan JQ, Chen YL, Zhu LL, et al. Ultrasound molecular imaging with cRGD-PLGA-PFOB nanoparticles for liver fibrosis staging in a rat model[J]. Oncotarget, 2017, 8(65): 108676-91.
[48] Shao T, Chen Z, Belov V, et al. 18F‑Alfatide PET imaging of integrin αvβ3 for the non-invasive quantification of liver fibrosis[J]." J Hepatol, 2020, 73(1): 161-9.
[49]" Zevon M, Ganapathy V, Kantamneni H, et al. CXCR‑4 targeted, short wave infrared (SWIR) emitting nanoprobes for enhanced deep tissue imaging and micrometastatic cancer lesion detection[J]. Small, 2015, 11(47): 6347-57.
[50]" Sung YC, Liu YC, Chao PH, et al. Combined delivery of sorafenib and a MEK inhibitor using CXCR4-targeted nanoparticles reduces hepatic fibrosis and prevents tumor development[J]. Theranostics, 2018, 8(4): 894-905.
[51] Chen Y, Huang YH, Reiberger T, et al. Differential effects of sorafenib on liver versus tumor fibrosis mediated by stromal-derived factor 1 alpha/C‑X‑C receptor type 4 axis and myeloid differentiation antigen-positive myeloid cell infiltration in mice[J]. Hepatology, 2014, 59(4): 1435-47.
[52] Wang L, Zhou JY, Wang J, et al. Hepatic stellate cell‑targeting micelle nanomedicine for early diagnosis and treatment of liver fibrosis[J]. Adv Healthc Mater, 2024, 13(12): e2303710.
[53]" Ise H, Kobayashi S, Goto M, et al. Vimentin and desmin possess GlcNAc‑binding lectin‑like properties on cell surfaces[J]. Glycobiology, 2010, 20(7): 843-64.
[54] Ise H, Goto M, Komura K, et al. Engulfment and clearance of apoptotic cells based on a GlcNAc-binding lectin-like property of surface vimentin[J]. Glycobiology, 2012, 22(6): 788-805.
[55] Zhang DL, Zhuang RQ, Guo ZD, et al. Desmin- and vimentin-mediated hepatic stellate cell-targeting radiotracer 99mTc-GlcNAc-PEI for liver fibrosis imaging with SPECT[J]." Theranostics, 2018, 8(5): 1340-9.
[56]" Huerta-Ángeles G, Nešporová K, Ambrožová G, et al. An effective translation: the development of hyaluronan-based medical products from the physicochemical, and preclinical aspects[J]. Front Bioeng Biotechnol, 2018, 6: 62.
[57] Ángeles GH, Nešporová K. Hyaluronan and its derivatives for ophthalmology: recent advances and future perspectives[J]." Carbohydr Polym, 2021, 259: 117697.
[58] Wang XM, Zhang XQ, Li ZQ, et al. A hyaluronic acid-derived imaging probe for enhanced imaging and accurate staging of liver fibrosis[J]. Carbohydr Polym, 2022, 295: 119870.
[59] Zhu B, Wei L, Rotile N, et al. Combined magnetic resonance elastography and collagen molecular magnetic resonance imaging accurately stage liver fibrosis in a rat model[J]. Hepatology, 2017, 65(3): 1015-25.
[60]" Li YF, Shang WT, Liang XY, et al. The diagnosis of hepatic fibrosis by magnetic resonance and near-infrared imaging using dual-modality nanoparticles[J]. RSC Adv, 2018, 8(12): 6699-708.
[61] Tang XY, Li X, Li MX, et al. Enhanced US/CT/MR imaging of integrin αvβ3 for liver fibrosis staging in rat[J]. Front Chem, 2022, 10: 996116.
[62] Li YP, Zhang T, Zhang JH, et al. Dually fibronectin/CD44-mediated nanoparticles targeted disrupt the Golgi apparatus and inhibit the hedgehog signaling in activated hepatic stellate cells to alleviate liver fibrosis[J]. Biomaterials, 2023, 301: 122232.
[63]" 辛" 军, 张" 新, 曹" 礼, 等. 18F-RGD多肽在肝纤维化诊断中的应用价值[J]. 解剖科学进展, 2015, 21(3): 245-8.
(编辑:郎" 朗)
收稿日期:2024-05-29
基金项目:南充市市校科技战略合作专项基金(22SXQT0302)
作者简介:李韩梅,在读硕士研究生,E-mail: 1013459172@qq.com
通信作者:余进洪,副教授,博士,E-mail: yujinhong@nsmc.edu.cn
