基于CT获得的心肌应变参数在肥厚型心肌病和高血压性心脏病中的应用
2024-10-30何泽明郑敏赵宏亮韩冬于楠张喜荣贺太平


摘要:目的" 探讨基于CT获得的心肌应变(MS)参数在评估肥厚型心肌病(HCM)和高血压性心脏病(HHD)早期左室功能的可行性,以及该参数区分这两种疾病的能力。方法" 本研究为回顾性研究,纳入2021年12月~2023年1月在空军军医大学西京医院接受心脏冠状动脉血管成像检查,结果呈阴性的205例成年受试者。依据各组纳入及排除标准将受试者分为HCM组(n=70)、HHD组(n=65)和健康对照组(n=70)。采用后处理软件对3组的左室形态学特征、传统心功能参数以及MS参数进行了量化,比较参数的差异,以及对这两种疾病的鉴别能力。结果" 相较于健康对照组,HCM与HHD组的左室壁最大厚度、左室质量指数均有不同程度增高(9.25±1.68 vs 15.32±1.67 vs 18.01±2.24;56.64±19.57 vs 86.90±12.31 vs 106.27±19.56,Plt;0.001),而MS绝对值则均有不同程度降低(心肌整体周向应变,-25.80±3.74 vs -23.00±4.49 vs -21.03±4.97;心内膜下整体周向应变,-40.95±8.13 vs -35.86±7.90 vs -31.85±9.16;心肌整体径向应变,81.26±37.76 vs 66.99±18.37 vs 55.31±23.19,Plt;0.001),其中以纵向应变降低最为显著(心肌整体纵向应变,-23.03±3.84 vs -19.86±2.22 vs -15.47±4.28;心内膜下整体纵向应变,-30.35±5.35 vs -25.01±3.62 vs -21.92±8.16,Plt;0.001)。多元Logistic回归分析结果显示左室壁最大厚度、左室质量指数和心肌整体纵向应变组合模型的ROC曲线下面积最大,为0.930(敏感度为97%,特异性为83%)。结论" 基于CT所获得的MS参数可以用于精确评估HCM和HHD患者的早期左室功能损伤,其中以纵向应变的损伤最为显著。所得参数中左室壁最大厚度、左室质量指数和心肌整体纵向应变的组合模型在区分这两种疾病时效果最佳。
关键词:肥厚型心肌病;高血压性心脏病;计算机断层成像;心肌应变
CT application in early left ventricular function assessment and differential diagnosis: the crucial role of myocardial strain parameters in hypertrophic cardiomyopathy and hypertensive heart disease
HE Zeming1, ZHENG Minwen2, ZHAO Hongliang2, HAN Dong3, YU Nan1, ZHANG Xirong1, HE Taiping1
1School of Medical Technology, Shaanxi University of Chinese Medicine, Xianyang 712046, China; 2Department of Radiology, The First Affiliated Hospital of Air Force Medical University, Xi'an 710032, China; 3Department of Medical Imaging, The First Affiliated Hospital of Shaanxi University of Chinese Medicine, Xianyang 712000, China
Abstract: Objective To explore the feasibility of myocardial strain (MS) parameters obtained through CT technology for assessing early left ventricular function in hypertrophic cardiomyopathy (HCM) and hypertensive heart disease (HHD), as well as the capability of this parameter to differentiate between these two diseases, providing clinical reference. Methods This study was a retrospective analysis involving 205 adult participants with negative results from cardiac coronary imaging examinations conducted at the Xijing Hospital of Air Force Medical University from December 2021 to January 2023. Based on inclusion and exclusion criteria, the participants were categorized into three groups: HCM (n=70), HHD (n=65), and healthy control group (n=70). Subsequently, post‑processing software was utilized to quantify left ventricular morphological characteristics, traditional cardiac function parameters, and MS parameters among the three groups. The differences in these parameters were compared and their discriminative abilities between the two diseases were assessed. Results Compared to the healthy control group, both the HCM and HHD groups exhibited increased maximal left ventricular wall thickness and left ventricular mass index (9.25±1.68 vs 15.32±1.67 vs 18.01±2.24; 56.64±19.57 vs 86.90±12.31 vs 106.27±19.56, respectively, Plt;0.001). Meanwhile, the absolute values of MS were reduced in both groups (myocardial global circumferential strain: -25.80±3.74 vs -23.00±4.49 vs -21.03±4.97; endocardial global circumferential strain: -40.95±8.13 vs -35.86±7.90 vs -31.85±9.16; myocardial global radial strain: 81.26±37.76 vs 66.99±18.37 vs 55.31±23.19, Plt;0.001), with the longitudinal strain showing the most significant decrease (myocardial global longitudinal strain: -23.03±3.84 vs -19.86±2.22 vs -15.47±4.28; endocardial global longitudinal strain: -30.35±5.35 vs -25.01±3.62 vs 21.92±8.16, Plt;0.001). Multivariate Logistic regression analysis revealed that the combination model of maximal left ventricular wall thickness, left ventricular mass index, and myocardial global longitudinal strain had the largest area under the ROC curve of 0.930 (sensitivity: 97%, specificity: 83%). Conclusion The MS parameters obtained from CT imaging can accurately assess early left ventricular functional impairment in patients with HCM and HHD, with longitudinal strain showing the most significant impairment. Among the parameters obtained, the combination model of maximal left ventricular wall thickness, left ventricular mass index, and myocardial global longitudinal strain demonstrated the best effectiveness in distinguishing between these two diseases. These discoveries hold promise for providing more accurate diagnostic and therapeutic guidance in clinical practice.
Keywords: hypertrophic cardiomyopathy; hypertensive heart disease; computed tomography imaging; myocardial strain
收稿日期:2023-09-24
基金项目:陕西省重点产业创新链项目(2021ZDLSF04-10)
作者简介:何泽明,在读硕士研究生,技师,E-mail: 1601158676@qq.com
通信作者:贺太平,主任医师,E-mail: htp89956@163.com
肥厚型心肌病(HCM)是一种常见的遗传性心肌疾病,其主要特征是心肌增厚[1]。然而,HCM患者的一些非特异性表现经常被忽视,如左室局部或整体心肌功能轻微下降等,直至左室射血分数(LVEF)明显异常时才引起关注,此时心脏收缩功能已经严重受损,可能导致心源性猝死和心力衰竭等[2]。因此,早期定量评估HCM患者左室功能至关重要。高血压性心脏病(HHD)同样会导致心肌肥厚,影像学特征与HCM相似度较高。然而,这两种疾病的治疗方法和风险分层却完全不同[3]。因此鉴别HCM与HHD尤为关键。
以往区分这两种疾病的方法主要依赖于左室形态学特征,即HCM通常表现为非对称性肥厚,而HHD则表现为对称性肥厚[4]。然而有研究显示,4%~47%的HHD患者存在非对称性肥厚,31%的HCM患者存在对称性肥厚[5],仅依靠这一特征鉴别HCM和HHD非常困难,需要更多的影像学指标来提高诊断的准确性。尽管已有研究使用了不同方法来区分这两种疾病,如生长分化因子-15[6],但该参数的区分能力有限,仍不能满足临床需求。而近年来新出现的心肌应变(MS)参数已广泛用于评估不同因素引起的心肌损伤和心肌疾病的鉴别诊断。然而,目前关于计算机断层成像特征追踪技术(CT-FT)的报道甚少。本研究旨在探讨基于CT-FT技术所获得的MS参数评估HCM和HHD患者的左室功能以及鉴别诊断方面的可行性,为临床提供更多有价值的参考信息。
1" 资料与方法
1.1" 一般资料
本研究通过空军军医大学附属西京医院伦理委员会审查(KY20192027-4),所有患者均签署检查同意书。本次研究回顾性纳入了2021年12月~2023年1月在空军军医大学西京医院放射科行冠状动脉计算机断层扫描血管造影(CCTA)检查结果呈阴性的205例成年受试者。依据纳入与排除标准,将患者分为3组:HCM组70例,其中男50例,女20例。纳入标准:符合2020年美国心脏协会和心脏病协会发布的HCM诊疗指南中的诊断标准[7],即排除负荷或生理等因素,影像学检查结果显示左室壁最大厚度(MLVWT)≥15 mm,存在家族史者≥13 mm即可诊断。排除标准:由其他疾病引起的心肌肥厚(如高血压、瓣膜性心脏病、先天性心脏病等)。HHD组65例,其中男39例,女26例。纳入标准:明确高血压病史(至少2次测量收缩压gt;140 mmHg和/或舒张压gt;90 mmHg),或者正在服用一种或多种降血压药物。排除标准:已知其他原因所致左室壁肥厚(如中度至重度心脏瓣膜疾病、获得性/遗传性心肌病等);有其他器质性心脏病病史(冠心病、风湿性心脏病、先天性心脏病等)。健康对照组70例,其中男44例,女26例,纳入标准:经问询、检查确认无其他基础性疾病的健康人群(如高血压、糖尿病等)。
1.2" 冠状动脉CT血管造影(CCTA)
CT扫描使用Siemens二代双源CT机器(Siemens Healthineers,Force)进行。参与者在检查前均接受吸气和屏气训练。CCTA扫描方案:扫描范围从气管隆嵴下1~2 cm水平至心脏膈面(依据患者体型适当调整),根据受试者的体质量,在肘正中静脉内注射非离子型对比剂碘佛醇(350 mgI/mL),注射量为1.2 mL/kg,注射流率4.0~6.0 mL/s,对比剂注射结束后立即注射30~40 mL生理盐水。采用前瞻性心电门控大螺距扫描,应用造影剂团注追踪法将监测的感兴趣区置于降主动脉,CCTA自动扫描触发阈值设为100 Hu。当感兴趣区内的CT值达到该阈值标准时,会自动间隔5 s触发扫描。扫描参数:管电压90 kV,采用自动调节管电流技术(CARE Dose 4D,Siemens),参考管电流350 mAs,探测器准直2 mm×64 mm×0.6 mm,层间距0.75 mm,层厚0.75 mm,根据心率自动调整螺距,矩阵512×512,并以RR间期10%重建全期相数据。
1.3" 图像分析及处理
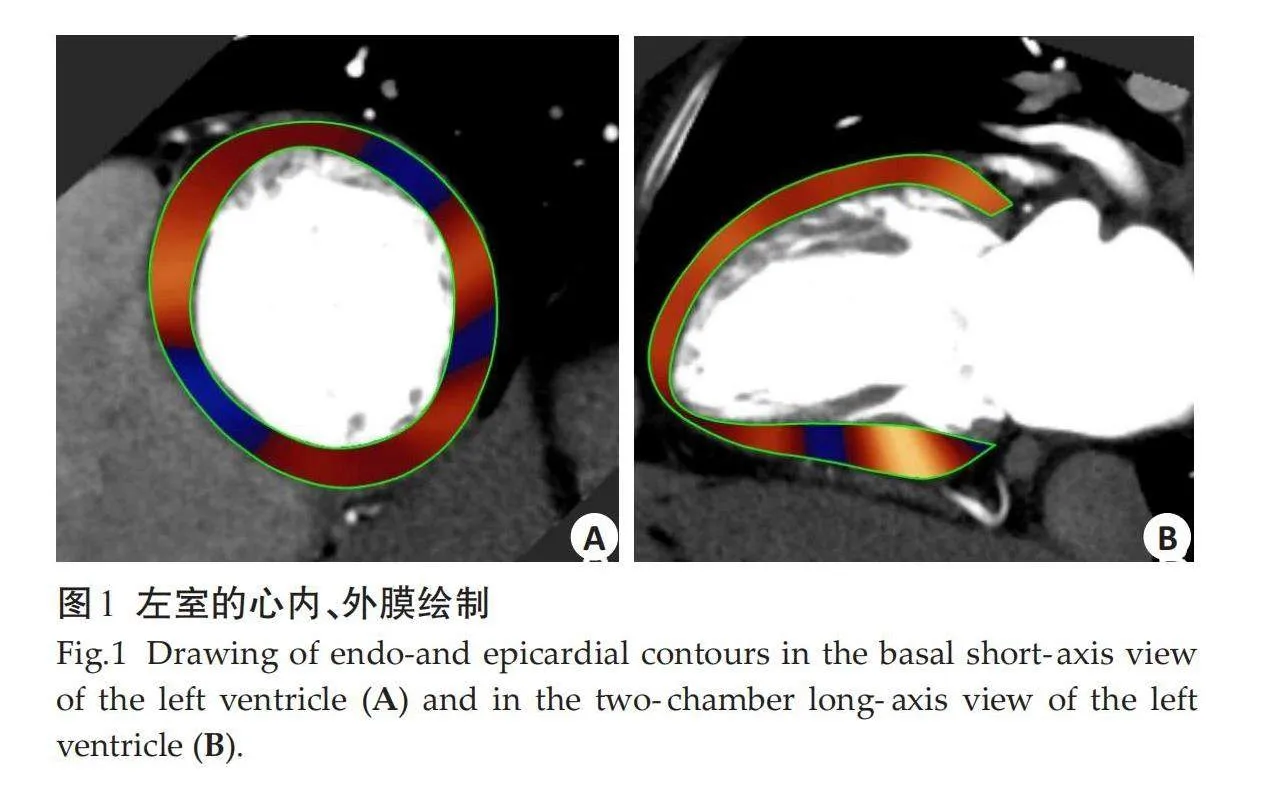
MLVWT根据美国心脏协会左室16节段模型,分别在舒张末期短轴基底层面、中间层面和心尖层面手动测量并选取最大值记录。心功能参数采用后处理软件MedisSuite v4.0进行评估,对CCTA原始图像进行多平面重组,获得长轴二、三、四腔心和短轴基底、乳头肌以及心尖层面图像。每组图像的舒张、收缩末期需要手动勾勒心内、外膜边界,软件会自动完成其余时相的心内、外膜绘制,如有必要,可以手动进行调整(图1)。所要测量的参数包括:左室质量指数(LVMI)、左室射血分数(LVEF)、左室收缩末期容积(LVESV)、左室舒张末期容积(LVEDV)、左室收缩末期长径(LVESL)、左室收缩末期内径(LVESD)、左室舒张末期长径(LVEDL)、左室舒张末期内径(LVEDD)。采用CCTA派生的MS用于评估心肌变形,径向和周向应变从二维短轴平面获得,纵向应变从二维长轴平面获得。定量参数包括整体纵向应变(GLS)、整体周向应变(GCS)和整体径向应变(GRS),其中GLS由心肌整体纵向应变(MyoGLS)和心内膜下整体纵向应变(EndoGLS)组成,GCS由心肌整体周向应变(MyoGCS)和心内膜下整体周向应变(EndoGCS)组成(图2)。
1.4" 统计学分析
采用SPSS25.0软件进行统计学分析。采用Kolmogorov-Smirnov检验和目测Q-Q图确定数据分布的正态性,采用Levene检验方差齐性。服从正态分布且方差齐的计量资料以均数±标准差表示,组间差异的比较行单因素方差分析,事后比较采用Bonferroni检验。计量资料以n(%)表示,组间差异的比较行Fisher确切概率法。采用多元Logistic回归分析来检验CT-FT测量值区分HHD和HCM的能力。特异性、敏感度、鉴别准确度、截断值和曲线下面积,通过使用约登指数的ROC曲线分析得出,采用DeLong法比较ROC曲线下面积。以Plt;0.05为差异有统计学意义。
1.5" 重复性检验
MLVWT与CT-FT参数均由1位工作10年以上从事CT诊断工作的医师资深完成。4周后,由同1位医师与另1位工作10年以上从事CT诊断工作的医师在各组中随机抽取90例进行重新分析。可重复性检验采用组内相关系数(ICC)和95% CI来表示。第1位医师所得数据对比作为观察者内一致性评估。第2位医师测得的数据与第1位医师首次所得数据对比作为评估观察者间一致性。
2" 结果
2.1" 组临床资料、形态学特征和常规心功能参数的比较
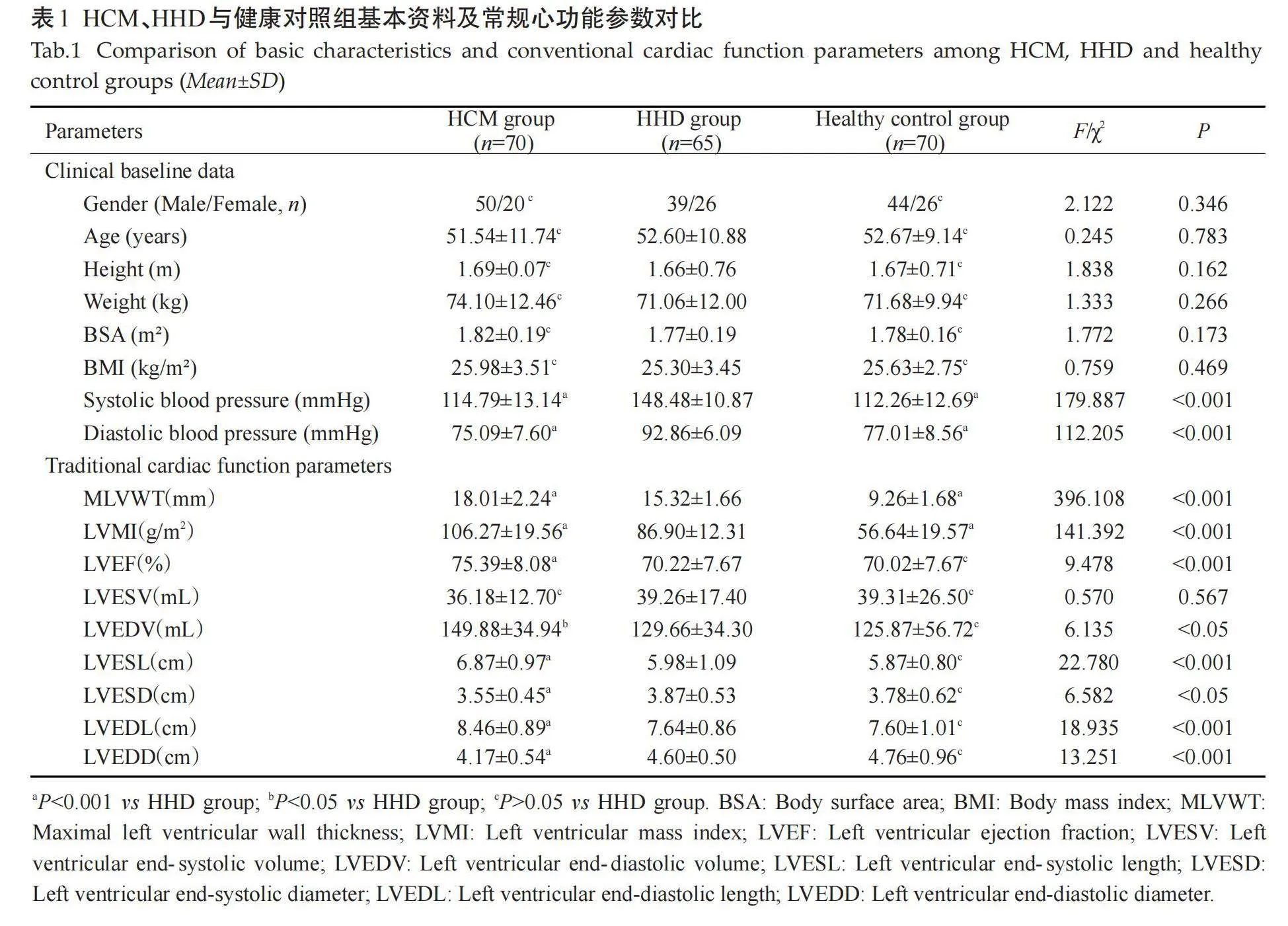
3组性别、年龄、身高、体质量、体质量指数、体表面积以及LVESV的差异无统计学意义(Pgt;0.05)。HHD组的动脉收缩压和舒张压均高于HCM和健康对照组(Plt;0.001)。相较于健康对照组,HCM与HHD组均表现出较高的LVWT和LVMI(Plt;0.001)。而相较于健康对照组与HHD组,HCM组的LVESL、LVEDL、LVEF和LVEDV增高,LVESD和LVEDD则降低(Plt;0.05,表1)。
2.2" MS参数的组间对比
相较于健康对照组,HCM与HHD组各向MS绝对值均降低,其中以纵向应变损伤最为显著(Plt;0.001,表2)。
2.3" HCM和HHD的鉴别诊断
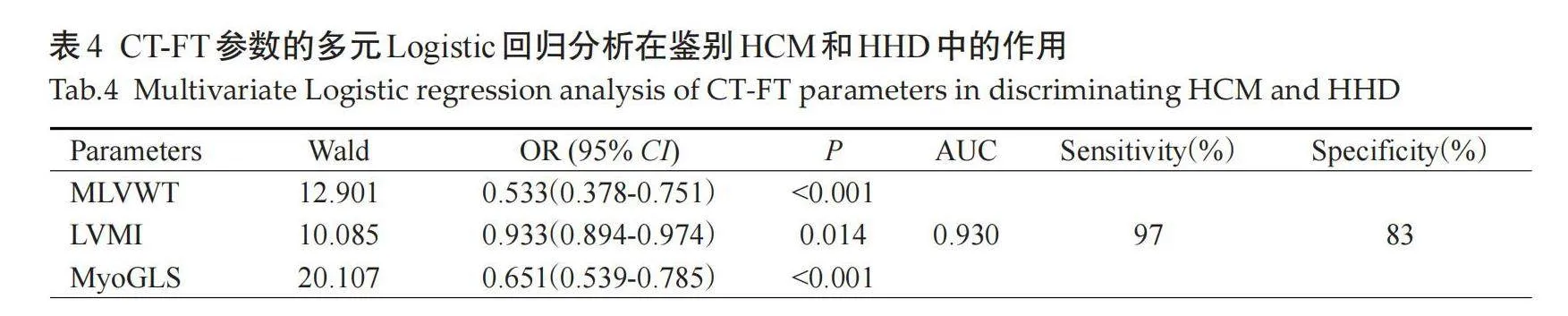
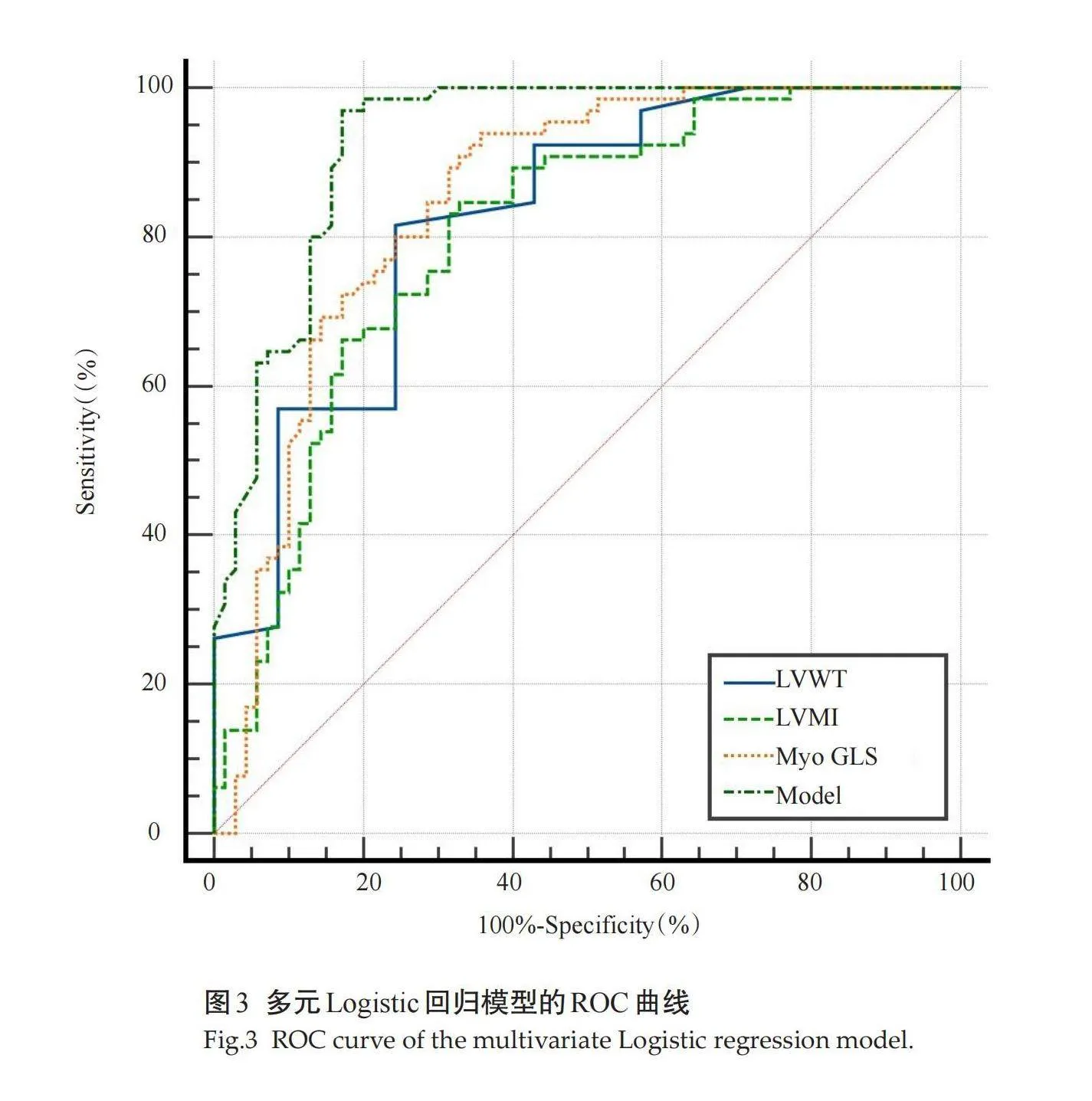
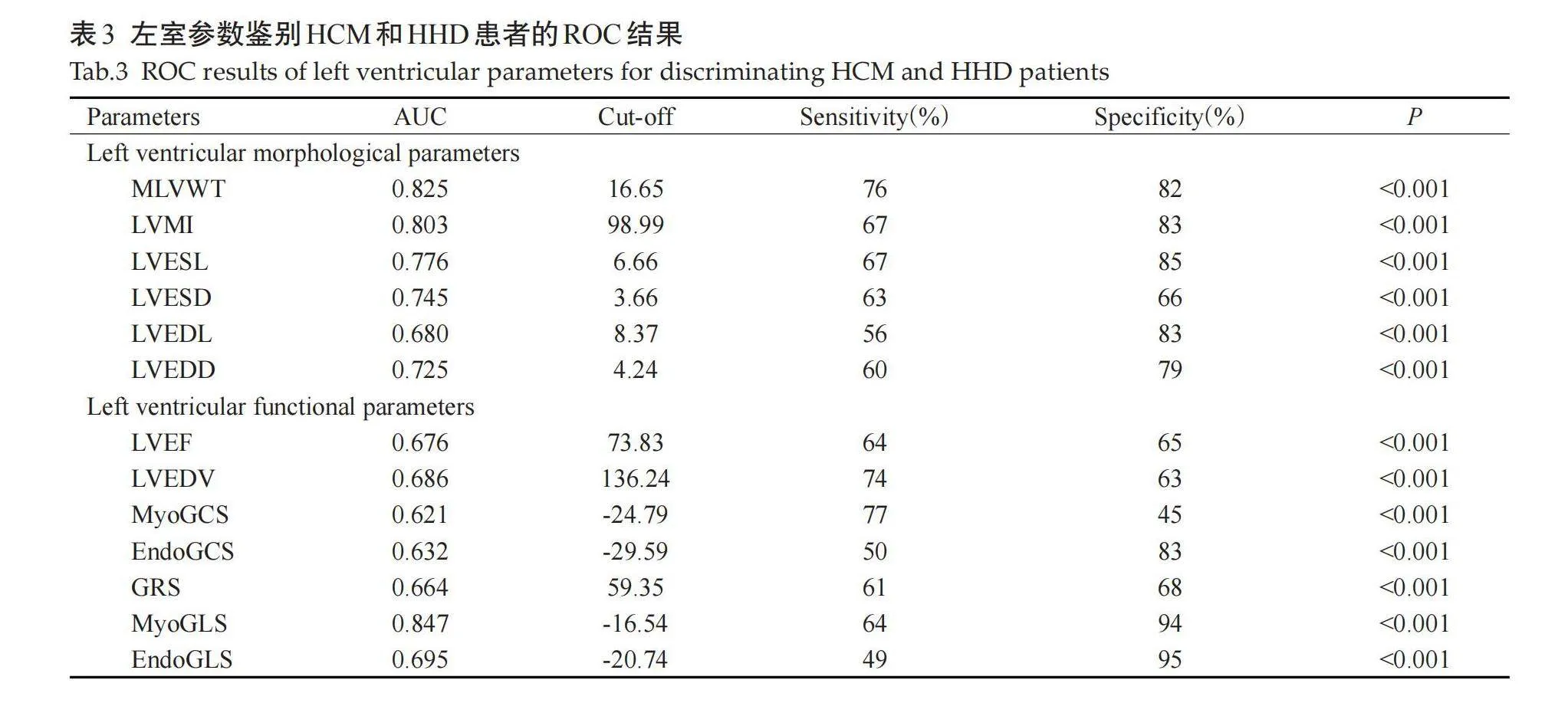
各项参数中,LVWT和MyoGLS区分HCM和HHD的效果最好(表3);Delong检验结果表明,三者的ROC曲线下面积差异无统计学意义。多元Logistic回归分析结果显示MLVWT、LVMI和MyoGLS组合模型的ROC曲线下面积为0.930(敏感度为97%,特异性为83%,表4),Delong检验结果显示,该模型的ROC曲线下面积高于前三者(Plt;0.05,图3)。
2.4" 心肌应变参数的可重复性
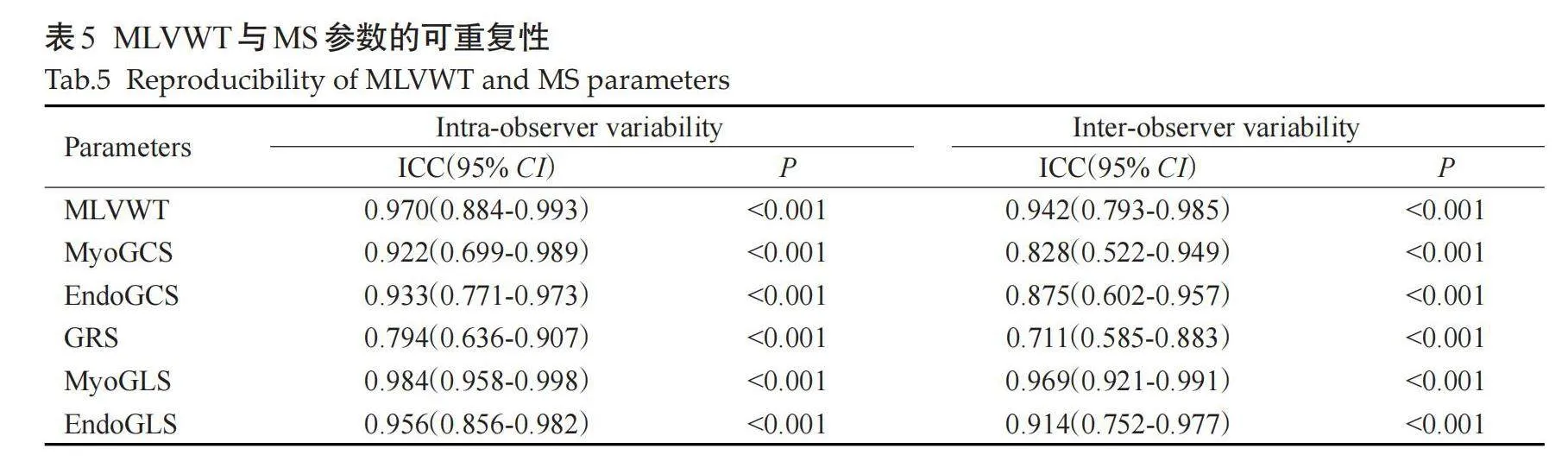
2位医师所测得的MLVWT与MS参数的观察者内与观察者间一致性均表现较好,ICC 值为0.904~0.988(Plt;0.001,表5)。
3" 讨论
以往用于评估MS的方法包括基于超声心动图的斑点追踪技术(STI)和基于心脏磁共振的特征追踪技术(CMR-FT)。但CMR-FT禁忌较多,STI则存在部分患者声窗质量不欠佳的限制[8]。近年来出现的CT-FT是一种半自动的MS定量评估技术,克服了以往CT无法量化MS的限制,仅需CCTA全期相数据即可分析。研究表明,CT-FT在评估MS方面与前两者相比具有较好的一致性,可作为心肌功能评估的可靠技术[9-10]。相较于前两种方法,CT-FT更加便捷,禁忌少,可在进行冠状动脉解剖结构观察的同时提供一站式的心功能评估。
本研究观察到HCM和HHD组的LVWT和LVMI相较于健康对照组均表现出不同程度的增加。尽管两者的病理基础不同,前者是由于肌小节蛋白编码基因变异,后者则是因为心肌细胞对高血压的代偿性改变,但均导致了左室的肥厚和质量增加[11]。而相较于其余两组,HCM组的LVESL和LVEDL增加,而LVESD和LVEDD缩小。这是由于多数HCM患者的左室肥厚程度高于HHD患者且以室间隔肥厚为主要特征,从而导致该类患者具有更加复杂的左室形态学特征[12]。虽然HCM和HHD患者的LVEF都在正常范围内,但这是由于这两种疾病早期的病理生理特点主要表现为舒张功能受损,而心脏通过代偿机制来维持正常甚至增强的收缩功能,从而导致LVEF保持正常甚至增高,因此该参数无法准确评估早期心功能受损[13]。
近年来,MS技术的发展填补了这一研究领域的空白。一项大规模多中心研究利用CMR-FT技术对1274例LVEF保留的就诊者进行了长期随访,结果表明GLSgt;-20%的患者生存期明显较短,且GLS每恶化1%,患者的死亡风险增加22.8%[14]。这一研究结果强调了MS参数相较于LVEF在识别早期心功能损伤方面具有独特优势,有助于改善患者的临床管理和预后。在此基础上,我们深入研究了HCM与HHD患者之间的MS参数差异,结果表明,3组GLS、GCS和GRS均有差异,其中HCM组的MS值最低,其次是HHD组,尤其以GLS的降低最为显著,这提示HCM患者的左室功能受损程度更为严重,且GLS对左室功能损伤的敏感度最高。既往研究发现,尽管3组受试者的LVEF均正常,但通过STI技术对比显示,HCM和HHD患者的内、中、外层心肌均表现出纵向应变损伤,以HCM组最为显著[15]。范泽政等[16]同样通过STI技术对比了HCM、HHD与健康对照组的MS值,结果同样表明HCM患者的心肌功能最低,且以纵向应变损伤为著。这进一步证实了本研究结论。由于这两种疾病具有不同的病理基础,并且HCM通常伴随着更严重的左室功能障碍以及更肥厚的心室壁,因此HCM患者的心功能损伤较重[12]。而GLS对左室功能损伤具有更高的敏感性则是由于心肌的排列导致它具有特殊的运动方式,即纵向、周向和径向运动,而纵向功能在心脏运动过程中起主要作用,因此GLS在这两种疾病进展过程中受损更早也更明显[17]。然而,上述研究中存在HHD组的GCS对比健康对照组无差异的情况,但本研究中HHD组的GCS则略低于健康对照组。根据既往研究报道,分析造成该差异的可能原因为:不同的商用软件采取了不同的追踪模式与算法[18],本次研究中所采用的CT-FT技术以心内、外膜追踪为主,而上述研究中采用的STI技术则以心肌斑点追踪为主,从而在细微的心肌功能差异中得出不同结果。在未来的研究中仍需进一步探讨多种追踪技术在不同应用领域中的优劣差异。
区分HCM和HHD同样是临床上常见的疑难问题。随着心脏影像学和计算机技术的进步,MS参数也被用于区分这两种疾病。有研究采用CMR-FT技术对HCM和HHD患者的MS值进行了分析,结果显示GLS、LVMI以及心肌纤维化范围都具有独立区分这两种疾病的能力,ROC曲线下面积分别为0.639、0.643和0.680,但Delong检验结果的差异无统计学意义[19]。有研究同样利用CMR-FT技术来区分这两种疾病,研究表明,室间隔中部的心肌纤维化范围和GRS的联合模型具有最高的ROC曲线下面积,为0.835 [20]。本研究显示,LVWT、LVMI以及MyoGLS均具有独立区分HCM与HHD的能力,ROC曲线下面积分别为0.825、0.803和0.847,但Delong检验结果表明三者的ROC曲线下面积对比无统计学意义,这与上述文献所得结果近似;但通过多元Logistic回归分析,我们进一步发现LVWT、LVMI和MyoGLS的组合模型的ROC曲线下面积高达0.930(敏感度为97%,特异性为83%),Delong检验结果也表明其区分能力优于前三者。本研究首次将基于CT所量化的MS参数应用于区分HCM和HHD患者。相对于既往研究,我们取得了一定的进展,这或许能为临床的科学决策提供更多信息。但本研究仍存在以下局限性:样本量较少,仅为单中心研究,有待进一步扩大样本量;仅使用一种CT-FT评估软件,且未与CMR、STI以及其他后处理软件所获值进行对比,之后将以此软件为对比进一步探索CT-FT技术在心血管疾病领域的用途。
综上,基于CT-FT衍生的MS参数表现出良好的可重复性,能够精确量化HCM与HHD患者的早期左室功能损伤,特别是在HCM患者中观察到了更明显的纵向应变受损,这为早期干预治疗提供了新思路。此外,LVWT、LVMI与MyoGLS的联合模型也展示出较高的诊断准确性,这一发现或许有望为HCM和HHD患者的鉴别诊断提供重要的新指标。
参考文献:
[1]" Maron BJ, Desai MY, Nishimura RA, et al. Diagnosis and evaluation of HypertrophicCardiomyopathy[J]. J Am Coll Cardiol, 2022, 79(4): 372-89.
[2]" "Yang LP, Zhang LB, Cao SD, et al. Advanced myocardial characterization in hypertrophic cardiomyopathy: feasibility of CMR-based feature tracking strain analysis in a case-control study[J]. Eur Radiol, 2020, 30(11): 6118-28.
[3]" "Ismail TF, Frey S, Kaufmann BA, et al. Hypertensive heart disease the imaging perspective[J]. J Clin Med, 2023, 12(9): 3122.
[4]" "Nwabuo CC, Vasan RS. Pathophysiology of hypertensive heart disease: beyond left ventricular hypertrophy[J]. Curr Hypertens Rep, 2020, 22(2): 1-18.
[5]" "Kato T, Noda A, Izawa H, et al. Discrimination of nonobstructive hypertrophic cardiomyopathy from hypertensive left ventricular hypertrophy based on strain rate imaging by tissue Doppler ultrasonography[J]. J Card Fail, 2005, 11(9): S284.
[6]" "Hanatani S, Izumiya Y, Takashio S, et al. Growth differentiation factor 15 can distinguish between hypertrophic cardiomyopathy and hypertensive hearts[J]. Heart Vessels, 2014, 29(2): 231-7.
[7]" "Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC guideline for the diagnosis and treatment of patients with hypertrophic cardiomyopathy: a report of the American college of cardiology/american heart association joint committee on clinical practice guidelines[J]. Circulation, 2020, 142(25): e558-e631.
[8]" "Li N, Liu T, Liu JA, et al. Quantifying myocardial strain of the left ventricle in normal people using feature‑tracking based on computed tomography imaging[J]. Diagnostics, 2022, 12(2): 329.
[9]" Miskinyte E, Bucius P, Erley J, et al. Assessment of global longitudinal and circumferential strain using computed tomography feature tracking: intra‑individual comparison with CMR feature tracking and myocardial tagging in patients with severe aortic Stenosis[J]. J Clin Med, 2019, 8(9): 1423.
[10]" Xie WH, Chen LJ, Hu LW, et al. Postoperative evaluation of left ventricular global strain using cardiac computed tomography in pediatric patients with congenital heart disease: a comparison with echocardiography[J]. Eur J Radiol, 2021, 142: 109868.
[11] Karaca Özer P, Ayduk Gövdeli E, Engin B, et al. Role of global longitudinal strain in discriminating variant forms of left ventricular hypertrophy and predicting mortality[J]. Anatol J Cardiol, 2021, 25(12): 863-71.
[12] la Rosa Angelo D, Maulin S, Takahiro S, et al. Comparing echocardiographic characteristics in genotype positive-phenotype positive hypertrophic cardiomyopathy and hypertensive left ventricular hypertrophy[J]. Eur Heart J Cardiovasc Imag, 2021, 23(3): 340-8.
[13] Cikes M, Solomon SD. Beyond ejection fraction: an integrative approach for assessment of cardiac structure and function in heart failure[J]. Eur Heart J, 2016, 37(21): 1642-50.
[14] Romano S, Judd RM, Kim RJ, et al. Feature-tracking global longitudinal strain predicts mortality in patients with preserved ejection fraction[J]. JACC, 2020, 13(4): 940-7.
[15]Sun J, Xu TY, Ni XD, et al. Echocardiographic strain in hypertrophic cardiomyopathy and hypertensive left ventricular hypertrophy[J]. Echocardiography, 2018, 36(2): 257-65.
[16]" 范泽政, 王" 静, 杨" 帆, 等. 三维斑点追踪技术在鉴别心脏淀粉样变与肥厚型心肌病和高血压心脏病中的应用[J]. 中国超声医学杂志, 2019, 35(7): 604-7.
[17]" Claus P, Omar AMS, Pedrizzetti G, et al. Tissue tracking technology for assessing cardiac mechanics[J]. JACC, 2015, 8(12): 1444-60.
[18]" 王" 姿, 冯泽豪, 武" 睿, 等. 不同类型心肌肥厚的心肌应变特征[J]. 中国医学影像学杂志, 2018, 26(5): 336-40, 346.
[19]" Neisius U, Myerson L, Fahmy AS, et al. Cardiovascular magnetic resonance feature tracking strain analysis for discrimination between hypertensive heart disease and hypertrophic cardiomyopathy[J]. PLoS One, 2019, 14(8): e0221061.
[20] Liu SL, Li YL, Zhao YM, et al. The combination of feature tracking and late gadolinium enhancement for identification between hypertrophic cardiomyopathy and hypertensive heart disease[J]. Front Cardiovasc Med, 2022, 9: 865615.
(编辑:林" 萍)
